Revista del Instituto Nacional de Higiene Rafael Rangel
versión impresa ISSN 0798-0477
INHRR v.40 n.1 Caracas ene. 2009
Respuesta cardiaca al estrés tóxico por exposición pasiva combinada al humo de cigarrillo y al etanol.
Cardiac stress toxic response to combined passive smoke cigarette exposition plus ethanol
Zoraida C Rodrigues De A
1 y Mirian C. Strauss R21, 2 Sección de Biología Celular, Instituto de Medicina Tropical. Facultad de Medicina. Universidad Central de Venezuela, Apartado 47019, Caracas 1041-A, Venezuela. Tlf. 0212-605.3650 FAX: 0212-605.3551, mstraussve@gmail.com.
1 Departamento de Cultivo Celular, Instituto Nacional de Higiene Rafael Rangel. Tlf. 0212-219.17.16, zorodrigues@cantv.net. Dirigir correspondencia a Lic. Rodrigues, zorodrigues@cantv.net
RESUMEN
El estrés oxidativo ha sido considerado por muchos investigadores como la principal causa de daño tisular generado por el consumo de alcohol en combinación con nicotina. Sin embargo, se desconoce si existe una potenciación de la inducción de Hsps como respuesta al daño celular en el caso de fumadores involuntarios que consumen etanol, y si los sistemas de citoprotección endógena, específicamente la proteína anti-estrés Hsp70, tienen alguna participación. En tal sentido, en este trabajo se determinó la presencia de las Hsp70 y su correspondencia con la respuesta subcelular cardiaca en el estrés tóxico individual y combinado de etanol y exposición pasiva al humo del cigarrillo (EPHC) en ratas. Se utilizaron 60 ratas hembras Sprague-Dawley (80- 100gr), divididas aleatoriamente en cuatro grupos: grupo control; grupo etanol (2 g/kg p.c. 50%, vía oral); grupo humo (exposición pasiva al humo de 8 cigarrillos) y grupo combinado (etanol-humo). Los tratamientos se suministraron diariamente en dosis única, durante 15 días continuos. Seguidamente, posterior al sacrificio de los animales se tomaron muestras de la pared ventricular izquierda del corazón para el estudio bioquímico y subcelular. Los resultados mostraron un paralelismo entre la mayor acumulación de Hsp70 y el menor daño subcelular en el tejido cardiaco. El tratamiento combinado de alcohol y EPHC promovió la respuesta al estrés en el corazón, a través de un proceso de coinducción, resultando en mayor acumulación de Hsp70. Se sugiere un papel cardioprotector de las Hsp70.
Palabras clave: Humo de cigarrillo, etanol, Hsp70, tejido cardiaco.
ABSTRACT
Many researchers have considered oxidative stress as the main cause of tisular damage induced by alcohol and nicotine together. Oxidative stress is associated to the induction of stress proteins. However, in the case of passive smoke, it is unknown whether the stress proteins are induced and what kind of role they could have. In this regard, this work determined Hsp70 and their relationship to subcellular heart response in individual and combined ethanol and passive smoke cigarette exposition in rats. 60 female Sprague-Dawley (80-100g) rats, were randomized into four group: control; ethanol (2 g/kg c.w. 50%, oral route); passive smoke of 8 cigarettes and ethanol/smoke group. Single dose daily treatment was given during 15 days. Once therats were killed, samples for biochemical and subcellular analysis were made from left ventricular wall. Results showed a strong relationship between bigger accumulation of Hsp70 and smaller cardiac cellular damage. Ethanol plus passive smoke treatment promoted the stress response by co-induction and an increased Hsp70 accumulation was induced. It is suggested a cardiac protective role for Hsp70.
Key word: Passive smoke cigarette, Ethanol, Hsp70, Cardiac Tissue
Recibido: 02 de abril de 2008 / Aprobado: 27 de agosto de 2008
LISTA DE ABREVIATURAS UTILIZADAS EN EL TEXTO
ADN: Ácido desoxirribonucleico
Col.: Colaboradores
DO: Densidad óptica
EPHC: Exposición pasiva al humo de cigarrillo
G: gramos
HSE: Heat Shock Element
HSF: Heat Shock Factor
Hsp70:Heat Shock Protein 70KDa
Hsps: Heat Shock Proteins
IMT: Instituto de Medicina Tropical
IVIC: Instituto Venezolano de Investigaciones Científicas
KDa: Kilo-Daltons
Kg: kilogramos
Kv: kilovoltios
MET: Microscopia Electrónica de Transmisión
P.C.: peso corporal
SPSS: Stadistic Packet Social Science
UCV: Universidad Central de Venezuela
Vs: Versión
INTRODUCCIÓN
Las células de los organismos vivos poseen un gran número de respuestas compensatorias dentro del rango de daño sub-letal, vinculadas a la activación de me - canismos endógenos que permiten la sobrevivencia celular en condiciones adversas, tales como: el sistema en zimático anti-oxidativo, productor de los llamados anti-oxidantes; así como la expresión y/o acumulación de proteínas citoprotectoras, conocidas como proteínas de choque térmico (Hsps). Las Hsps constituyen un sistema celular de protección endógena, que contribuye a la homeóstasis proteica y es esencial para la viabilidad celular (1). La mayoría de las Hsps funcionan como chaperonas moleculares participando en el plegamiento, ensamblaje, desensamblaje, degradación, reparación y translocación de proteínas, así como en la estabilización de ribosomas y del proceso de traducción (2,3). En particular, el efecto protector de Hsp70 ha sido demostrado utilizando ratones transgénicos que sobreexpresan Hsp70 en músculo cardiaco, resultando en un incremento de la resistencia del corazón al daño isquémico (4,5). La inducción rápida de Hsp70 durante el estrés oxidativo ha sido vinculada con un posible papel protector de dicha proteína en el corazón (6).
La exposición individual o combinada al consumo de bebidas alcohólicas a base de etanol y al humo de cigarrillo, promueve la producción de especies reactivas de oxígeno, generando un desbalance entre pro-oxidantes y anti-oxidantes, resultando en un fuerte ciclo de óxido-reducción (redox) (7). Adicionalmente, se ha sugerido la existencia de una correlación de potenciación de efectos ante el uso combinado de alcohol y nicotina (8,9). Hahn y colaboradores (1991) señalaron que la combinación alcohol-nicotina potencia el daño tisular, vinculado al estrés oxidativo generado por ambos agentes tóxicos (10). Sin embargo, se desconoce si existe una correlación de potenciación de la respuesta de daño celular en el caso de fumadores involuntarios o pasivos y el consumo de etanol.
En este trabajo se determinó la presencia de Hsp70 y su correspondencia con la respuesta subcelular cardiaca en el estrés tóxico individual y combinado de etanol y EPHC en ratas.
MATERIALES Y MÉTODOS
Animales: Se emplearon 60 ratas hembras Sprague-Dawley (80-100g p.c.), provenientes del Bioterio del Ins tituto Venezolano de Investigaciones Científicas (IVIC). Las ratas fueron distribuidas al azar en doce jaulas metálicas (37 x 47 x 18 cm) con cinco animales en ca da una, con libre acceso a una dieta estándar de rataratarina y agua ad libitum. Los animales fueron mantenidos de acuerdo con las normas especificadas en la Guía de Cuidados y Uso de Animales de Laboratorio publicada por el US Nacional Institute of Health (NIH, publicación N° 85-23, revisado en 1985). Asimismo el diseño experimental y manejo del modelo experimental de la línea de investigación de la Sección de Biología Celular del Instituto de Medicina Tropical de la Universidad Central de Venezuela (IMT-UCV): Respuesta celular al estrés y diseño de estrategias citoprotectoras, ha sido avalado por el Comité de ética del IMT-UCV.
Diseño experimental
: las ratas se agruparon en cuatro grupos experimentales: Grupo Humo
: exposición pasiva al humo de 8 cigarrillos, en una cámara de vidrio (21x41x30 cm) con dispositivo de incorporación de aire fresco. Grupo Etanol
: administración de 2 g/kg p.c. de eta nol al 50%, por vía oral. Grupo Combinado:
administración de 2 g/kg p.c. de etanol al 50%, por vía oral y exposición pasiva al humo de 8 cigarrillos. Grupos Controles/Blanco:
1.- Control Hacinamien to: ubicación de los animales en la cámara de vidrio lavada y descontaminada, por un tiempo de 20 minutos2.-
Control Agua: administración de un volumen equivalente de agua filtrada en igualdad de condiciones al grupo Etanol. 3.- Blanco.Los tratamientos se suministraron diariamente en dosis única, durante 15 días continuos. Al finalizar el tiempo fueron sacrificados con el método de aspiración de vapores de cloroformo y seguidamente se tomaron muestras de la pared ventricular izquierda del corazón, para el estudio bioquímico, ultraestructural y morfológico de todos los grupos experimentales.
Análisis por Western Blot: Las muestras de la pared libre ventricular izquierda se homogeneizaron (1 ml amortiguador de extracción Tris-HCl 20mM, EDTA 2mM y PMSF 1mM, pH 7.4, 4°C) usando un homogeneizador de tejido Potter Elverjheim®. Las muestras se centrifugaron a 20.000g por 10 min. a 4 °C. El contenido de proteínas en el sobrenadante fue determinado mediante el microensayo de Bradford (11). La separación de proteínas se realizó por electroforesis en geles de poliacrilamida al 10%, en condiciones disociantes SDS-PAGE (5,75 μg/pozo) (12) por duplicado usando el sistema de mini-geles de Bio-Rad®; uno de los geles fue destinado a coloración con Azul Brillante Coomassie G-250 (BioRad laboratorios, 1993), y el segundo gel se utilizó para transferir las proteínas a papel de nitrocelulosa de 0,45 μm de poro (13) y coloreado con Rojo Ponceau para visualizar las bandas de Hsp70. En el reconocimiento in munológico se empleó un anticuerpo primario monoclonal anti-Hsp70 (1:5000, Sigma), y uno secundario IgG de ratón conjugado a peroxidasa (1:4000, Sigma). Los resultados de la inmunodetección se evidenciaron con un sustrato quimioluminiscente (estuche de luminol, Sigma) y se registraron en placas fotográficas Kodak®. Los patrones de bandas proteicas fueron analizados con un densitómetro GS-800® y el uso del programa Quan tity One® (Bio-Rad).
Análisis Estadístico: Las bandas evidenciadas fue ron analizadas densitométricamente en condiciones de linealidad con respecto a la concentración de proteínas de la muestra y al tiempo de exposición de la película fotográfica. Con el propósito de comparar la tendencia de los valores de DO de las bandas proteicas de Hsp70, se realizaron pruebas estadísticas paramétricas y no pa ramétricas, T de Student y U de Mann-Whitney, respectivamente, empleando el programa SPSS. Se evaluó el cumplimiento de los supuestos para ambas prue bas con el propósito de seleccionar la adecuada. Las diferencias de intensidad de cada banda entre los grupos fueron consideradas estadísticamente significativas, con un intervalo de confianza de 95% (α= 0,05).
Análisis ultraestructural: Las muestras de la pared libre ventricular izquierda fueron procesadas por la técnica modificada de corte fino (14). Las muestras de 2 mm de diámetro fueron fijadas en solución Karnovsky (350mOsm, pH 7,4, 2h, 4 °C) y post-fijada con tetraóxido de osmio al 2% en solución Millonig (0,12M, 320mOsm, pH 7,4, 2h, 4 °C). Las muestras fueron deshidratadas en concentraciones crecientes de acetona (50%, 70% + uranilo, 80%, 95% y 100%; 30 min cada uno), e incluidas en resina epóxica (48h, 60 °C). Después de la polimerización, las muestras fueron secciona das (150μm) con una cuchilla de diamante (Ultramicrotomo Reichert Om 13) y colocadas sobre rejillas de cobre (300 mesh). Se contrastaron con acetato de uranilo 3% (45 min. 60°C) y citrato de plomo (15 min. 25 °C). Los registros se efectuaron en un microscopio electrónico de transmisión Hitachi 300® (75kV).
Análisis morfométrico: La interpretación del estudio ultraestructural se realizó mediante la elaboración del análisis morfométrico de las placas fotográficas con la aplicación del programa de morfometría Image Pro Plus®, en el cual se cuantificaron parámetros característicos para el tejido cardiaco. Se seleccionaron y digitalizaron las imágenes, seguido de la calibración del programa, estableciendo criterios de medición y cuantificación de los parámetros característicos de la arquitectura celular del tejido cardiaco, a saber, de longitud del núcleo, área de los espacios intracelulares, área de las acumulaciones mitocondriales, longitud de las unidades sarcolemales, y el área de los lisosomas, a los fines de cuantificar los cambios subcelulares.
RESULTADOS
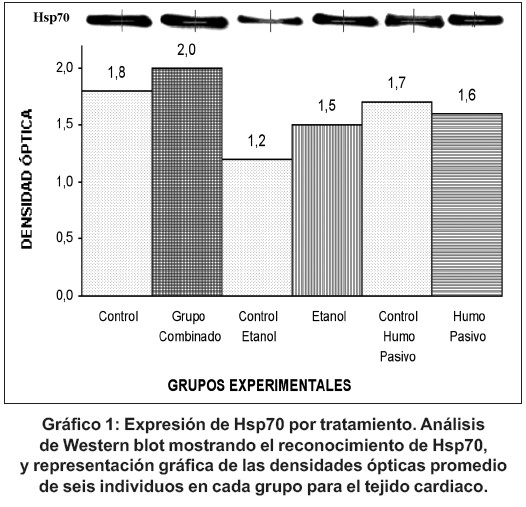
Detección de Hsp70: El análisis por Western blot de las muestras cardiacas de todos los grupos experimentales, mostró el reconocimiento de bandas proteicas correspondientes a una proteína de peso molecular de 70 KDa (gráfico 1), previa corrida y separación de una proteína de peso molecular 70 KDa (figura 1). La acumulación de Hsp70 fue de orden decreciente: grupo combinado, blanco, control hacinamiento, grupo humo, grupo alcohol y control agua (gráfica 1).
En el análisis estadístico fueron comparadas las medias y medianas para las pruebas paramétricas y no paramétricas, con base en el cumplimiento de todos los supuestos por todos los grupos, como también en el número de muestras, siendo seleccionada la U de Mann- Whitney como la prueba estadística para el estudio. Las diferencias en acumulación de Hsp70 entre los grupos tratados y sus respectivos controles, así como también entre el grupo blanco y los controles, y entre los distintos tratamientos, resultaron estadísticamente significativas (tabla 1).
Tabla 1. Valor del estadístico U de Mann-Whitney en la prueba no paramétrica (a=0.05)
| Blanco/ Control Hacinamiento
| Control Hacinamiento /Humo | Control Hacinamiento /Combinado | Humo/ Combinado | Blanco/ Control Agua | Control Agua/ alcohol | Control Agua/ Combinado | Alcohol/ Combinado | |
| Corazón | 0,800 | 1,000 | 1,000 | 0,071 | 0,200 | 0,800 | 0,333 | 0,400 |
Análisis ultraestructural y morfométrico: Las micrografías electrónicas seleccionadas muestran características subcelulares representativas para todos los grupos experimentales. El grupo blanco (Fig. 2A) mostró un patrón de arreglo paralelo entre las columnas de mitocondrias y los paquetes de miofibrillas, con periodicidad normal de las bandas z, de núcleo alargado y en posición central. En el grupo combinado (Fig. 2B) se observaron cambios en la longitud del sarcómero y engrosamiento de las bandas z. El control agua (Fig. 2C) presentó invaginaciones y evaginaciones de la cisterna perinuclear y además vacuolas en la zona perinuclear. El grupo alcohol (Fig. 2D) mostró mayores cambios en parámetros como la forma del núcleo, presencia de mayor número y tamaño de invaginaciones y de los espacios intracelulares.
Entre los distintos grupos experimentales se observó que las dimensiones del núcleo, la longitud de la unidad sarcomérica y el área ocupada por los espacios intracelulares no presentaron mayores variaciones en su longitud (Gráfico 1). En cuanto a las acumulaciones mitocondriales, el área ocupada fue de mayor dimensión en el grupo alcohol, seguida de los grupos control hacinamiento, grupo humo y blanco. En el grupo combinado y control agua fueron sustancialmente menores las dimensiones de tal acumulación. En el grupo tratado individualmente con alcohol se observó la presencia de lípidos.
DISCUSIÓN
A pesar de la alta prevalencia del uso combinado de alcohol y nicotina en humanos, son pocos los laboratorios que han examinado los efectos de estas drogas en combinación (15). La situación es aún de mayor desconocimiento cuando la combinación es con exposición pasiva al humo del cigarrillo (EPHC). Existe un cuerpo, cada vez mayor, de evidencias de que los constituyentes bioquímicos del humo juegan un papel significativo en el desarrollo y progresión del daño de vasos sanguíneos y corazón, conocida como Cardiomiopatía del humo (16). Ambos, la exposición al humo del cigarrillo activo y pasivo, predisponen a eventos cardiovasculares (17).
En este trabajo se presenta por primera vez la coindución como posible ruta de promoción de la respuesta cardiaca al estrés combinado de alcohol y EPHC, en ratas. La acumulación de Hsp70, tratamiento dependiente, determinada podría estar vinculada a la susceptibilidad diferencial de la bomba pulsátil, ante el potencial tóxico de los metabolitos resultantes de la biotransformación de los agentes en cuestión (18). En condiciones de hostilidad, la expresión de las Hsps inducibles y la sobreexpresión de las constitutivas representa una respuesta universal de recuperación de la homeostasis celular (2,19,20,21,22). Lo anterior, a través de un mecanismo de defensa celular común para la promoción de la sobrevivencia en respuesta a varios estímulos de estrés (23),
incluyendo etanol, nicotina y los miles de componentes tóxicos que forman parte del humo del cigarrillo. La nicotina en combinación con etanol es capaz de bajar el umbral de inducción de la respuesta al estrés, siendo el efecto de la nicotina sinérgico con respecto a la inducción de Hsp, la termotolerancia y a la inducción del enlazamiento específico del HSF con el HSE (10). A pesar que no se conocen los mecanismos por los cuales la nicotina induce el sinergismo, la regulación de tal proceso ocurre a nivel transcripcional, asociada a la inducción del enlazamiento específico HSF-HSE en los genes de Hsp. Las alteraciones inducidas por alcohol en el mRNA de Hsps son selectivas y sexo específicas y además, pueden contribuir o reflejar las lesiones bioquímicas asociadas al músculo expuesto al alcohol (24).
Por otra parte, en el caso del estrés individual (humo o alcohol) en el tejido cardiaco, hubo una menor acumulación de Hsp70 respecto al combinado. Lo anterior podría entenderse como ausencia de sinergismo, respuesta a un estrés leve o como respuesta a un estrés altamente tóxico, capaz de afectar el ADN, incluyendo genes que codifican la síntesis de Hsp y la subsecuente disminución de su expresión y/o acumulación. La comparación de los tratamientos individuales con sus respectivos blancos, sugiere un estrés altamente tóxico co mo posible explicación. El reconocimiento de las Hsp70 constitutivas del blanco supera, aparentemente a los grupos individualmente tratados y a sus controles, para ambos agentes. Lo anterior, pudiese sugerir daño de las Hsp70 constitutivas, aunado a la falta de expresión de las inducibles como resultado de la toxicidad extrema vinculada al daño cercano a la letalidad. En tal sentido, el humo del cigarrillo genera oxidación proteica, daños en el ADN y apoptosis en bajas concentraciones, así como necrosis en altas concentraciones (25). La exposición al humo del cigarrillo incrementa el estrés oxidativo como mecanismo potencial para iniciar la disfunción cardiovascular (17). Las diferencias entre células de distinto origen en cuanto a la estabilidad lisosomal ante el estrés oxidativo, refleja una divergencia en su capacidad para degradar peróxido de hidrógeno, mientras que las diferencias en las cantidades de hierro redox-activo intralisosomal explicaría las variaciones intracelulares e intercelulares (26).
Los cambios en la arquitectura del citoesqueleto del miocito, sugieren que la patología ultraestructural inducida por los tóxicos puede estar estrechamente vinculada a una crisis energética y de la arquitectura celular, asociada con desorganización generalizada y posible muerte celular, en el largo plazo. Tal crisis podría tener su origen en el estrés oxidativo inicial, la desregulación iónica y la pérdida de la homeostasis del calcio. La alteración en la homeostasis del calcio que conduce a un incremento sostenido del nivel citosólico de este catión, se ha asociado con citotoxicidad hepática (27,28). La capacidad mutagénica de los componentes tóxicos, en particular el humo del cigarrillo, pudiera explicar las alteraciones a nivel nuclear (29,30). Asimismo, la presencia de edema sugiere cambios en la permeabilidad de las membranas asociado con estrés oxidativo, peroxidación lipídica, alteraciones de las membranas, volumen celular y desregulación iónica, particularmente, vinculado al incremento de la concentración de calcio (31,32). Por otra parte, investigaciones recientes muestran que el consumo de etanol genera una respuesta diferencial en la acumulación de las Hsp70 en hígado y pulmón, es decir, hay susceptibilidad tejido-dependiente asociada a una menor presencia de las Hsp en el tejido pulmonar (33). De manera general, el análisis morfométrico preliminar corroboró en un marco cuantitativo a través de la determinación de áreas y longitudes, la tendencia mostrada por los cambios estudiados subcelularmente.
En otros contextos tóxicos, se ha demostrado que la res puesta cardiaca al estrés es zonal dependiente. La acumulación cardiaca de Hsp70 en ratas tratadas con Adriamicina difiere, dependiendo de si se trata de la pared ventricular izquierda, derecha o el tabique interventricular (34). Más específicamente, el análisis de múltiples isoformas eucarióticas de Hsp70 demuestra distintos papeles funcionales para algunos miembros de Hsp70, desde ser el punto de transición de una proteína facilitadora del plegamiento proteico, hasta un cofactor de chaperoneo (35).
Finalmente, el mantener una respuesta de coindución de Hsp70 ante la exposición combinada en la rata podría ser protectora sólo en el corto plazo, lo cual se corrobora con el paralelismo de la respuesta a ambos niveles de estudio, es decir, el molecular y el subcelular. El humo del cigarrillo en aquellos quienes son alcoholdependientes, estaría asociado a una más alta morbilidad y mortalidad (36).
CONCLUSIONES
En este trabajo se presentan evidencias de la respuesta diferencial subcelular de daño cardiaco, al estrés tóxico combinado a la exposición pasiva al humo de cigarrillo y al etanol. La relación entre la coinducción de Hsp70 y la citoprotección podría ser importante para comprender el papel de esta proteína en el daño diferencial de órganos, en el tratamiento combinado de exposición pasiva al humo de cigarrillo y etanol en rata.
AGRADECIMIENTOS
Este trabajo ha sido apoyado por el Consejo de Desarrollo Científico y Humanístico (CDCH) de la Universidad Central de Venezuela, a través del Proyecto Individual N° 09-34-4491-2000, y por Laboratorios ELMOR S.A. a través de un proyecto LOCTI 2007.
REFERENCIAS
1. Blatch G. Networking of chaperones by Co-chaperones, Molecular Biology intelligence unit. 2 ed. USA: Landes Bioscience; 2007. [ Links ]
2. Lindquist S. The heat shock response. Ann Rev Biochem; 1986; 55: 1151-91. [ Links ]
3. Cornivelli L, zeidán Q, De Maio A. Hsp70 interacts with ribosomal subunit of thermotolerant cells. Shock; 2003; 24:320-25. [ Links ]
4. Marber M, Mestril R, Chi S, Sayen N, Yellow D, Dillman W. Overexpression of the rat inducible 70kD heat stress protein in a transgenic mouse increases the resistance to the heart to ischemic injury. J Clin Invest; 1995; 95: 1446-56. [ Links ]
5. Mestril R. Stress protein involvement in cardioprotection induced by hypothermy. J Mol Cell Cardiol; 2005; 33: 2075-78. [ Links ]
6. Mestril R. The use of transgenic mice to study cytoprotection by the stress protein. Methods; 2001; 35:165-69. [ Links ]
7. Gentry-Nielsen M, Top E, Snitily M, Casey A, Preheim C. A rat model to determine the biomedical consequences of concurrent ethanol ingestion and cigarette smoke exposure. Alcohol Clin Exp Res; 2004; 28:1120-28. [ Links ]
8. zacny P. Behavioral aspects of alcohol-tobacco interactions. Recent Dev Alcohol; 1990; 8:205-19. [ Links ]
9. Perkins A. Combined effects of nicotine and alcohol on subjective, behavioral and physiological responses in humans. Addict Biol; 1997; 2:255-67. [ Links ]
10. Hahn M, Shiu C, Auger A. Mammalian stress proteins Hsp70 and Hsp28 coinduced by nicotine and either ethanol or heart. Mol Cell Biol; 1991; 11:6034-40. [ Links ]
11. Bradford M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem; 1976; 72: 248-54. [ Links ]
12. Laemmli U. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature, 1970; 15:680-85. [ Links ]
13. Towin H, Staehelin T, Gordon J. Electrophoretic transfer of proteins from polyacrylamide gels to nitrocellulose sheets: procedure and some applications. Proc Natl Acad Sci; 1979; 76:4350-54. [ Links ]
14. Finol H. Contribución al estudio de la ultraestuctura del músculo esquelético enfermo. Trabajo de ascenso para optar a la categoría de profesor titular. Caracas: Universidad Central de Venezuela; 1986. [ Links ]
15. Kouri E, McCarthy E, Faust A, Lukas S. Pretreatment with transdermal nicotine enhances some of ethanol's acute affects in men. Drug Alcohol Depend; 2004; 75:55-65. [ Links ]
16. Leone A. Biochemical Markers of Cardiovascular Damage from Tobacco Smoke. Curr Pharm Des; 2005; 11(17): 2199-2208. [ Links ]
17. Ambrose J, Barua R. The pathophysiology of cigarette smoking and cardiovascular diseases: an update. J Am Coll Cardiol; 2004; 43(10):1731-37. [ Links ]
18. Bianchi G, Bugianesi E, Ronchi M, Fabbri A, zoli M, Marchesini G. Glutathione kinetics in normal man and in patients with liver cirrhosis. J Hepatol; 1997; 26:606-13. [ Links ]
19. Parsell D, Lindquist S. The function of the heat shock proteins in stress tolerance: degradation and reactivation of damage proteins. Annu Rev Genet. 1993; 27:437-96. [ Links ]
20. Parsell D, Lindquist S. Heat shock proteins and stress tolerance. En: The biology of heat shock proteins and molecular chaperones. Ed. Morimoto R, Tissieres A, Georgopoulos C. Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY, 1994; 457-93. [ Links ]
21. Morimoto R, Santoro M. Stress-inducible responses and heat shock proteins: new pharmacologic targets for cytoprotection. Nature Biotech; 1998; 16(9):833-38. [ Links ]
22. Hartl F, Hayer-Hartl M. Molecular chaperones in the cytosol: from nascent chain to folded protein. Science, 2002; 295:1852-58. [ Links ]
23. Akerfelt M, Trouillet D, Mezger V, Sistonen L. Heat shock factors at a crossroad between stress and development. Ann N.Y. Acad Sci. 2007; 1131: 15-27. [ Links ]
24. Nakahara T, Hunter R, Hirano M, Uchimura H, McArdle A, Broome C, et al. Alcohol alters skeletal muscle heat shock protein gene expression in rats: these effects are moderated by sex, raised endogenous acetaldehyde, and starvation. Metabolism, 2006; 55:843-51. [ Links ]
25. Vayssier-Taussat M, Camili T, Aron Y, Replan C, Hainaut P, Polla B, Weksler B. Effects of tobacco smoke and benzo[a]pyrene on human endothelial cell and monocyte stress responses. Am J Physiol Heart Circ Physiol; 2001; 280: 1293-1300. [ Links ]
26. Kurz T, Gustafsson B, Brunk U. Intralysosomal iron chelation protects against oxidative stress-induced cellular damage. FEBS J; 2006; 273:3106-17. [ Links ]
27. Cenarruzabeitia E, Cobreros A, Sainz L. Liver damage produced by alcohol: therapeutic perspectives with calcium blockers. ANALES Sis San Navarra; 1998; 21: 47-55. [ Links ]
28. Cobreros A, Sainz L, Lasheras B, Cenarruzabeitia E. Hepatotoxicity of ethanol: protective effect of calcium channel blockers in isolated hepatocytes. Liver, 1997; 17: 16-82. [ Links ]
29. Ho Y, Chen C, Wabg Y, Pestelll R, Albanese C, Chen R, et al. Tobacco-specific carcinogen 4-(methylnitrasamino)-1- (3-pyridyl)-1-butane (NNK) induces cell proliferation in normal human bronchial epithelial cells through NfkappaB activation and cyclin D1 up-reguation. Toxicol Appl Pharmacol, 2005; 205: 133-48. [ Links ]
30. Contreras C. El tabaco, droga legalizada en Venezuela. Tesis de grado para optar al título de licenciado. Caracas: Universidad Central de Venezuela; 1991. [ Links ]
31. Bertolami M. Mechanismo of hepatotocixity. Arq Bras Cardiol; 2005; 5: 25-7. [ Links ]
32. Ruso M, Kane A, Farber J. Ultrastruct pathology of phalloidinintoxicated hepatocytes in the prsence and absence of extracellular calcium. Am J Pathol; 1982; 109: 133-44. [ Links ]
33. Porras N, Strauss M, Rodriguez M, Anselmi G. Hsp70 accu mulation and ultrastructural features of lung and liver induced by ethanol treatment with and without L-carnitine protection in rats. Exp Toxicol Pathol; 2006; 57:227-37. [ Links ]
34. Strauss M, Maita R, Anselmi G. Biopsia de músculo esque lético: ¿Alternativa diagnóstica del daño cardíaco por adriamicina?. Acta Pediatr Mex; 2004; 25: 159-63. [ Links ]
35. Morano K. New tricks for an old dog: The evolving world of Hsp70. Ann N.Y. Acad Sci; 2007; 1113: 1-14. [ Links ]
36. Connor J, McD. Young R, Lawford B, Saunders J, Ritchie T, Noble E. Heavy nicotine and alcohol use in alcohol dependence is associated with D2 dopamine receptor (DRD2) polymorphism. Addictive Behaviors; 2007; 32: 310-19. [ Links ]












 uBio
uBio