Revista del Instituto Nacional de Higiene Rafael Rangel
versión impresa ISSN 0798-0477
INHRR v.40 n.1 Caracas ene. 2009
El Virus del Nilo Occidental: Revisión.
West Nile Virus: Review.
Rosa I Hernández R1, 4, Lola L Bravo1, Dulce M Morón R2, Eduardo Armas A1, Blanca J Girón B1, Carlos D Aponte T3
1 Instituto Nacional de Higiene Rafael Rangel. Gerencia Sectorial de Diagnóstico y Vigilancia Epidemiológica. División de Diagnóstico de Enfermedades Transmisibles. Departamento de Virología. Venezuela.
2 Instituto Nacional de Higiene Rafael Rangel. Gerencia Sectorial de Diagnóstico y Vigilancia Epidemiológica. División de Vigilancia Epidemiológica. Venezuela.
3 Instituto Nacional de Higiene Rafael Rangel. Gerencia de Docencia e Investigación. Coordinación de Investigación. Venezuela.
4 Instituto Nacional de Higiene Rafael Rangel. Gerencia Sectorial de Diagnóstico y Vigilancia Epidemiológica. División de Diagnóstico de En fermedades Transmisibles. Departamento de Virología. Ciudad Universitaria. Caracas, Venezuela. Teléfonos: (0212) 631.2048–219.7102. e-mail: rosaihernadezr@yahoo.com
RESUMEN
El virus del Nilo Occidental (VNO) es un arbovirus perteneciente a la familia Flaviviridae, filogenéticamente relacionado con el complejo de la encefalitis japonesa y aislado por primera vez en el año 1937 a partir del suero de una paciente febril, nativa del Nilo Occidental en Uganda-África. Al igual que muchos otros arbovirus, el VNO, presenta dos ciclos de transmisión: un ciclo enzoótico primario o ciclo de amplificación que envuelve un grupo de vectores (mosquitos y hospedadores aviares), y un ciclo secundario que involucra diferentes artrópodos, con la correspondiente transmisión del virus a hospedadores como humanos y caballos, entre otros. La infección por el VNO causa un espectro de manifestaciones clínicas que van desde la infección subclínica hasta la muerte.
Su amplia distribución geográfica, la transmisión por mosquitos, la relación con aves silvestres como hospedadores en zoóticos y algunas infecciones humanas fueron bien documentadas en los años sesenta. El VNO no había sido considerado como un patógeno humano de importancia porque muchas infecciones resultaban asintomáticas o febriles, sin ninguna complicación. Es a partir del año 1996 cuando se reportan importantes epidemias, en donde un gran porcentaje de pacientes después de algunos días de fiebre, progresaron al síndrome de meningoencefalitis.
La emergencia del virus del Nilo Occidental (VNO) en el Este de Estados Unidos en 1999 representó un evento muy importante en la arbovirología moderna, no sólo por el impacto de la enfermedad o por la amenaza potencial que representó, sumado a esto, alertó al mundo que los patógenos podrían emerger en cualquier lugar y momento.
En este artículo se hace una revisión bibliográfica relacionada con la emergencia del virus del Nilo Occidental en las Américas, ecología, epidemiología, clínica, diagnóstico, manejo clínico y prevención de la enfermedad.
Palabras clave: arbovirus, virus del Nilo Occidental, encefalitis japonesa, infección, aves, equinos, mosquitos, síndrome de meningoencefalitis.
ABSTRACT
The West Nile Virus (WNV), an arthropod borne virus belonging to the family Flaviviridae, is phylogenetically related to the Japanese Encephalitis group, and it was firts isolated in 1937 from the blood of a woman with fever in the West Nile province of Uganda-Africa.
Like others arboviruses, the West Nile Virus has two transmission cycles: one primary enzootic cycle or amplifying cycle that involves a group of mosquitoes vectors and birds as the main amplifying hosts and a second cycle that comprises differents virus-carring arthropod with virus transmission to susceptibles humans and horses, among others.
WNV infection in humans causes a spectrum of manifestations from subclinical infection to death.
WNV broad geographic distribution, its transmission by mosquitoes and its circulation in cycles of transmission between wild birds as enzootic hosts and some human infections were well documented in the 1960's years.
WNV had not been considered important as a human pathogen due to cases with no symptoms or mild clinical symptoms in cases without severity.
Since 1996 have been reported important outbreaks with an important progression to cases of meningoencephalitis.
The emergence of WNV in eastern North America in 1999 was a major event in modern arbovirology, not only because of the disease impact or the potential threat it represented, but because it alerted the world that pathogens may turn up anywhere at anytime.
This article briefly reviews the emergence of West Nile Virus in the Americas, its ecology and epidemiology, clinic, diagnosis and treatment and prevention of West Nile Virus illness.
Key words: arbovirus, infection, West Nile Virus, Japanese encephalitis, meningoencephalitis, birds, horses, mosquitoes.
Recibido: 27 de marzo de 2008 / Aprobado: 30 de mayo de 2008
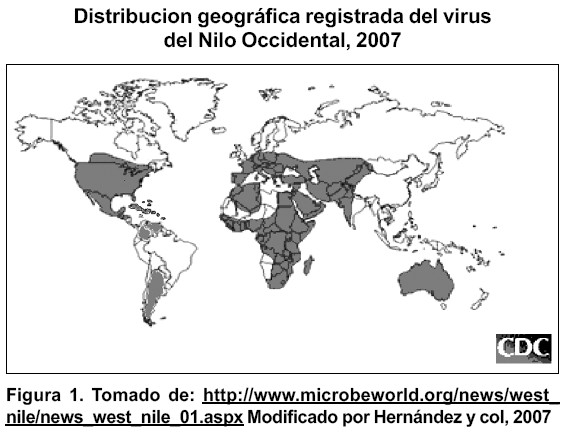
Historia Del virus Del Nilo Occidental El Virus del Nilo Occidental (VNO) fue aislado por primera vez en el año 1937, del suero de una paciente febril, natural del Nilo Occidental, en uganda–áfrica. Este arbovirus se encuentra entre los primeros virus des cubiertos transmitidos por artrópodos; posteriormente ha sido aislado de muestras de aves, caballos, mosquitos, garrapatas y humanos, caracterizándose por ser el más ubicuo de los arbovirus al encontrarse en todos los continentes(1) (Fig. 1).
Su amplia distribución geográfica, la transmisión por mosquitos, la relación con aves silvestres como hospedadores enzoóticos, y las infecciones humanas poco frecuentes, fueron bien documentadas en los años sesenta(1) (2) (3).
El VNO no había sido considerado como un patógeno humano de importancia porque muchas infecciones resultaban asintomáticas o febriles sin ninguna complicación. Algunas epidemias habían sido documentadas antes de 1996, afectando a cientos de personas en poblaciones principalmente rurales, registrándose pocos casos de enfermedad neurológica(1) (2) (3).
Las tres epidemias más importantes ocurridas entre 1996 y 1999 fueron la del sureste de Rumania, la del delta del Volga en el sureste de Rusia y la ocurrida en la ciudad de Nueva York, en el noreste de Estados unidos. dichas epidemias involucraron cientos de casos de enfermedad neurológica severa e infecciones fatales en grandes poblaciones urbanas. un factor común en estas epidemias lo constituyó la participación del mosquito Culex pipiens como vector. Esta especie no había sido señalada antes como vector de importancia en la transmisión del VNO(4) (5). durante la epidemia en el noreste de Estados unidos resalta el hecho de la asociación de la infección por el VNO con enfermedades fatales en las aves, sugiriendo un cambio en la virulencia de dicho agente(6) (7).
En Estados unidos se logró aislar por primera vez la cepa del VNO de Nueva York (NY99) a partir de un cuervo americano (Corvus brachyrhynchos), y subsecuentemente en 22 aves de diferentes especies recolectadas entre agosto y noviembre de 1999. Adicionalmente se logró secuenciar ARN específico del virus a partir de muestras de cerebro de humanos fallecidos(8).
Después del brote inicial en 1999, el VNO continuó causando brotes esporádicos en equinos y humanos, llegando a alcanzar la frontera con canadá en el año 2001. En el año 2002 ocurre el brote de encefalitis de mayor duración documentado en los Estados unidos por causa de un arbovirus, registrándose actividad del virus en 46 estados, y en zonas fronterizas con canadá y México(8).
El vno continúa su expansión en las américas, evidenciada al registrarse en agosto de 2001 en Florida y en las Islas caimán infecciones humanas confirmadas por medio de métodos serológicos, y el aislamiento del virus a partir de un paciente con enfermedad neurológica(9).
Posteriormente, continúa la evidencia de circulación del virus en el caribe, con los estudios realizados en Jamaica en el año 2002, en los que se registraron 18 aves residentes seropositivas de un total de 348 analizadas. Las muestras se tomaron durante el primer trimestre del 2002, reflejando probablemente que la transmisión ocurrió durante el año 2001(10).
En el año 2002, en Guadalupe, mediante el análisis de muestras de sueros de caballos y pollos por medio de la prueba serológica de neutralización por Reducción en placas (PNRP), se confirma la presencia del virus en esa región al obtenerse seropositividad en los sueros de estos animales(11).
En noviembre del mismo año, Komar y col. realizaron un muestreo en la isla La española: en primer lugar se tomaron muestras de tejidos de ojos, bazos y riñón de un total de 89 aves de 29 especies (25 residentes, 4 migratorias) en el parque nacional sierra de Baoruco y de 58 aves de 27 especies (18 residentes, 9 migratorias) en el parque nacional Los Haitises ubicado al noreste de la República dominicana. de este grupo de aves muestreadas se obtuvo muestras de sangre de 41 (18 especies residentes) de la sierra de Baoruco y 33 (16 especies residentes) de Los Haitises, analizándose por la técnica de PNRP, encontrando que cinco (5) fueron seropositivas al VNO, tanto por la técnica de Bloqueo de epítopes como por PNRP(12).
En México, en julio del 2002, se evidenció la circulación del virus del nilo occidental, al encontrar seropositividad en caballos en un muestreo que abarcó seis estados(13). en otro estudio en aves, realizado en los primeros meses del invierno del año 2003, la seropositividad encontrada fue muy baja. con base en estos resultados se incrementaron los estudios de seroprevalencia, tanto en aves como en caballos, en 22 estados del país, obteniéndose seropositividad principalmente en equinos. ese mismo año se logró el aislamiento del virus a partir de un cuervo (Corvus corax) muerto en cautiverio, en un zoológico ubicado en la ciudad de tabasco-México, así como de otras aves muertas al noroeste del país(14) (15). Al año siguiente se reportan por primera vez seis casos humanos, tres de ellos con síntomas de encefalitis(16).
Evidencia de circulación del VNO se encontró en el salvador, entre noviembre 2001 y abril 2003, durante un brote de enfermedad de etiología desconocida que causó una epizootia en caballos, mediante técnicas serológicas se evidenció la infección por el VNO(17).
tomando en consideración los hallazgos relacionados con la transmisión del vno en la región, en Guatemala, entre septiembre de 2003 y marzo de 2004, se llevó a cabo un estudio en 19 departamentos, confirmándose la circulación del VNO al resultar positivas 149 muestras de sueros de caballos (de un total de 352) por la técnica serológica del bloqueo de epitopes que utiliza un monoclonal específico para el VNO(18). simultáneamente, se registra en Belice seropositividad en caballos y un caso de encefalitis equina por VNO(19).
La actividad del VNO continúa detectándose en la región este del caribe, específicamente en las Bahamas, cuando se notifica un caso de encefalitis en humano en el año 2003(20).
A principio del año 2004, en la Base naval de Guantánamo-cuba, de un total de 734 aves muestreadas, dos resultaron seropositivas. paralelamente en la parte oriental de puerto Rico, de un total de 1.200 aves muestreadas, una resultó seropositiva. entre los meses de mayo y julio de ese mismo año, se reportaron tres caballos seropositivos en esa región y dos más en la parte central del la isla(14).
En el mismo año en trinidad, ocho caballos de un total de doscientos, y dos patos domésticos de un total de cuarenta aves, resultaron seropositivas al VNO(20). posteriormente, en noviembre de 2004, durante una vigilancia serológica realizada en dos departamentos de la costa caribeña colombiana (córdoba y sucre) se encontraron 12 equinos positivos de un total de 130 analizados, verificándose la circulación del virus en el sistema local(21).
En enero de 2005, se reportan cuatro caballos seropositivos en la ciudad de La Habana-cuba y tres casos de encefalitis en humanos en el centro del país(14).
La evidencia más reciente de la circulación del VNO en las Américas se detecta en Argentina y Venezuela. en argentina, en febrero del 2006, se aísla el virus a partir de muestras de cerebro de tres caballos con diagnóstico de encefalitis, los cuales pertenecían a diferentes haras de la parte central de argentina, sin antecedentes de viaje fuera del país(22). en Venezuela, en el año 2006, se analizaron muestras de sueros de equinos y aves, colectadas entre febrero 2004 y mayo de 2006, utilizando la ELISA de captura de anticuerpos tipo IgG contra el VNO y confirmada por la PNRP. se encontró que de un total de 791 sueros de caballo y 576 sueros de aves muestreados en 33 municipios del país, 34 resultaron positivos en equinos y 5 en aves residentes, 3 aves pertenecientes a la especie T. leucomelas, 1 a C. flaveola y 1de la especie G. gallus como primera evidencia de circulación local y amplia diseminación en Venezuela(23).
Biología del virus del Nilo Occidental
El VNO es un arbovirus perteneciente a la familia Flaviviridae de forma esférica y su cápside posee una envoltura lipídica. tiene un diámetro aproximado de 50 nm y un genoma ARN de cadena simple y polaridad positiva(24). el genoma contiene una región no codificante en los extremos 5 y 3 de 96 y 631 nucleótidos, respectivamente. estos extremos contienen estructuras terciarias que cumplen funciones regulatorias importantes en la replicación y en el ensamblaje del virus. dichas regiones flanquean un único marco abierto de lectura de 10.302 nucleótidos que codifican una poliproteína. esta poliproteína es clivada por proteasas virales y celulares en tres proteínas estructurales: 1) la proteína de la cápside (c), la cual presenta un tamaño de 12 Kda; 2) la proteína principal de envoltura (e), de 53 Kda; y 3) la pro teína de membrana (M); de 8 Kda. La proteína M deriva de una proteína precursora (prM) de 18-20 kda, la cual es clivada antes de que el virión se libere de la célula hospedadora.
Adicionalmente, producto de este clivaje, se generan 5 proteínas no estructurales, ns1, ns2a/ns2b, ns3, ns4a/ns4b y ns5, las cuales tienen funciones en los mecanismos de replicación, ensamblaje y liberación del virión(24, 25, 26).
Relaciones filogenéticas del VNO
El VNO está filogenéticamente relacionado al complejo de la encefalitis japonesa, que incluye el virus de la encefalitis japonesa (JEV) en asia, la encefalitis del valle de Murray (MVEV) y el virus alfuy (ALFV) en Australia, los virus Koutango (KOUV) y usutu (USUV) en áfrica y los virus de la encefalitis de san Luis (SLEV), Ro cio (ROCV), Ilheus (ILHV) y cacipacore (CPCV) en las Américas(25).
El análisis de las secuencias nucleotídicas que codifican la proteína E es quizás el que ha revelado más nítidamente las relaciones filogenéticas entre los aislados del VNO, encontrándose dos linajes genéticos característicos. Las cepas del linaje 1 se encuentran en Norteamé rica, Europa, África, Asia y Australia, mientras que las cepas del Linaje 2 han sido aisladas sólo en el África subsahariana y Madagascar, e incluye la cepa prototipo deUganda aislada en 1937(1, 26).
Las cepas del linaje 1 han sido divididas en cuatro clados: Kunjin, Indian, a y B. Los aislados pertenecientes al clado B, incluye las cepas aisladas en EE.UU. de alta virulencia en ratones. el linaje 2 y otros clados del linaje 1 comprenden tanto cepas virulentas como atenuadas, pero por lo general se encuentran circulando en ciclos enzoóticos en aves. La diferencia en la patogenicidad podría estar relacionada a nucleótidos que codifican para regiones especificas en la prM, en la de envoltura (e) o en las proteínas no estructurales del virus(27).
Ecología
El ciclo natural de todos los miembros del complejo antigénico de la encefalitis japonesa envuelve a las aves como los principales hospedadores amplificadores y algunas especies de mosquitos como vectores. en el caso del VNO, el ciclo típicamente envuelve mosquitos ornitofílicos, principalmente del género Culex sp. La identidad de los vectores primarios y las especies de hospedadores vertebrados es dependiente del área geográfica y los niveles de virus circulante(25). No obstante, hay un amplio rango de especies tanto de aves como de mosquitos que pueden ser infectados(28). Estudios ecológicos realizados en Egipto, entre los años 1952-1954, establecieron el ciclo del virus, el cual involucra también a humanos y caballos como hospedadores incidentales finales. Estos estudios a su vez indican que el agente puede ser introducido en nuevas áreas por aves migratorias( 29) (1). En la figura 3 se muestra el ciclo de transmisión del VNO.
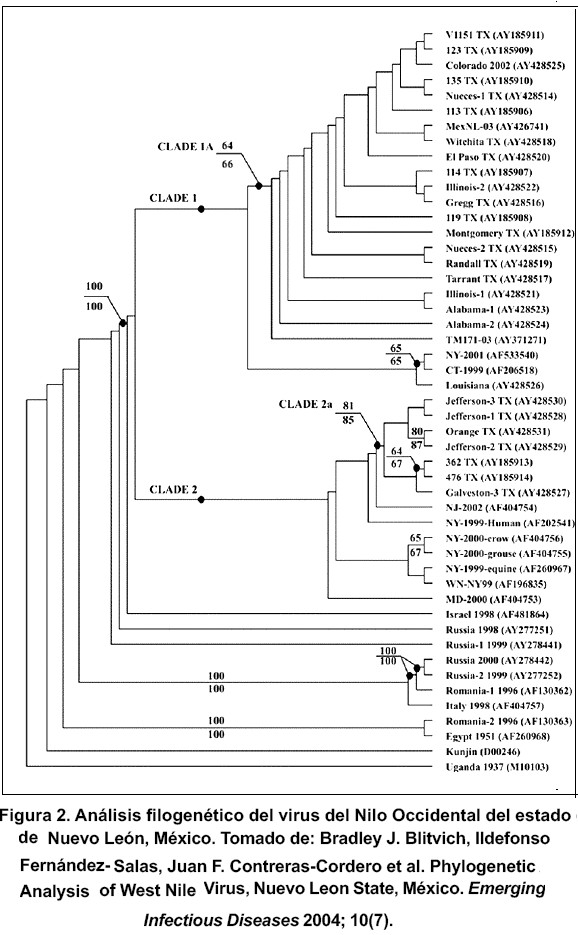
Durante los períodos en donde mosquitos adultos se alimentan de la sangre de vertebrados, el VNO puede ser transmitido constantemente entre los vectores mosquitos y los hospedadores reservorios aviares. Los hospedadores vertebrados competentes podrían sostener una viremia por más de cinco días, momento en el cual otros insectos vectores podrían alimentarse de estos hospedadores virémicos e infectarse. al igual que en otros arbovirus, el tiempo que transcurre desde que el mosquito adquiere la infección hasta que está en capacidad de transmitirla, al alimentarse nuevamente, depende entre otros factores, de la temperatura y humedad del ambiente. este período llamado tiempo de incubación extrínseco dura aproximadamente 2 semanas en épocas cálidas, en el cual el virus se replica en el organismo del vector y luego invade las glándulas salivales( 28). Después de este período, si se mantiene el ciclo, un gran número de mosquitos infectados podrían alimentarse nuevamente de hospedadores susceptibles e infectarlos.
La influencia de la temperatura tanto en la reproducción del mosquito vector, como en la replicación viral, resulta en una variación altamente estacional de la transmisión del VNO y de los brotes de la enfermedad. en zonas templadas como Europa, Canadá y en el noroeste de estados unidos, muchos casos de encefalitis se dieron a finales del verano y principio del otoño, cuando tanto la densidad poblacional de mosquitos como la temperatura son altas(25).
Tanto el título de viremia como su duración son más altos en las aves que en los mamíferos, variando enormemente entre las diferentes especies de aves. Los mamíferos incluyendo al hombre y al caballo, no desarrollan, por lo general, títulos virémicos altos suficientes para infectar a los mosquitos, por lo que es poco probable que contribuyan con el ciclo de transmisión.
La importancia de las diferentes especies de mosquitos en el ciclo de transmisión del VNO es afectada por la competencia de cada una de las especies en ser infectada. La subsecuente transmisión del virus, la densidad del mosquito, sus preferencias alimenticias por un determinado hospedador, la actividad estacional y la tasa de contacto entre hospedador competente y vector son otros de los factores implicados en la efectividad del vector mosquito en dicho ciclo de transmisión.
Existen especies de mosquitos del género Culex que se alimentan de la sangre tanto de aves como de mamíferos. Estas especies de mosquitos podrían funcionar como importantes vectores puentes que diseminarían la infección a caballos y al hombre, entre otros vertebrados, a partir de aves infectadas(28).
HOSPEDADORES INVERTEBRADOS
La transmisión del virus por artrópodos incluye el ciclo de transmisión por vectores a hospedadores no infectados(30). En el ciclo primario, las especies del género Culex parecen ser el principal vector implicado en el ciclo de amplificación aviar. Algunos mosquitos del género Cx pipiens tienen hábitos alimenticios oportunistas, alimentándose tanto de mamíferos como de aves, y se infectan cuando se alimentan de aves virémicas, siendo capaces de transmitir el virus a otros hospedadores tanto amplificadores como no amplificadores. En el brote de Bucarest en el año 1996 el vector implicado fue Cx pipiens(31).
Los mosquitos vectores del VNO de gran importancia en Europa, África, el Medio Oriente y Asia, son en su mayoría ornitofilicos del género Culex, incluyendo Cx. Tritaeniorhynchus en Sur Asia; Cx annulirostris en Australia, Cx perexiguus en el norte de África y el Medio Oriente; Cx univittatus en el Subsahara Africana, y las especies de Cx pipiens y Cx quinquefasciatus en regiones donde sus intervalos de distribución se solapan con la actividad del VNO(8).
En Nueva York, durante el brote de 1999, se obtuvieron 15 aislados a partir de varias especies de mosquitos Culex, entre ellos Cx. pipiens, Cx. salinarius, y Cx. restuans(32).
Se han logrado aislamientos del VNO a partir de ciertas especies de garrapatas que pertenecen a las familias Ixodidae y Argasidae, pero su papel, al igual que el de otros géneros de mosquitos en salud pública, se desconoce(33).
HOSPEDADORES VERTEBRADOS
Las aves representan los hospedadores vertebrados primarios para el VNO y se infectan con gran frecuencia, tal como se determinó por amplios estudios serológicos en aves y mamíferos en países como Egipto, Israel, Pakistán, Rumania, entre otros(34) (35) (36) (37) (38).
Las epidemias en Nueva York en 1999 y en Israel (1997-2000) se caracterizaron por presentar un gran número de cuervos y gansos muertos respectivamente, a diferencia de las epidemias ocurridas por el VNO en el Viejo Mundo, que reportaron pocas epizootias en aves(1). Una posible explicación para las altas tasas de mortalidad en aves es la introducción de una cepa aviar más virulenta. Estudios realizados en Estados Unidos por Lanciotti RS et al apoyan esta hipótesis al evidenciar que los aislados virales del brote en la ciudad de Nueva York en 1999, mostraron un 99,8% de similitud genómica con la cepa aislada del cerebro de un ganso muerto en Israel en 1998(39).
Evidencias serológicas de infecciones por el VNO en equinos han sido señaladas desde al año 1956 en Egipto, 1960 en Israel y de enfermedad neurológica y/o epizootias en Marruecos (1996), Italia (1998), Francia (1998-1999-2003), Estados Unidos (1999-2005), Canadá (2002), Belice (2003), Argentina (2006)(30)(40).
Después del brote de 1999, Komar y Col. evaluaron la exposición del VNO en mamíferos domésticos y peridomésticos de algunos condados de la ciudad de Nueva York, utilizando la técnica de neutralización por reducción en el número de placas (PRNT). De los mamíferos estudiados (73 caballos, 189 perros y 12 gatos), 3% de los caballos (2) y 5% de los perros (10) fueron sero-positivos, mientras en los gatos no se detectaron anticuerpos. Estos investigadores realizaron un estudio adicional experimental en caballos, encontrando que eran reservorios incompetentes al alcanzar un nivel de viremia mucho menor del que se necesita para infectar mosquitos vectores(8). Evidencias del VNO en otros mamíferos, como roedores en Nigeria y murciélagos en la India, han sido señaladas, sin embargo éstos no generan niveles de viremias suficientes para contribuir significativamente en la transmisión(41).
Estudios realizados en Rusia con la rana de la especie Rana ridibunda evidenciaron que era un reservorio competente(42). Altos niveles de viremia con títulos suficientes para infectar mosquitos se encontraron después de que cocodrilos (Alligator mississippiensis) jóvenes fueron infectados experimentalmente(43).
Se han detectado anticuerpos contra el VNO en muchas especies diferentes de vertebrados que incluyen animales de granja, animales domésticos y silvestres. La diferencia de la seroprevalencia en estas especies podría estar relacionada con la susceptibilidad del hospedero, condiciones ambientales que favorezcan la exposición a los mosquitos, y/o a otros factores que pudiesen estar relacionados con la patogenicidad de la infección por el VNO.
MANIFESTACIONES CLÍNICAS EN HUMANOS
La infección por el VNO causa un espectro de manifestaciones que va desde la infección subclínica hasta la muerte. La mayoría de estas infecciones son sub-clínicas. En los casos sintomáticos, las manifestaciones clínicas se desarrollan entre un lapso de tiempo entre 2 y 21 días después de la infección. Los casos en donde no hay evidencia de manifestaciones neurológicas generalmente no requieren hospitalización y son denominadas fiebre del Nilo Occidental, caracterizada por fiebre y cefalea.
En un estudio cuyo objetivo principal era describir los síntomas y secuelas de la fiebre del Nilo Occidental, Watson et al en el año 2004 seleccionaron 98 habitantes de una comunidad en Illinois-Estados Unidos, con evidencia de infección por virus del Nilo, sin historia de evidencia clínica previa de meningitis, encefalitis o parálisis flácida aguda. Los síntomas registrados fueron: fatiga 96%, fiebre 81%, dolor de cabeza 71%, debilidad muscular 61%, dificultad de concentración 53%, encontrándose que en 63% de los pacientes algunos síntomas persistieron por 30 días(44). Dos casos de infección con manifestaciones neuromusculares por el virus del Nilo se observaron en un centro de cuidado para la tercera edad(45).
Antes de 1996, pocos pacientes infectados por el virus sufrieron manifestaciones neurológicas, pero las encefalitis severas y a menudo fatales que han sido aso ciadas con brotes subsecuentes, han sido sorprendentes. Durante las principales epidemias a partir del año 1996, un gran porcentaje de pacientes después de algunos días de fiebre progresaron al típico síndrome de meningoencefalitis. Aproximadamente, 60% de estos individuos presentaron alteraciones del estado mental que indicaron encefalitis. Un porcentaje superior a 13% de estas infecciones progresaron a coma. Dos terceras partes de los casos con manifestaciones que comprometen al sistema nervioso central se presentaron como encefalitis, observándose fiebre, dolor de cabeza, cambios del estado mental, debilidad muscular, náuseas y vómitos. La debilidad muscular es un síntoma que prevalece en la presentación clínica de la encefalitis por VNO. También han sido descritas otras manifestaciones tales como depresión profunda de los reflejos de tendones, difusa debilidad muscular, parálisis flácida y fallas respiratorias(46).
Además de la meningitis y encefalitis, otras manifestaciones neurológicas de la infección por VNO incluyeron ataxia, síndrome extrapiramidal y neuropatías craneales. Las convulsiones no son comunes, en contraste con otras encefalitis virales. La meningitis causada por infección del VNO es una típica meningitis aséptica viral con baja mortalidad, representando entre un 20 y 30% de las infecciones del sistema nervioso central asociada con este virus(47) (48).
Otros hallazgos incluyen poliomielitis parecida a una parálisis flácida, síndrome de Guillan–Barré, acentuada debilidad muscular y anormalidades oculares que incluyen uveítis, vitritis y corioretinitis(8).
La virulencia y neuroinvasividad de los virus probablemente se relaciona con el nivel y duración de la viremia en los individuos infectados, así como también de la preservación relativa del endotelio cerebro-vascular. En casos fatales, el foco inflamatorio más común es el del tallo cerebral pero el tálamo, cerebelo y la corteza cerebral también podrían estar involucrados. En contraste con otras infecciones de arbovirus, el infiltrado inflamatorio es mínimo y no hay vasculitis(47).
MANIFESTACIONES CLÍNICAS EN EQUINOS
La infección por el VNO en caballos y otros équidos domésticos tiene un rango que abarca desde los casos asintomáticos hasta las encefalitis fatales, sólo 10-12% aproximadamente se presenta como enfermedad clínica(49). En los recientes brotes se ha observado un aumento en la proporción de enfermedad neurológica en caballos, con una aproximación de 10% de los caballos infectados por el virus que presentan manifestaciones neurológicas(5).
Los signos clínicos de la enfermedad podrían confundirse con otras encefalitis equinas, tales como: Rabia, Herpes tipo-1, encefalitis equina por protozoarios, encefalitis equina venezolana y del Este, por lo que las pruebas diagnósticas diferenciales son necesarias para un diagnóstico definitivo. Las muestras que se deben tomar en cuenta para el diagnóstico son sangre total, suero y líquido cefalorraquídeo.
Exceptuando la fiebre, los signos clínicos de la enfermedad por el VNO en equinos, son casi exclusivamente de naturaleza neurológica, reflejando la patología en el sistema nervioso central, afectando principalmente a la médula espinal, el romboencéfalo y mesencéfalo, siendo la corteza cerebral la menos afectada(25). Los signos más comunes de daño de la médula espinal son ataxia, parexia o parálisis de los miembros, afectando un miembro o dos (usualmente los miembros posteriores), o todos los miembros progresando a recumbencia. A menudo, estos signos son acompañados por fasciculaciones de la piel, temblores musculares y rigidez muscular. Adicionalmente, en los brotes en equinos ocurridos en Estados Unidos se ha observado manifestación de síntomas que indican un daño a nivel de médula oblongada, del tálamo, de la formación reticular, del cerebelo y de la corteza cerebral(50).
Una gran proporción de caballos infectados por el VNO y que presentan la enfermedad no se recuperan y mueren, o a menudo son sacrificados por eutanasia. Las tasas de mortalidad en caballos afectados clínicamente han sido estimadas alrededor de 38%, 57,1% y 42% durante los brotes en Estados Unidos año 2000, Francia 2000 e Italia 1998, respectivamente. En contraste con la enfermedad en humanos, la enfermedad neurológica severa en caballos no está relacionada con la edad del individuo(25).
En Estados Unidos no se habían registrado hallazgos patológicos de caballos infectados, se presumía que era similar a la descrita durante el brote equino ocurrido en Italia en 1998, en donde se observó que la médula espinal fue la más afectada(40).
En un estudio sobre los hallazgos patológicos e inmunohistoquímicos encontrados en tejido cerebral de caballos infectados por el VNO en los brotes equinos de Italia (1998) y Estados Unidos (2000), se observó en los caballos italianos evidencia moderada de polioencefalomielitis, con un constante compromiso de los cuernos ventrales y laterales de la médula espinal toráxico-lumbar y en algunos caballos asociada con una moderada a severa hemorragia, con presencia de pocos linfocitos T, escaso infiltrado perivascular de macrófagos, dispersos nódulos gliales multifocales. En un caballo del noroeste de Estados Unidos las lesiones presentadas eran macroscópicamente evidentes, con petequias esparcidas por todo el romboencéfalo y extensión multifocal por toda la médula espinal. Estas petequias fueron principalmente prominentes dentro del tálamo, el tallo caudal cerebral y los cuernos ventrales. Todos los caballos americanos mostraron cambios microscópicos similares a los que presentaron los italianos.
Las lesiones observadas en los caballos americanos fueron más severas que las presentadas en los caballos italianos estudiados, en donde las lesiones eran moderadas, ubicadas principalmente en la médula espinal en la zona toráxico-lumbar y con medianas lesiones romboencefálicas, mientras que en los caballos americanos las lesiones se evidenciaron en el núcleo basal, la materia gris del tálamo, el cerebro medio y los cuernos ventrales y laterales de la médula espinal(51).
MANIFESTACIONES CLÍNICAS EN AVES
La susceptibilidad de las aves a la infección por el VNO varía entre los diferentes géneros de aves. Las Passeriformes: Corvus brachyrhynchos (cuervo americano), Progne subis (golondrina de Iglesia), Catharus fus cescens (Paraulata Cachetona ), Icterus galbula (Turpial de Baltimore), Dendroica petechia (Canario de Mangle), Dendroica caerulescens (Reinita azul y negra) entre otras, son las más susceptibles, alcanzan niveles de viremia muy altos y excretan un nivel alto de virus tanto en las heces como a nivel oral, encontrándose muchos casos de enfermedad neurológica y altas tasas de mortalidad. Especies de aves pertenecientes al orden Caradriformes: Charadrius vociferus (Playero Gritón) así como también del orden Anseriformes: Anser anser domesticus (Ganso doméstico), también son altamente
susceptibles a la infección y de sufrir la enfermedad. En otras especies de aves, la viremia y la excreción de virus son moderados y es poco frecuente la enfermedad o muerte. Las aves Psittaciformes: Forpus conspicillatus (Periquito de anteojos), Brotogeris jugularis (Periquito bronceado), Amazona ochrocephala (Lora común), Ara sp y las pertenecientes al orden Galliformes: Gallus gallus (Pollo común) son las menos susceptibles(49).
La enfermedad severa y muerte en aves no había sido señalada hasta el año 1998, cuando en un brote ocurrido en Israel, de un total de 400 gansos domésticos 160 desarrollaron encefalitis fatales. Un año más tarde, en el brote ocurrido en la ciudad de Nueva York (Estados Unidos), miles de aves nativas y exóticas murieron, resultando ser las más afectadas las pertenecientes al orden Passeriformes, familia Corvidae, cuyo ejemplar típico, el cuervo americano: Corvus brachyrhynchos sucumbió en gran número ante la infección. Estudios genómicos de los aislados de Israel y de Nueva York, demostraron que eran idénticos y diferían de los aislados de otros brotes anteriores causados por el VNO(52).
En algunas aves infectadas la viremia dura de 1-4 días. Las aves enfermas podrían presentar las siguientes manifestaciones clínicas(8):
– Manifestaciones hemorrágicas, tales como sangre en heces y orina.
– Manifestaciones no neurológicas tales como anorexia y pérdida de peso, depresión, debilidad, miocarditis, pancreatitis.
– Manifestaciones neurológicas: parálisis, temblores, ausencia de coordinación, desorientación y encefalitis que podría conducir a la muerte.
MANIFESTACIONES CLÍNICAS EN OTROS VERTEBRADOS
En vertebrados, diferentes a las aves y equinos, no se había registrado enfermedad neurológica. No obstante, en el otoño de los años 2001 y 2002 en un grupo de cocodrilos de una granja en los Estados Unidos, la infección por el VNO resultó en un brote con manifestaciones neurológicas: presentaban mirada fija, espasmos a nivel de nuca y pérdida de coordinación de los miembros. En dicho brote, de más de 10.000 cocodrilos de esa granja, 250 murieron en el 2001 y más de 1.000 en el 2002; los animales más jóvenes fueron afectados más severamente que los adultos. Interesantemente, se determinó que los cocodrilos fueron alimentados con carne cruda de caballo en la cual se detectó la presencia del virus mediante PCR(53). El virus del Nilo Occidental es altamente patógeno para los cocodrilos y ha sido implicado en dos epizootias de estos animales cautivos en Estados Unidos(54).
La lista de vertebrados susceptibles a la infección por el VNO basada en investigaciones serológicas y enfermedad adquirida naturalmente se incrementa mediante los estudios de inoculación experimental, que han confirmado susceptibilidad en otros animales como ciertas ranas, culebras, iguanas y ratones(30).
DIAGNóSTICO
Humanos
Las infecciones por el VNO deben ser incluidas en el diagnóstico diferencial de enfermedades febriles de etiología a precisar, así como en los casos de meningitis aséptica y encefalitis. Las pruebas serológicas son las principales herramientas de diagnóstico de la infección por el VNO. El ensayo inmunoenzimático (ELISA), de captura de inmunoglobulinas tipo IgM en suero o líquido cefalorraquídeo permite señalar presunción de infección reciente. ésta prueba tiene una sensibilidad cer cana a 100% después de los ocho días de enfermedad. Aunado a esta prueba, la ELISA de captura de anticuerpos IgG específicos al virus del Nilo Occidental en sueros en fase convaleciente, son las herramientas serológicas que pueden contribuir a un primer tamizaje.
La prueba confirmatoria de las pruebas serológicas señaladas anteriormente es el ensayo de neutralización por reducción en el número de placas (PRNT), que disminuye notablemente el problema de reactividad cruzada con otros miembros de la familia Flaviviridae que podría darse en algunos casos estudiados por la ELISA.
En la infección por VNO los anticuerpos tipo IgM en el suero pueden perdurar por un tiempo mayor de 16 me ses en algunos pacientes con encefalitis por el virus, y esta persistencia podría conducir a un diagnóstico errado en pacientes con enfermedad febril aguda o una enfermedad neurológica, o ambas, por lo que se hace necesaria una adecuada interpretación de las pruebas diagnósticas basadas en la historia clínica del paciente(48).
El intento de aislamiento del virus a partir de líquido cefalorraquídeo (LCR), suero o tejidos es posible aunque no siempre sea exitoso. En el caso de pacientes con manifestaciones neurológicas o de fallecidos, se pueden analizar las biopsias o los tejidos de diferentes zonas del cerebro y del corazón principalmente, e intentar aislar el virus por medio de líneas celulares susceptibles, tales como células C6/36 procedentes de mosquito y de células de riñón de mono africano (Vero E6). La identificación del aislado se lleva a cabo por el ensayo de inmunofluorescencia indirecta (IFI), utilizando un anticuerpo monoclonal específico para el VNO.
Simultáneamente se deben realizar estudios histopatológicos e Inmunohistoquímicos de los tejidos seleccionados, pruebas moleculares como la reacción en cadena de la polimerasa (PCR), la prueba de PCR en tiem po real, la reacción en cadena de la polimerasa que utiliza un nested (RT-nestedPCR). Los ensayos de amplificación molecular (PCR) han sido evaluados como método diagnóstico en el estudio de la encefalitis por VNO, demostrando moderada sensibilidad en el diagnóstico de la enfermedad aguda, posiblemente al nivel bajo y transitorio de la viremia(48).
La PCR fue de gran utilidad en el caso de un pa ciente inmunosuprimido con linfoma y en quien se sospechaba de una encefalitis por VNO, los ensayos serológicos fueron persistentemente negativos y la PCR dio positiva(55).
Debido a la baja sensibilidad de la reacción en cadena de la polimerasa convencional en detectar el virus del VNO, se recomienda utilizar otros métodos moleculares más sensibles, como son: la PCR en tiempo real, o la prueba RT-nestedPCR(56)(57).
Aves y equinos
En aves y equinos se realiza una prueba serológica de captura de anticuerpos totales contra el VNO que se de nomina ELISA, de bloqueo de epítopes, que ha demostrado ser bastante sensible y específica(58). Para los casos fatales en equinos se recomienda seleccionar muestras del tejido cerebral para intentar aislar el virus, realizar pruebas moleculares como las ya citadas para humanos, e inmunohistoquímica; y en el caso de aves se puede intentar aislar el virus de tejidos como cerebro, riñón y corazón. La confirmación de la identidad del aislado se lleva a cabo por el ensayo de inmunofluorescencia indirecta (IFI), utilizando un anticuerpo monoclonal específico para el VNO.
Manejo clínico y prevención
Para las infecciones producidas por el VNO no existe tratamiento antiviral específico. Los pacientes con encefalitis producidas por este virus deben ser hospitalizados y manejados como otras encefalitis virales, tales como las causadas por Herpes simple o como las meningoencefalitis bacterianas o como la enfermedad de Guillain-Barré. La mortalidad por encefalitis causada por el VNO es usualmente secundaria, progresando a disfunción neuronal, edema cerebral y falla respiratoria(46).
La terapia de soporte: (soporte respiratorio, prevención y tratamiento de las infecciones bacterianas), es la base del manejo clínico. La ribavirina y el interferón alfa han demostrado eficacia limitada contra el VNO en modelos animales y en estudios in vitro.
No existe vacuna humana, y a causa de la baja incidencia de la enfermedad es poco probable cuando se comparan factores como costo-efectividad(59). La forma más eficiente de reducir las tasas de infección, morbilidad y mortalidad debido a este virus es la reducción del contacto de los mosquitos vectores con los posibles hospedadores, evitando la actividad en áreas donde podrían estar presentes mosquitos infectados, eliminando los posibles sitios de reproducción peridomésticos y el mantenimiento de mallas protectoras en las ventanas y puertas que restrinjan el paso de insectos al interior del hogar(46).
Para los equinos se recomienda la vacunación como primer método de reducción del riesgo de infección por el VNO en aquellas áreas donde la enfermedad se ha presentado o es endémica. Existen dos vacunas auto rizadas para su utilización en equinos: una es la llamada Prevenile, en donde se utiliza el virus vacunal de la fiebre amarilla, y se forma una quimera Virus del Nilo Occidental-fiebre amarilla por medio de tecnología molecular, es una vacuna que confiere alta protección y muy recomendada. La otra es una vacuna recombinante llamada Recombitek, que utiliza un vector modificado
por tecnología recombinante, diseñada por Merial Animal Health Ltd(60). Además existe una vacuna muy prometedora creada por el equipo de laboratorio del Instituto Nacional de Alergia y Enfermedades Infecciosas (NIAID), Estados Unidos, donde se reemplazan segmentos específicos de material genético de un virus relacionado con el VNO, el virus serotipo Den-4, con las correspondientes proteínas del VNO, creando así una vacuna de virus híbrido. éstos experimentos fueron realizados en monos, obteniéndose una gran protección contra la infección(61).
El desarrollo de una vacuna para equinos que utiliza fragmentos específicos de material genético del VNO en lugar de utilizar formas atenuadas o muertas del virus completo representa una innovación verdadera y excitante, cuyos beneficios van más allá de la prevención de la enfermedad del VNO en equinos, constituyendo la base para una futura vacuna segura y efectiva para los seres humanos.
CONCLUSIONES Y RECOMENDACIONES
El impacto en salud pública y veterinaria del virus del Nilo Occidental en regiones como en la América Central y del Sur, en donde otros flavivirus circulan no puede predecirse, desconociéndose su futura dinámica en estas regiones. Así mismo, se desconoce el papel que jugarán los anticuerpos heterólogos a otros virus del serocomplejo de la encefalitis japonesa que están presentes en aves y otros hospedadores vertebrados.
Venezuela, por su ubicación geográfica, diversidad de posibles reservorios y vectores, y características climatológicas de predominio tropical, reúne todas las condiciones que favorecen el establecimiento del virus del Nilo Occidental. Este escenario pudiera favorecer la aparición de epizootias en aves, o en equinos, y posibles casos humanos, tanto sintomáticos como asintomáticos.
La evidencia de circulación en Venezuela del virus coloca en riesgo de sufrir la fiebre del Nilo Occidental o de meningoencefalitis a los humanos, equinos y a las poblaciones aviares de nuestro país, por lo que se recomienda se considere a este agente en el diagnóstico diferencial de enfermedades virales de humanos y otros vertebrados de interés veterinario.
La vigilancia de arbovirus y el reforzamiento de los programas de control de posibles vectores, de la vigilancia de enfermedad en aves, equinos y humanos, son esenciales. Aunado a esto, el monitoreo y diagnóstico temprano de este riesgo potencial para nuestro país. Además es importante destacar la necesidad de ampliar los sistemas de vigilancia a otras especies de reservorios y hospedadores potenciales como fue destacado en esta revisión.
Es importante señalar que esta enfermedad que pertenece al grupo de otras ya bien conocidas como zoonosis, constituye una frontera en donde se solapan la medicina humana y la veterinaria. Es por ello que el trabajo en conjunto del grupo de salud animal como de salud pública, se hace necesario.
AGRADECIMIENTOS
Deseamos darle nuestro agradecimiento a: Dra. Patricia Chacón, jefe de la División de Enfermedades Transmisibles, Gerencia de Diagnóstico y Epidemiología-Instituto Nacional de Higiene Rafael Rangel. Dr. Juan Carlos Navarro, Profesor Investigador de la Facultad de Ciencias UCV Dra. Carmen Estévez, Médico Veterinario, Departamento de Bioterio, Instituto Nacional de Higiene Rafael Rangel. Dr. Jorge Albornoz, Médico Veterinario, Departamento de Bioterio, Instituto Nacional de Higiene Rafael Rangel. Dr. Enrique López, Médico Patólogo, jefe del Departamento de Patología, Instituto Nacional de Higiene Rafael Rangel, por sus recomendaciones y opiniones en la ejecución de esta revisión bibliográfica.
REFERENCIAS
1. zeller H, Schuffenecker I. West Nile Virus: an overview of its spread in Europe and the Mediterranean in contrast to it's spread in the Americas. Eur J Clin Microbiol Infect Dis; 2004;3:147-156. [ Links ]
2. Weinberger M, Pitlik S, Gandacu D, Lang R, Nassar F, Ben David D, et al. West Nile fever outbreak, Israel, 2000: Epidemiologic aspects. Emerg Infect Dis; 2001; 7(4): 686-691. [ Links ]
3. Hubálek z, Halouzka J. West Nile fever a reemerging mosquito-borne viral disease in Europe. Emerg Infect Dis; 1999; 5(5): 643-50. [ Links ]
4. Valles X, Sánchez F. West Nile Virus; el virus de la fiebre del Oeste del Nilo. Enf Emerg; 2000; 2(4): 232-238. [ Links ]
5. Petersen L, Roehrig J. West Nile Virus: A Reemerging Global Pathogen. Emerg Infect Dis; 2001; 7(4): 611-614. [ Links ]
6. Hayes C. West Nile Virus: Uganda, 1937, to New York City, 1999. Ann NY Acad Sci; 2001; 951: 25-37. [ Links ]
7. Kulasekera V, Kramer L, Nasci R, Mostashari F, Cherry B, Trock S, et al. West Nile Virus infection in mosquitoes, birds, horse and humans, Staten island, New York, 2000. Emerg Infect Dis; 2001; 7(4): 722-725. [ Links ]
8. Komar N. West Nile Virus: Epidemiology and ecology in North America. Adv Vir Res; 2003;61:185-234. [ Links ]
9. Huang C, Slater B, Rudd R, Parchuri N, Hull R, Dupuis M, et al. First isolation of west Nile Virus from a Patiente whit encephalitis in the United States. Emerg Infect Dis; 2002;8(12):1367-1371. [ Links ]
10. Dupuis A, Marra P, Kramer L. Serologic evidenc of West Nile virus transmission, Jamaica, West Indies. Emerg Infect Dis; 2003; 9(7): 860-63. [ Links ]
11. Quirin R, Salas M, zientara S, zeller H, Labie J, Murri S, et al. West Nile virus, Guadeloupe. Emerg Infect Dis; 2004; 10(4): 706-708. [ Links ]
12. Komar O, Robbins M, Klenk K, Blitvich B, Marlenee N, Burkhalter K, et al. West Nile virus transmission in resident birds, Dominican Republic. Emerg Infect Dis; 2003; 9(10): 1299-1302. [ Links ]
13. Blitvich B, Fernandez I, Contreras J, Marlenee N, Gonzalez J, Komar N, et al. Serologic Evidence of Wet Nile Vi rus infection in horses, Coahuila State, México. Emerg Infect Dis; 2003; 9(7): 853-856. [ Links ]
14. Komar N, Clark G. West Nile virus activity in Latin America and the Caribbean. Rev Panam Salud Pública; 2006; 19(2): 112-117. [ Links ]
15. Estrada J, Navarro R, Beasley D, Coffey L, Carrera A, Travassos da Rosa A, et al. West Nile Virus in Mexico: Evi dence of widespread circulation since july 2002. Emerg Infect Dis; 2003; 9 (12): 1604-1607. [ Links ]
16. Ramos C, Falcón Lezama J. La fiebre del Nilo Occidental una enfermedad emergente en México. Salud Pública Mex; 2004; 46(5): 488-90. [ Links ]
17. Cruz L, Cárdenas V, Abarca T, Rodríguez T, Serpas M, Fontaine R, et al. Serological evidence of West Nile Virus activity in El Salvador. Am J Trop Med Hyg; 2005; 72(5): 612-615. [ Links ]
18. Morales M, Morales H, Blitvich B, Powers A, Davis A, Klein R, et al. West Nile Virus in Horses, Guatemala. Emerg Infect Dis; 2006; 12(6): 1038-39. [ Links ]
19. World Organization for Animal Health (OIE). West Nile fever in Belize in October 2003. Disease Information 2004;17(10):5 March 2004. Available from: http://www.oieint/eng/info/hebdo/AIS_55.HTMAccessed 17 May 2007. [ Links ]
20. Caribbean Epidemiology Center (CAREC). Recom mendations for West Nile virus surveillance in the Caribbean 2004. Available from http://www.carec.org/west-nile-2004/ . Accessed 15 May 2007. [ Links ]
21. Mattar V, Edgard S, Laguado J, González M, Álvarez J, Komar N. West Nile Virus infection in Colombian horses. Emerg Infect Dis; 2005; 11(9):1497-98. [ Links ]
22. Morales M, Barrandeguy M, Fabbri C, Garcia J, Vissani A, Trono K, et al. West Nile Virus Isolation from Equines in Argentina. Emerg Infect Dis; 2006; 12: 1559-61. [ Links ]
23. Bosh I, Herrera F, Navarro J, Lentino M, Dupuis A, Maffei J, et al. West Nile Virus Venezuela. Emerg Infect Dis; 2007; 13(4): 651-653. [ Links ]
24. Mukhopadhyay S, Kim B, Chipman P, Rossmann M, Kuhn R. Structure of West Nile Virus. Science, 2003; 302(5643): 248. [ Links ]
25. Castillos J, Wood J. West nile Infection of horse. Vet Res; 2004; 35: 467-483. [ Links ]
26. Brinton M. The Molecular Biology of West Nile Virus: a new invader of western hemisfhere. Ann Rev Microbiol; 2002; 56: 371-402. [ Links ]
27. Hayes E, Sejvar J, zaki S, Lanciotti R, Bode A, Campbell G. Virology, Pathology and Clinical Manifestations of WNV. Emerg Infect Dis; 2005; 11(8): 1174-79. [ Links ]
28. Bernard K, Kramer L. west Nile Virus Activity in the United State. Viral Immunol; 2001; 14: 319-338. [ Links ]
29. Hayes C. West Nile Fever In: the arboviruses: Epidemiology and Ecology; 1989; (5): 59-88. [ Links ]
30. Van der Meulen K, Pensaert M, Nauwynch H. West Nile Virus in the Vertebrate world. Arch Virol; 2005; 150: 637-657. [ Links ]
31. Tsai T, Popovici F, Cernescu C, Nedelcu N. West Nile encephalitis epidemic in southeastern Romania. Lancet, 1998; 352(9130): 767-71. [ Links ]
32. Molaei G, Andreadis T, Armstrong P, Anderson J, Vossbrinck C. Host feeding patterns of Culex Mosquitoes and West Nile Virus transmission, northeastern united status. Emerg Infect Dis; 2006; 12(3): 468-474. [ Links ]
33. Mumcuoglu K, Banet-Noach C, Malkinson M, Shalom U, Galun R. Argasid ticks as possible vectors of West Nile in Israel. Vector-Borne zoonotic Diseases, 2005; 5(1):65-71. [ Links ]
34. Hayes C. West Nile fever. In: Monath TP, ed. The Arbo viruses: Epidemiology and Ecology. Vol. 5. Boca Raton, FL: CRC Press; 1989:59-88. [ Links ]
35. Taylor R, Work T, Hurlbut H, Rizk F. A study of the ecology of west nile virus in Egypt. An J Tropical Med Hyg; 1956; 5: 579-620. [ Links ]
36. Akov Y, Golwasser R. Prevalence of antibodies to arboviruses in varius animals in Israel. Bull Who; 1966; 34:105-112. [ Links ]
37. Hayes C, Bagr S, Ehmed T, Chowdhry M, Reisen W. West Nile virus in Pakistan: Sero-epidemiological studies in Punjab Province. Trans R Soc Trop Med Hyg; 1982; 76: 431-436. [ Links ]
38. Savage H, Ceianu C, Nicolescu G, Krabatsos N, Lanciotti R, Vladimirescu A, et al. Entomologic and avian investigations of epidemic of West Nile fever in Romania in 1999, with serologic and molecular characterizations of a virus iso late from mosquitoes. Am J Trop Med Hyg; 1999; 61: 600-611. [ Links ]
39. Lanciotti R, Roehrig J, Deubel J, Smith M, Parker K, Steele B, et al. Origin of the WNV responsible for an outbreak of encephalitis in the North Eastern United state. Science, 1999; 286: 2333-337. [ Links ]
40. Murgue B, Murri S, zientara S, Durand B, Durand J, zeller H, et al. West Nile Outbreak in Horses in Southern Fran ce, 2000: The Return after 35 Years. Emerg Infect Dis; 2001; 7: 692-96. [ Links ]
41. Hayes E, Komar N, Nasci R, Montgomery S, O'leary D, Camp bell G. Epidemiology and Transmission Dynamics of West Nile Virus Disease. Emerg Infect Dis; 2005; 11(8): 1167-1173. [ Links ]
42. Kostiukov M, Gordeeva z, Bulychev V, Nemova N, Danijarov O. The lake frog (rana ridibunda)-one of food host of blood-sucking mosquitoes in Tadzhikistana reservoir of the West Nile fever virus. Med Parazitol (Mosk). 1985; 49-50. [ Links ]
43. Klenk K, Snow J, Morgan K, Bowen R, Stephens M, Foster F, et al. Alligators as west nile virus amplifiers. Emerg Infect Dis; 2004; 10: 2150-2155. [ Links ]
44. Watson J, Pertel P, Jones R, Siston A, Paul W, Austin C, et al. Clinical Characteristics and Functional Outcomes of West Nile Fever. Ann Intern Med; 2004; 5(141): 360-365. [ Links ]
45. Madden K. West Nile Virus Infection and Its Neurological Manifestations. Clin Med Res; 2005; 1(2):145-150. [ Links ]
46. Campbell G, Marfin A, Lanciotti R, Gubler D. West Nile Virus. Lancet Infect Dis; 2002; 2(9): 519-29. [ Links ]
47. Marfin A, Gubler D. West Nile encephalitis: an emerging di sease in the United State. Clin Infect Dis; 2001; 33(10): 1713-719. [ Links ]
48. Gelfand M. West Nile virus infection: What you need to know about this emerging threat. Postgraduate medicine, 2003; 114(1): 31-8. [ Links ]
49. Van der Meulen K, Pensaert M, Nauwynch H. West Nile Virus in the Vertebrate world. Arch Virol; 2005; 150: 637-657. [ Links ]
50. Osttlund E, Crom R, Pedersen D, Johnson D, Williams W, Schmitt B. Equine west Nile encephalitis, United States. Emerg Infect Dis; 2001; 7: 665-669. [ Links ]
51. Cantlie C, Del Piero F, Di Guardo G, Arispici M. Pathologic and immunohistochemical finding in naturally accurring West Nile Virus infections in horse. Vet pathol; 2001; 38: 414-421. [ Links ]
52. Kramer L, Bernard K. West Nile virus infection in birds and mammals. Ann NY Acad Sci; 2000; 951: 84-93. [ Links ]
53. Miller D, Maule M, Baldwin C, Burtle G, Ingram D, Hines M, et al. West Nile Farmer Alligators. Emerg Infect Dis; 2003; 9: 794-799. [ Links ]
54. Klenk K, Snow J, Morgan K, Bowen R, Stephens M, Foster F, et al. Alligartors as West Nile Virus amplifiers. Emerg Infect Dis; 2004; 10: 2150-2155. [ Links ]
55. Huang C, Slater B, Rudd R, Parchuri N, Hull R, Dupuis M, et al. Firts Isolation of West Nile Virus from a patient with encephalitis in the United State. Emerg Infect Dis; 2002; 8(12): 1367-1371. [ Links ]
56. Johnson D, Ostlund E, Pedersen D, Schmitt B. Detection of North American West Nile Virus in animal Tissue by a reverse Trancription-Nested Polymerase Chain reaction Assay. Emerg Infect Dis; 2001; 7(4): 739-741. [ Links ]
57. Lanciotti R, Kerst A, Nasci R, Godsey M, Mitchell C, Savage H, et al. Rapid Detection of west Nile Virus from Human Clinical Specimens, Field-Colledted Mosquitoes, and Avian Samples by a TaqMan Reverse Transcriptase- PCR Assay. J Clin Microbiol; 2000; 38(11): 4066-4071. [ Links ]
58. Blitvich B, Marlenee N, Hall R, Calisher C, Bowen R, Roehrig J, et al. Epítopes-Blocking Enzyme Linked In munosorbent Assays for the Detection of Serum Antibodies to West Nile Virus in Multiple Avian Species. J Clin Microbiol; 2003; 41(3): 1041-47. [ Links ]
59. zohrabian A, Hayes E, Petersen L. Cost-effectiveness of West Nile Virus Vaccination. Emerg Infect Dis; 2006; 12(3): 375-380. [ Links ]
60. Arroyo J, Millar C, Catalou J, Myers G, Rattenree M, Trent D, et al. Chimerivax, West Nile Virus Live-Attenuated Vac cine: Preclinical Evaluation of Safety, Immunogenicity and Eficacy. J Virol.; 2004; 78(22): 12497-12507. [ Links ]
61. Center for Infectious Disease Research and Policy (CIDRAP). West Nile shot for horses is firs licensed DNA Vaccine. 2005. Available from: http://www.cidrap.umn.edu/cidrap/conent/other/wnv/news/july2105wnv.html. [ Links ]












 uBio
uBio