Revista del Instituto Nacional de Higiene Rafael Rangel
versión impresa ISSN 0798-0477
INHRR vol.44 no.2 Caracas dic. 2013
Valoración de los efectos fisiológicos y neuroquímicos de altas concentraciones de Tetrahidrocannabinol en modelos biológicos
Assessment physiological and neurochemical effects of high concentrations of Tetrahydrocannabinol in biological models
María Luisa Di Bernardo1, Yasmin Morales2, Douglas González3, Alexis Morales1, José Gregorio Salazar1, Lester Rodríguez1.
1 Dr. Química Analítica. Grupo de Investigaciones en Toxicología Analítica y Estudios Farmacológicos (GITAEF). Universidad de Los Andes-Mérida-Venezuela.
2 Farmacéutico. Unidad de Neuroquímica. Centro de Microscopia Electrónica Dr. Ernesto Palacios Prü (CME). Universidad de Los Andes-Mérida-Venezuela.
3 Teniente Coronel Exdirector del Observatorio Venezolano de Drogas- Actual enlace antidrogas en México.
Correspondencia de autor: Dra. María Luisa-Di Bernardo Navas. Grupo de Investigaciones en Toxicología Analítica y Estudios Farmacológicos (GITAEF). Facultad de Farmacia y Bioanálisis. Departamento de Toxicología y Farmacología. Universidad de Los Andes-Mérida-Venezuela. Correo: girard@ula.ve., marydi32@gmail.com.
Resumen
El objetivo de esta investigación fue evaluar los efectos fisiológicos y neuroquímicos en 60 ratones machos cepas Naval Medical Research Institute (NMRI) en edad adulto-joven con pesos promedios de 25,45 ± 3,05 g, sometidos durante seis semanas a dosis del principio psicoactivo de la marihuana el Δ-9-tetrahidrocannabinol en concentraciones entre 4 - 20%. Se realizaron tomas de sangre retroorbital para evaluar parámetros hematológicos y bioquímicos antes, durante y post experiencia. Se monitorearon medidas tales como: peso, ingesta de agua, alimentos, actividad locomotora horizontal y vertical, entre otros. Al final de la experiencia se realizo autopsia y toma de muestras de regiones cerebrales, para medir niveles de neurotransmisores aminoacidicos y dopamina. Estos resultados permiten concluir que altas concentraciones del principio psicoactivo de la marihuana hacen más dependiente al consumidor con los consecuentes daños fisiológicos y neurológicos. Esto lleva a que cada vez se necesite más droga para producir el mismo efecto.
Palabras claves: marihuana, Δ-9-tetrahidrocannabinol, hematología, bioquímica sanguínea, neurotransmisores, dopamina, ratones Naval Medical Research Institute (NMRI).
Abstract
The objective of this research was to evaluate the physiological and neurochemical effects in 60 (Naval Medical Research Institute) NMRI male mice strains in young adult - age average weight 25.45 ± 3.05 g, underwent six weeks at doses of the psychoactive ingredient in marijuana the Δ -9-tetrahydrocannabinol in concentrations between 4-20 %. Retroorbital blood shots were conducted to evaluate hematological and biochemical parameters before, during and post experience. Weight, water intake, food, horizontal and vertical locomotors activity include: measures such as monitored. At the end of the experience autopsy was conducted and sampling of brain regions to measure levels of amino acid neurotransmitters and dopamine. These results suggest that high concentrations of the psychoactive ingredient in marijuana consumers become more dependent with consequent physiological and neurological damage. This leads to more and more drugs is needed to produce the same effect.
Keywords: marijuana, Δ -9-tetrahydrocannabinol, hematology, blood biochemistry, neurotransmitters, dopamine, Naval Medical Research Institute (NMRI) mice.
Recibido: 04 de marzo de 2013 Aprobado: 06 de diciembre de 2013
Introducción
El uso de la marihuana, droga bajo control internacional y cuya sustancia psicoactiva es el Δ -9 tetrahidrocannabinol (THC). Es la droga ilegal más usada y la que más tempranamente se empieza a consumir a la par con el alcohol y el tabaco, se sabe por estudios epidemiológicos que la prevalencia de su uso sobre todo en población joven va en aumento (1,2). En Venezuela el Observatorio Venezolano de Drogas (OVD), dirección adscrita a la Oficina Nacional Antidrogas (ONA) realizo en el año 2011un estudio nacional de drogas en población general (ENADPOG-2011), con resultados que muestran que el 1,08 % de la población con edades entre 12-65 años mantienen patrones de consumo hacia la droga y un 0,61% se encuentra en situación de dependencia a la misma. Por otra parte los centros de tratamiento han venido reportando un incremento en la cantidad de consumidores que solicitan y ameritan atención y tratamiento médico (3).
Se admite que la concentración promedio de THC expresado en porcentaje (peso/peso) en una planta de cannabis es de 4-6, lo que equivale a la concentración típica de un porro-cigarrillo que oscila entre 5 y 150 mg, cuya biodisponibilidad fracción de THC en el cigarrillo que pasa a la sangre, está entre el 5 y el 24 % (entre 0,25 y 30 mg), considerándose que para producir un breve efecto embriagante en consumidores ocasionales son suficientes 2 a 3 mg. El Instituto Nacional de Toxicología Española, hace reportes que en 1994, la concentración media de THC en el cannabis incautado en España oscilaba entre el 4-7%, pero para el 2003 ya se movía en la banda de 10-20% (4-6)
En el año 2009-2010 se realizaron en Venezuela estudios de perfiles químicos-forenses a incautaciones de cannabis realizadas por los diferentes organismos de seguridad, encontrando concentraciones expresadas en porcentajes de THC entre el 10-30%, porcentajes mayores que los encontrados en años anteriores, de lo que se dedujo que la droga es cada vez más potente y tóxica (3,7)
La marihuana ha sido considerado históricamente como una droga relativamente inocua. Sin embargo, en los últimos años existe una creciente evidencia científica de la existencia de efectos adversos y tóxicos de esta droga. En animales, produce síntomas de toxicidad neuroconductual, interfiere todas las fases de la función reproductora gonadal y es fetotóxico. En las personas, se asocia con síntomas de obstrucción respiratoria, metaplasia escamosa, cáncer de boca, lengua y pulmón entre los 19 a los 30 años; altera permanentemente la memoria y el rendimiento psicomotor; sextuplica la incidencia de esquizofrenia; puede causar fetotoxicidad; e inducir leucemia no linfoblástica en hijos de madres consumidoras (8-11)
Además de efectos nocivos agudos y crónicos sobre la salud el uso de la droga aumenta la propensión a conductas de riesgo para adquirir enfermedades de trasmisión sexual, incluida la trasmisión de VIH. Se sabe que existe una fuerte relación entre el uso de drogas y las prácticas sexuales riesgosas (12-14)
Refiere Solowij, que los efectos perjudiciales del THC no sean bien conocidos y se debata permanentemente sobre sus riesgos, junto con opiniones encontradas en cuanto a su legalización, tiene como consecuencia la falta de consenso en la información que los profesionales en el área de ciencias de la salud e instituciones que luchan contra esta adicción deberían dar a los actuales y potenciales consumidores de la marihuana. La droga provoca sensaciones intensas de sed y de hambre, deteriora la memoria en corto plazo (de sucesos recientes) y, por lo tanto, dificulta la realización de tareas complejas (15)
Con el uso de las variedades más potentes de la droga (altas concentraciones de THC) pueden surgir problemas más severos e incluso para realizar tareas sencillas. Debido a los efectos de la droga sobre las percepciones y los reflejos, también puede ser causa de accidentes de tránsito. El seguimiento de personas expuestas a THC desde el inicio de la adolescencia demostró que 5 años después eran más propensos a abandonar los estudios, a no percibir peligro en otras drogas y a involucrarse con mayor frecuencia en actividades delictivas (16-19)
En todas sus formas (marihuana, hachis, aceite) es una droga que altera la función mental (psicoactiva) porque contiene THC, principal componente psicoactivo identificado desde 1914. Se ha informado extensamente que el THC actúa principalmente en el sistema nervioso central (SNC). En comparación con otras drogas psicoactivas, el THC es una sustancia química muy potente. Por vía intravenosa, una dosis de tan sólo 1 miligramo puede producir graves efectos mentales y psicológicos. Tras su inhalación, y una vez en el torrente sanguíneo, el THC llega al cerebro en cuestión de segundos (20,21)
Castillo (22) reporto que al igual que las otras drogas la marihuana eleva los niveles de dopamina en el núcleo accumbens (NAc), una de las estructuras del sistema de recompensa. El descubrimiento es sumamente importante, ya que a la marihuana no se la había podido conectar con el modelo de adicción, por lo que se discutía mucho sobre si lo era o no adictiva. Con esto se zanja la polémica pues ya sabíamos que toda sustancia de abuso que conduzca a la elevación de la dopamina en el núcleo accumbens causa adicción.
Pretender con esta investigación elucidar los efectos del THC a nivel del SNC no es objetivo de la misma, pues es un tema bien discutido y estudiado por muchos investigadores. Sin embargo, actualmente circula a nivel mundial una variedad de la droga con altas concentraciones de THC, lo que podría hacer la droga más adictiva al producir mayor inhibición del ácido gamma-aminobutírico (GABA), por bloqueo del sistema cannabinoide (CB1), específicamente la anandamida (AEA), ocupando sus receptores e inhibiendo las funciones normales de la misma con consecuente excesiva liberación de dopamina, altas cantidades de dopamina estimulan el centro de refuerzo del cerebro y este centro de refuerzo haría que sus consumidores desarrollen mayor dependencia a la droga(22,28,30)
Es aquí donde centraremos nuestra investigación la cual permitirá alertar a la población vulnerable a su consumo y a sus habituados de los daños potenciales que origina esta droga, donde tal vez la planta a sufrido manipulaciones genéticas aumentándole su contenido de THC.
Materiales y métodos
Se trataron 60 ratones cepa NMRI machos, adulto-jóvenes, con pesos promedios 25,45 ± 3,05 g., producidos y mantenidos en el Bioterio de la Universidad de Los Andes (BIOULA), bajo las siguientes condiciones: mantenidos en áreas bajo barreras de ventilación y procedimientos estandarizados, temperatura de 23ºC ± 2, humedad relativa de 75%, con ciclos luz/oscuridad de 12 horas, alimentados con ratarina Protinal® (alimento a base de proteínas crudas: 26%, grasas crudas: 2%, fibra cruda 6%, extractos libres de nitrógeno 40%, suplementada con vitaminas A, B1, B12, D3, E, Acido Pantenoico, Biotina, Colina y Niacina, y minerales trazas Co, Cu, Fe, I, Mn y Zn) sometida a proceso calórico 121ºC/1min., consumieron un promedio de 12,3 g/día, y agua esterilizada Ad Libitum, el encamado con cascara de arroz esterilizado en autoclave. Se contó con el permiso y aval del Comité de Bioética (protocolo CEBIOULA/018), para esta investigación con animales experimentales. Los 60 ratones recibieron dosis vía intraperitoneal calculadas semanalmente por peso corporal para asegurar en los grupos bajo tratamiento la dosificación correcta de los porcentajes de THC ensayados. El grupo control recibió durante toda la experiencia 50µL solución salina 0,1%. Los grupos (n=15) y dosis recibidas se describen a continuación: grupo I (control solución salina 0,1%), grupo II (THC 4,8%-12 µL), grupo III (THC 12 %-30 µL), grupo IV (THC 20%-50 µL). El patrón estándar de THC (Sigma) se preparo diluyendo 100 mg en una solución 0,1% solución salina y posteriormente se enraso a 1000 ml con solución salina. Previo al experimento, durante y final se les tomo muestra de sangre vía retroorbital para realizar parámetros hematológicos (hemoglobina, hematocrito, tiempo de coagulación, formula banca) y bioquímicos (transaminasas y creatinina). Al final del experimento se le tomo sangre intracardiaca para evitar el stress y que el mismo interfiriera en la evaluación de NTs. Se les monitoreo semanalmente ingesta de agua, consumo de alimentos, relación actividad-sueño, conducta, actividad locomotora horizontal y vertical. Transcurridas las seis semanas del experimento los animales fueron sacrificados por la técnica de dislocación cervical e inmediatamente decapitados para la toma de muestra de las regiones cerebrales. Las regiones cerebrales estudiadas (ganglio basal e hipotálamo) fueron removidas e identificadas microscópicamente en lapso inferior a 50 segundos, conservadas en hielo, suspendidas en solución buffer de fosfato 0,05 Molar y trasladadas inmediatamente para su homogenización y derivatización, para posterior análisis por cromatografía liquida de alta eficiencia (HPLC), se utilizo un equipo marca Agilent, serie 1200. Los niveles de NTS excitatorios (glutamato y aspartato) e inhibitorios (GABA y glycina) fueron calculados comparando las áreas pico con estándares y los resultados expresados en mmol/100 mg de proteínas. Las determinaciones de proteínas se realizaron por el método de Lowry modificado y con albúmina de suero bovino como estándar. Los niveles de dopamina se determinaron por HPLC con detección electroquímica, los resultados están expresados en nanogramos por gramos (ng/g). Se realizaron observaciones y evaluaciones de hallazgos anatomopatológicos.
Análisis estadístico de los resultados
Los datos obtenidos fueron expresados como promedios ± desviaciones estándar. Las comparaciones entre los grupos fueron hechas usando el test t de Student para muestras independientes. El promedio de los parámetros evaluados fueron comparados por prueba de medias para medidas repetidas y test de correlación de Pearson. Se utilizo el programa estadístico Statistix 7.0 for Windows y se trabajo con un 95% de confianza.
Resultados y Discusión
Evaluaciones generales
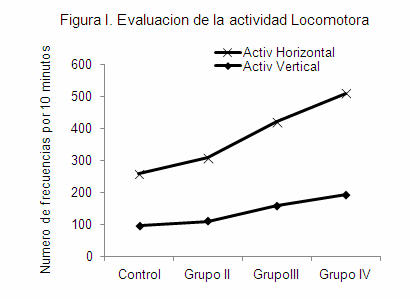
Estas evaluaciones comprendieron monitoreo diario de ingesta de agua, alimentos, actividad locomotora vertical y horizontal automatizada, respiratoria, cardiovascular, horas sueño y comportamiento. Las evaluaciones generales mostraron que el 75% de los animales ensayados e identificados como grupo II, III y IV aumentaron la ingesta de agua y alimentos con respecto al grupo I, siendo más significativo en el grupo III y IV, con ganancia marcada de peso corporal en un 25%. Estos mismos grupos (III y IV) inmediatamente a la dosis (5 minutos) mostraban signos claros de incoordinación locomotora con aumento de su actividad horizontal y vertical (Figura I). Además, fuertes conductas de agresividad demostradas en peleas entre ellos y autoagresión, lo que obligo a individualizarlos en jaulas, inclusive su manipulación era de cuidado. Las conductas agresivas se incrementaban en la primera hora después de administrar la dosis y duraban por espacio de 3 horas, donde finalmente desarrollaban estados de angustia y ansiedad (hiperactividad) para luego caer en un estado de torpeza e incoordinación motora. En el grupo II, la conducta agresiva no fue significativa, mas si la incoordinación motora. La frecuencia cardiaca y respiratoria se vio más comprometida en el grupo III y IV, donde hubo un 15% de mortalidad (colapso cardiovascular y paro respiratorio). El 10 % presento convulsiones previo al deceso.
Se observo en los grupos II, III y IV una edematización generalizada a nivel abdominal, lo que posteriormente fue revelado por autopsia era producto de adherencias viscerales (hígado, páncreas, intestino delgado y vesícula seminal). El grupo III y IV disminuyo en un 55% las horas de sueño con respecto al grupo II y en un 70% con respecto al grupo control, se mantenían hiperactivos (inquietud y movimientos en círculos que no controlaban), lo que nos llevo a pensar que altos porcentajes de THC desarrollan rápidamente dependencia, presumimos explicado por el efecto del THC en el SNC de aumentar la liberación de dopamina.
Evaluación de parámetros hematológicos y bioquímicos.
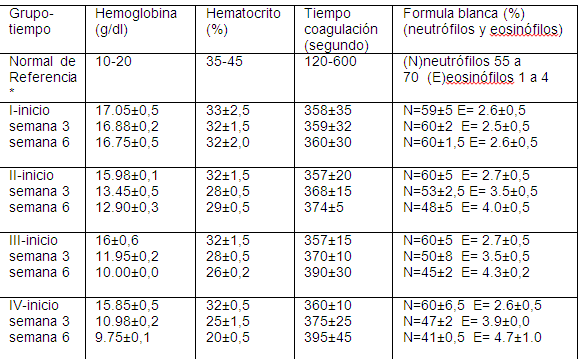
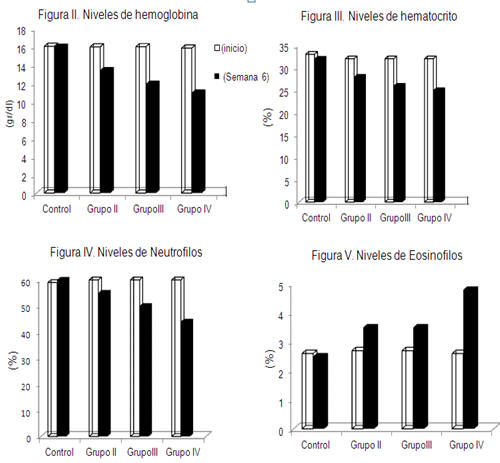
El grupo control (grupo I), mostro niveles promedios de hemoglobina, hematocrito, tiempo de coagulación y formula blanca durante las 6 semanas del estudio dentro de los niveles de referencia reportados como normales(23,24).Los demás grupos mostraron tendencia a disminución de hemoglobina, hematocrito y neutrófilos con aumento de eosinófilos y leve tendencia al aumento del tiempo de coagulación, sin embargo, este ultimo durante las 6 semanas de experiencia se mantuvo dentro de los rangos establecidos como normales, probablemente un tiempo más amplio de experiencia fue necesario para observar cambios en el mismo. Estos resultados evidenciaron daños a nivel del sistema inmunológico con alta predisposición a desarrollar procesos anémicos, infecciosos, inflamatorios y enfermedades alérgicas.
Al realizar el test de correlación de Pearson este mostro relación directamente proporcional entre la concentración de THC y las alteraciones observadas en los parámetros evaluados con un R2= 0,99 y un p= 0.099, lo que indica que a medida que aumentan las concentraciones de THC aumenta la predisposición a sufrir daños a nivel de estos parámetros hematológicos. Este resultado está en concordancia con lo reportado por otros investigadores (2, 6,8) donde indican que el THC induce a daños del sistema inmunológico predisponiendo a sus usuarios a sufrir enfermedades tales como: infecciones, anemias, leucemias linfociticas, enfermedades de trasmisión sexual incluyendo el VIH, entre otras.
En la Tabla I y Figuras II, III, IV y V se muestran estos resultados.
Tabla I.- Valores hematológicos de referencia en ratones y obtenidos en nuestro estudio obtenidos en nuestro estudio desglosado por grupo-tiempo de tratamiento.
Normales de referencia: tener en cuenta que hay influencias considerables de raza, sexo y edad en estas cifras y hay que utilizar animales de la misma edad y sanos como controles.
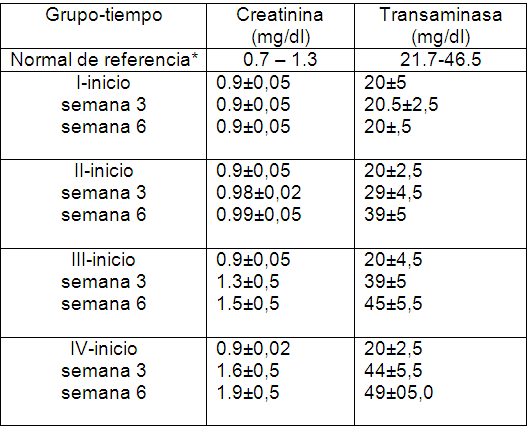
Los resultados obtenidos de los parámetros bioquímicos tales como transaminasas y creatinina se muestran en la Tabla II, estos permitieron evidenciar presencia de un compromiso hepático y renal marcado en el grupo III y IV, sin que se menosprecie lo observado en el grupo II. El valor de referencia de transaminasas y creatinina (23,24) en ratones adultos machos es de 21.7- 46.5 mg/dl y 0,7 - 1,3 mg/dl, respectivamente. El grupo III y IV reportaron valores entre 45-49 mg/dl de transaminasas y 1,5 - 1,9 mg/dl de creatinina, coincidiendo con los que fallecieran por colapso cardiovascular, durante la experiencia. Las transaminasas son enzimas que catalizan la transferencia reversible de un grupo amino entre un aminoácido y un cetoácido. Esta función es necesaria para la producción de aminoácidos esenciales para la síntesis de proteínas. La creatinina confiere un carácter pronóstico y un incremento del riesgo cardiovascular, la literatura reporta que niveles de creatinina alta se presentan en enfermedades renales e insuficiencia renal, con disminución de la filtración glomerular, obstrucción del tracto urinario, reducción en el flujo sanguíneo puede conducir a infarto y fallo cardíaco, shock y deshidratación (25,26)
Tabla II. Niveles de creatinina y transaminasa de referencia en ratones y obtenidos en nuestro estudio desglosado por grupo-tiempo de tratamiento.
*Normales de referencia: tener en cuenta que hay influencias considerables de raza, sexo y edad en estas cifras y hay que utilizar animales de la misma edad y sanos como controles.
Autopsia (Hallazgos anatomopatológicos)
Es de destacar que los ratones bajo dosis variadas de THC durante toda la experiencia, no mostraron daños físicos de interés, solo una inflamación a nivel abdominal, que por autopsia revelo adherencias viscerales. Lo que nos hizo asumir ser producto del tratamiento con la droga, independientemente de la concentración de THC. Consideramos conveniente destacar esta observación, pues sus consumidores y adictos esto es lo que observan, lo que les hace vociferar que se trata de una droga inofensiva, sin embargo, sus graves daños son internos y marcados en órganos vitales.
El grupo III y IV mostro marcada esplenomegalia con tamaño de bazo de 25-30% con respecto al grupo II y 60% con respecto al grupo control, la inflamación de este órgano verifico lo obtenido hematológicamente, donde se evidencio tendencia a predisposición de cuadros infecciosos, tumores genitales,(que no fueron elucidados si eran benignos o malignos), hipertrofia hepática, renal y corazón la cual fue moderada del lado derecho. La hipertrofia hepática y renal igual coincidió con los resultados de los parámetros bioquímicos. La tendencia que se observo de aumento de los tiempos de coagulación, se asume como indicativo de insuficiencia hepática aguda por producción insuficiente de las proteínas de la coagulación. Sin lugar a dudas, el THC es una sustancia química altamente toxica con graves daños a los órganos y sistemas esenciales para el mantenimiento homeostático del organismo, repercutiendo en un deterioro no solo neuropsicológico de los consumidores, sino fisiopatológico muchas veces desapercibido y despreciado, donde la mayoría de sus adictos tienen la falsa creencia de que la misma es una droga natural, inocua, nada tóxica.
Evaluación de neurotransmisores (Aspartato, Glutamato, Glicina, GABA y Dopamina)
Nuestros resultaron mostraron que concentraciones de THC superiores a 4,8 %, originan cambios en los niveles de los NTs aminoacidicos inhibitorios (GABA y glycina) y excitatorios (aspartato y glutamato), con liberación de altas concentraciones de dopamina. Los grupos II, III y IV mostraron valores de dopamina (Figura VI) en el orden de 21±2, 28±3 y 35±5 ng/g respectivamente, en comparación con 18±0,5 ng/g observado en grupo control.
Al realizar correlación de Pearson, la misma mostro una correlación directa y proporcional con un R2 de 0,997 y un p= 0,002, lo que indica que a mayor concentración de THC mayor liberación de dopamina y se asume consecuente bloqueo de la AEA, saturando el receptor de la misma e impidiendo realizar sus funciones. El THC imita a los transmisores cannabinoides naturales, donde se adhiere a los mismos receptores saturándolos. Investigadores (27, 28) han comprobado que las alteraciones en la circulación de la dopamina, como en el caso del consumo de cocaína, produce fenómenos plásticos en los neurorreceptores. Es decir, los encargados de captar la dopamina se hipersensibilizan, esto lleva a que cada vez se necesite más droga para producir el mismo efecto, que al comprobarse la marihuana altera estos circuitos, la hipótesis de que pueda producir las mismas consecuencias negativas que otras drogas, es totalmente válida (29)
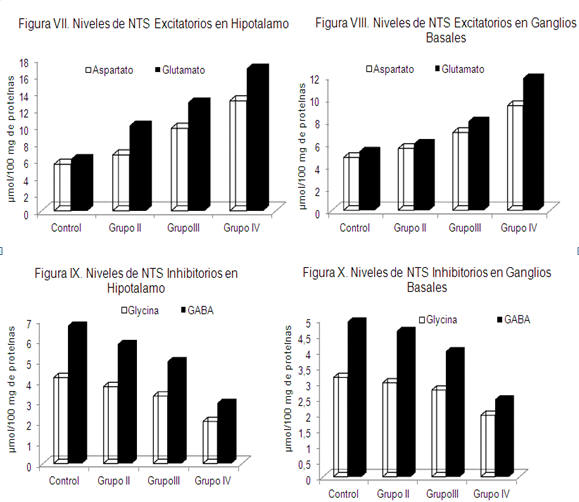
Los ratones del grupo III y IV con concentraciones de 12 y 20% de THC respectivamente, mostraron mayor inhibición del GABA y la glycina, en ambas regiones cerebrales evaluadas con exagerado aumento de los NTs excitatorios (Figuras VII, VIII, IX y X), específicamente el glutamato con valores de 15±2,5 y 22±3,5 µmol/100gr de proteínas en los grupos III y IV, respectivamente. La inhibición extremada del GABA que hace el THC en los grupos III y IV, con respecto al grupo II permitiría explicar la conducta agresiva, el aumento de la actividad locomotora vertical y horizontal, incoordinación motora del movimiento fino, hiperactividad, excesiva ingesta de agua y alimentos, entre otros.
Recomendaciones
Consideramos que es de suma importancia la revisión de los programas de prevención contra el consumo de esta droga, por la necesidad de actualización con las nuevas investigaciones que se realizan de esta sustancia química, donde cada vez hay un incremento de los jóvenes que se exponen a la misma, de la cual fundamentan es una droga natural inofensiva y sin efectos tóxicos sobre el organismo. Son alarmantes y preocupantes los daños severos y acentuados que estas altas concentraciones de THC ocasionaron a los ratones los cuales físicamente no mostraban signos de interés. Sin embargo, al ser sometidos a los análisis bioanalíticos, observar, evaluar los hallazgos anatomopatológicos y neuroquímicos, los daños ocasionados resultaron de gran escala y notabilidad.
Conclusiones
Nuestros resultados permiten concluir con 95% de confianza lo siguiente:
1.-La marihuana independientemente de las concentraciones de THC es una droga altamente toxica y nociva, produce daños marcados y considerables al sistema inmunológico, hepático, renal y nervioso. Las altas concentraciones del principio psicoactivo de la droga predisponen a los consumidores a desarrollar rápidamente adicción y consecuente dependencia.
Referencias Bibliográficas
1.- Robertson JR, Miller P, Anderson R. Cannabis use in the community. Br J Gen Pract, Nov;46(412):671-4. 1996. [ Links ]
2.- Thomas H. A community survey of adverse effects of cannabis use. Drug Alcohol Depend, Nov;42(3):201.1996.
3.- Oficina Nacional Antidrogas. Observatorio Venezolano de Drogas. Revista Balance de la Lucha Antidrogas en Venezuela. Venezuela, 2011.
4.- Observatorio Español sobre drogas: Informe Nº 6. Noviembre 2003. Ministerio del Interior, Delegación del Gobierno para el Plan Nacional sobre Drogas. Madrid, 2003.
5.- Observatorio Español sobre drogas: Informe Nº 4. Marzo 2001. Ministerio del Interior, Delegación del Gobierno para el Plan Nacional sobre Drogas. Madrid, 2001.
6.-L. Gutierrez Rojas, JM. Martínez Ortega, MA. Martínez González. Efectos del cannabis en consumidores jóvenes. Rev. Med. Univ. Navarra; Vol 49 (2), 9-15.2005.
7.- María Luisa Di Bernardo, Yasmin Coromoto Morales, Néstor Uzcateguí, Yoselyn Rojas, Edgar Leónidas Arellano, Karibay Rivas. Estudio botánico y químico de THC en muestras de cannabis sativa l. Una experiencia en Venezuela. RETEL. Vol. 23 (2). 2009.
8. - Nahas G, Latour C. The human toxicity of marijuana. Med J Aust; 156(7):495-7. 1992.
9.-Nahas G. Haschis, cannabis et marijuana. Premièr Edition, Vendôme (France), Presses Universitaires de Fance.1976.
10. - Division of mental health and prevention of substance abuse. World Health Organization. Cannabis: a health perspective and research agenda. WHO/MSA/PSA/97.4, English Only Distr.: General. Geneva. 1997.
11. - Polen MR, Sidney S, Tekawa IS, Sadler M, Friedman GD. Health care use by frequent marijuana smokers who do not smoke tobacco. West J Med; 158(6):596-601. 1993.
12. - Liau A, Dickemente RJ, Wingood GM, Crosby RA, Williams KM, Harrington K, Davies SL, Hook EW 3rd, Oh MK. Associations between biologically confirmed marijuana use and laboratory confirmed sexually transmitted diseases among African American adolescent females. Sex Transm Dis; 29:387-90.2002.
13. - Rostosky SS, Owens GP, Zimmerman RS, Riggle ED. Associations among sexual attraction status, school belonging, and alcohol and marijuana use in rural high school students. J Adolesc; 26:741-51. 2003.
14.- Kingree JB, betz H. Risky sexual behaviour in relation to marijuana and alcohol use among African-American, male adolescent detainees and their female partners. Drug Alcohol Depend; 72:197-203.2003.
15.- Hall W, Solowij N. Adverse effects of cannabis. Lancet;352(9140):1611-16.1998.
16.- Kouri EM, Pope HG Jr, Lukas CE. Changes in aggressive behaviour during withdrawl from long-term marijuana use. Psychopharmacology (Berl); 143: 302-8. 1999.
17.- Cherek DR, Roache JD, Egli M, Davis C, Spiga R, Cowan K. Acute effects of marijuana smoking on aggressive, scape and point maintained responding of male drug users. Psychopharmacology (Berl); 111: 163-8. 2005.
18.- Newcombe T, Bentler P. Consequences of adolescent drug use: impact on the lives of young adults. Newbury Park, CA: Sage 1998.
19.- Brook JS, Balka EB, Whitheman M. The risk for late adolescence of early adolescents marijuana use. Am J Public Health; 89 :1549-54.1999.
20.- Block RI, Farinpour R, Braverman K. Acute effects of marijuana on cognition: relationships to chronic effects and smoking techniques. Pharmacol Biochem Behav; Nov;43(3):907-17. 1992.
21.- L. Chang. Marijuana GM use is associated with a reorganized visual-attention network and cerebellar hypoactivation, Brain; 129: 1096 – 1112. 2010.
22.- Castillo E. El fin de un mito. Rev Que Pasa. 6 (46): 7-9. 2010.
23.- William Medway, D.V.M, James E. Prier, John S. Wilkinson, Patología Clínica Veterinaria, editorial UTEHA, México, 1990.
24.- B. M. Bush, Manual del Laboratorio Veterinario de Análisis Clínicos, editorial ACRIBIA Zaragoza España, 1982.
25.- Bagby GC. Leukopenia and leukocytosis. In: Goldman L, Ausiello D, eds. Cecil Medicine. 23rd ed. Philadelphia, Pa: Saunders Elsevier;chap 173.2007.
26.- Dinauer MC, Coates TD. Disorders of phagocyte function and number. In: Hoffman R, Benz EJ Jr, Shattil SJ, et al, eds. Hoffman Hematology: Basic Principles and Practice. 5th ed. Philadelphia, Pa: Churchill Livingstone Elsevier; chap 50.2008.
27.- Laizure S. Marihuana metabolism and interaction: role of dopamine. Drug Metab Dispos;31(1):16-20.2003.
28.-Ramírez B, Blázquez C, Gómez del Pulgar T, Guzmán M, de Ceballos ML. Prevention of Alzheimers disease pathology by cannabinoids: neuroprotection mediaded by blockade of microglial activation. J. Neuroscienc; (25) 1904-1913. 2005.
29. - Newlin DB, Pretorius MB, Wong CJ, Dax EM. Acute marijuana smoking reduces vagal tone. NIDA Res Monogr;105:565-66. 1999.
30. - Chait LD, Zacny JP. Reinforcing and subjective effects of oral delta 9-THC and smoked marijuana in humans. Psychopharmacology (Berl), 107(2-3):255-62.1992.












 uBio
uBio