Revista del Instituto Nacional de Higiene Rafael Rangel
versión impresa ISSN 0798-0477
INHRR vol.47 no.1-2 Caracas dic. 2016
Validación del método de formación de coágulo para la determinación de endotoxinas bacterianas en inmunoglobulinas (IgG) nacionales
Method validation clot formation for determining bacterial endotoxins national immunoglobulin (IgG)
Dolly E Montaño E1, Moisés G Alvarado R1, Maritza J Burgos Q1.
1 Departamento de Control de Hemoderivados y Afines, División de Control Nacional de Productos Biológicos, Gerencia Sectorial de Registro y Control. Instituto Nacional de Higiene Rafael Rangel. 0212-219.17.50. Correo: maritzaquijada43@gmail.com
RESUMEN
Las endotoxinas bacterianas son lipopolisacáridos (LPS) localizados exclusivamente en la membrana externa de las bacterias gramnegativas, su ingreso al organismo a través de productos parenterales puede causar fiebre, taquicardia, aumento de presión sanguínea y en algunos casos ocasiona la muerte. Existen normativas internacionales acerca del límite de endotoxina para productos farmacéuticos inyectables, tal como las inmunoglobulinas (IgG), que pueden estar expuestas a contaminación durante el proceso de producción y por lo tanto es necesario realizar pruebas para la determinación de endotoxinas bacterianas. El método del lisado de amebocitos de Limulus (LAL) es una de ellas. Este método se fundamenta en la reacción del LAL, el cual es un extracto de células sanguíneas que interaccionan con endotoxinas, activando la cascada del proceso de coagulación y originando la formación de la coagulina. En diversas ocasiones algunas proteínas intervienen en la activación o desactivación de esta cascada, bien sea potenciando o inhibiendo la formación del coágulo. En el caso de la potenciación, el calentamiento es uno de los métodos recomendados por la farmacopea estadounidense (USP) para eliminar interferencias, puesto que desnaturaliza las proteínas que causan la potenciación sin pérdida de endotoxinas. En este trabajo se validó la determinación de endotoxinas bacterianas en IgG mediante el método LAL, el cual es un método rápido y de fácilejecución, por lo que puede implementarse como ensayo de rutina en control de calidad y por ende nos permite agilizar las Liberaciones de Lotes de estos productos.
Palabras claves: Endotoxinas bacterianas, Lisado de amebocito de limulus (LAL), Inmunoglobulina G (IgG), lipopolisacaridos, Potenciación de la reacción, Interferencia en la reacción
ABSTRACT
Bacterial endotoxins are lipopolysaccharides (LPS) located exclusively in the outer membrane of gram-negative bacteria, their entry into the body through parenteral products can cause fever, tachycardia, increased blood pressure and in some cases cause death. There are international standards for endotoxin limit for injectable pharmaceuticals, such as immunoglobulins (IgG), which may be exposed to contamination during the production process and therefore it is necessary to test for determination of bacterial endotoxins. The method of the Limulus amebocyte lysate (LAL) is one of them.
This method is based on the LAL reaction, which is an extract of blood cells which interact with endotoxin, triggering the cascade of the coagulation process and causing the formation of coagulin. On several occasions some proteins involved in the activation or deactivation of this waterfall, either by enhancing or inhibiting clot formation. In the case of empowerment, the warming is one of those recommended by the US Pharmacopoeia (USP) to eliminate interference, since denatures proteins that cause endotoxin enhancement lossless methods. In this paper the determination of bacterial endotoxins in IgG was standardized by the LAL method, which is quick and easy to implement method, which can be implemented as a routine test in quality control and thus allows us to streamline releases Lots of these products.
Key words: Bacterial endotoxins, Limulus amoeboid lysate (LAL), Immunoglobulin G (IgG), Lipopolysaccharides, Reaction potentiation, Interference in reaction.
Recibido: 04 de noviembre de 2016 Aprobado: 27 de marzo de 2017
INTRODUCCION
Las endotoxinas bacterianas son lipopolisacáridos (LPS) localizados exclusivamente en la membrana externa de las bacterias gramnegativas; su presencia en productos farmacéuticos inyectables pueden estar asociados a problemas durante la producción, existen límites de endotoxinas establecidos para este tipo de producto (1).
Las endotoxinas pueden producir fiebre, taquicardia, aumento de presión sanguínea y en algunos casos ocasionar la muerte.
El reactivo de Lisado de Amebocitos de Limulus (LAL) es empleado en la prueba para la determinación de endotoxinas bacterianas (2).
En diversas ocasiones algunas proteínas intervienen en la activación o desactivación de la cascada de coagulación, bien sea potenciando o inhibiendo la formación del coágulo.
El calentamiento es uno de los métodos recomendados por la farmacopea estadounidense (USP) para eliminar interferencias, puesto que desnaturaliza las proteínas responsables de la potenciación sin pérdida de endotoxinas (3).

OBJETIVO GENERAL:
Validar la determinación de endotoxinas bacterianas en Inmunoglobulinas (IgG) de producción nacional mediante el método LAL.
MATERIALES Y MÉTODOS
Reactivos
Para el ensayo LAL se emplea muestras de Inmunoglobulinas intravenosas (IgG) de un mismo fabricante.
Agua grado reactivo LAL (LRW), Associates of Cape Cod Inc.
Control Estándar Endotoxina (CSE) 0.5 mg/vial y 125 mg/vial, Associates of Cape Cod Inc.
Lisado de amebocitos de Limulus (LAL) Pyrotell® λ=0.06 UE/mL, Associates of Cape Cod Inc.
Materiales
Tubos de reacción de soda lime Pyrotube®-S, Associates of Cape Cod Inc., apirogénicos.
Tubos de dilución de Borosilicato Pyrotube – D ®, Associates of Cape Cod Inc., apirogénicos.
Bloque de calentamiento verificado a 37 ± 1 º C.
Método
Se verificó la Sensibilidad del Reactivo Lisado de Amebocitos del Limulus polyphemus (Figura 2)
Se determinó la Máxima Dilución Válida (MDV) del producto
![]()
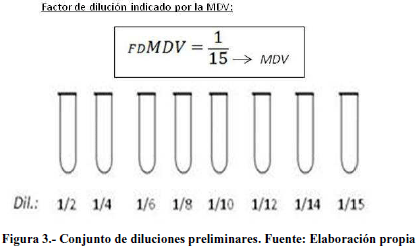
Luego se determinó el conjunto de diluciones a utilizar para las pruebas preliminares. Para ello, se eligieron diluciones intermedias hasta alcanzar la máxima dilución válida (MDV). (Figura 3).
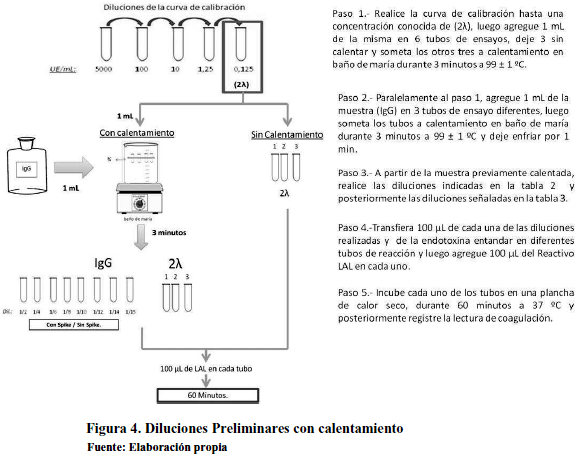
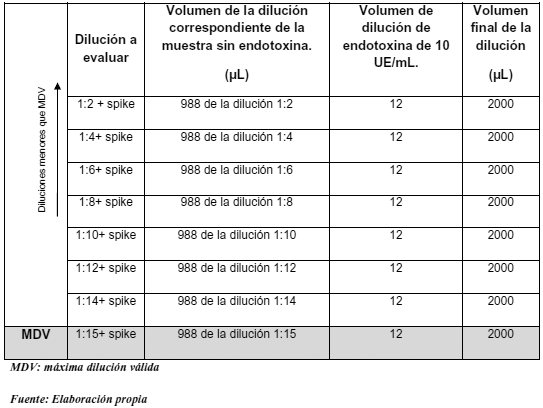
Se caracterizó la muestra a ser evaluada, tal como lo indica la Tabla 1. La solución A comprende las diluciones a ser evaluadas, para las cuales se debe diluir la muestra con agua grado reactivo LAL como se observa en la Tabla 2. La solución B comprende las diluciones primarias a la que se agrega una concentración conocida de endotoxinas (2λ), partiendo de 10 UE/mL tal como se observa en la Tabla 3. La solución C se preparó para verificar la sensibilidad del reactivo Lisado de Amebocitos del Limulus polyphemus (LAL) a fin de constatar su efectividad; para ello se empleó el control estándar de endotoxina que declara 125 mg/vial y previamente reconstituido de acuerdo al certificado del proveedor.
Tabla 1. Caracterización de la inmunoglobulina (IgG).

Tabla 2. Preparación de las diluciones sin spike.
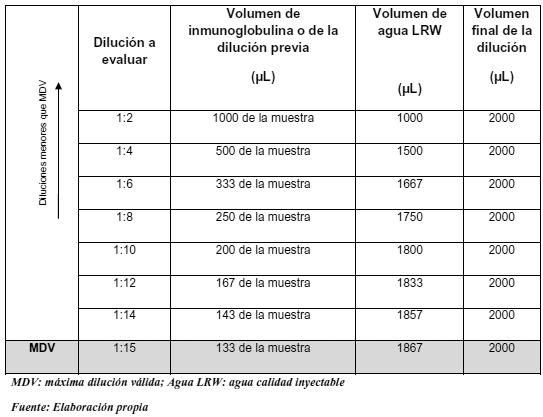
Tabla 3. Preparación de las diluciones primarias con spike.
Esta caracterización nos permitió conocer el comportamiento de la muestra y evidenciar posibles interferencias de la reacción de coagulación para su posterior eliminación. La solución D es el control negativo, este indica que el diluyente empleado no contiene endotoxinas u otra sustancia que interfiera con la reacción de coagulación. Para esta solución se empleó únicamente agua grado reactivo LAL
Se observó potenciación en la reacción de coagulación (interferencia), por lo que se aplicó calentamiento en baño de termostático a una temperatura de 99°C±1°C durante 3 minutos. Este proceso permite desnaturalizar las proteínas presentes en la muestra y con ello se logra inactivar las proteínas que posiblemente interfieren en la reacción. Sin embargo, es necesario garantizar que el proceso de calentamiento no interfiere en la determinación de endotoxinas, por lo tanto se estandarizó el tiempo del mismo.
Se agregó 1 ml de endotoxina estándar con una concentración conocida (2λ) en 4 tubos de ensayo diferentes, y se sometió a diferentes tiempos de calentamiento como se indica en la tabla 4.
Tabla 4.- Estandarización del tiempo de calentamiento.
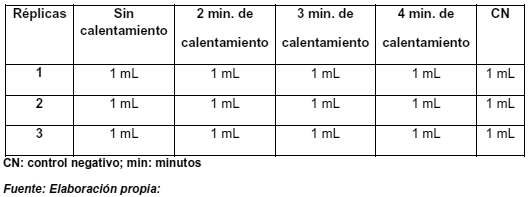
Este proceso permitió determinar un tiempo adecuado de calentamiento para inhibir la interferencia sin eliminar endotoxinas, es por ello que se debe elegir el tiempo intermedio entre el primer tiempo de coagulación y el último. En este caso, para todos los tiempos de calentamiento se observó coagulación, por lo tanto se eligió 3 minutos para las posteriores pruebas preliminares.
Luego de establecer las condiciones específicas de calentamiento se realizó el mismo proceso, pero con la muestra en análisis, para ello se siguió las indicaciones enunciadas en la Figura 4.
En cada ensayo se realizó un control positivo para monitorear si el procedimiento se ha efectuado correctamente.
En base a los resultados obtenidos se seleccionó la dilución más apropiada para realizar las pruebas de interferencia; la cual debe estar libre de endotoxinas.
Prueba de Interferencia (potenciación): se realizó para verificar si la solución de trabajo elegida logra eliminar por completo la interferencia ocasionada por la muestra. Esta prueba se realizó en 3 lotes diferentes de inmunoglobulina y por triplicado. Tabla 5.
Tabla 5. Prueba de interferencia.

RESULTADOS Y DISCUSIÓN
Inicialmente se confirmó la sensibilidad del lote empleado de reactivo LAL (Figura 2) y se comprobó que no hay variación en la sensibilidad declarada del mismo, por lo que los resultados obtenidos se encuentran dentro de los parámetros establecidos por normativas internacionales para productos farmacéuticos inyectables.
Además se calculó la Máxima dilución válida (MDV) (1:15), que es la máxima dilución permitida en la que se puede determinar el límite de endotoxinas de IgG.
![]()
En este trabajo se estandarizó el tiempo de calentamiento de la muestra de IgG, de tal manera que pudiéramos eliminar la interferencia sin que ello implicara la pérdida de endotoxinas. Para ello, se calentó en baño de maría una concentración estándar de endotoxinas (2λ) y se sometió a diferentes tiempos de calentamiento (Tabla 6). De los resultados obtenidos, se pudo apreciar que para 1 mL ((2λ) de endotoxina el proceso de coagulación se mantienen, incluso hasta los 4 minutos de calentamiento.
Tabla 6.- Resultados de calentamiento de la endotoxina estándar

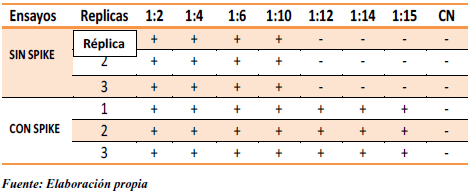
Previo al proceso de calentamiento se caracterizaron diferentes lotes de inmunoglobulina, en donde se observó una considerable potenciación de la reacción LAL (Tabla 7). No obstante, luego de someter los mismos lotes a 3 minutos de calentamiento en baño de maría (Tabla 8), se pudo apreciar disminución de la interferencia a partir de la dilución 1:12. Esta última dilución es menor a la MDV y además no contiene endotoxinas detectables, por lo tanto, presenta todas las características necesarias para ser elegida como dilución de trabajo rutinaria.
Tabla 7.- Caracterización de la muestra mediante pruebas preliminares.
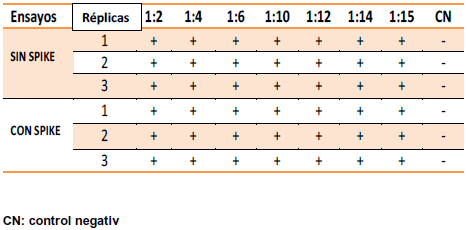
Tabla 8.- Caracterización de la muestra mediante pruebas preliminares, después del calentamiento.
Luego de establecer 1:12 como la dilución de trabajo, se realizaron pruebas de factores de interferencia en tres lotes diferentes de inmunoglobulina; de los cuales todos obtuvieron valores de media geométrica entre las diluciones (2λ) y (λ) (Tabla 9), lo que indica que efectivamente el proceso de calentamiento logró eliminar la interferencia producida en las cascada de señalización, probablemente, debido a la presencia de algunas proteínas que producen potenciación de la reacción LAL.
Tabla 9. Prueba de la validación en Inmunoglobulina de diferentes lotes

CONCLUSIÓN
Los resultados obtenidos de la validación del método, nos permite plantear esta técnica para las inmunoglobulinas intravenosas de producción nacional, en las cuales prevalece una interferencia que afecta la lectura final de la prueba.
El calentamiento durante 3 minutos 99°C±1°C en baño de termostático es suficiente para desnaturalizar las proteínas presentes en la muestra y por ende eliminar la potenciación de la reacción LAL, lo que nos permite confirmar que el método de la formación del coágulo con previa eliminación del factor interferente, queda validado para las Inmunoglobulinas (IgG).
La técnica aplicada es sencilla, rápida y eficaz, por lo que puede implementarse en los Laboratorios de la División de Control Nacional de Productos Biológicos, como ensayos de rutina para el control de calidad de las inmunoglobulinas de producción nacional, que son sometidas a liberación lote a lote; y por ende agilizar la puesta en el mercado de los lotes del producto por parte de la Autoridad Nacional Reguladora.
Por otra parte, implementar una técnica in vitro, que sustituya técnicas aplicadas en animales de experimentación, las cuales son pruebas largas y laboriosas es una tendencia a nivel mundial, actualmente esta es la recomendación en las principales farmacopeas y órganos internacionales que regulan el control de calidad de los medicamentos.
REFERENCIAS BIBLIOGRAFICAS
1. FDA. Guideline on Validation of the Limulus Amebocyte Lysate test as an end-product endotoxins test for human and animal parenteral drugs, biological products and medical devices. Food and Drug Administration. Pág. 11- 18. December, 1987. [ Links ]
2. USP 38 – NF 33. Pruebas Biológicas / 85 Prueba de Endotoxinas Bacterianas. Pág. 164 – 168. 2015. [ Links ]
3. Formación Continuada para Farmacéuticos de Hospital (4.3). Hemoderivados (I): Inmunoglobulinas. Bernal, Carlota; Joda, Ramón, Monturo, Bruno. Pág. 68-76. Fundación Promedic. Promocion Medica. Barcelona España [ Links ]
4. Revista CENIC. Ciencias Biológicas, Vol.32, N° 3. Eliminación de endotoxinas presentes en la cristalería utilizada en la preparación de disoluciones parenterales por calor seco. Jorge Fernández; Jorge A. Padrón; Laritza Carballosa; Lissette Luis, Gerardo Limra. 2001 [ Links ]
5. ICH, International Conference on Harmonisation of Technical Requirements for Registration of Pharmaceuticals for Human Use. Validation of Analytical Procedures: Text and Methodology Q2 (R1). November 2005. [ Links ]
6. Pearson FC. Microbial Pyrogen. En: Pearson FC, eds. Endotoxins, LAL Testing, and Depyrogenation. New York: Marcel Dekker; 1985. [ Links ]
7. Desarrollo de un sistema de detección de endotoxinas basadas en la optimización e implementación de un protocolo de biofuncionalización sobre biosensor electroquímico de diseño específico. Capítulo 3.2. Las Endotoxinas. Pág. 24 – 3. Capítulo 3.5 Técnica de detección de endotoxinas. Pág. 44 – 49. Año 2013. [ Links ]
8. Mascoli CC, Wery ME. Limulus amebocyte lysate (LAL) test for detecting pyrogens in parenteral injectable products and medical devices: Advantages to manufacturers and regulatory officials. J Parenteral Drugs Assoc. 33(2):81-95. 1.979. [ Links ]












 uBio
uBio