Revista Científica
versión impresa ISSN 0798-2259
Rev. Cient. (Maracaibo) v.16 n.2 Maracaibo mar. 2006
RESPUESTAS INFLAMATORIA Y DE ANTICUERPOS
CONTRA Cladophialophora carrionii EN CAPRINOS
Inflamatory and Antibody Responses against Cladophialophora carrionii in Goats
Eustacia Coromoto Martínez1, Catalina Rey-Valeirón2, Hilda Romero3 y Francisco Yegres4
1,2Unidad de Diagnóstico y Servicios. 2Programa de Veterinaria. Complejo Docente El Hatillo, Intercomunal Coro-La Vela. Universidad Nacional Experimental Francisco de Miranda. Coro, Venezuela. Telefax 0268 2778446. E-mail: crey@unefm.edu.ve
3Cátedra de Micología, Escuela de Bioanálisis, Facultad de Medicina, Universidad Central de Venezuela, Caracas.
4Programa de Ciencias de la Salud, Universidad Nacional Experimental Francisco de Miranda. Coro, Venezuela.
RESUMEN
Cladophialophora carrionii es un hongo dimórfico con melanina que causa en humanos una micosis profunda, localizada y crónica llamada cromomicosis, y se adquiere a través de la inoculación con espinas de cactáceas infectadas. El estado Falcón es una zona endémica para esta enfermedad, donde las poblaciones están integradas principalmente por campesinos criadores de caprinos. El objetivo de este trabajo fue evaluar la respuesta inmunitaria humoral e inflamatoria contra C. carrionii en caprinos con el fin de conocer la interacción hospedador-parásito en un animal usualmente considerado como resistente a la infección, a pesar de su exposición permanente a las espinas infectadas. Se inocularon seis cabritos con 1×106 células de C. carrionii, vía subcutánea, en la tabla del cuello. Se midió la temperatura corporal de cada animal y se tomaron muestras de sangre completa y suero para análisis hematológicos y ensayos inmunoenzimáticos (ELISA) dos veces a la semana. Se midió el diámetro de la piel 24 y 48 horas después de la inoculación. La respuesta inflamatoria en el sitio de inoculación fue notoria a las 48 horas. No hubo respuesta significativa de anticuerpos en los animales inoculados a partir de los 50 días post-inoculación. Se confirma que la respuesta celular es importante en la resistencia contra C. carrionii, pero la respuesta de anticuerpos parece no ser relevante en esta especie animal.
Palabras clave: Caprinos, cromomicosis, Cladophialophora carrionii, anticuerpos.
ABSTRACT
Cladophialophora carrionii is a dimorphic fungus with melanin which causes a deep, localized and chronic mycosis in humans, named chromomycosis, acquired through inoculation with cactuses infected-spines. Falcon state is an endemic zone to this disease, where human populations make use of goat breeding as their main way of living. The objective of this work was to evaluate both humoral immune and inflammatory responses against C. carrionii in goats to improve knowledge about host-parasite interactions in a species usually considered as infection-resistant, in spite of permanent exposition to infected spines. Six kids were inoculated with 1 ×106 cells of C. carrionii, by subcutaneous route on the neck. Blood and sera samples for hematological and immunoenzimatic tests were taken and body temperature was also measured. The diameter of the inoculated skin was also evaluated 24 and 48 hours post-inoculation. Inflammatory response was considerable at 48 hours. There was no valuable response of antibodies. It is established that inflammatory response is important in resistance against C. carrionii, but antibody response seems not to be relevant for this animal specie.
Key words: Goats, chromomycosis, Cladophialophora carrionii, antibodies.
Recibido: 25 / 05 / 2005. Aceptado: 24 / 11 / 2005.
INTRODUCCIÓN
La cromomicosis es una micosis granulomatosa crónica localizada que afecta piel y tejido subcutáneo de los humanos, causada por varios hongos dimórficos con melanina. Los agentes etiológicos más frecuentes de la cromomicosis en Venezuela son Cladophialophora carrionii y Fonsecaea pedrosoi [19]. El estado Falcón es considerado zona endémica para C. carrionii. Existen en el Estado factores ambientales relacionados con la presencia del hongo sobre la superficie de especies xerófilas como Prosopis juliflora, Opuntia caribeae y otras cactáceas. La asociación del hongo con esta vegetación fue demostrada mediante la recuperación de estos microorganismos en los medios de cultivo adecuados [14,15]. La infección ocurre por inoculación de las espinas de cactáceas en la piel. Algunos estudios han demostrado que los pacientes infectados por C. carrionii provenían de zonas secas con escasas precipitaciones y poca elevación del terreno mientras que los afectados por F. pedrosoi habitaban zonas húmedas con un clima más fresco, menos seco [20]. En el estado Falcón la ocupación más frecuente es la cría de caprinos. Esto ofrece un mayor riesgo de infección porque los criadores habitan en un ambiente xerófito con probabilidad de inoculación accidental, pero se ha planteado una susceptibilidad heredable en algunas familias, posiblemente relacionada con una respuesta celular ineficiente [5].
En los humanos, la enfermedad se caracteriza clínicamente por lesiones escamo-costrosas, verrugosas y ulceradas. Al comienzo, la lesión es pequeña, elevada, eritematosa, con pápulas pustulosas y nódulo abscedado que evoluciona lenta y progresivamente a placa verrugosa de superficie irregular con hemorragias diminutas, visibles como puntos negros. Esta lesión puede permanecer localizada y/o agruparse lentamente en varias lesiones tomando el aspecto verrugoso característico de lesiones crónicas que se asemejan a un coliflor [2]. Hasta ahora, no existen reportes de infección natural en caprinos, lo que ha llevado a la creencia de que estos animales son resistentes a ella a pesar de estar permanentemente expuestos a la infección a través de las espinas infectadas. El objetivo de este trabajo fue evaluar aspectos de la respuesta inmunitaria contra Cladophialophora carrionii en esta especie animal, con la finalidad de establecer algunos aspectos de la interacción hospedador-parásito.
MATERIALES Y MÉTODOS
Animales
Los grupos experimentales se conformaron con seis caprinos mestizos criollos, machos, entre 5 y 6 meses de edad, estabulados y alimentados con pasto fresco y heno, así como agua ad libitum. Los animales fueron tratados con albendazol a razón de 7,5 mg/ kilogramo de peso quince días antes del comienzo de los experimentos. Desde el momento de su adquisición hasta los 60 días post-inoculación, se tomaron muestras de sangre dos veces a la semana para determinación de parámetros hematológicos (hemoglobina, hematocrito, contaje de leucocitos y hemograma de Schilling) y recolección de suero para ensayos inmunoenzimáticos. La temperatura corporal de cada uno de los animales se midió dos veces a la semana.
Inoculación de los animales
Los caprinos fueron separados en dos grupos (experimental y control). El grupo experimental (animales 002, 003, 004, 006) fue inoculado vía subcutánea en la parte superior de la tabla del cuello previamente rasurada, con 1 mL de suspensión celular conteniendo 1×106 células/mL (conidias/hifas) de una cepa patógena de C. carrionii obtenida de un paciente con cromomicosis proveniente de la zona semi-árida del estado Falcón (PP-8201), mantenida por siembras sucesivas en agar Sabouraud dextrosa [3, 18]. Simultáneamente se inoculó 1 mL de solución salina estéril en la parte inferior del cuello. El grupo control (cabritos 001 y 005) recibió un inóculo de 1 mL de solución salina estéril al 0,85%, por la misma vía. El día de la inoculación fue tomado como el día cero del período experimental. Un mes más tarde, se aplicó una segunda dosis al animal 002 a fin de evaluar el efecto de la reinoculación sobre la respuesta inmune o la aparición de lesiones.
Intradermoreacción
Se midió con un vernier el pliegue de la piel inoculada 24 y 48 horas después de la inyección intradérmica del inóculo infectante. Se midió asimismo el pliegue de la piel del tercio superior de la tabla del cuello, donde se inoculó 1 mL de solución salina al 0,85%. Los valores resultantes de la medición del pliegue cutáneo proporcionaron datos que permitieron evaluar la reactividad cutánea al antígeno inyectado, comparándolos con el grosor obtenido después de la inoculación con solución salina [1,12].
Obtención del antígeno
Se utilizó una cepa de C. carrionii de un paciente con cromomicosis proveniente de la zona semi-árida del estado Falcón (PP-8201), la cual fue utilizada en su fase logarítmica de crecimiento para la obtención del antígeno mediante la metodología descrita previamente [6, 16, 18]. La cantidad de proteína en el antígeno se estimó según Lowry y col. [9].
Estandarización del ensayo. Concentración óptima
del antígeno
Las placas de ELISA (Dynatech) se sensibilizaron con concentraciones decrecientes de 100, 50, 25 y 10 µg/mL. El antígeno liofilizado se diluyó en solución tampón carbonato/bicarbonato pH 9,6 hasta la concentración deseada.
Ensayo inmunoenzimático (ELISA)
Para este ensayo se empleó una modificación de Rey-Valeirón y col. [13]. Las placas de ELISA de poliestireno (Dynatech) se sensibilizaron con 100 µL del antígeno de C. carrionii a una concentración de 25 µg/mL, en solución tampón carbonato/ bicarbonato pH 9,6 y se incubó toda la noche a 4°C en cámara húmeda. Posteriormente se lavaron los pozos tres veces por cinco minutos con solución tampón fosfato salina pH 7,2 conteniendo Tween 20 al 0,1% (PBS-T). Los pozos fueron bloqueados con 200 µL de PBS-Tween 20 y gelatina (Sigma) (PBS-T-G) al 1% a 37°C por una hora en cámara húmeda. Al cabo de ese tiempo la solución bloqueante fue removida por aspiración y se añadieron por triplicado 100 µL de los sueros problema y controles diluidos 1:100 en PBS-T-G y se incubaron a 37°C por 60 minutos en cámara húmeda. Transcurrido este tiempo se realizaron tres lavados de 5 minutos cada uno con PBS-T y cada pozo se incubó a 37°C por una hora con 100 µL del conjugado anti IgG caprina marcada con peroxidasa (Pierce) diluida 1:25.000 en PBS-T-G. Una vez lavados los pozos, se colocaron 100 µL del sustrato de la enzima con peróxido de hidrógeno y cromógeno ABTS (2-2 azino-di-(3-etil benzothiazol-sulfona-6)-(diamino), a temperatura ambiente, durante 90 minutos en oscuridad y con movimiento. La densidad óptica se leyó en un espectrofotómetro a 405 nm. En cada placa se incluyeron como sueros negativos aquellos provenientes de caprinos inoculados con solución salina fisiológica y sueros pre-inoculación con C. carrionii.
Determinación del punto de corte
Se estableció el punto de corte utilizando sueros de animales experimentales pre-inoculados (002, 003, 006) y sueros de animales controles (001 y 005), utilizando la siguiente fórmula: Promedio de absorbancia de los sueros negativos + 3 × desviación estándar de los sueros negativos [13].
RESULTADOS Y DISCUSIÓN
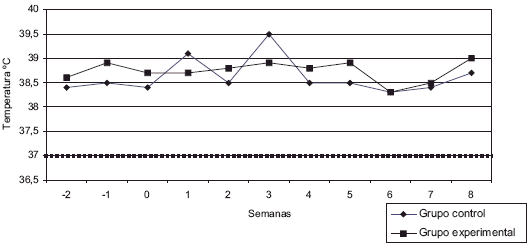
Los animales experimentales se mantuvieron en estabulación desde el momento de la inoculación hasta 60 días después de la misma. La temperatura corporal de los caprinos se mantuvo dentro de los valores normales en ambos grupos experimentales, con un promedio de temperatura rectal de 38,6°C (FIG. 1). Uno de los caprinos (004) murió por causas independientes al ensayo.
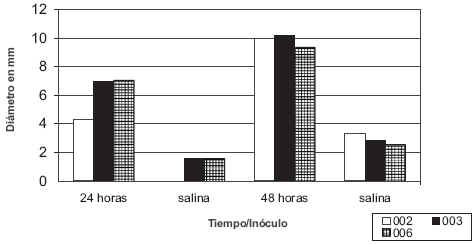
La respuesta inflamatoria fue medida a las 24 y 48 horas y se observó un aumento significativo del grosor de la piel inoculada con C. carrionii con diámetros superiores a 10 mm, en relación con el grosor de la piel inyectada con solución salina fisiológica estéril. Se encontraron diferencias significativas (P<0,0001) para ambos tiempos y tipo de inóculo (FIG. 2). Albornoz y col. [1] evaluaron la respuesta inflamatoria en el humano y consideraron una respuesta positiva a aquellas infiltraciones superiores a 5 mm a las 48 horas post-inoculación. Otros estudios enfocados en la interacción hospedador-hongo en humanos han demostrado una respuesta predominantemente celular, con activación de macrófagos [11]. Aunque la fagocitosis del hongo ocurre, la muerte de células micóticas es raramente observada. Si se extrapolan estos resultados a la especie caprina, se puede concluir que los animales inoculados presentaron una fuerte respuesta celular al hongo. En un trabajo previamente publicado, Martínez y col. [10] demostraron mediante estudios histopatológicos una intensa proliferación de células inflamatorias en los caprinos inoculados. Algunos modelos de mecanismos inflamatorios en animales han demostrado que las concentraciones de mediadores químicos, así como su duración, son mayores en caprinos en comparación con otras especies animales [17].
Sin embargo, Fusch y Pescher [7] determinaron que los pacientes humanos presentaban supresión de la respuesta inmunitaria celular y esto contribuía a la persistencia del hongo en la piel. Martínez y col. [10] demostraron que el hongo permaneció viable hasta 30 días post-inoculación en caprinos experimentales. Estos animales mantuvieron temperaturas corporales promedio de 38,6°C, en contraposición a lo publicado por De Hoog y col. [4], quienes señalaron que el hongo inhibe su crecimiento in vitro a más de 37°C. También se observaron células escleróticas en los cortes histopatológicos y eliminación transepitelial del hongo hasta 60 días después. Los datos obtenidos en conjunto no explican por qué a pesar de una respuesta celular tan marcada, el hongo permaneció en los tejidos hasta 60 días post-inoculación. Estos resultados indicarían que el caprino no es totalmente resistente a la infección como empíricamente se cree.
Valor normal de temperatura corporal: 38,5-39,5°C
FIGURA 1. PROMEDIO SEMANAL DE TEMPERATURA CORPORAL EN CABRITOS CONTROLES E INOCULADOS CON Cladophialophora carrionii / WEEKLY BODY TEMPERATURE AVERAGE IN Cladophialophora carrionii NON-INOCULATED AND INOCULATED GOATS).
No se observaron variaciones en ninguno de los parámetros hematológicos con respecto a los valores normales de referencia en los animales controles. Los resultados de cuenta leucocitaria y linfocitos obtenidos en los animales experimentales (002, 003 y 006) mostraron una ligera variación post-inoculación por encima de los valores normales, pero estas variaciones no fueron significativas estadísticamente (P > 0,01). Sin embargo, la elevación de leucocitos a expensas de los linfocitos a partir de los 21 días post-inoculación, pudiera sugerir expansión clonal [8]. En el caprino 002, re-inoculado con una dosis similar a la primera se observó un descenso de la hemoglobina y hematocrito a partir de los 21 días. No se encontraron otros agentes etiológicos (parásitos) o problemas alimentarios (disminución de consumo, dietas deficientes) que causaran esta disminución, ni se ha reportado en la literatura un efecto anemizante del hongo.
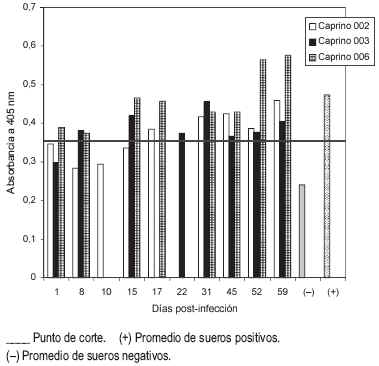
El análisis de proteína del antígeno reveló una concentración de 7,82 µg/µL. La concentración de 25 µg/mL fue escogida por ser aquella que presentó la mayor absorbancia con los sueros positivos (cabritos inoculados) y la menor absorbancia con los sueros negativos (cabritos inoculados con solución salina fisiológica y pre-inoculados). Una vez determinada la concentración óptima de antígeno, se estableció el punto de corte en 0,363.
Los sueros de caprinos inoculados con C. carrionii fueron confrontados contra este antígeno en un ELISA indirecto, obteniéndose lecturas ligeramente superiores al punto de corte. Del grupo experimental (002, 003 y 006), el caprino 006 obtuvo una mejor respuesta de anticuerpos, principalmente a partir del día 52 post-inoculación, y en menor proporción los otros dos cabritos a partir del día 31 post-inoculación (FIG. 3). Yegres y col. [18] señalaron que en diversas cepas de ratones, no habría relación entre la presencia de anticuerpos (detectados mediante inmunofluorescencia indirecta) y la sobrevivencia del hongo. La re-inoculación del animal 002 con una dosis homóloga (1×106 células/mL) a los 24 días post-inoculación, no tuvo efecto notorio sobre la respuesta de anticuerpos. Esto pudiera sugerir que infecciones repetidas con el hongo no potencian respuestas secundarias y que a diferencia de los humanos [6,16], en esta especie animal la respuesta inmune humoral contra C. carrionii no es relevante.
FIGURA 2. RESPUESTA INFLAMATORIA, 24 Y 48 HORAS DESPUÉS DE LA INOCULACIÓN CON C. carrionii Y SOLUCIÓN SALINA FISIOLÓGICA EN LA TABLA DEL CUELLO DE LOS ANIMALES EXPERIMENTALES / INFLAMMATORY RESPONSE, 24 AND 48 HOURS AFTER INOCULATION WITH C. carrionii AND SALINE IN THE NECK OF EXPERIMENTAL ANIMALS.
FIGURA 3. RESPUESTA DE ANTICUERPOS DE ANIMALES INOCULADOS EXPERIMENTALMENTE CON Cladophialophora carrionii MEDIDA POR ELISA INDIRECTO / ANTIBODY RESPONSE OF EXPERIMENTALLY Cladophialophora carrionii-INOCULATED ANIMALS MEASURED BY INDIRECT ELISA.
CONCLUSIONES
La fuerte respuesta inflamatoria observada en los animales inoculados con C. carrionii pareciera evidenciar la existencia de un mecanismo de eliminación del hongo. Aún queda por dilucidar la participación de los diversos tipos celulares en la respuesta contra el hongo, así como las citocinas que en ella participan, por lo que el caprino pudiera constituirse en un excelente modelo animal para el estudio de la cromomicosis.
AGRADECIMIENTO
Al Decanato de Investigación de la Universidad Francisco de Miranda (CI.TG. 2003.021) y al Fondo Nacional de Ciencia, Tecnología e Innovación (FONACIT) (PEM-2001001623) por el apoyo financiero otorgado.
REFERENCIAS BIBLIOGRÁFICAS
1. ALBORNOZ, M.; MARIN, C.; IWATSU T. Estudio epidemiológico de un área endémica de cromomicosis en el estado Miranda. Dermat. Venez. 23: 29-30. 1982. [ Links ]
2. BORELLI, D. Células displásticas de Cladosporium carrionii. Dermat. Venez. 26:39-45. 1988. [ Links ]
3. CARDONA, N.; AGUDELO, P. Development of a chronic chromoblastomycosis model in immunocompetent mice. Med. Mycol. 37: 81-83.1999. [ Links ]
4. DE HOOG, G.S.; GUÉHO, E.; MASCLAUX, F.; GERRITS VAN DEN ENDE, A.; KWON- CHUNG, K.; MCGINNIS, M. Nutritional physiology and taxonomy of human-pathogenic Cladosporium-Xylohypha species. J. Med. Vet. Mycol. 33: 339-347. 1995. [ Links ]
5. DE HOOG, G.S.; QUEIROZ-TELLES, F.; HAASE, G.; FERNANDEZ-ZEPPENFELDT, G.; ATTILI-ANGELIS, D.; GERRITS-VAN DEN ENDE, A.H.; MATOS, T.; PELTROCHE-LLACSAHUANGA, H.; PIZZIRANI-KLEINER, A.A.; RAINER, J.; RICHARD-YEGRES, N.;VICENTE, V.; YEGRES, F. Black fungi: clinical and pathogenic approaches. Med. Mycol. 38:243-250. 2000. [ Links ]
6. ESTERRE, P.; JAHEVITRA, M.; RAMARCEL, E.; ANDRIANTSIMAHAVANDY, A. Evaluation of the ELISA technique for the diagnosis and the seroepidemiology of chromoblastomycosis. J. Mycol. Med. 7: 137-141.1997 [ Links ]
7. FUSCH, J.; PECHER, S. Partial suppression of cell mediated immunity in chromoblastomycosis. Mycopath. 119(2): 73-6. 1992. [ Links ]
8. GOLDSBY, R.A.; KINDT, T.J.; OSBORNE, B.A.; KUBY, J. B-cell generation, activation and differentiation. In: Immunology. 5th Ed. W.H. Freeman. 266-274 pp. 2003. [ Links ]
9. LOWRY, G. H.; ROSENBROUGH, N. J.; FARR, A. L.; RANDALL R J. Protein measurement with the folin phenol reagent. J. Biol. Chem. 193: 265-275. 1951. [ Links ]
10. MARTINEZ, E.C.; REY-VALEIRÓN, C.; YEGRES, F.; REYES, R. El caprino: aproximación a un modelo animal en la cromomicosis humana. Inv. Clin. 46(2):131-138. 2005. [ Links ]
11. MAZO-FÁVERO, V.; DE SOUZA, M.; SPARADARI-FERREIRA, K.; MARQUES, S.G.; GUEDES-GONCALVES, A.; VAGNER DE C., D.; PEDROSO E SILVA, C.M.; ROGÉRIO A., S. Cytokines and lymphocyte proliferation in patients with different clinical forms of chromoblastomycosis. Microbes Infect. 7:708-713. 2005. [ Links ]
12. GÓMEZ, A.; LEBRIJA, A. Pruebas Intradérmicas. En: Morilla, A.; Bautista, C. (Eds). Manual de Inmunología. Editorial Diana, México, 255- 264 pp. 1986. [ Links ]
13. REY-VALEIRÓN, C.; ASO, P.M.; CORONADO, A. Prevalencia de Anaplasma marginale y anticuerpos específicos en becerros neonatos. Acta C. Venez. 54 (2): 121-126. 2003. [ Links ]
14. RICHARD-YEGRES, N.; YEGRES F. Cladosporium carrionii en vegetación xerófila: aislamiento en una zona endémica para la cromomicosis en Venezuela. Dermt. Venez. 25: 15-18. 1987. [ Links ]
15. RICHARD-YEGRES, N.; YEGRES, F.; ZEPPENFELDT G. Cromomicosis: endemia rural, laboral y familiar en Venezuela. Rev. Iberoam. Micol. 9: 38-41. 1992. [ Links ]
16. ROMERO, H.; FERRARA, G.; PÉREZ-BLANCO, M.; CONTRERAS, I. An ELISA test for the serodiagnosis of chromoblastomycosis caused by Cladophialophora carrionii. J. Mycol. Med. 9: 210-213. 1999. [ Links ]
17. SIDHU, P.; SHOJAEE-ALIABADI, F.; ANDREWS, M.; LEES, P. Tissue chamber model of acute inflammation in farm animal species. Invest. Clin. 74:67-77.2003. [ Links ]
18. YEGRES, F.; NIEL, F.; GANTIER, J.C.; RICHARD-YEGRES, N. Murine humoral immune response against Cladophialophora carrionii and Fonsecaea pedrosoi infection. J. Mycol. Med. 8: 179-182.1998. [ Links ]
19. YEGRES, F.; RICHARD-YEGRES, N. Cladophialophora carrionii: Aportes al conocimiento de la endemia en Venezuela durante el siglo XX. Rev. Soc. Ven. Microbiol. 2: 153-157. 2002. [ Links ]
20. YEGRES, F.; RICHARD-YEGRES, N.; MEDINA-RUIZ, E.; GONZÁLEZ-VIVAS, R. Cromomicosis por Cladosporium carrionii en criadores de caprinos del Estado Falcón. Invest Clin. 26: 235-246. 1985. [ Links ]












 uBio
uBio