Revista Científica
versión impresa ISSN 0798-2259
Rev. Cient. (Maracaibo) v.16 n.4 Maracaibo jul. 2006
Irrigación Arterial y Venosa del Útero y los Ovarios de la Perra (Canis familiaris) y su Relación con la Actividad Ovárica
Raquel Céspedes1, José Pradere1, Víctor Bermúdez2, Thaís Díaz3, Eudomar Perozo4 y Mario Riera4
1Cátedra de Anatomía. 2Cátedra de Patología. 3Instituto de Reproducción Animal e Inseminación Artificial.
Facultad de Ciencias Veterinarias, Universidad Central de Venezuela, Apartado 4563. Maracay, Venezuela.
4Cátedra de Anatomía, Facultad de Ciencias Veterinarias, Universidad del Zulia. Correo electrónico: cespeder@ucv.ven
RESUMEN
Con el objetivo de describir las características anatómicas de la vascularización arterial y venosa del útero y los ovarios, el ciclo estral de nueve perras fue monitoreado utilizando citologías vaginales y ultrasonografía para inferir el mecanismo por el cual el útero ejerce su efecto sobre el ovario, mediante técnicas radiográficas, clarificación de tejidos y maceración tisular. El estudio comprobó que en todas las fases del ciclo estral, el útero y los ovarios de la perra están irrigados principalmente por las arterias ovárica, uterina y vaginal, las cuales establecen anastomosis ipsilaterales entre ellas y contralaterales entre las arterias uterina y vaginal. En el ligamento ancho, la vena uterina forma un circuito de dos ramas que se anastomosan craneal y caudalmente para permitir la conexión venosa entre el ovario y el cuerno ipsilateral al mismo. Pudo observarse a simple vista que en los especímenes provenientes de perras en fases de proestro y estro, el número y grosor de los vasos sanguíneos que irrigan el tracto reproductor es mayor en comparación con los especímenes provenientes de perras en fases de diestro y anestro. Estos estudios sugieren la necesidad de realizar investigaciones más avanzadas con el uso de hormonas marcadas para dilucidar el mecanismo de luteólisis en esta especie.
Palabras clave: Perra, vasos sanguíneos, útero, ovarios, ultrasonido, ciclo estral.
Arterial and Venous Supply of the Uterus and Ovaries in the Bitch (Canis familiaris)
and Its Relationship with Ovarian Activity
ABSTRACT
Estrous cycles of nine bitches were monitored using vaginal cytology in order to describe the anatomical characteristics of the arterial and venous vascularization of the uterus and ovaries during the estrous cycle, using radiographic, tissue clarification and tissue maceration techniques. The ovaries were monitored using ultrasonography. The results indicated that the uterus of the bitch is mainly irrigated by the ovarian, uterine and vaginal arteries, which establish ipsilateral anastomoses among them and contralateral anastomoses between the uterine and vaginal arteries. However, ovaries are mainly irrigated by the ovarian and uterine arteries, which establish ipsilateral anastomoses between them and contralateral anastomoses between the uterine and vaginal arteries. These results suggest the need for advanced research using labeled hormones to explain the mechanism of luteolysis in this specie.
Key words: Bitch, blood supply, uterus, ovary, ultrasound, estrous cycle.
Recibido: 14 / 03 / 2005. Aceptado: 04 / 04 / 2006.
INTRODUCCIÓN
El rol que juega el útero en el proceso luteolítico ha sido objeto de numerosos estudios [1, 5, 6, 8, 9, 20, 23]. Sin embargo, los mecanismos implicados en la persistencia del cuerpo lúteo y su regresión cíclica en la perra aún no están claros [10, 18, 22]. A partir de los años 70 se demostró claramente que el útero participaba de una forma activa en el proceso de regresión luteal, surgiendo un nuevo concepto que establece la regulación interna de procesos fisiológicos a través de vías arteriovenosas locales [12, 19, 21, 22, 24, 34].
Se han descrito al menos tres rutas, en varias especies, mediante las cuales una sustancia luteolítica, la prostaglandina F2a (PGF2a), puede pasar del útero al ovario ya sea por vía sistémica como en la yegua (Equus caballus) y coneja (Oryctolagus cuniculus), local como en la oveja (Ovis aries), vaca (Bos taurus), cobayo (Cavia porcellus), hámster (Mesocricetus auratus) y rata (Rattus norvegicus) y mixta, como en la cerda (Sus scrofa doméstica) [5, 8, 19].
De acuerdo a investigaciones realizadas en el laboratorio de Anatomía de la Facultad de Ciencias Veterinarias de la Universidad Central de Venezuela (UCV), se han obtenido hallazgos que soportan la hipótesis propuesta por Ginther [18] en especies tales como el chigüire (Hydrochoerus hydrochaeris), pécari de collar (Tayassu tajaccu) y ovejas (Ovis aries), en las cuales se encontraron evidencias de un sistema de vasos arteriales que interconectan las ramificaciones de las ramas ováricas y uterina de la arteria ovárica atravesando la vena uteroovárica [26, 29, 30].
Pradere [31], en un estudio sobre las derivaciones arteriovenosas del pedículo vascular uteroovárico en la perra (Canis familiaris), observó anastomosis entre una o varias ramas de la arteria ovárica con las ramas segmentales más craneales de la arteria uterina, las cuales irrigan la extremidad craneal del cuerno respectivo y una anastomosis directa entre una rama de la arteria ovárica con la vena ovárica en el pedículo vascular uteroovárico, constituyendo la primera evidencia micrográfica de una anastomosis arteriovenosa, que fundamenta la hipótesis del mecanismo de contracorriente propuesto por Ginther [18]. El hecho de no conocer la fase del ciclo estral en que se encontraban las perras de este estudio, hace probable que las anastomosis citadas puedan estar sujetas a la acción de factores de crecimiento angiogénicos dependientes de hormonas esteroideas y luteotróficas según lo descrito por Mc Cracken y col. [22].
En la perra (Canis familiaris) no se conoce la fuente de PGF2a [10, 12, 15, 16], así como tampoco se ha demostrado su transferencia local entre la vena ovárica y la arteria ovárica, aunque la relación anastomótica entre ambos vasos y las anastomosis venosas entre las diferentes partes del tracto reproductivo, sitios probables de producción de prostaglandinas, permiten la mezcla del efluente sanguíneo venoso y arterial, entre ellos. El objetivo del presente estudio fue investigar las características anatómicas de la vascularización arterial y venosa del útero y los ovarios de la perra y los cambios vasculares durante las diferentes fases del ciclo estral, que permitan inferir el mecanismo a través del cual el útero ejerce su función sobre el ovario.
MATERIALES Y MÉTODOS
Animales experimentales
En este estudio se utilizó un total de nueve (9) perras mestizas, con edades comprendidas entre 1 y 3 años, con un peso aproximado de 15-25 Kg, procedentes del bioterio de la Facultad de Ciencias Veterinarias de la UCV, las cuales estuvieron alojadas en ese sitio mientras duró el ensayo. Se les hizo despistaje de Leptospirosis y Brucelosis en el Instituto de Investigaciones Veterinarias, resultando negativas, y despistaje de Ehrlichia en el Hospital de Pequeños Animales Dr. Daniel Cabello de la FCV de la UCV, obteniéndose resultados positivos. Las perras fueron tratadas con Doxiciclina®1 a una dosis de 10 mg/Kg/12 horas. Se desparasitaron con Ivomec®2 a razón de 0,5 mL/10 Kg. Además se les administró Heparra®3 a una dosis de 7 mL/animal/3 días y se alimentaron con Perrarina®4. El agua y el alimento fueron suministrados ad libitum. El tratamiento previo se realizó para mantener a las perras en un estado nutricional y de salud adecuado y que no afectara su ciclicidad. Se hicieron citologías vaginales a través de la técnica del aplicador descrita por Feldman y Nelson [13], para lo cual se utilizaron Culturettes (Marion Scientific, Kansas City, Mo, EUA), coloreados con Citocrom®5, las mismas fueron observadas utilizando el objetivo de 40X y se tomaron las micrografías en un microscopio Carl Zeiss, Modelo STEM 2.000 con cámara Carl Zeiss incorporada (modelo 010). Lo descrito previamente se realizó en el laboratorio de Anatomía Patológica de la FCV de la UCV.
Una vez que las perras presentaron su ciclo natural, se les suministró una dosis de 200 µg de PGF2a (Lutalyse®6)/Kg de peso, vía subcutánea cada 12 horas por 4 días para sincronizar y acortar el próximo ciclo, a los 8-10 días, siguiendo el protocolo de sincronización establecido por Okkens y col. [25]. Con la finalidad de tener seguridad de la fase del ciclo en la cual se encontraban, cuando las perras presentaron su nuevo ciclo, se les hizo citologías diariamente y se estudiaron los ovarios, cada 8 días utilizando un aparato de ultrasonido equipado con un transductor de frecuencia lineal de 5,0 y 7,5 MHz (Pie Medical, 480 VET, Philipsweg, Holanda). La terminología utilizada para describir los distintos tipos de reflexión fue la descrita por Cartee y col. [3], y Poffenbarger y Feeney [28], siendo estos términos: Anecoico: aquella área o estructura que no proyecta nada de reflexión, tales como fluidos, sangre, etc.; Hiperecoico: utilizado para describir una alta intensidad ecográfica, en casos donde hay una gran cantidad de tejido cicatrizal, fibroso o elástico; Mesoecoico: que presenta mediana ecogenicidad e Hipoecoico: que presenta poca ecogenicidad.
Preparación de los animales
Una vez sincronizada y verificada la fase del ciclo estral de las perras, de la manera descrita anteriormente, se llevaron al laboratorio de Anatomía para practicarles la eutanasia. Para ello se anestesiaron con Nesdonal®7, a una dosis de 30 mg/Kg, vía intravenosa y seguidamente se les administró Heparina Sódica®8, a razón de 60 U.I. /Kg, por la arteria carótida común. Se esperó 10 minutos hasta que la heparina se distribuyera por todo el cuerpo. Posteriormente, se disecó la vena yugular externa dentro de la cual se colocó una cánula calibre 12, practicando la eutanasia por desangramiento. También se colocó una cánula calibre 12 en la arteria carótida común para perfundir una solución de NaCl al 0,9% a una temperatura aproximada de 37°C con una bomba médica Thomas modelo 1130-2, a presión constante (120mm/Hg) y perfundir todo el sistema arterial y venoso. La perfusión se mantuvo hasta que, por la cánula colocada en la vena yugular externa, saliera un fluido completamente claro.
Preparación de los especímenes
Los animales se dividieron en tres grupos, cada uno incluyendo tres perras: una en fase de proestro, otra en estro y otra en diestro.
Grupo I: A los animales de este grupo se les abordó el hemitoráx izquierdo y derecho, retirando la pared costal para exponer la arteria aorta y la vena cava caudal en su trayecto torácico. En ellas se colocaron cánulas calibre 12, para perfundir acetato de vinil rojo por la arteria aorta, y azul por la vena cava caudal, con una jeringa de 20 mL de capacidad, a presión manual. Los especímenes se conservaron en la cava de refrigeración a 4°C durante 24 horas. Posteriormente, se abordó la cavidad abdominal mediante una incisión en la línea media ventral, extendiéndola desde el apéndice xifoides hasta el borde craneal del pubis, fracturando la sínfisis isquiopúbica para continuar la incisión media ventral y separar sus bordes y observar macroscópicamente, los vasos que irrigan el aparato genital, realizándose un registro fotográfico utilizando una cámara Canon Eos- 1000, lente macrozoom 28-80 mm.
Grupo II: Los animales pertenecientes a este grupo, se les practicó la eutanasia siguiendo la metodología descrita anteriormente. A estos especímenes se les abordó la cavidad abdominal de igual forma a la descrita previamente, exponiendo por disección la arteria aorta abdominal y la vena cava caudal, efectuando ligaduras en ambos vasos caudalmente a los vasos renales. Luego se procedió a cateterizar la aorta con una cánula calibre 12, perfundiendo lentamente una solución de sulfato de bario (Barin®9) con jeringas de plástico a presión manual, efectuando ligaduras de las arterias ilíacas externas, con el propósito de garantizar la distribución del sulfato de bario en los vasos del aparato genital. Luego se extrajo el tracto genital ligando los vasos que los irrigan para evitar el derrame del sulfato de bario. Los especímenes obtenidos se colocaron en una lámina de vidrio de tamaño apropiado, extendiendo el ligamento ancho para observar los vasos que lo irrigan, con mejor precisión. Posteriormente se realizaron estudios radiográficos, tomándose posiciones dorsoventrales con un aparato de rayos X, marca Bennet de 300 mA. Luego de la toma de radiografías, estos especímenes se sometieron a la técnica de clarificación, descrita por Del Campo y col. [7].
Grupo III: Los animales de este grupo se prepararon de la misma manera que fue señalada previamente, procediéndose luego a abordar la cavidad abdominal, tal y como se señaló para los grupos I y II. Se inyectó acetato de vinil rojo en la aorta abdominal, y azul en la vena cava caudal a través de una cánula calibre 12 en cada uno de los vasos, caudal a los vasos renales y previa ligadura de las arterias y venas iliacas externas. Los animales se refrigeraron a 4°C durante 48 horas y posteriormente se les extrajo el aparato genital, sometiéndose a la técnica de maceración con hidróxido de potasio, la cual se describe a continuación: los especímenes se colocaron en recipientes de vidrio, siendo sumergidos en una solución de KOH al 30% durante 9 días, lavando con agua destilada los moldes cada tres días y reemplazando la solución por una nueva para permitir la completa digestión del tejido. Por último, la denominación de las estructuras anatómicas se realizó según lo propuesto por la Nómina Anatómica Veterinaria [4].
RESULTADOS Y DISCUSIÓN
Las perras utilizadas en el presente estudio respondieron a la dosis de 200 µg de PGF2a/Kg, para la sincronización del celo, presentándose éste nuevamente, en intervalo de 3 meses; lo que sugiere que el tratamiento recomendado por Echeverría [10] y England y Concanon [12] sobre la dosis, días e intervalo del tratamiento con esta droga, es el más idóneo. Además, con este protocolo de sincronización no se observó ningún efecto secundario. Existe acuerdo entre los resultados de este trabajo con los de Echeverría [10], England y Concanon [12], Feldman y Nelson [13] y Schramm y col. [32], con respecto a que la administración repetida de PGF2a, a los ocho o diez días postovulación es efectiva para inducir luteólisis en perras.
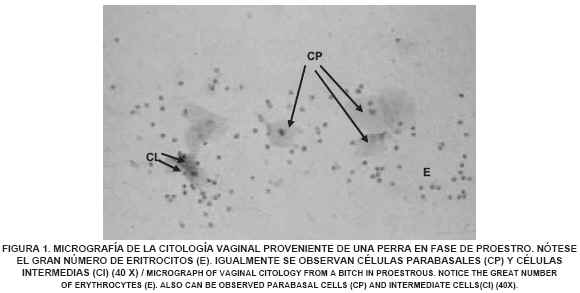
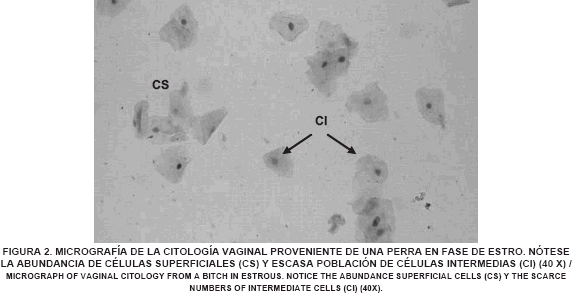
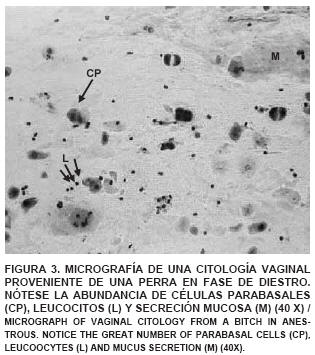
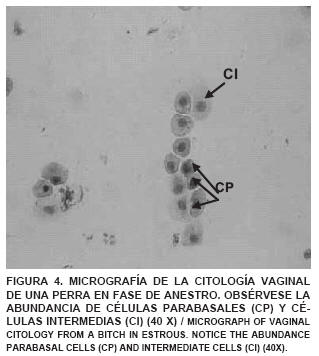
Se evidenció en la citología vaginal de una perra en fase de proestro, la presencia de abundantes eritrocitos, células tipo parabasales e intermedias (FIG. 1). En la citología de una perra en fase de estro se observó el predominio, en un 90%, de células epiteliales superficiales y disminución de la población de glóbulos rojos (FIG. 2). En el estudio de la citología de una perra en diestro se detectó un cambio abrupto, en un 50% del campo, de células superficiales a células parabasales e intermedias, indicando que había ocurrido la ovulación. Igualmente, se observaron neutrófilos y la desaparición completa de los glóbulos rojos (FIG. 3). A lo largo del anestro se observa, en la citología, la predominancia de células de tipo parabasal e intermedia (FIG. 4). Los resultados de las citologías vaginales en las diferentes fases del ciclo estral de la perra, concuerdan con lo encontrado por Feldman y Nelson [13] y Fontbonne y col. [14], quienes señalan que a medida que progresa el ciclo va cambiando el tipo de células predominantes en cada fase.
Bondestan y col. [2], Shille y Gontarek [33], han señalado que ha sido muy lento y difícil el uso del ultrasonido para detectar fases del ciclo estral, ovulación y preñez en perras, debido probablemente a que los equipos utilizados son fijos e imprácticos, aunque England y Allen [11], señalan que se ha estado usando este método diagnóstico recientemente. England y Allen [11], Pharr y Post [27], han realizado estudios de diagnóstico de preñez, de desarrollo fetal, de imágenes del útero postparto y de diversas patologías en perras. En ellos se establece que el ultrasonido provee un mejor método diagnóstico de preñez y de patologías que afectan el tracto reproductor de la perra, si se compara con imágenes radiográficas o con palpación. De acuerdo a lo obtenido en esta investigación y por lo señalado por los investigadores antes mencionados, el ultrasonido como método diagnóstico y de investigación en pequeños animales es seguro, rápido y relativamente fácil. Sin embargo, debe conocerse muy bien la ubicación y tipo de imagen que reflejen los diferentes órganos, para evitar confusiones.
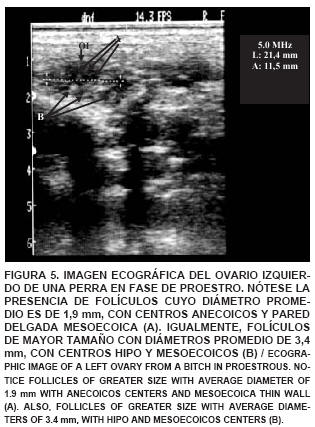
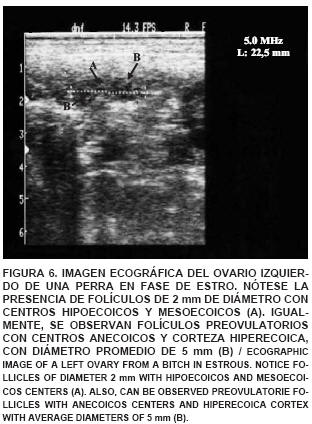
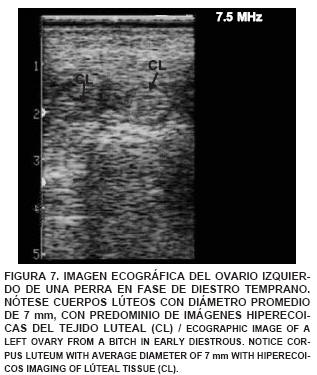
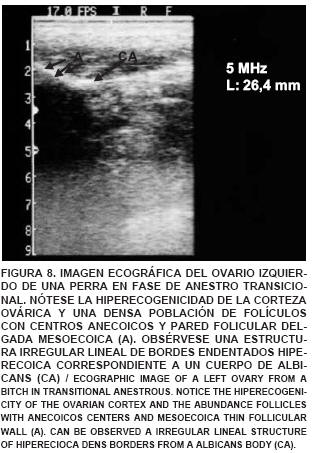
En el estudio ecográfico de una perra en fase de proestro, se observó que el ovario izquierdo es más fácilmente observable que el ovario derecho, éste está ubicado inmediatamente caudal al riñón izquierdo, midiendo 21,4 mm de largo x 11,5 mm de ancho. En él se observó gran actividad folicular encontrándose folículos con centros anecoicos y pared delgada con aspecto mesoecoico. También se visualizaron folículos de mayor diámetro con centros hipo y mesoecoicos (FIG. 5). En la imagen ultrasonográfica de los ovarios de una perra en fase de estro se observaron ovarios con una longitud de 22,5 mm y un grosor de 12,6 mm, presentando folículos de 2 mm de diámetro, con centros hipoecoicos, y mesoecoicos. Asimismo, fueron visualizados folículos preovulatorios (5 mm) con centros anecoicos, indicando la presencia de líquido folicular y corteza hiperecoica (FIG. 6). La imagen ecográfica de los ovarios de una perra en fase de diestro, mostró cuerpos lúteos maduros, proyectando una imagen hiperecoica (FIG. 7) y a lo largo del anestro se observó una imagen ecografica del ovario reflejando una gran hiperecogenicidad de su corteza y una densa población de folículos en fase de crecimiento con centros anecoicos y pared delgada mesoecoica, cuerpos cicatrizales irregulares o cuerpos albicans con bordes evidentemente hiperecoicos (FIG. 8). El tamaño de los ovarios encontrados fue incrementando a medida que avanzaba el ciclo estral, coincidiendo con lo señalado por England y Allen [11], quienes indican que al comienzo del proestro es posible encontrar un ovario que mide cerca de 15 mm de largo y 12 mm de ancho, pudiendo llegar a un tamaño promedio de 30 mm de largo y 16 mm de ancho. Además, indican que las imágenes del ovario se hacen imprecisas sobre todo cuando ocurre la luteinización del folículo preovulatorio y la ovulación, coincidiendo también con lo observado en este estudio.
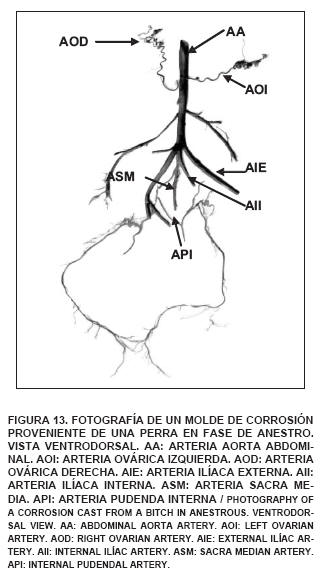
Durante las diferentes fases del ciclo estral se observó que la fuente principal de sangre arterial del ovario es la arteria ovárica, la cual se origina de la arteria aorta abdominal, siendo el origen de la arteria ovárica derecha más craneal que el de la arteria ovárica izquierda. En los nueve especímenes utilizados en este estudio, la arteria ovárica derecha se origina cranealmente con respecto a la arteria ovárica izquierda, a diferencia de lo señalado por Del Campo y Ginther [5] y concordando con lo indicado por Getty [17] y Pradere [31].
La arteria ovárica se divide en tres ramas: a) la rama ovárica de la arteria ovárica, b) la rama tubárica de la arteria ovárica y c) la rama uterina de la arteria ovárica (FIG. 9). La rama ovárica al llegar al hilio del ovario, forma un ovillo arterial que irriga los dos tercios craneales de la gónada (FIG. 9). La rama tubárica contornea craneolateralmente al ovario, irrigando las porciones craneales de la tuba uterina y, en su trayecto, envía un número variable de ramas que discurren en el mesosalpinx e irrigan la bolsa ovárica y el tercio craneal y medial del ovario, anastomosándose con ramas tubáricas de la arteria uterina (FIG. 9). La rama uterina se anastomosa con las ramas segmentales más craneales de la arteria uterina y contribuye a irrigar el extremo craneal del cuerno uterino (FIG. 9). Aunque la arteria ovárica no irriga directamente al útero, en los nueve especímenes utilizados en este estudio, se observó que una o varias de sus ramas formaron anastomosis con las ramas segmentales más craneales de la arteria uterina, irrigando así la extremidad craneal del cuerno respectivo, coincidiendo con lo señalado por Getty [17] y Pradere [31]. Estas anastomosis se observaron en las fases de proestro y estro, indicando que dichas anastomosis están posiblemente sujetas a la acción de factores angiogénicos dependientes de las hormonas esteroideas y luteotróficas, de acuerdo a lo señalado por Garrido y col. [12].
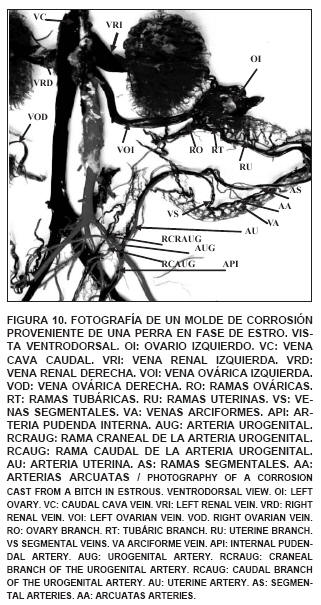
Asimismo, también interviene en la irrigación del ovario, la arteria urogenital que se origina de la arteria pudenda interna. La arteria urogenital emite dos ramas principales: a) una rama craneal y b) una rama caudal. La rama craneal da origen a la arteria uterina, que en el cuerpo del útero diverge, emitiendo ramas segmentales, que irrigan al extremo craneal del cuerno uterino y se anastomosan con una o varias ramas de la arteria ovárica (FIGS. 9 y 10), terminando cranealmente en una rama que irriga las porciones caudales de la tuba uterina y el tercio caudal del ovario. La arteria uterina es el vaso principal que irriga al útero durante todas las fases del ciclo estral (FIGS. 9-13).
Es importante hacer notar que en especímenes provenientes de perras en fases de proestro y estro, una vez formada la vena ovárica izquierda, ésta se bifurca, para luego unirse nuevamente antes de drenar hacia la arteria renal izquierda. Además, se observó una gran cantidad de vasos que drenan hacia el polo caudal y superficie lateral del riñón izquierdo (FIGS. 9 y 10).
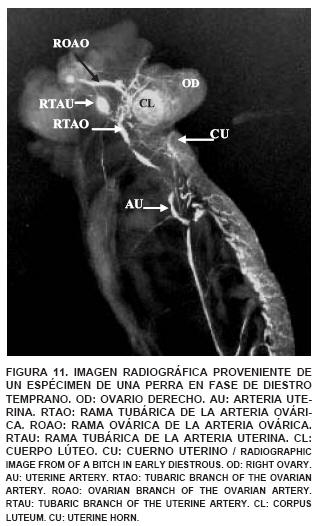
En los especímenes clarificados, provenientes de una perra en fase de diestro, se observó en el ovario derecho un cuerpo lúteo, con arterias de un grosor muy delgado, disminuyendo la cantidad y sus anastomosis dentro de la estructura (FIG. 11). La anastomosis entre la arteria ovárica y la arteria uterina puede constituir una fuente adicional de aporte sanguíneo arterial al ovario, tuba uterina o al útero, sustentando lo indicado por Ginther [14], quien señala que los requerimientos tisulares pueden favorecer la aparición de vasos colaterales que aumentan el flujo sanguíneo en un sitio específico.
En los especímenes clarificados, provenientes de perras en diestro, se observó a nivel del cuerpo uterino, una arteria que cruza, desde el lado derecho hacia el cuerno izquierdo, para distribuirse por el borde antimesométrico del cuerno izquierdo (FIG. 12).
El drenaje venoso del tracto reproductor de la perra ocurre a través de las ramas craneal y caudal de la vena ovárica, esta se origina de numerosas ramas ováricas, tubáricas y uterina que presentan calibres variables (FIG. 9). El drenaje del tercio craneal, medio y caudal del cuerno uterino lo realizan las venas arciformes (venas arcuatas), las cuales confluyen hacia el borde mesométrico del cuerno uterino y forman las venas segmentales (FIG. 9). La porción de las fimbrias, infundíbulo, parte media del cuerpo de la trompa y polo craneal del ovario es drenado por la rama tubárica de la vena ovárica y la extremidad uterina de la trompa por los vasos oviductales de la vena ovárica, los cuales también participan, en un menor grado, en el drenaje de la extremidad craneal del cuerno uterino, siendo la rama uterina de la vena ovárica el vaso principal que drena la extremidad craneal del cuerno uterino (FIG. 10).
La vena ovárica derecha desemboca en la vena cava caudal, mientras que la vena ovárica izquierda es afluente de la vena renal izquierda, La vena ovárica izquierda se bifurca antes de llegar a la vena renal y la presencia de un gran número de vasos que drenan hacia los vasos del polo caudal del riñón izquierdo, indicando que posiblemente durante estas fases es necesario un efectivo y rápido flujo sanguíneo, tanto de aporte como de reemplazo hacia el útero y los ovarios. Lo señalado anteriormente apoya lo establecido por Dobrowolski y Hafez [7], quienes administrando estrógenos a ovejas lograron que el látex inyectado en las venas pudiera distribuirse en los vasos de ambos cuernos. En este estudio, los especímenes que se encontraban en fases de proestro y estro evidenciaron la presencia de conexiones anastomóticas y la ausencia de válvulas que impiden la distribución de la resina en sentido contrario al flujo venoso. Lo mencionado anteriormente demuestra los postulados de Mc Cracken y col. [20], con relación al efecto de los estrógenos sobre el útero y la síntesis de prostaglandina F2a, los cuales ejercen un efecto coordinado sobre los factores hemodinámicos y éstos a su vez son dependientes de las hormonas esteroideas.
CONCLUSIONES
Durante las fases del ciclo estral existe una marcada diferencia en la irrigación arterial y venosa del útero y los ovarios de la perra, que puede depender de la acción de hormonas esteroides a través de la regulación de factores angiogénicos.
La PGF2a, a una dosis de 200 µg/Kg, es efectiva para provocar luteólisis y sincronizar el ciclo estral en la perra, siendo el cuerpo lúteo refractario a la acción de este fármaco después del día 15 post ovulación.
La citología vaginal es un método de diagnóstico eficaz para monitorear las fases del ciclo estral en la perra.
Notas
1 Laboratorios Reveex de Venezuela C.A.
2 Veterinarias Valmorca C.A., Venezuela.
3 Laboratorios Merial, Lyon-France.
4 Protinal, Venezuela.
5 Producam-Chemical, Venezuela.
6 Pharmacia-Upjohn, Venezuela.
7 Laboratorios Palenzola, Venezuela.
8 Laboratorios Valmorca, Venezuela.
9 Laboratorios Protón, Venezuela.
AGRADECIMIENTO
Los autores agradecen al C.D.C.H.- U.C.V., por el financiamiento del proyecto Nº P.I. 11-10-4462-1.999, a los técnicos del laboratorio de Anatomía de la Facultad de Ciencias Veterinarias y al personal del área de la perrera del bioterio de la Universidad Central de Venezuela.
REFERENCIAS BIBLIOGRÁFICAS
1. ANDERSON, L.L.; BLAND, K. D.; MELAMPHY, R. E. Comparative Aspects of Uterine- Luteal Relationships. Rec. Prog. Horm. Res. 25:57-104. 1969. [ Links ]
2. BONDESTAM, S.; ALITALO, I.; KARKKAINNEN, M. Real-Time Ultrasound Pregnancy Diagnosis in the Bitch. J. Small Anim. Pract. 24: 145-151. 1983. [ Links ]
3. CARTEE, R.; HUDSON, J.; FINN-BODNER, S. Ultrasonography. Vet. Clin. of North Amer.: Small Anim. Pract. 2(23):345-377. 1993. [ Links ]
4. COMITÉ INTERNACIONAL DE NOMENCLATURA ANATÓMICA VETERINARIA. Nómina Anatómica Veterinaria. Editorial Aedos. Barcelona- España. 68-91pp. 1983. [ Links ]
5. DEL CAMPO, C.; GINTHER, O. Vascular Anatomy of the Uterus and Ovaries and the Unilateral Luteolytic Effect of the Uterus: Guinea Pigs, Rats, Hamster and Rabbits. Am. J. Vet. Res. 33:2561-2578. 1972. [ Links ]
6. DEL CAMPO, C.; GINTHER, O. Arteries and Veins of the Uterus and Ovaries in Dogs and Cats. Am. J. Vet. Res. 35:409-415. 1974. [ Links ]
7. DEL CAMPO, C.; STEFFENHAGEN, W.; GINTHER, O. Techniques for Clearing of Tissue and Photography of Specimens for Study of Vascular Anatomy. Am. J. Vet. Res. 35:303. 1974. [ Links ]
8. DOBROWOLSKI, W.; HAFEZ, E. Ovaryuterine Vasculature in Sheep. Am.J. Vet. Res. 31:2121-2126. 1970. [ Links ]
9. DOYLE, L.L.; BARCLAY, D.L.; DUNCAN, G.W.; KIRTON, K.T. Human Luteal Function Following Hysterectomy as Assessed by plasma Progestin. Am. J. Obst. Gynecol. 110:92-97. 1971. [ Links ]
10. ECHEVERRÍA, J. Aspectos Farmacológicos en el Manejo Reproductivo de la Perra. Revisión Bibliográfica (Pharmacological aspects in reproductive managenent of the bitch. A review). Revista Electrónica de Veterinaria REDVET. http://www.veterinaria.org/revistas/redvet. Vol.VI.Nº 3. 2005. [ Links ]
11. ENGLAND, G. C.; ALLEN, W. E. Real-Time Ultrasonic Imaging of the Ovary and Uterus of the Dog. J. Reprod. Fertil. 39 (Suppl.):91-100. 1989. [ Links ]
12. ENGLAND, G.; CONCANNON, P.W. Determinación del Momento Óptimo en la Perra: Consideraciones Básicas. In Concannon, P.W.; England, G., Verstegen III. J. and Linde-Forsberg, C. (Eds.), Recents Advances in Small Animal Reproductions. International Veterinary Information Service, Ithaca NY (www.ivis.org), 2002. [ Links ]
13. FELDMAN, E.C.; NELSON, R.W. Endocrinología y reproducción en perros y gatos. McGraw-Hill Interamericana. 2da Ed. 572-728 pp. 2000. [ Links ]
14. FONTBONNE, A.; BUFF, S.; GARNIER, F. Recent Data in Canine Reproductive Physiology and Hormones. Summa. 18:17-22. 2001. [ Links ]
15. FRASER, H.M.; LUNN, S.F. Regulation and Manipulation of Angiogenesis in the Primate Corpus Luteum. J. of Reprod. Fertil. 3(121): 355-362. 2001. [ Links ]
16. GARRIDO, C.; SAULE, S.; GOSPODARO, W. D. Transcriptional Regulation of Vascular Endothelial Growth Factor Gene Expression in Ovarian Bovine Granulosa Cells. Growth Factor. 8:109-117. 1993. [ Links ]
17. GETTY, R. Anatomía de los Animales Domésticos. Tomo II. Editorial Salvat. 5ta Ed. 1746-1810 pp. 1982. [ Links ]
18. GINTHER, O. Internal Regulation of Physiological Processes through Local Venoarterial Pathways: A Review. J. Anim. Sci. 39:550-564. 1974. [ Links ]
19. GINTHER, O. Comparative Anatomy of Uteroovarian Vasculature. Veter. Scope. 20:3-17. 1976. [ Links ]
20. LOEB, L. The Effect of Extirpation of the Uterus on the Life and Function of the Corpus Luteum in the Guinea Pig. Proc. Soc. Exp. Biol. Med. 20:441-464. 1923. [ Links ]
21. MC CRACKEN, J.; GLEW, M.; SCARAMUZZI, R. Corpus Luteum Regression Induced by Prostaglandin F2a. J. Clin. Endocrinol. Metabol. 30:544-546. 1970. [ Links ]
22. MC CRACKEN, J.; SCHRAMM, W.; OKULICZ, W. Hormone Receptor Control of Pulsatile Secretion of PF2a from the Ovine Uterus during Luteolysis and its Abrogation in early Pregnancy. Anim. Reprod. Sci. 7:31-55. 1984. [ Links ]
23. MC CRACKEN, J.; CUSTER, E.E.; LAMSA, J. C. Luteolysis: a Neuroendocrine Mediated Event. Physiol. Rev. 79:263-323. 1999. [ Links ]
24. METCALF, M.; BRAIDEN, C. V.; LIVESEY, J. H. Retention of Normal Ovarian Function after Hysterectomy. J. Endocrinol. 135:597-602. 1992. [ Links ]
25. OKKENS, A.; DIELEMAN, S.; BEVERS, M.; WILLENSE, A. Evidence for the Noninvolvement of the Uterus in the Life Span of the Corpus Luteum in the Cyclic Dog. Vet. Quart. 7:169-176. 1985. [ Links ]
26. PEROZO, E. Vascularización Arterial y Venosa del Útero y los Ovarios de la Oveja en Diferentes Fases del Ciclo Estral. Facultad de Ciencias Veterinarias. Universidad Central de Venezuela. Maracay. Venezuela. (Tesis de Maestría). 61pp. 1996. [ Links ]
27. PHARR, J.W.; POST, K. Ultrasonography and Radiography of the Canine Postpartum Uterus. Vet. Radiol. Ultrasound. 1(33):35-40. 1992. [ Links ]
28. POFFENBARGER, E.M.; FEENEY, D.A. Use of Gray-Scale Ultrasonography in the Bitch: 18 cases (1981-1984). J.A.V.M.A. 1(189):90-95. 1986. [ Links ]
29. PRADERE, J. Irrigación Arterial del Aparato Genital Femenino del Chigüire (Hydrochoerus hydrochaeris). Universidad Central de Venezuela. Facultad de Ciencias Veterinarias. Maracay. Venezuela. (Trabajo de Ascenso). 47pp.1983. [ Links ]
30. PRADERE, J. Irrigación Arterial del Aparato Genital Femenino del Pécari Collar (Tayassu tajaccu). Universidad Central de Venezuela. Facultad de Ciencias Veterinarias. Maracay. Venezuela. (Trabajo de Ascenso). 42pp. 1991. [ Links ]
31. PRADERE, J. Derivaciones Arteriovenosas en el Pedículo Vascular Úteroovárico de la Perra (Canis familiaris). Universidad Central de Venezuela. Facultad de Ciencias Veterinarias. Maracay. Venezuela. (Trabajo de Ascenso). 46pp. 1998. [ Links ]
32. SCHRAMM, W.; BOVAIRD, L.; GLEW, M.E.; SCHRAMM, G.; Mc CRACKEN, J.A. Corpus Luteum Regression Induced by Ultra-Low Pulses of Prostaglandin F2a. Prostag. 3:347-364. 1983. [ Links ]
33. SHILLE, V.; GONTAREK, J. The Use of Ultrasonography for pregnancy diagnosis in the Bitch. J.A.V.M.A. 10 (187):1021-1025. 1985. [ Links ]
34. THORBURN, G.D.; COX, R.I.; CURRIE, W.B.R.; RESTALL, B.J.; SCHNEIDER, W. Prostaglandin F and Progesterone Concentrations in the Uteroovarian Venous Plasma of the Ewe During the Oestrous Cycle and Early Pregnancy. J. Reprod. Fertil. 18(Suppl.): 151-158. 1973. [ Links ]












 uBio
uBio