Revista Científica
versión impresa ISSN 0798-2259
Rev. Cient. (Maracaibo) v.16 n.6 Maracaibo dic. 2006
Lesiones gástricas asociadas a la presencia de bacterias del género helicobacter en caninos.
Gastric lesions associated with the presence of bacteria of the helicobacter genusin canine.
Rito R. Polanco Z.1, Víctor M. Bermúdez G.2, Iris Vivas2, Carlos M. Saldivia2, Venecia de Saldivia3 y Luis Arévalo4
1 Unidad de Investigaciones Quirúrgicas Veterinarias, Universidad Nacional Experimental Francisco de Miranda. Coro, Venezuela.
2 Facultad de Ciencias Veterinarias, Universidad Central de Venezuela. Maracay.
3 Hospital General de Maracay, Venezuela.
4 Vetamericana Caracas, Venezuela. E-mail: rirapoz@yahoo.com.
RESUMEN
Las lesiones digestivas se presentan dependiendo del agente causal, su duración y del grado de exposición. La spirocercosis compromete los sistemas digestivo, circulatorio y óseo, y la helicobacteriosis, es relacionada a gastritis, ulceraciones gastroduodenales y procesos neoplásicos estomacales, reportando a el H. pylori en perros y gatos, como posibilidad zoonótica. Este estudio se realizó en la Sección de Caninos del Bioterio de FCV-UCV, en 43 perros caracterizados por antecedentes callejeros y variados manejos alimenticios, médicos y sanitarios. Sus objetivos, registrar patologías en estómago y determinar, presencia de bacterias del género Helicobacter en lesiones gástricas asociadas a esta bacteria. Las técnicas diagnosticas registraron 16,3% de nódulos por S. lupi, y 13,9% de lesiones inflamatorias y úlceras gastroduodenales; 100% de positividad a ureasa. La histopatología, 58,14% de gastritis aguda superficial, 20,93% de gastritis crónica superficial y 6,98% de gastritis crónica atrófica; la histoquímica evidenció bacterias espiraladas en mucosa gástrica y, se detectó anticuerpos contra H. pylori a 4,7%. No hubo crecimiento bacteriano en cultivos de biopsia. La prueba no paramétrica de Friedman reveló que no hay significancia entre la relación sexo (0,0833) y lesiones esófago-gástricas (0,1561), pero sí, para el sexo (0,0455) en relación con lesiones gástricas (0,1196). El manejo de la población en estudio, tuvo influencia en la aparición de spirocercosis y en la colonización de Helicobacter spp. además, fueron propensos a la infección con H. pylori siendo el perro entonces una alternativa como modelo para el estudio de la helicobacteriosis.
Palabras clave: Helicobacteriosis, gastritis, lesiones gastrointestinales.
ABSTRACT
The digestive injuries appear depending on the causal agent, his duration and on the degree of exhibition. The spirocercosis compromises the digestive, circulatory and osseous systems, and the helicobacteriosis, is related to gastritis, gastroduodenal ulcerations and stomach neoplasics processes, reporting to H. pylori in dogs and cats, as zoonótic possibility. This study was realized in the Canine Section of FCV-UCVs Bioterio, in 43 dogs characterized by street antecedents and varied nourishing, medical and sanitary managings. Its objectives were to register pathologies in stomach and to determine the presence of bacteria of the Helicobacter genus in gastric injuries associated with this bacterium. The diagnostic techniques showed 16.3% of nodules for S. lupi, and 13.9% of inflammatory injuries and sores gastroduodenals; 100% of positivity to ureasa. The histopathology revealed 58.14% of acute superficial gastritis, 20.93% of chronic superficial gastritis and 6.98% of chronic atrophic gastritis; the histochemist demonstrated espiral bacterias in gastric mucous, also, antibodies were detected against H. pylori to 4.7%. There was no bacterial growth in cultures of biopsy. The non paramétric test of Friedman revealed no significance between the sex relation (0.0833) and esophagus gastric injure (0.1561), but if, for the sex (0.0455) in relation with gastric injuries (0.1196). The managing of the population in study had influence in the appearance of spirocercosis, and the colonization of Helicobacter spp., in addition, they were inclined to the infection with H. pylori, being the dog then an alternative as model for the study of the helicobacteriosis.
Key words: Helicobacteriosis, gastritis, gastrointestinal injuries.
Recibido: 03 / 11 / 2004. Aceptado: 22 / 06 / 2006.
INTRODUCCIÓN
Investigaciones científicas han relacionado al género Helicobacter con diversos padecimientos del tubo digestivo como gastritis atrófica, úlcera gástrica, úlcera duodenal y posiblemente, carcinoma gástrico, debido a que causa estimulación de la mucosa gástrica antral [34, 39]. La infección por Helicobacter pylori es una de las enfermedades infecciosas crónicas más frecuentes en la actualidad, pudiendo afectar a cualquier estrato social, raza, sexo o grupo etario aunque evidentemente con distinta frecuencia [19, 31]. Investigaciones en perros y gatos reportan también esta infección, que en contraste con las realizadas en humanos, la patogenia es complicada, ya que los animales domésticos pueden ser colonizados por varias especies de Helicobacter y a veces por múltiples especies en forma simultáneas [37, 38]. A pesar de que los primeros trabajos que informan sobre la presencia de esta bacteria espiralada en estómago de humanos datan hace más de un siglo, es a partir de 1980 cuando Warren y Marshall reportan los conceptos etiopatológicos y terapéuticos sobre los diversos procesos gastroduodenales, presentando evidencias de bacterias curvadas en biopsias gástricas de pacientes con gastritis y úlcera péptica, cultivan esta bacteria espiral y la relacionan con los procesos inflamatorios gástricos [31].
El género Helicobacter abarca más de 15 especies, la mayoría aisladas a partir de la mucosa gástrica de diferentes mamíferos [27, 33], por otra parte, epidemiológicamente se han identificado aproximadamente 40 especies de este género; las especies descubiertas son imputadas como patógenas al humano y según las observaciones en infecciones en el hombre y los animales, este género coloniza y causa inflamación en el estómago (H. pylori, H. heilmannii, H. mustelae), colitis (H. fennelliae) y en ratones, hepatitis (H. bilis) [20]. Algunos autores coinciden en señalar que el Helicobacter posee distintos factores de virulencia que le permite colonizar la cavidad gástrica y persistir en un medio ácido intragástrico, como lo son su movilidad, capacidad de adhesión, metabolismo microaerófilo, capacidad hidrófoba y actividad de la ureasa además de otras enzimas secretadas [6, 9]. Secuencialmente continúa el evento infeccioso con la multiplicación bacteriana, internalización entre las células epiteliales, activación de una fuerte respuesta inflamatoria crónica, humoral y respuesta inmune y seguidamente, control de infección y diseminación de la repuesta inmune favoreciendo a la infección crónica [4, 40]. Puede haber cambios en la mucosa gástrica en regiones diferentes de los perros y gatos a causa de la colonización de especies de este género, tales como formación de folículos linfoides, infiltración celular intersticial con linfocitos, células plasmáticas y neutrófilos, degeneración glandular y fibrosis intersticial [13] pero no en todos los casos [24].
La producción de ureasa es capaz de hidrolizar la urea en amonio rompiendo la integridad de la mucosa gástrica, permitiendo la ulceración y contribuye a la hipoclorhidria observada en enfermedades asociadas al Helicobacter. Por otro lado, el Helicobacter libera catalasa, superóxido dismutasa, la fosfolipasa, y el factor inhibidor de la secreción ácida gástrica, factores que favorecen la colonización de la bacteria [9, 17, 18, 34]. El único marcador de virulencia es el gen asociado a la citotoxina (Cag A) sin especificidad alguna. La citotoxina vacuolizante (Vac A), carece de especificidad y suele asociarse a cepas positivas Cag A; los marcadores gen inductor de contacto con el epitelio (Ice A) y antígeno adherido al grupo sanguíneo (Bab A), no parecen asociarse ni a virulencia ni a especificidad [17, 36].
Las respuestas inmunes locales y sistémicas son complejas y varían entre los seres infectados [8, 32]. Los pacientes infectados responden a anticuerpos anti-Helicobacter esencialmente inmunoglobulinas de la clase IgG, y son detectados en el suero sanguíneo de éstos y de individuos asintomáticos [5, 30]. La respuesta local incluye la producción de IgA, la cual se liga a los antígenos de superficie del Helicobacter; además, la infección es asociada con una intensa respuesta inflamatoria y la infiltración de células polimorfonucleares e infiltraciones de linfocitos B y células T; se ha indicado el aumento de la actividad del asesino natural de los linfocitos de sangre periférica, posiblemente estimulando la producción de interferón y otras citoquinas [8, 32]. Se han realizado vacunas basadas en la actividad de la ureasa, la Vac A, Cag A y otros, la cual percibe conferir profilaxia terapéutica [7, 23]. Existe la hipótesis de que la relación del Helicobacter con el desarrollo de cáncer gástrico se basa en el daño progresivo provocado por la bacteria y su evolución de una gastritis superficial a gastritis crónica, gastritis atrófica y en esta última etapa, infiltración inflamatoria con agregados foliculares linfoides que destruyen la mucosa provocando pérdida de la función e induciendo una metaplasia intestinal, displasia y eventualmente cáncer, pudiendo haber también relación con la epidemiología de el linfoma gástrico MALT [3, 9, 21, 29, 33].
Se ha informado de la colonización gástrica de esta bacteria en el 90 a 95% de los pacientes con úlcera duodenal y entre un 60 a 80% de los pacientes con úlcera gástrica [11, 20]. En 1994, la Organización Mundial de la Salud (OMS) a través de su Agencia para la Investigación en Cáncer (IARC), consideró a el Helicobacter agente carcinógeno del Grupo 1 para el hombre [17]. Algunos estudios hacen pensar a sus investigadores que la metaplasia intestinal puede ser un mecanismo de adaptación para erradicar a la bacteria ya que ésta no es observada en el área de metaplasia intestinal, a pesar de que las pruebas serológicas si lo confirman. En el estado Táchira, Venezuela, se ha encontrado una prevalencia de anticuerpos Helicobacter en los casos de cáncer gástricos (65,7%) en pacientes humanos [4].
Se han usado modelos de animales (cerdos gnotobióticos, primates no humanos, gatos, perros y varias especies de roedores) para investigar los procesos de la enfermedad y terapia para la infección de Helicobacter [14, 16, 23], reportándose resultados que demuestran histolopatológicamente los cambios secuenciales en la mucosa gástrica, los cuales son mínimos con respecto a los producidos en los humanos [10]. Algunos autores [2, 12, 15, 22, 39], citan el reporte de alta prevalencia de infecciones por Helicobacter en las inflamaciones gástricas en carnívoros domésticos, y en animales exóticos en cautiverio [13]. Se ha reportado el diagnóstico de 73,9% de H. felis y H. pylori en uno de los casos evaluados [2], describiendo a los principales organismos espiralados gástricos en perros y gatos morfológicamente distintos al H. pylori los cuales son más herméticos, enrollados y más largos y, debido a que no pueden ser distinguidos en el microscopio de luz cuando son examinados en tejidos gástricos, se les ha denominado "gastric Helicobacter-Like organisms" [12]. Se han descubierto inmunoglobulinas anti-Helicobacter tipo IgG circulantes en perros y gatos [24]. Estudios recientes en Estados Unidos, reportan una prevalencia alta de infección por Helicobacter en lesiones gástricas en perros y gatos [36]. Se ha detectado y aislado este microorganismo en gatos domésticos, planteando otra posible vía de diseminación, que podría afectar principalmente a los niños que juegan con estas mascotas, sugiriendo ello una posible zoonosis [31, 33]. El Helicobacter no ha sido encontrado en perros, y en gatos, ha sido poco común, haciendo mínimo entonces el riesgo de zoonosis. sosteniendo que una variedad de otro Helicobacter spp. puede infectar el estómago de animales domésticos, sin embargo, este papel no ha podido ser aclarado, y ellos tienen un potencial zoonótico pequeño pero real [24].
En Venezuela, los estudios de la infección con las especies de Helicobacter en veterinaria han sido poco documentados. Investigaciones realizadas en una muestra conformada por 22 caninos tomados al azar provenientes de cuatro clínicas veterinarias de la ciudad de Barquisimeto, resultaron en este estudio 17 caninos positivos a la prueba de diagnóstico rápido serológico "Pyloriset", evidenciando que el 77,28% de los animales muestreados tenía anticuerpos contra H. pylori, lo que significaba que alguna vez en sus vidas tuvieron contacto con la bacteria, sugiriendo además, que el canino puede ser fuente de infección para el humano [26]. Por ello el objetivo del presente trabajo fue determinar lesiones en mucosa gástrica en caninos y su relación con bacterias espiraladas semejantes a Helicobacter.
MATERIALES Y MÉTODOS
Esta investigación de tipo descriptivo, fue aplicada a la población de 81 perros de la Sección de Caninos del Bioterio de la Facultad de Ciencias Veterinarias, de la Universidad Central de Venezuela (UCV), núcleo Maracay, animales que se caracterizaban por la convivencia de machos y hembras de diferentes edades y tamaños, variados hábitos, los cuales fueron seleccionados al azar en una muestra conformada por 30 hembras y 13 machos, todos adultos mayores de 2 años de edad, siendo entonces éste el tamaño de la muestra de estudio, basado en la fórmula epidemiológica [1, 25], la cual fue desarrollada como sigue:
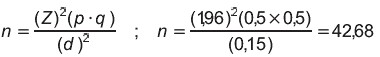
n = 43 animales muestreados.
donde:
n : número de la muestra.
p : animales positivos (0,5)
q : animales negativos (0,5)
(Z)2 : Nivel de confianza a 95% (1,96).
(d)2 : Error máximo esperado (0,15).
Metodología
Fueron usados los métodos invasivos y no invasivos para el diagnóstico de esta enfermedad, los cuales permitieron registrar lesiones en esófago y orientar esta investigación específicamente a la caracterización de los cambios macroscópicos y microscópicos obtenidos en la mucosa gástrica (cardia y antro pilórico). Para verificar la significancia estadística de los resultados obtenidos, fue empleado el análisis de varianza por la prueba no paramétrica de Friedman [35], adaptado al programa computarizado Statistix para el software Windows.
Estudio macroscópico
Video-endoscopia. A cada perro se le administró 0,04 mg/kg sc de sulfato de atropina y 1 mg/kg im de clorhidrato de xilacina al 2%, como agentes pre-anestésicos y luego, inducción anestésica general con Tiopental sódico al 5% (25 mg/kg. iv). Una vez anestesiados, se procedió a la descripción y registro macroscópico de los cambios observados como nódulos parasitarios de Spirocerca lupi y las características de las lesiones en esófago y estómago, las cuales fueron erosiones, inflamaciones y ulceraciones superficiales. Para ello se utilizó un endoscopio Olimpus®, GFX II (Japón) de 1 metro de largo por 0,8 milímetros de diámetro con pinza para toma de biopsias, cámara de video y una fuente de luz universal.
Toma de las muestras para biopsias gástricas. Se tomaron varias muestras de tejido gástrico de las regiones fúndicas y antro pilórico utilizando el mismo equipo para posteriormente ser utilizados en las evaluaciones del resto de las pruebas realizadas en esta investigación.
Prueba bioquímica: Test de ureasa. Este método se basa en la capacidad del Helicobacter de hidrolizar la úrea provocando liberación de CO2 y NH3 con el consiguiente aumento del pH y para ello, se utilizaron muestras de mucosa gástricas conjugadas con el test SERIM PYLORITEK® TEST KIT.
Prueba microbiológica. Cultivo bacteriológico. Se tomaron muestras pareadas de biopsias de mucosas gástrica, las cuales fueron colocadas en medios de preservación que contenía solución salina fisiológica al 0,9% estéril (culturetes) y para luego sembrarlas en medios de cultivos a base agar enriquecidos con sangre de bovino y de antibiótico, los cuales fueron preparados en el laboratorio de Microbiología de la Facultad de Ciencias Veterinarias de la UCV, y en medios de cultivos específicos para especies de los géneros Helicobacter y Campylobacter en un laboratorio privado.
Estudio microscópico
Estudio histopatológico de mucosa gástrica. Las muestras de biopsia fueron colocadas en viales (tubos Eppendorf) con solución de formol al 10% identificados con el número asignado a cada perro en el estudio, procesadas en parafina, cortadas en micrótomo de 4 µm. de espesor y posteriormente coloreadas siguiendo la metodología Standard descrita por el Instituto de Patología de las Fuerzas Armadas de los Estados Unidos de América (AFIP), en el laboratorio de Histoquímica de la Facultad de Ciencias Veterinarias de la UCV.
Las fotografías digitales fueron tomadas con oculares de 40 a 100X de aumentos con objetivos de 10 X en un microscopio NIKON® labophot modelo 234913 (Japón); los aumentos de las fotografías fueron calculados directamente sobre el microscopio (ocular x objetivo) y las imágenes pasadas a una video cámara a color SONY® modelo CCD-IRIS (Japón), a su vez conectada a un ordenador compaq desk pro, que contiene una tarjeta de video de alta resolución y alta velocidad, con un ATI.NLK de 25 frame/second.
Determinación de la presencia de bacterias gástricas espiraladas en cortes histológicos de mucosa gástrica. Se realizaron coloraciones de giemsa y de azul de toluidina para tratar evidenciar formas características y posibles estructuras flageladas presentes en los tejidos de mucosa gástricas evaluadas.
Estudio serológico. Se utilizaron pruebas sencillas basadas en la detección de anticuerpos específicos frente antígenos del Helicobacter como consecuencia de la reacciones inmunológicas local (anticuerpos del tipo IgA) o sistémica (anticuerpos del tipo IgG) del individuo. Para ello, fueron aplicados a cada uno de los sueros sanguíneos la prueba rápida de descarte de detección de anticuerpos de Helicobacter "Rapid Test® DRG Internacional" (proteínas totales) y la prueba de detección rápida de anticuerpos AuroDex® Helicobacter pylori Multi Test (anti-IgA, anti-M, anti-G).
RESULTADOS Y DISCUSIÓN
Estudio macroscópico
La TABLA I describe que de estos individuos, 13 de ellos (33,23%) presentaron lesiones en el tracto digestivo. De estos animales, siete (16,27%) evidenciaron crecimientos nodulares esofágicos a causa de S. lupi, y en los otros seis individuos (13,95%), se encontraron lesiones correspondientes a úlceras gástricas superficiales, concordando este hallazgo con lo descrito en otras investigaciones [4, 8, 28, 40]. Los 30 perros restantes (69,76%), no presentaron lesiones macroscópicas. La prueba estadística no paramétrica de Friedman, resultó no significativa (P > 0,05) entre la relación de hallazgos entre sexo (0,0833) y lesiones en esófago, estómago y mucosa normal (0,1561) de la población muestreada.
TABLA I. DISTRIBUCIÓN TOTAL, PORCENTUAL Y POR SEXO DEL ÁREA ANATÓMICA EVALUADA DE LAS LESIONES MACROSCÓPICAS ENCONTRADAS EN LA POBLACIÓN EN ESTUDIO / TOTAL DISTRIBUTION, PORCENTUAL AND BY SEX OF THE ANATOMICAL ZONE EVALUATED FO THE MACROCOSPIC INJURIES FOUND IN THE POPULATION IN ESTUDY
| Muestras | Esófago (%) | Estómago (%) | Normal (%) | Total (%) |
| Machos | 2 (15,385%) | 1 (7,692%) | 10 (76,923%) | 13 (100%) |
| Hembras | 5 (16,666%) | 5 (16,666%) | 20 (66,666%) | 30 (100%) |
| Total | 7 (16,279%) | 6 (13,953%) * | 30 (69,767%) | 43 (100%) |
La concordancia y el valor predictivo positivo de la prueba bioquímica, está alrededor de 100% cuando se comparan los resultados de este test con los métodos histológicos [9]. El hallazgo de 100% de positividad de las muestras, indica la presencia de microorganismos gástricos productores de ureasa, coincidiendo con otras investigaciones [5], que afirman que la efectividad de esta prueba está relacionada con la cantidad de bacilos presentes en la biopsia y según otros reportes [9], la posibilidad de producirse falsos positivos, por la presencia de gérmenes productores de ureasa como Proteus, Yersinia u otros contaminantes es poca, ya que la especificidad de la prueba es alta porque el numero de bacterias contaminantes en la mucosa gástrica es escasa y la producción de ureasa en cantidades suficientes es casi exclusiva del género Helicobacter.
A pesar de la utilización de medios no selectivos enriquecidos con sangre y otros nutrientes y, medios selectivos como el de Shirrow, el crecimiento de las colonias de bacterias espiraladas en estos medios fue negativo debido posiblemente, al manejo inadecuado de las muestras, o al no haberlas sembradas inmediatamente después de tomarlas, coincidiendo estas consideraciones con otros estudios [9]. Otra posibilidad pudo haber estado relacionada con la necesidad de alojar la muestra de biopsia gástrica mayor tiempo en el caldo de cultivo durante el aislamiento primario, o la necesidad de homogenizar la muestra de biopsia posterior al medio de cultivo primario. Esto es válido para incrementar la tasa de aislamiento de microorganismos facultativos intracelulares que son obligatorios dependientes de la célula huésped como es Helicobacter spp.
Estudio microscópico
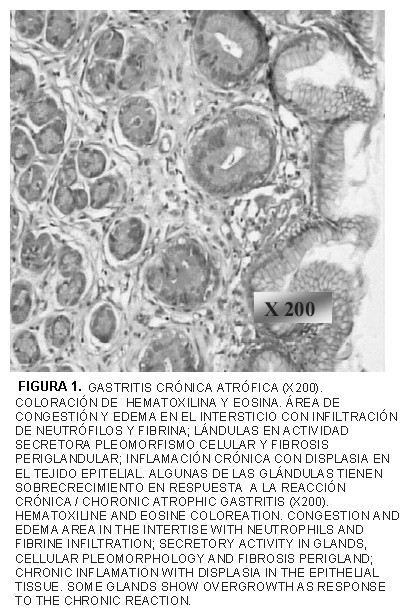
En la TABLA II se describen los hallazgos encontrados en las 43 muestras de biopsias de tejido gástrico, en donde 37 perros (86,047%) presentaron evidencias histopatológicas, registrándose entonces entre éstos 25 individuos (58,14%) con gastritis aguda superficial, 9 (20,93%) con gastritis crónica superficial y 3 (6,977%) con gastritis crónica atrófica, 2 de ellos incluían crecimiento hiperplásico gástrico polipoide de la mucosa, coincidiendo con otros estudios [13, 24]. Estas alteraciones (FIG. 1), podrían ser consecuencia de las condiciones propias y características de la procedencia de los caninos que conformaron la muestra estudiada, ya que estas condiciones variaban indistintamente entre cada uno de estos caninos. En la relación entre el sexo y las lesiones encontradas en mucosa gástricas, la prueba estadística no paramétrica de Friedman, adaptada al programa estadístico computarizado Statistix softwer bajo ambiente Windows, reveló que los resultados son solo significativos para el sexo (0,0455) y no para las lesiones gástricas (0,1196).
TABLA II. DISTRIBUCIÓN TOTAL, PORCENTUAL Y POR SEXO DEL ESTUDIO MICROSCÓPICO DE LAS LESIONES GÁSTRICAS ENCONTRADAS POBLACIÓN MUESTREADA / TOTAL DISTRIBUTION, PORCENTUAL AND BY SEX OF THE MICROSCOPICAL ANÁLISIS OF THE GASTRICS INJURIES FOUND IN THE POPULATION IN STUDY
| Muestras | Lesiones gástricas | ||||
| G.A.S. | G.C.S. | G.C.A. | Normal | Total | |
| Machos | 8 (61,538%) | 3 (23,077%) | 1 (7,692%) | 1 (7,692%) | 13 (100%) |
| Hembras | 17 (56,668%) | 6 (20%) | 2(6,666%)* | 5 (16,666%) | 30 (100%) |
| Total | 25 (58,140%) | 9 (20,930%) | 3 (6,977%) | 6 (13,953%) | 43 (100%) |
G.A.S.: Gastritis aguda superficial. G.C.S.: gastritis crónica superficial. G.C.A.: gastritis crónica atrófica.
* Incluye 1 individuo con crecimiento linfoide polipoideo.
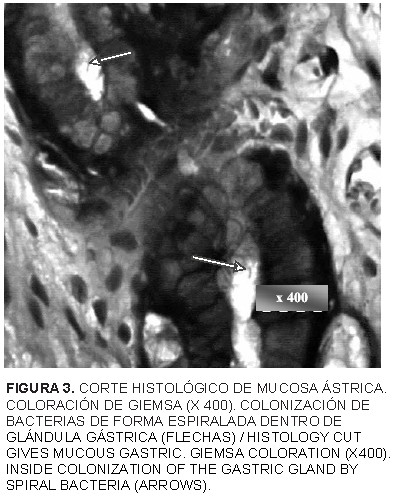
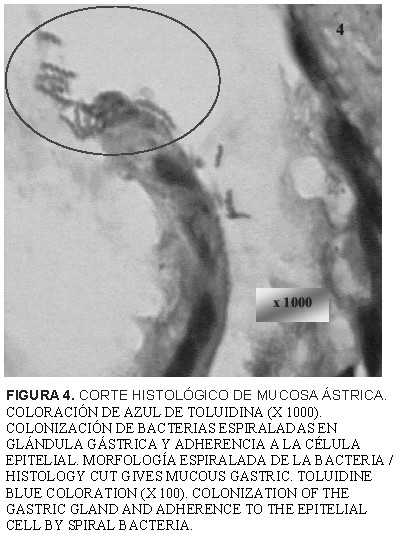
En 39 casos de las muestras evaluadas (90,69%) se registraron bacterias con morfología espiraladas con la tinción de hematoxilina y eosina. La tinción especial de Warthin-Starry, constató 35 de ellas (81,39%), tal como lo muestra la FIG. 2. Las coloraciones especiales de giemsa y de azul de toluidina (FIGS. 3 y 4), pudieron mejorar la observación en algunos casos la morfología característica, apariencia de cubierta externa y posibilidad de presencia de estructuras flajelares. Las bacterias de formas espiraladas y las variadas lesiones tisulares encontradas, coinciden con la presencia y patogenia del Helicobacter spp. reportados en otras investigaciones [15, 36, 37, 38].
Algunos autores aseguran que la infección de Helicobacter en animales no ha sido demostrada e insisten, que los animales domésticos solo pueden estar infectados por variedades de Helicobacter spp. [24], y en este trabajo, las pruebas serológicas determinaron la presencia de anticuerpos contra Helicobacter, tanto para la prueba de determinación de inmunoglobulinas totales, como para Inmunuglobinas G y M en dos (2) caninos (4,65%) del total de la muestra; ello indica, que la infección natural con esta especie si es posible en caninos y que estos animales en algún momento, han podido estar en contacto con esta bacteria, coincidiendo con lo descrito en trabajos anteriores [5] que señalan que estas pruebas son positivas aun después de que la infección ha sido erradicada. Es probable que los resultados positivos sean debido a la similitud antigénica del Helicobacter spp. (H. felis y H. bezzozeronii) con el Helicobacter, mientras que lo obtenido en el resto de las muestras evaluadas (95,35%), se deban a una respuesta compleja o poca satisfactoria, por infección múltiple con bacterias de morfología espiraladas (como es demostrado en los estudios histopatológicos y bioquímicos respectivos) o, estar contaminados solo con especies de antígenos diferentes de Helicobacter, demostrándose con esto lo descrito por otros investigadores [38].
CONCLUSIONES
A pesar de la ausencia microbiológica y adecuada seroconversión a Helicobacter spp., los hallazgos clínicos e histológicos, soportan la respuesta inflamatoria activa de la mucosa gástrica en forma aguda y crónica en el 86,05% de los casos estudiados, y tomando en cuenta las posibilidades de manejo y respuesta ante esta enfermedad, el canino puede ser utilizado líneas de investigaciones sobre la helicobacteriosis.
El estudio macroscópico mediante videoendoscopia reveló la presencia de nódulos esofágicos parasitarios y lesiones en la mucosa estomacal de algunos animales, la conjugación de esta técnica con los hallazgos de biopsia, es recomendable para corroborar el diagnóstico de la lesión.
La producción de ureasa en la mucosa gástrica del grupo experimental del presente estudio indica la presencia de Helicobacter spp., por ser género-específica.
Los requerimientos de medios enriquecidos para el cultivo de Helicobacter spp., y el manejo de los especimenes de biopsias gástricas, probablemente influyeron en la tasa de aislamiento negativo de colonias bacterianas, siendo recomendable, el procesamiento de la biopsia por homogenización para su cultivo.
La utilización de la coloración especial de Warthin-Starry permitió el estudio morfológico de bacilos espiraladas en los cortes histológicos de la mucosa gástrica. Las tinciones con Giemsa y de azul de Toluidina corroboraron estos hallazgos.
La presencia de bacilos espiralados, pudo estar relacionado con las lesiones inflamatorias observadas en la mucosa gástrica del grupo experimental ya que el 86,05% (37 de 43 casos), fueron consistentes con esta asociación.
La confirmación de la presencia de Helicobacter spp., no debe estar ceñida a una sola técnica diagnóstica, por lo que es recomendable, la integración de las técnicas ya descritas para el diagnóstico, incluyendo las utilizadas en este estudio.
REFERENCIAS BIBLIOGRÁFICAS
1. AZORIN, F. Curso de muestreo y aplicaciones. Dirección de Publicaciones de la Facultad de Economía del Instituto de Economía. Instituto de Investigaciones Económicas y sociales de la UCV. 2da Ed. Caracas Venezuela. 375pp. 1970. [ Links ]
2. BABA, A.; CATOI, C.; PRICA, A.; BABA, C.; FARTAN, S. Infectia cu Helicobacter spp: Si gastritei la caine. Rev. Rom. Med. Vet. 3:281-288. 1999. [ Links ]
3. BARRAGRY, T. Helicobacter pylori and gastric ulceration. Irish Vet. J. 4(6):381-383. 1997. [ Links ]
4. CASTRO, D.; PACHECO, O. Helicobacter pylori y cáncer gástrico. Rev. de la Soc. Ven. de Gastroenterol. 52(1):57-62. 1998. [ Links ]
5. CAVAZZA, M.; CORRENTI, M. Aspectos metodológicos para el diagnóstico y estudios de la infección por Helicobacter pylori. Rev. de la Soc. Ven. de Gastroenterol. 52(1):43-47. 1998. [ Links ]
6. COTRAN, R.; KUMAR, V.; COLLINS, T. Patología estructural y funcional. 6ª Ed. McGraw-Hill Interamericana. Madrid. 377-853 pp. 2000. [ Links ]
7. DEL GIUDICE, G.; COVACCI, U.; TELFORD, J.; MONTECUCCO, C.; RAPPUOLI, R. Desarrollo del plan contra el Helicobacter pylori. J. Vet. Int. Med. 14(2):223. 2000. [ Links ]
8. DUBOIS, A. Spiral bacteria in the human stomach: The gastric Helicobacter. Emerg. Infect. Dis. 1:79-85. 1996. [ Links ]
9. FERRÁNDIZ, S.; ROMERO, A. Helicobacter pylori. Rev. de Postgrad. de la VI Cát. de Med. 138:11-17. 1999. [ Links ]
10. FUJIOKA, T.; HONDA, S.; TOKIEDA, M. Helicobacter pylori infection and gastric carcinoma in animal models. J. of Gastroenterol. and Hepatol. 15(1):55. 2000. [ Links ]
11. GOYAL, R. Enfermedades inflamatorias. En: Harrison (Ed.), Principios de medicina interna. 13ª Ed. McGraw Hill Interamericana. España. 1561-1565 pp. 1994. [ Links ]
12. HWANG, CH.; HAN, H.; YOUR, H. Prevalence and clinical characterization of gastric Helicobacter species infection of dog and cats in Korea. J. Vet. Sci. 3:123-133. 2002. [ Links ]
13. JAKOB, W.; SCOLTE, M.; VALENTIN, A.; SCHRÖDER, H.-D. Demonstration of Helicobacter pylori-like organisms in the gastric mucosa of captive exotic carnivores. J. Comp. Path. 116:21-33. 1997. [ Links ]
14. JALAVA, K.; DE UNGRIA, M; O'ROURKE, J.; LEE, U.; HIRVI, U.; HANNINEN, M. Characterization of Helicobacter felis by pulsed-field gel electrophoresis, plasmid profiling and ribotyping. Helicobacter 4(1):17-27. 1999. [ Links ]
15. LECOINDRE, P.; CHEVALIER, M.; PEYROL, S.; BOUDE, M.; FERRERO, R.; LABRIGNE, A. Pathogenic role of gastric Helicobacter spp: in domestic carnivores. Vet. Res. 28:207-215. 1997. [ Links ]
16. LEE, A. Animal models of Helicobacter Infection. Mol. Med. Today 5(11):500-1. (Review). 1999. [ Links ]
17. LÓPEZ-BREA, M.; ALARCÓN, T.; MEGRAUD, F. Diagnosis of Helicobacter pylori infection. Curr. Op. Gastroenterol. 13(Suppl. 1):13-19. 1997. [ Links ]
18. MAILLO, G. Aporte de la endoscopia en la enfermedad acidopéptica. Curso de Postgrado de Endoscopía Digestiva. XVIII Congreso Nacional de la Sociedad Española, (American Society of gastrointestinal endoscopy). Curso de Postgraduados. Madrid, 16-20 de Junio. http://www. aeed.org/POSTEND1.htm/#03. 2001 [ Links ]
19. MARSHALL, B. Helicobacter pylori. The Am. J. of Gastroenterol. 89:S116-28. 1994. [ Links ]
20. MINS, C.; PLAYFAIR, J.; ROITT, I.; WAKELIN, D.; WILLIAMS, R. Microbiología Médica. 2ª Ed. Harcourt Brace Publishers International. España. 559-568 pp. 1999. [ Links ]
21. MORGAN, R. Clínica de Pequeños Animales. 3ª Ed. Harcourt Brace de España. 335-343 pp. 1998. [ Links ]
22. MURRAY, P.; KOBAYASHI, G.; PFALLER, M.; ROSENTHAL, K. Microbiología Médica. 2ª Ed. Harcourt Brace Publisher International. España. 779 pp. 1999. [ Links ]
23. NEDRUD, J.; BLANCHARD, S.; CZINN, S. Helicobacter pylori inflamation and immunity. Helicobacter 7(1):24. 2002. [ Links ]
24. NEIGER, R.; DE SIMPSON, K. Infección de Helicobacter en perros y gatos: hechos y ficción. J. Vet. Intern. Med. 14(2):125-33. 2003. [ Links ]
25. ORGANIZACIÓN PANAMERICANA DE LA SALUD. Programa de adiestramiento en Salud Animal para América Latina. Vigilancia Epidemiológica. Ediciones Aguafuerte S.A. C.V. Washington D.C. Vol.2. 628 pp. 1988. [ Links ]
26. ORELLANA, N. Determinación de la respuesta serológica para Helicobacter pylori en caninos mediante la técnica Pyloriset Dry. Universidad Centroocidental "Lisandro Alvarado", Decanato de Ciencias Veterinarias. Barquisimeto, Estado Lara. (Trabajo de ascenso). 65 pp. (1997). [ Links ]
27. OWEN, R. Helicobacter-especies classification and identification. Br. Med. Bull. 1978; 54(1):17-30. (Review). 1998. [ Links ]
28. PAJARES, J. Infección por Helicobacter pylori: de lo básico a la práctica médica. Curso de Postgrado de Endoscopía Digestiva. XVIII Congreso Nacional de la Sociedad Española, (American Society of Gastrointestinal Endoscopy). Curso de Postgraduados. Madrid, 16-20 de Junio. http://www.congressreview. com/gastro/ga-in-01.htm. 2001 [ Links ]
29. PERAZA; S.; CASTAÑEDA, L. Helicobacter pylori y linfoma tipo Malt. Rev. de la Soc. Ven. de Gastroenterol. 52(1):19-21. 1998. [ Links ]
30. PIÑERO, R.; CAVAZZA, M.; CORRINTIO, M.; CARVAJAL, Z.; SALMA, A.; PIÑERO, R.; URRESTARAZU, M. Presencia de IgG anti-Helicobacter pylori en mujeres embarazadas y muestras sanguíneas de cordón umbilical. Rev. de la Soc. Ven. de Gastroenterol. 52(1):63-69. 1998. [ Links ]
31. PUEYO, A.; HUARTE, M.; JIMENEZ, C. Epidemiología de la infección por Helicobacter pylori. Anales Sis San Navarra 21:9-17. 1998. [ Links ]
32. QUINTANA, E.; SALAS, P.; ACHÍ, R.; DAVIDOVICH, H.; SCHOSINSKY, K. Valor diagnóstico de anticuerpos anti- Helicobacter pylori en pacientes referidos al servicio de endoscopía digestiva del Hospital San Vicente de Paul, Costa Rica. 13:15-23. 2002. [ Links ]
33. RIVAS, F.; HERNÁNDEZ, F. Helicobacter pylori: factores de virulencia, patología y diagnóstico. Rev. Biomed. 11:187-205. [ Links ]
34. ROMERO, R. Helicobacter pylori. Rev. de la Soc. Ven. de Gastroenterol. 52(1):22-34. 2000. [ Links ]
35. SIEGEL, S. Estadística no paramétrica, aplicada a las ciencias de la conducta. Editorial Trillas, México. 188-225 pp. 1994. [ Links ]
36. SIMPSON, K. The relationship of Helicobacter spp.infection to gastric disease in dogs and cats. J. Vet. Intern Med. 14(2):223-227 (Review). 2000. [ Links ]
37. SIMPSON, K.; BURROWS, C. Gastric Helicobacter species infection in dogs and cats: In practice. J. of Vet. Postgrad. Clin. Stud. 8: 427-435. 1999. [ Links ]
38. STRAUSS-AYALI, D.; SIMPSON, K.; SCHEIN, A.; MCDONOUGH, P.; JACOBSON, R.; VALENTINE, B.; PEACOCK, J. Serological discrimination of dogs infected with gastric Helicobacter spp: and uninfected dogs. J. of Clin. Microbiol. 37(5):1280-1287. 1999. [ Links ]
39. TENNANT, B. Scientific information document Helicobacter pylori. J. of Small Anim. Pract. 37(12):609-610. 1996. [ Links ]
40. VIVAS, J.; FERNANDEZ, O. Epidemiología de la infección por Helicobacter pylori. Rev. de la Soc. Ven. de Gastroenterol. 52(1):35-42. 1998. [ Links ]












 uBio
uBio