Revista Científica
versión impresa ISSN 0798-2259
Rev. Cient. (Maracaibo) v.17 n.2 Maracaibo abr. 2007
Obtención de cepas de lactobacillus. Caracterización in-vitro como potenciales probióticas.
Obtention of Lactobacillus strains. In-Vitro Characterization as Potentials Probiotics.
José Andrés Mejía Rodríguez, Zarack Chacón Rueda, Balmore Guerrero Cárdenas, Julio Otoniel Rojas y Guillermo López Corcuera
Postgrado en Biotecnología de Microorganismos, Laboratorio de Biotecnología de Microorganismos. Dpto. de Biología, Facultad de Ciencias, Universidad de Los Andes. Mérida, Venezuela. E-mail: chzarack@ula.ve
RESUMEN
En el presente trabajo se aislaron trescientas sesenta cepas de microorganismos a partir de heces de niños lactantes y muestras vaginales de diez mujeres. Sólo veintidós se identificaron como Lactobacillus. Éstas fueron resistentes a condiciones hostiles como pH 3 y 0,30% de sales biliares. En los caldos de cultivo donde crecieron estas cepas se detectó actividad antimicrobiana contra: Bacillus subtilis ATCC 60519, Candida albicans ATCC 14053, Escherichia coli ATCC 25922 y Staphylococcus aureus ATCC 25923 y contra cepas bacterianas enteropatógenas como Shigella sonnei, Escherichia coli poli I y Salmonella typhi aisladas de infantes con diarrea. Se observó resistencia de las cepas de Lactobacillus a una mezcla de 1,25 µg de trimetropim y 23,75 µg de sulfametoxazol, pero todas fueron sensibles a 10 µg de ampicilina. Estas cepas pueden considerarse posibles probióticas de gran utilidad en la industria láctea.
Palabras clave: Bacterias ácido lácticas, Lactobacillus, probióticos.
ABSTRACT
In this work three hundred and sixty strains of microorganisms were isolated from feces of nursing children and vaginal samples of ten women. Only twenty-two of the strains were identified as Lactobacillus. They were resistant to hostile conditions such as pH 3 and 0.30% of bile salts. It was detected antimicrobial activity in the growth supernatant against: Bacillus subtilis ATCC 60519, Candida albicans ATCC 14053, Escherichia coli ATCC 25922 and Staphylococcus aureus ATCC 25923 and against enteropatogenics bacteria strains such as Shigella sonnei, Escherichia coli poli I and Salmonella typhi isolated of infants with diarrhea. It was observed resistance of Lactobacillus strains to a mixture of 1.25 µg of trimethoprim and 23.75 µg of sulphamethoxazole. However they were sensitive to 10 µg of ampiciline. These strains can be considered as posibles probiotics of great utility in the dairy industry.
Key words: Acid lactic bacteria, Lactobacillus, probiotics.
Recibido: 21 / 10 / 2005 Aceptado: 11 / 10 / 2006.
INTRODUCCIÓN
La flora del colon humano consiste en por lo menos cuatrocientas especies diferentes de microorganismos aerobios y anaerobios, que desarrollan el ecosistema, mantienen un equilibrio dinámico con cada uno de sus huéspedes y contribuyen con las funciones digestivas propias del ser humano. Entre estos microorganismos existen bacterias ácido lácticas incluyendo los géneros Streptococcus, Enterococcus y Lactobacillus [12, 18].
Respecto a su ecología y hábitat, los lactobacilos representan el grupo de bacterias ácido lácticas más ubicuas pudiendo crecer en todos los hábitats que contengan azúcares fermentables, productos hidrolizados de proteínas, vitaminas, factores de crecimiento y aun baja tensión de oxígeno. Además, por ser buenos productores de ácido láctico (hasta 2,7%) y en ocasiones de sustancias antimicrobianas, tienden a dominar numéricamente y limitar o impedir el desarrollo de microorganismos patógenos. En el hombre, los animales y las plantas, cotidianamente se encuentran lactobacilos, probablemente porque éstos son sus huéspedes naturales [9, 27].
Muchas de las propiedades de los lactobacilos hacen que puedan ser catalogados como probióticos, lo cual refiere a microorganismos viables, bien como monocultivo o cultivo mixto, que tienen efectos benéficos para el huésped ya que mejoran las propiedades de la microflora indígena en el tracto gastrointestinal [14, 24, 29, 30]. La mayoría de las cepas que se emplean como probióticos, pertenecen al género Lactobacillus, que son comensales humanos que han sido aplicados históricamente de forma segura en la fermentación de alimentos. Estos son aspectos que garantizan a priori su inocuidad. Sin embargo, a pesar de que estas bacterias se consideran seguras (GRAS), se recomienda que sean sometidas a pruebas que garanticen que su aplicación no tendrá efectos colaterales, que afecten negativamente la salud del huésped [25]. En un comienzo se consideraba que los microorganismos que se emplearían como probióticos, debían formar parte de la flora normal del intestino de la especie animal a la que se suministrarán, sin embargo, posteriormente esta condición no se consideró indispensable siendo más importante los efectos beneficiosos que ocasionaban en el huésped así como su inocuidad [11, 30].
Para que la administración de bacterias ácido lácticas como probióticas, tanto en humanos como en animales, sea exitosa, tienen que ser resistentes a condiciones específicas del tracto gastrointestinal. Entre las propiedades más importantes está la capacidad de sobrevivir el paso a través de la boca, estómago, intestino delgado, intestino grueso, debido a la existencia de sales biliares y pH extremos, que hacen un ambiente hostil [16, 17, 23, 26]. Aunque generalmente la adhesión al mucus intestinal es considerada como un factor importante para lograr la colonización del intestino y prerrequisito esencial para ejercer una actividad probiótica, también hay quien considera que, la unión no es esencial dado que un rápido crecimiento del microorganismo puede lograr el mismo fin [10].
En los diversos epitelios del organismo humano o animal y desde el momento del nacimiento, la luz intestinal es colonizada por la flora microbiana proveniente del medio ambiente instalándose ecosistemas microbianos que contribuyen con el huésped a mantener un estado de normalidad. La ruptura de este equilibrio por diversos factores predispone a la aparición de enfermedades [20, 29].
Los microorganismos probióticos instalados en su nicho ecológico tienen acción preponderante en conservar condiciones de permeabilidad de la mucosa gastrointestinal, en definir perfiles nutricionales y principalmente en interferir en la colonización de bacterias patógenas [3, 6, 14, 17, 19, 22].
En el caso de los animales los probióticos son susceptibles de mejorar los índices de producción (efecto zootécnico) debido al incremento de la higiene digestiva, disminuyendo el estrés y actuando como promotores del crecimiento, con beneficios significativos sobre todo en terneros, pollos y cerdos [5, 13, 31, 32, 33].
Dado que existen reportes en la literatura sobre la presencia de lactobacilos en heces y vaginas [9], en este trabajo se propone, a partir de aislamientos hechos en dichos ambientes, detectar mediante experimentos in vitro, cepas de lactobacilos con propiedades probióticas con posibilidad de usarse en humanos o animales.
MATERIALES Y MÉTODOS
Medios y condiciones de cultivo
Las bacterias ácido lácticas aisladas en este trabajo se cultivaron en caldo o agar MRS (Hi Media) a 37°C durante 10-12 h, sin agitación y en atmósfera rica en CO2 empleando para ello jarras de anaerobiosis (Gas Pack). Como medio de conservación a corto plazo se utilizó agar MRS (Hi Media) en forma de cuñas, manteniendo los cultivos en nevera entre 4-8°C realizando repiques mensuales. Para la conservación a largo plazo, se utilizó caldo MRS con un 30% de glicerol, a –20°C.
Obtención y procesamiento de la muestra
Las cepas de microorganismos se obtuvieron: a) de heces de niños lactantes sanos recolectadas en el hospital Sor Juana Inés y b) muestras vaginales de diez mujeres, ambos tipos de muestras, de la ciudad de Mérida, Edo. Mérida, Venezuela. El tiempo transcurrido entre la recolección de las muestras y su procesamiento fue de aproximadamente 10 minutos. Las muestras vaginales, previo consentimiento de las donantes o de sus representantes legales y con conocimiento pleno del uso que se les daría, fueron recolectadas directamente por ellas con un hisopo estéril. Las heces fueron recolectadas con una paleta estéril y se introdujeron en un colector de heces. Ya que no era objetivo del trabajo determinar el título microbiano de las muestras de los pacientes y sólo interesaba el aislamiento microbiano, hisopos con las muestras vaginales o una pequeña porción de las heces, se introdujeron directamente en tubos con 5 mL de caldo MRS y se incubaron en anaerobiosis a 37°C durante 12 horas. Transcurrido este tiempo se realizaron diluciones seriadas en agua fisiológica y se sembró 0,1 mL de cada dilución en placas de Petri con agar MRS, que fueron incubadas a 37°C en anaerobiosis durante 18 horas. Se escogieron aquellas placas en las que el número total de colonias crecidas se encontraba entre 100 y 150, se tomaron entre 10 y 12 colonias equivalente a la raíz cuadrada del total de ellas, de esta manera se garantizó tomar muestras representativas de los microorganismos presentes [7].
Selección e identificación de las cepas
De las cepas aisladas se hicieron observaciones al microscopio óptico conservándose únicamente aquellas con morfología de bacilos. Posteriormente se realizaron coloraciones de Gram, determinación de esporas, tinción ácido resistentes, motilidad, y las siguientes pruebas bioquímicas: catalasa, producción de ácido a partir de glucosa, producción de H2S [9, 15].
Selección de los microorganismos con capacidad de coagulación de la leche
10 mL de leche estéril pH 6,6, fueron inoculados con un volumen de 1% v/v de un cultivo de cada una de las cepas a ensayar. Se incubaron a 37°C, sin agitación durante 3 días. Pasado el tiempo de incubación se observó la formación o no de un coagulo uniforme.
Crecimiento en medios hostiles
Los ensayos se realizaron modificando el método propuesto por Suscovic y col. [29], para ello las cepas se cultivaron en caldo MRS acidificado hasta pH 3,0 con HCl. También se hicieron pruebas en caldo MRS con 0,30% de Bilis de Buey (Merck). Todos los ensayos se realizaron a 37°C, sin agitación durante 8 horas, el crecimiento se siguió por incremento de turbidez, efectuándose lecturas a 550 nm cada hora con un Spectronic 20D (Milton Roy Company, EUA).
Efecto de inhibición de las cepas seleccionadas sobre microorganismos de prueba.
Los microorganismos de prueba utilizados en el presente estudio provienen del Centro de Cultivo Internacional American Type Culture Collection, EUA, representados por: Bacillus subtilis ATCC 60519, Candida albicans ATCC 14053, Escherichia coli ATCC 25922 y Staphylococcus aureus ATCC 25923. También se emplearon microorganismos enteropatógenos aislados de heces de niños afectados con diarrea y donados por el cepario de Síndromes Gastrointestinales y Urinarios de la Facultad de Farmacia de la Universidad de Los Andes; ellos fueron: Shigella sonnei, Salmonella typhi y Escherichia coli poli I. El ensayo se realizó modificando el método propuesto por Suscovic y col. [29], para ello cada una de las cepas ácido lácticas seleccionadas fue cultivada en caldo MRS sin agitación durante 8 horas. Transcurrido el tiempo de incubación los cultivos se centrifugaron a 13000 g durante 15 minutos, el sobrenadante se filtró estérilmente a través de un filtro marca Millipore con un poro de 0,45 µm. El filtrado se agregó en una proporción de 10 y 50% en caldo nutritivo estéril, y se sembró con un preinóculo de 1% de cada uno de los microorganismos de prueba, se incubó por 8 horas a 37°C sin agitación. El crecimiento se determinó mediante la lectura de densidad óptica a 550 nm, cada hora.
Prueba de sensibilidad de las cepas a los antibióticos
Se empleó ampicilina (Laboratorios Farmacéuticos SM C.A., Maracaibo) y trimetoprim-sulfametoxazol (Productos RONAVA, Caracas). Se utilizó el método de difusión en agar con discos [4], para ello se sembró cada una de las cepas seleccionadas en caldo MRS sin agitación a 37°C durante 8 horas. Pasado el tiempo de incubación se sembraron en superficie sobre placas de Petri con agar Mueller Hinton (Hi Media) 0,5 mL del cultivo de cada una de las cepas a ensayar, las placas fueron colocadas a 37°C durante 30 minutos para que se secaran. Las concentraciones que se probaron de los antibióticos fueron 10 µg para la ampicilina y una mezcla de 1,25 µg de trimetropin y 23,75 µg de sulfametoxazol. Los antibióticos estaban en discos comerciales de 0,6 mm de diámetro (Difco), estos discos se colocaron con una pinza estéril sobre las placas inoculadas. Las placas fueron incubadas en jarras de anaerobiosis a 37°C durante 3 días, midiéndose diariamente en caso de existir, el diámetro de la zona de inhibición.
Determinación de la acidez titulable.
La acidez titulable en los sobrenadantes de cultivo de las bacterias seleccionadas, se determinó mediante una titulación con NaOH 0,1 N y fenolftaleina al 1% como indicador de punto final [2].
RESULTADOS Y DISCUSIÓN
Aislamiento e identificación de los microorganismos aislados
Inicialmente se aislaron 360 colonias. En una primera etapa, luego de observaciones al microscopio se hizo una preselección descartándose 80 colonias que morfológicamente correspondían a cocos, conservándose 280 con las características morfológicas de lactobacilos. Entre estas se descartaron las cepas Gram negativas y se conservaron 93 cepas Gram positivas. Al realizar las pruebas para comprobar la presencia del género Lactobacillus [9,15] se encontró que todas ellas presentan las características propias del género es decir: endospora y tinción ácido resistente negativas, producción positiva de ácido a partir de glucosa; no se detectó actividad catalasa ni producción de sulfuro de hidrógeno.
Selección de microorganismos con capacidad de coagulación de la leche.
Pensando que las cepas aisladas podrían a futuro emplearse en la elaboración de leches fermentadas con probióticos, se evaluó si las cepas podían coagular la leche. De las 93 cepas ensayadas, sólo 22 cepas presentaron esta propiedad, el resto fue descartado. Las cepas que se conservaron fueron numeradas para los posteriores estudios como Bio 1 al 22.
Es importante señalar que el 54% de las cepas se obtuvo de las heces de los infantes y 46% de vagina humana. Esto no es sorprendente ya que es bien conocido que el tracto digestivo y los órganos genitales del hombre y de los animales, son hábitats donde muchas especies de lactobacilos encuentran condiciones favorables para su desarrollo [9].
Crecimiento de los microorganismos en estudio en diferentes medios hostiles
Las sales biliares y la acidez gástrica son algunas de las barreras a superar por los microorganismos que actúan como probióticos. De ahí partió el interés en realizar el crecimiento de las cepas aisladas en diferentes medios hostiles: crecimiento en medio MRS con un pH inicial de 3 y crecimiento en medio MRS con 0,30% de bilis de buey obteniéndose los resultados mostrados en la TABLA I.
TABLA I. TIEMPO DE GENERACIÓN (MINUTOS) DE LAS CEPAS BIO EN LOS DIFERENTES MEDIOS. PORCENTAJE DE INHIBICIÓN CON RESPECTO AL CONTROL / GENERATION TIMES (MINUTES) OF BIO STRAINS IN DIFFERENT CULTURE MEDIA. PERCENTAGE OF INHIBITION TOWARDS THE CONTROL.
| Cepa | I Control | II pH 3 | III % de inhibición | IV Bilis | V % de inhibición |
| Bio 1 | 93 | 130 | 40 | 141 | 52 |
| Bio 2 | 106 | 155 | 46 | 165 | 56 |
| Bio 3 | 120 | 178 | 48 | 192 | 60 |
| Bio 4 | 84 | 116 | 38 | 128 | 52 |
| Bio 5 | 112 | 164 | 46 | 177 | 58 |
| Bio 6 | 110 | 158 | 44 | 165 | 50 |
| Bio 7 | 95 | 133 | 40 | 144 | 52 |
| Bio 8 | 87 | 118 | 36 | 129 | 48 |
| Bio 9 | 94 | 131 | 39 | 141 | 50 |
| Bio 10 | 93 | 131 | 41 | 143 | 54 |
| Bio 11 | 96 | 136 | 42 | 149 | 55 |
| Bio 12 | 90 | 126 | 40 | 137 | 52 |
| Bio 13 | 105 | 151 | 44 | 164 | 56 |
| Bio 14 | 94 | 132 | 40 | 143 | 52 |
| Bio 15 | 115 | 169 | 47 | 184 | 60 |
| Bio 16 | 102 | 148 | 45 | 153 | 50 |
| Bio 17 | 108 | 153 | 42 | 164 | 52 |
| Bio 18 | 97 | 138 | 42 | 147 | 52 |
| Bio 19 | 105 | 151 | 44 | 164 | 56 |
| Bio 20 | 97 | 137 | 41 | 145 | 50 |
| Bio 21 | 93 | 128 | 38 | 136 | 50 |
| Bio 22 | 113 | 167 | 48 | 174 | 54 |
I.- Crecimiento de las cepas en estudio en caldo MRS (control). II.- Crecimiento de las cepas en estudio en caldo MRS con un pH inicial de 3,0.
III.- Porcentaje de inhibición de las cepas crecidas a un pH de 3,0. IV.- Crecimiento de las cepas en caldo MRS con 0,30% de bilis de buey.
V.- Porcentaje de inhibición de las cepas crecidas en presencia de bilis de buey.
En ambos medios hubo inhibición del crecimiento, encontrándose un 42% en promedio, con mínimos de 36% y máximos de 48% para el medio ácido; mientras que en el caso de la bilis de buey, hubo un promedio de 54%, con mínimos de 48% y máximos de 60% de inhibición. Con estos resultados se puede inferir que las cepas aisladas en este experimento pueden ser utilizadas para elaborar una leche fermentada, con algunas de las características de probióticas, ya que podrían transitar el aparato digestivo humano y facilitando, de este modo, la colonización del tracto gastrointestinal.
En el estómago es posible encontrar cantidades importantes de Lactobacillus spp. [1, 28], no es sorpresivo que las cepas aisladas, aunque con un tiempo de generación mayor al del control, pudieran crecer a pH 3, lo cual es un hallazgo interesante, ya que existen reportes que indican que otras cepas de lactobacilos como la M92 de Lactobacillus acidophilus sólo puede sobrevivir durante 3 horas a ese pH, produciéndose luego la lisis del 60% de la población inicial [29].
Con respecto a las sales biliares, algunas cepas de Lactobacillus no crecen en presencia de sales conjugadas de la bilis, pero si en presencia de sales deconjugadas [29]. En las cepas aisladas en este trabajo pareciera que la situación es diferente, ya que la bilis deshidratada de buey posee una mezcla de ambos tipos de sales, y sin embargo, las cepas lograron crecer. Este resultado podría implicar que las cepas examinadas poseen actividad hidrolítica para las sales biliares; en relación a este punto las opiniones son contradictorias: hay autores que opinan que la presencia de actividad hidrolítica para las sales biliares no es deseable en una bacteria probiótica ya que podría disminuirse la concentración de sales conjugadas a niveles por debajo de los necesarios para la óptima digestión y absorción de los lípidos. Además las formas deconjugadas pueden sufrir una modificación posterior y se suponen participan en procesos responsables en el desarrollo de cáncer de colon [29]. Sin embargo, en ensayos in-vitro con cepas de Lactobacillus reuteri, con actividad hidrolítica para las sales biliares, no se detectaron efectos perjudiciales, atribuyéndose esta propiedad a que las sales deconjugadas se adsorben sobre la superficie celular del lactobacilo, disminuyendo así su biodisponibilidad [8]. Los mismos autores reportan que Enterococcus faecium CRL 183 y Lactobacillus reuteri CRL 1098, ambos con actividad hidrolítica sobre las sales biliares, ejercen inhibición contra Listeria monocytogenes gracias a las sales deconjugadas por ellas producidas.
A pesar que los porcentajes de inhibición son importantes en la totalidad de las cepas ensayadas en medios hostiles, es importante destacar que en este caso se probó la habilidad de las cepas a crecer en dichos medios hostiles más que su resistencia a esas condiciones adversas. En caso de que alguna de estas cepas se utilizara en la elaboración de un alimento lácteo probiótico, estos porcentajes de inhibición no serían tan importantes ya que el tránsito de un alimento por el estómago o por el intestino delgado es menor que las 8 horas que duraron los ensayos de crecimiento y por tanto el efecto negativo sería mucho menor.
Efecto inhibitorio de las cepas Bio sobre microorganismos patógenos de prueba
Al tratar los microorganismos patógenos de prueba con cualquiera de los sobrenadantes de cultivo de las diferentes cepas Bio se encontró que independientemente del microorganismo de prueba empleado, cuando la concentración fue de 10%, durante las primeras 5 horas se produjo una inhibición del crecimiento, luego de lo cual se registró un crecimiento más lento en comparación al del control. Después de 24 horas el crecimiento alcanzó valores cercanos al control (resultado no mostrado). Sin embargo, al utilizar un 50% de sobrenadante, no sólo se produjo una inhibición del crecimiento, sino que luego de 3 horas de incubación comenzó una ligera disminución de la densidad óptica, probablemente debido a una lisis celular. Como un ejemplo representativo de esta situación se presenta el caso de E. coli ATCC 25922 crecida en presencia del sobrenadante de cultivo de la cepa Bio 12 (FIG.1).
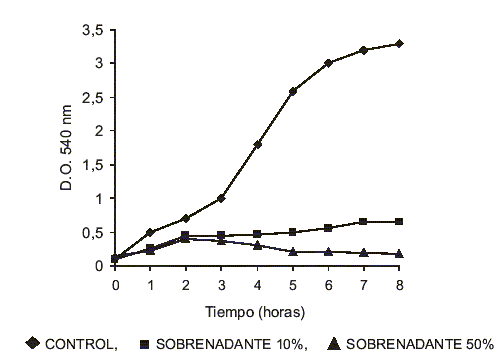
FIGURA 1. CRECIMIENTO DE E. Coli ATCC 25922 EN PRESENCIA DE SOBRENADANTE DE CULTIVO DE LA CEPA BIO 12 / GROWTH CURVES OF E. Coli ATCC 25922 IN THE PRESENCE OF GROWTH SUPERNATANT OF BIO 12 STRAIN.
Aparentemente, a bajas concentraciones el efecto es bacteriostático afectando tan sólo un cierto número de células, las restantes crecerían lentamente hasta que luego de 24 horas alcanzan un número equivalente al control. A 50% de concentración todas las células presentes fueron afectadas y no sólo se impidió el crecimiento de ellas sino que se provocó su lisis celular; en esta proporción de sobrenadante, el agente responsable de la muerte celular actuó como un agente bacteriolítico.
Durante el crecimiento de las bacterias ácido lácticas y como consecuencia del metabolismo de la lactosa, éstas producen ácido láctico, el cual de por si es un inhibidor de muchos microorganismos [21]. Para descartar que el efecto inhibitorio se debiera al ácido láctico, se realizaron ensayos en presencia de este ácido. Al determinar la acidez titulable en el sobrenadante de cultivo de las 22 cepas BIO se encontró que ésta varió entre 4,55 y 5,13 g de ácido láctico/L. Realizando ensayos con la máxima concentración de ácido (0,25% de ácido para 50% de sobrenadante), se encontró que Candida albicans ATCC 14053, Staphylococcus aureus ATCC 25923, Shigella sonnei y Salmonella typhi se vieron afectadas en su crecimiento pero no en la magnitud que se produjo en presencia del sobrenadante de cultivo de las cepas BIO, además en ninguno de los casos se observó lisis celular. Escherichia coli poli I no fue afectada en lo absoluto. Por tanto la inhibición no sólo se debe al ácido láctico sino a otro metabolito, probablemente tipo bacteriocina.
Susceptibilidad de las cepas Bio a Trimetoprim-Sulfametoxazol (1,25 µg y 23,75 µg) y Ampicilina (10 µg)
Con frecuencia las personas afectadas por diarreas de origen microbiano, son tratadas con antibióticos, que no sólo pueden afectar a los patógenos, sino también a microorganismos normales del huésped. Entre estos últimos podrían estar los probióticos, es por ello que otra propiedad deseable hasta cierto punto es que sean resistentes a antibióticos. Por esta causa se probó la sensibilidad de las cepas frente a dos antibióticos normalmente usados en casos de diarreas, ellos fueron: trimetoprim-sulfametoxazol y ampicilina. Casi todas las cepas (77%) fueron resistentes al primero de ellos, a excepción de Bio 3, 4, 14, 19 y 20, que fueron susceptibles (TABLA II). Para el caso de la ampicilina, todas las cepas fueron susceptibles con halos de inhibición entre 12 y 30 mm; concentraciones menores (0,5 µg) no afectaron a ninguna de las cepas.
TABLA II. SUSCEPTIBILIDAD DE LAS CEPAS BIO A AMPICILINA (10 µg) Y TRIMETROPIN-SULFAMETOXAZOL (1,25 Y 23,75 µg) / SUSCEPTIBILITY OF BIO STRAINS TO AMPICILINE (10 µg) AND TRIMETHOPRIM-SULPHAMETHOXAZOLE (1.25 AND 23.75 µg)
| Halos de inhibición en milímetros | ||
| Cepa | Ampicilina (10 µg) | Trimetropin-Sulfametoxazol (1,25 -23,75 µg) |
| Bio 1 | 20 | R |
| Bio 2 | 25 | R |
| Bio 3 | 30 | 10 |
| Bio 4 | 30 | 12 |
| Bio 5 | 30 | R |
| Bio 6 | 30 | R |
| Bio 7 | 15 | R |
| Bio 8 | 20 | R |
| Bio 9 | 14 | R |
| Bio 10 | 16 | R |
| Bio 11 | 22 | R |
| Bio 12 | 25 | R |
| Bio 13 | 25 | R |
| Bio 14 | 28 | 12 |
| Bio 15 | 16 | R |
| Bio 16 | 18 | R |
| Bio 17 | 25 | R |
| Bio 18 | 30 | R |
| Bio 19 | 30 | 25 |
| Bio 20 | 25 | 16 |
| Bio 21 | 14 | R |
| Bio 22 | 15 | R |
R: resistente.
Resultados similares han sido reportados por otros autores [29], quienes trabajando con la cepa M92 de Lactobacillus acidophilus encontraron resistencia hacia trimetroprin-sulfametoxazol, incluso con concentraciones para ambos tan altas como 25 µg; sin embargo, para el caso de la ampicilina hubo sensibilidad a partir de concentraciones de 0,5 µg.
El empleo de estas bacterias, resistentes a algunos antibióticos es interesante en la manufactura de productos lácteos como por ejemplo las leches fermentadas, sobre todo si hay residuos de antibióticos como consecuencia de terapias en los animales, ya que pueden afectar el desarrollo da las bacterias ácido lácticas que se emplean como iniciadoras, lo que podría permitir el desarrollo de bacterias indeseables como Staphilococcus aureus o cepas de Salmonella resistentes a antibióticos [29].
Por otro lado es importante señalar, que hay autores que consideran que la resistencia a los antibióticos no es una propiedad deseable en probióticos, ya que por intermedio de plásmidos podría transferirse a bacterias patógenas presentes en el intestino del huésped creando situaciones no deseables para la salud [23]. No se conoce si las cepas de lactobacilos aisladas en este estudio poseen plásmidos y en caso de poseerlos, si son los responsables de proporcionar la resistencia a los antibióticos mencionados.
CONCLUSIONES Y RECOMENDACIONES
Se lograron aislar y mantener 22 cepas de Lactobacillus spp de heces de niños lactantes y vagina de mujeres. Estas cepas presentaron in vitro algunas características deseables en microorganismos probióticos, tales como resistencia a pH 3 y a 0,30% de sales biliares, además poseen actividad antimicrobiana contra algunos microorganismos de prueba (Bacillus subtilis, Candida albicans, Escherichia coli, Staphylococus aureus, Shigella sonnei, Salmonella typhi), algunos de ellos asociados con síndromes diarreicos de origen microbiano.
El 77% de las cepas aisladas presentaron resistencia sobre la concentración ensayada de trimetropim-sulfometoxazol, antibiótico usado frecuentemente en los síndromes diarreicos, lo cual es importante conocer ya que luego de una terapia con antibióticos en el intestino quedan restos de estas sustancias, las cuales podrían causar la muerte de microorganismos de interés. Todas las cepas fueron sensibles a la concentración empleada de ampicilina.
En conclusión las bacterias obtenidas podrían ser utilizadas de manera positiva para elaborar productos lácteos con probióticos o como aditivos en alimentos para humanos o animales, ya que resisten a la acidez gástrica y a las propiedades antibacterianas de las sales biliares sin contar con la capacidad antimicrobiana contra algunos microorganismos enteropatógenos.
Es recomendable emplear metodologías más precisas como las de taxonomía molecular que permitan identificar las cepas aisladas hasta su especie.
Es necesario determinar si las cepas aisladas poseen plásmidos y si estos confieren resistencia a algún antibiótico.
REFERENCIAS BIBLIOGRÁFICAS
1. ANTOINE, J.M.; ADAM, F.; FAZEL, A.; HARTLEY, D. Bactéries lactiques en alimentation humaine. In: Bactéries Lactiques, Vol II. Lorica. 419-420 pp.1994. [ Links ]
2. AMARIGLIO, S. Determination de l´acidite titrable. En: Controle de la qualité des produits laitiers. Analyses physiques et chimiques, AFNOR-ITSV (ASSOCIATION FRANCAISE DE NORMALIZATION – INFORMATION TECHNIQUES DES SRVICES VETERINAIRES). 123-124 pp. 1986. [ Links ]
3. ALANDER, M.; SATOKARI, R.; KORPELA, R.; SAXELIN, M.; VILPPONEN-SALMELA, T.; MATILLA-SANDHOLM, T.; VON WRIGTH, A. Persistance of colonisation of human colonic mucosa by a probiotic strain, Lactobacillus rhamnosus GG after oral comsuption. Appl. Environ. Microbiol. 65: 351-354. 1999. [ Links ]
4. BAUER, A.W.; KIRBY, W.M.; SHERRIS, J.C.; TURK, C. Antibiotic susceptibility testing by a standarized single disk method. Am. J. Clin. Pathol. 45: 493-496. 1996. [ Links ]
5. CALLAWAY, T.R.; ANDERSON, R.C.; EDRINGTON, T.S.; GENOVESE, K.J.; HARVEY, R.B.; POOLE, T.L.; NISBET, D.J. Recent pre-harvest supplementation strategies to reduce carriage and shedding of zoonotic enteric bacterial pathogens in food animals. Anim. Health Res. Rev. 5: 35-47. 2004. [ Links ]
6. COCONIER, M.H.; LIEVIN, V.; HEMERY, E.; SERVIN, A.L. Antagonistic activity against Helicobacter infection in vitro and in vivo by the human Lactobacillus acidophilus strain LB. Appl. Environ. Microbiol. 64: 4573-4580. 1998. [ Links ]
7. CHAMBA, J.F.; DUONG, C.; FAZEL, A.; PROST, F. Sélection des Souches de Bactéries Lactiques. En: Bactéries Lactiques. Vol. I. Lorica. 501-502 pp. 1994. [ Links ]
8. DE BOEVER, P.; WOUTERS, R.; VERSCHAEVE, l.; BERCKMANS, P.; SCHOETERS, G.; VERSTRAETE, W. Protective effect of the bile salt hydrolase-active Lactobacillus reuteri against bile salt cytotoxity. Appl. Microbiol. Biotecnol. 53: 709-714. 2000. [ Links ]
9. DELLAGLIO, F.; DE ROISSART, H.; TORRIANI, S.; CURK, M.C.; JANSSENS, D. Caractéristiques Générales Des Bactéries Lactiques. En: Bactéries Lactiques. Vol. I. Lorica. 25-116 pp. 1994. [ Links ]
10. FULLER, R. Introduction, In: Probiotics 2, Aplications and practical aspects, Chapman and Hall. London. New York. 1-9 pp. 1997. [ Links ]
11. GILLILAND, S.E. Beneficial interrelationships between certain microorganism and humans: candidate microorganisms for use as dietary adjuncts. J. Food Protect. 42: 164-167. 1979. [ Links ]
12. HOLDEMAN, L.C.; GOOD, I.J.; MOORE, W.E.C. Human faecal flora variation in bacterial composition within individuals and a posible effect of emocional stress. Appl. Environ. Microbiol. 31: 359-375. 1976. [ Links ]
13. HUANG, M.K.; CHOI, Y.J.; HOUDE, R.; LEE, B.; ZHAO, X. Effects of Lactobacilli and an acidophilic fungus on the production performance and immune responses in broiler chickens. Poult Sci. 5: 788-795. 2004. [ Links ]
14. KAILASAPATHY, K.; RYBKA, S. Lactobacillus acidophilus and Bifidobacterium sp. Their terapeutic potencial and survival in yogurt. Aust. J. Dairy Tech. 52: 28-25. 1997. [ Links ]
15. KANDLER, O.; WEISS, N. Regular, Nonsporing Gram-Positive Rods. In: Bergeys Manual of Systematic Bacteriology. 7th Ed. The Williams and Wilkins C., Baltimore. 1209-1234 pp. 1986. [ Links ]
16. KIMOTO, H.; OHMOMO, S.; NOMURA, M.; KOBAYASHI, M.; OKAMOTO, T. In vitro studies of probiotic properties of Lactococci. Milchwissenschaft. 55: 245-249. 2000. [ Links ]
17. KIRJAVAINEN, P.; OUWEHAND, A.; ISOLAURI, E.; SALMINEN, S. The ability of probiotic bacteria to bind to human intestinal mucus. FEMS Microbiol. Lett. 167: 18189. 1998. [ Links ]
18. MADIGAN, M.; MARTINKO, J.; PARKER, J. Prokaryotic Diversity: Bacteria, En: Brock Biology of Microorganisms. 9th Ed. Pretice Hall New Jersey. 506-507 pp. 2000. [ Links ]
19. PASCUAL, M.; HUGOS, M.; BADIOLA, J.J.; MONFORT, J.M.; GARRIGA, M. Lactobacillus salivarius CTC 2197 prevents Salmonella enteriditis colonization in chickens. Appl. Environ. Microbiol. 65: 4981-4986. 1999. [ Links ]
20. PERDIGÓN, G.; AGÜERO, G.; ÁLVAREZ, S.; GAUDIOSO DE A, C. PESCE DE R.H. Effect of viable Lactobacillus casei feeding on the inmunity of the mucosae and intestinal microflora in mal-nourished mice. Milchwissenschaft. 50: 251-256. 1995. [ Links ]
21. PIARD, J.C.; DESMAZEAUD, M. Inhibiting factors produced by lactic acid bacteria. 1. Oxigen meabolites and catabolism end-products. Lait 71: 525-541. 1991. [ Links ]
22. REID, G. The scientific basis for probiotics strains of Lactobacillus. Appl. Environ. Microbiol. 65: 3763-3766. 1999. [ Links ]
23. RELALAIS, G.P. Recent advances in the prevention and treatment of diarrheal diseases. Curr Opin Infect Dis. 9: 210-213. 1996. [ Links ]
24. SALMINEN, S.; DEIGHTON, M.; GORBACH, S. Lactic Acid Bacteria in Health and Disease. Capítulo 7. En: Salminen, S. y Wright, A. (EdS.) Lactic Acid Bacteria. Marcel Dekker. Inc. New Cork. 203-204 pp. 1993. [ Links ]
25. SANT, Y.; COLLADO, M.C.; DALMAU, J. Probióticos: criterios de calidad y orientaciones para el consumo. Acta Pediátr. Españ. 61: 476-482. 2003. [ Links ]
26. SAREM, L.; SAREM, F.; MARCHAL, L.; NICOLAS, J. In Vitro colonization ability of human colon mucosa by exogenous Lactobacillus strains. FEMS Microbiol. Lett. 13: 133-137. 1995. [ Links ]
27. SHARPE, M., E. The Genus Lactobacillus In: The Prokaryotes, Vol II Springer-Verlag: 1653-1679 pp. 1981. [ Links ]
28. SUÁREZ, E.; ÁLVAREZ, R. Yogur y leches fermentadas. Aspectos generales. Alimentación Equipos y Tecnología. Nº 9. Editorial Alicón, S.A. España. 119-126 pp. 1991. [ Links ]
29. SUSKOVIC, J.; BRKIC, B.; MATISIC, S.; MARIC, V. Lactobacillus acidophilus M92 as potential probiotic strain. Milchwissenschaft. 52: 430-435. 1997. [ Links ]
30. TOURNUT, J. Perspectives de Développement des Probiotiques á Base de Bactéries Lactiques. In: Bactéries Lactiques. Vol II. Lorica. 471-488 pp. 1994. [ Links ]
31. WOLTER, R.; HENRY, N. Bactéries Lactiques en Alimentation Animale. In: Bactéries Lactiques. Vol II. Lorica. 453-470 pp.1994. [ Links ]
32. YORUK, M.A.; GUL, M.; HAYIRLY, A.; MACIT, M. The effects of suplementation of humete and probiotic on egg production quality parameters during the late laying period in hens. Poult. Sci. 83: 84-88. 2004. [ Links ]
33. YOUNTS-DAHL, S.M.; GALLEAN, M.L.; LONERAGAN, G.H.; ELAM, N.A.; BRASHEARS, M.M. Dietary supplementation with Lactobacillus and Propionibacterium based direct fed microbials and prevalence of Escherichia coli 0157 in beef feedlot cattle and hides at harvest. J. Food Prot. 67: 889-893. 2004. [ Links ]












 uBio
uBio 
