Revista Científica
versión impresa ISSN 0798-2259
Rev. Cient. (Maracaibo) v.17 n.4 Maracaibo ago. 2007
Evaluación y mejoramiento del ensayo Inmunoenzimático (Elisa) para el diagnóstico de la Anaplasmosis Bovina, utilizando la Msp5 Recombinante como antígeno.
Mariana Eleizalde 1, 2, Henry Caballero 3 y Armando Reyna-Bello 1
1 Universidad Nacional Experimental Simón Rodríguez-IDECYT, Centro de Estudios Biomédicos y Veterinarios.
Laboratorio de Inmunobiología. Apartado postal 47925, Caracas 1041. Venezuela. Tele/Fax (0212) 671-92-89.
E-mail: areyna@inmunobiologia.net.ve. 2 Universidad Central de Venezuela, Facultad de Ciencias, Escuela de Biología.
3 Universidad Simón Bolívar, División de Ciencias Biológicas, Departamento de Biología Celular.
Resumen
La anaplasmosis, es una enfermedad producida por la bacteria Anaplasma marginale que está ampliamente distribuida en Venezuela, originando efectos negativos en la salud y productividad de los rebaños bovinos. Hasta el presente se han caracterizado 6 proteínas mayoritarias de superficie (MSP) de esta bacteria, de las cuales la MSP5, ha sido señalada como un excelente polipéptido para el diagnóstico de la enfermedad, debido a que esta proteína es altamente conservada e inmunogénica. Esto ha motivado su clonamiento e inserción en un plásmido de E. coli, para usarla purificada como antígeno en ensayos inmunoenzimáticos. Sin embargo, estudios posteriores, indican que proteínas de E. coli recombinante que eluyen conjuntamente con la MSP5 durante el proceso de purificación, interfieren en el ELISA originando falsos positivos. En el presente trabajo se estandarizó un ELISA indirecto, utilizando la MSP5 como antígeno y se logró disminuir las uniones inespecíficas a las proteínas contaminantes de E. coli, por adición de un suero de conejo anti E. coli que bloquea los epítopes de estas proteínas. A través de un cuadro de contingencia de doble entrada, se determinaron los parámetros de validación del ELISA al compararla con la técnica de naranja de acridina-bromuro de etídio, obteniéndose como resultado que la técnica de ELISA mejorada es 96,1% sensible, 9% específica y presenta un valor predictivo del 88,6%. Además, se estudió una población bovina de 48 mautes de la Estación Experimental La Iguana (estado Guárico), utilizando ambas técnicas, obteniendo una seroprevalencia de 93,7% por ELISA y una prevalencia de 54,1% por naranja de acridina-bromuro de etidio. Estos resultados muestran que el bloqueo de los epítopes de las proteínas de E. coli contaminates, utilizando para ello un suero de conejo anti-E. coli, permite disminuir los falsos negativos cuando se utilizan proteínas recombinantes.
Palabras clave: Anaplasma marginale, ELISA, MSP5, naranja de acridina-bromuro de etidio.
Evaluation and Improvement of an Immunoenzimatic Assay (ELISA) for Diagnosis of Bovine Anaplasmosis, Using Recombinant MSP5 as Antigen.
Abstract
Anaplasmosis, is a disease produced by Anaplasma marginale widely distributed in Venezuela, causing negative effects on the health and productivity of bovine herds. Until now, 6 constitutive Anaplasma marginale Mayor Surface Proteins (MSPs) have been characterized, including MSP5 which appears to be an excellent polypeptide for the diagnosis of this disease since it is highly conserved and immunogenic. This has motivated its cloning and insertion into a plasmid in E. coli and the use of the purified antigen in immunoenzymatic assays. However, subsequent indicated that E. coli recombinant proteins, that copurify with MSP5, interfere with the ELISA giving rise to false positives. In the present study, it was accomplished the standardization of an indirect ELISA, using MSP5 as the antigen and it was also diminishing the non-specific unions to the contaminating proteins of E. coli by adding anti-E. coli rabbit serum that blocks the epitopes of these proteins. With the use of a double entry contingency table, the parameters of validation of the ELISA were determined, comparing it to the acridine orange-ethidium bromide technique. The result indicate that the improve MSP5 indirect ELISA has a 96.1% sensitivity, 9% specificity and a predictive value of 88.6%. It was also studied a bovine population of 48 cattle from the Experimental Station La Iguana (Guárico State), using both techniques, obtaining a seroprevalence of 93.7% with ELISA and a prevalence of 54.1% with orange acridine-ethidium bromide. These results show that the blockage of the contaminating E. coli protein epitopes using an anti-E. coli rabbit serum permits the diminishment of false negatives when using recombinant proteins.
Key words: Anaplasma marginale, MSP5, ELISA, acridine orange-etidium bromide.
Recibido: 17 / 01 / 2006. Aceptado: 23 / 02 / 2007.
INTRODUCCIÓN
La anaplasmosis es una enfermedad que afecta un gran número de animales en todo el mundo ocasionando grandes pérdidas económicas [ 8, 10]. En Venezuela, se estima una prevalencia de un 50% en varios Estados, ocasionando grandes pérdidas [ 9, 14, 28]. Esta enfermedad es causada por una bacteria Gram-negativa denominada Anaplasma marginale (A. marginale) clasificada dentro de las a- proteobacterias, orden de las Rickettsias [ 7, 19, 29], la cual ocasiona en rumiantes: anemia severa, pérdida de peso, baja productividad, disminución de la líbido en los toros, aborto y a veces hasta la muerte del animal enfermo [ 15, 27, 30, 35]. Esta bacteria es transmitida en Venezuela principalmente, por insectos hematófagos de la familia Tabanidae y por el uso de instrumentos quirúrgicos contaminados (transmisión iatrogénica) y posiblemente por garrapatas (Boophilus microplus) aunque es discutido el papel de este artrópodo en la trasmisión de A. marginale [ 2, 12, 18, 26, 30].
El diagnóstico de esta enfermedad se basa principalmente, en los hallazgos clínicos, métodos directos a través de frotis sanguíneos y métodos serológicos tales como inmunofluorescencia indirecta (IFI) y el ensayo inmunoenzimático (ELISA) [ 26]. El frotis sanguíneo teñido con Giemsa es la coloración más utilizada para la identificación de A. marginale [ 23]. Sin embargo, se ha demostrado que este colorante puede originar falsos positivos debido a ciertos depósitos de precipitados sobre la células rojas similares a la rickettsia, o falsos negativos, que resultan cuando el porcentaje de glóbulos rojos infectados es muy bajo. Es por este motivo que, Caballero ha reportado un método más sensible, simple y relativamente económico para la detección de A. marginale por microscopía de fluorescencia utilizando naranja de acridina-bromuro de etídio [ 4].
Hasta el presente, se han descrito 6 proteínas mayoritarias de superficie de A. marginale, designadas como MSP1a (105KDa) y MSP1b (100-105KDa), MSP2 (36KDa), MSP3 (86KDa), MSP4 (31KDa) y la MSP5 (19KDa) [ 3, 24, 25, 39]. Esta última ha sido reportada como una proteína conservada en todas las cepas conocidas de A. marginale, A. centrale y A. ovis y se ha detectado que, al menos un epítope conservado de esta proteína, resulta inmunodominante, de allí su valor como antígeno de reconocimiento de la anaplasmosis en bovinos [ 17, 20, 21, 28, 34, 41].
La MSP5 ha sido aislada, clonada, secuenciada e insertada en un plásmido dentro de la bacteria E. coli, para desarrollar ensayos inmunoenzimáticos basados en la purificación de esta proteína y poder detectar anticuerpos que la reconocen [ 22, 28, 33]. De acuerdo a esto, Knowles y col. [ 17] desarrollaron un ELISA competitivo utilizando la MSP5 recombinante (MSP5r), demostrando que es altamente específico para el diagnóstico serológico de la anaplasmosis en el ganado de los Estados Unidos y que este ensayo es capaz de detectar animales con infecciones tempranas o crónicas [ 17]. En Venezuela se evaluó esta proteína de superficie MSP5r como antígeno, para desarrollar un ELISA indirecto para el diagnóstico de la anaplasmosis bovina en el país, encontrando una prevalencia superior al 50% [ 28].
Reyna-Bello y col. [ 28], al probar y desarrollar el ELISA indirecto utilizando la MSP5r como antígeno, indican que las proteínas contaminantes de E. coli, que eluyen conjuntamente a MSP5r durante la purificación, no presentan mayores dificultades para el ELISA. Sin embargo, estudios recientes en nuestro laboratorio (no publicados), indican que estas proteínas de E. coli si interfieren en el ELISA permitiendo la aparición de falsos positivos, debido a que E. coli es una bacteria saprófita, por lo que la mayoría de los organismos desarrollan anticuerpos contra ella [ 40].
Es por ello que en el presente trabajo, se planteó mejorar el ensayo inmunoenzimático descrito por Reyna -Bello y col. [ 28], disminuyendo esas uniones inespecíficas por adición de un suero anti E. coli, que bloquea los epítopes de las proteínas contaminantes y compararlo con la técnica de tinción acridina naranja-bromuro de etidio, cuya sensibilidad no ha sido estudiada a profundidad.
MATERIALES Y MÉTODOS
Purificación de la proteína MSP5r: el antígeno recombinante fue purificado según el protocolo recomendado por la marca comercial Xpress (Invitrogen, San Diego, EUA) en condiciones desnaturalizantes, tal como ha sido descrito previamente [ 28]. Para esto se utilizó la E. coli transfectada previamente con el plásmido que contiene el gen msp5 (pAR1903), cultivada en medio Luria Bertani (LB) conteniendo 50 µg/mL de ampicilina, durante toda una noche a 37°C en agitación fuerte y estimuladas para la expresión de la proteína recombinante con 1 µg/mL de isopropiltiogalactosidasa (IPTG). El sedimento de estas bacterias fue sonicado y sumergido en solución de guanidina (6 M), para luego eluir en una columna de afinidad de metal inmovilizado (IMAC) (Invitrogen, San Diego, EUA), en un gradiente decreciente de pH en presencia de Urea (5 M) y tampón fosfato salino (0,02 M).
Sueros Negativos: Se utilizaron 3 sueros bovinos provenientes de Francia (zona libre de anaplasmosis bovina) y otros 20 sueros de Carora, estado Lara, Venezuela. La negatividad a la anaplasmosis de estos sueros fue confirmada por inmunoelectrotransferencia [ 28].
Cinética de anticuerpos: Se utilizaron 8 sueros provenientes de un novillo infectado experimentalmente con A. marginale (aislado Zulia), colectados desde la semana -1 a la semana 6.
Sueros positivos: Se utilizaron dos sueros como controles positivos, un suero hiperinmune obtenido de un novillo al cual se inoculó 3 veces con 100 µg de MSP5r, la primera vez con adyuvante completo de Freund y las otras dos, con adyuvante incompleto de Freund. Para todos los casos se mezcló el antígeno diluido en PBS (0,02 M) V/V con el adyuvante, inoculando 1 ml cada 21 días subcutaneamente. Luego se extrajo el suero de este animal 15 días después de la última inoculación. El otro suero positivo utilizado corresponde al suero de la semana 6 de la cinética de anticuerpos.
Muestras bovinas problema: Se obtuvieron muestras de sangre y suero de la vena yugular de 48 mautes provenientes de la Estación Experimental La Iguana, ubicada al sur del Edo. Guárico, Venezuela, para ello, se utilizaron tubos vacutainers con EDTA y sin anticoagulante.
Preparación del suero de conejo anti E. coli: Se utilizó un conejo al cual se le aplicaron 3 inmunizaciones cada 21 días con 100 µg de E. coli (cepa JM109), vía subcutánea. Para la primera inmunización se utilizó adyuvante completo de Freund V/V del adyuvante con las E. coli diluidas en PBS y para las 2 inoculaciones posteriores se utilizó adyuvante incompleto de Freund. Se obtuvo el suero del conejo a nivel de la vena marginal de la oreja, el día 0 y a los 15 días posteriores a cada inmunización.
Estandarización de la técnica de ensayo inmunoenzimático (ELISA): Las placas de 96 pozos de polivinilo se sensibilizaron con el antígeno MSP5r (100 µl /pozo) a diferentes concentraciones (0,5; 1 y 2 µg/ml), diluido en buffer carbonato-bicarbonato (50 mM, pH 9,6) y se incubaron toda la noche en cámara húmeda a 4°C. Posteriormente se realizaron 5 lavados usando NaCl (0,15 M) con 0,05% de Tween - 20 (S.L) empleando un lavador automático de placas (Wallac, Delfia Plate wash, EUA). Luego se colocó una solución de bloqueo que consistió en leche descremada al 5% diluida en solución tampón fosfato salino (0,02M; pH 7,2) (PBS) (200 µl/pozo), durante 1 hora a 37°C en cámara húmeda, utilizando una incubadora (Thelco, 6DG, EUA). Las placas se lavaron nuevamente bajo las mismas condiciones antes mencionadas. Después se agregó el suero anti E. coli diluido en solución tampón PBS conteniendo 0,1% de Tween-20 (PBS-T) en diluciones 1/25, 1/50 y 1/100 (100 µl en cada pozo) durante una hora a 37°C. Posteriormente se procedió al lavado de las placas en idénticas condiciones. Los sueros bovinos se diluyeron en tampón PBS-T para alcanzar las diferentes diluciones (1/100, 1/200, 1/400) y se agregaron 100 µl de los mismos en cada pozo durante 1 hora a 37°C. Se procedió luego al lavado de las placas y se añadió el conjugado (Sigma, St. Louis, EUA) diluido en buffer PBS-T bajo diferentes diluciones (1/5000, 1/10000, 1/20000 y 1/40000), durante 1 hora a 37° en cámara húmeda. Las placas se lavaron nuevamente con S.L y se añadió el cromógeno TMB (Sigma, San Luis, EUA) por 30 minutos a temperatura ambiente. Finalmente las placas se leyeron a una doble lectura de 595 - 450 nm en un lector de ELISA Bio-Rad 3550 (EUA).
Técnica de naranja acridina-bromuro de etidio: En un tubo de centrífuga de 1 mL, se colocaron 90 µl de sangre y 10 µl de la mezcla naranja acridina (Sigma, cat N° A-6014, EUA)- bromuro de etidio (Sigma cat, N° E- 8751, EUA) a una concentración de 100 µg/mL y se agitó. Se tomaron 20 µl de la mezcla y se dejó correr en forma de gota a lo largo de un porta objeto. Posteriormente se dejó secar y se observó en un microscopio de epifluorescencia (Zeiss, modelo Standard Lab 16, Alemania), con el fin de determinar el porcentaje de animales infectados por la rickettsia.
Determinación de criterios de fiabilidad: Con el fin de evaluar los criterios de fiabilidad, tales como sensibilidad, especificidad y valor predictivo del ensayo inmunoenzimático con respecto a la técnica naranja de acridina-bromuro de etidio, se realizó un cuadro de contingencia de doble entrada donde se compararon los resultados de ambas técnicas, según Tizard [ 36].
Validación del ELISA respecto a la naranja de acridina - bromuro de etídio.
Sensibilidad = (positivos ELISA y naranja de acridina/total de positivos naranja de acridina-bromuro de etidio) x 100.
Especificidad = (negativos ELISA y naranja de acridina/total de negativos naranja de acridina - bromuro de etidio) x 100.
Valor predictivo = (Positivos por ambas técnicas / total de positivos por ELISA) x 100.
RESULTADOS Y DISCUSIÓN
Estandarización de la prueba de ELISA convencional: Una vez obtenida la MSP5r por la metodología descrita [ 28] y confirmada su purificación en geles de poliacrilamida en condiciones desnaturalizantes, se procedió a realizar varios ensayos con diferentes concentraciones del conjugado, antígeno y de los sueros, a fin de obtener las condiciones óptimas para cada uno de ellos. En estos ensayos se determinó que la condición óptima para el antígeno era 2 µg/mL, para los sueros se estableció como margen entre 1/100 y 1/200 y para el conjugado se determinó como concentración óptima, los márgenes 1/5.000 1/10.000 ( resultados no presentados).
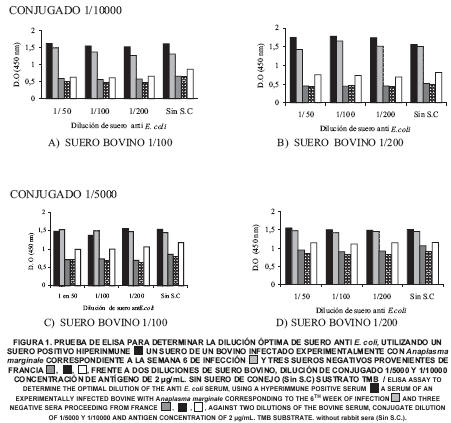
Determinación de la dilución óptima de suero anti E. coli: En las FIGS. 1A, 1B, 1C y 1D, se puede observar que las lecturas de las muestras negativas a las que no se les agregó el suero anti E. coli de conejo, son más altas en comparación con aquellas en las que si se añadió dicho suero (hasta 1,14 veces), demostrando el reconocimiento de estos sueros negativos a las proteínas contaminantes que eluyen conjuntamente con la MSP5r. Este hecho importante, permite reducir el error en el ensayo inmunoenzimático, pues el suero anti E. coli de conejo, bloquea los epítopes de las proteínas de E coli que eluyen conjuntamente a MSP5r, disminuyendo la probabilidad de falsos positivos.
Por otra parte, en estas mismas Figuras, se muestra un comportamiento homogéneo de los sueros positivos de referencia frente las diferentes diluciones de suero de conejo anti E. coli, pues los valores de D.O no variaron significativamente entre una dilución y otra (menor de 0,01%). Esto se debe posiblemente a que cuando las muestras son realmente positivas a la anaplasmosis, las uniones anticuerpo anti MSP5-MSP5r, predominan sobre los reconocimientos anticuerpo anti E. coli.
En este caso, la mayor diferencia entre las muestras positivas y negativas fue de 3,17 y se observó con la dilución de suero anti E. coli 1/100, conjugado 1/10000 y suero bovino1/200 (FIG. 1B).
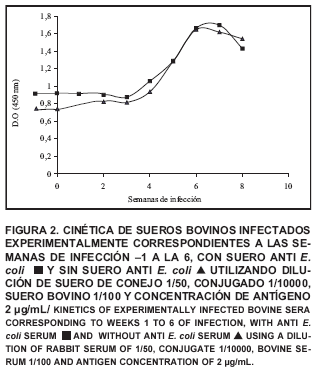
Una vez estandarizadas las condiciones óptimas del ELISA, se procedió a realizar una cinética de sueros provenientes de bovinos infectados experimentalmente con A. marginale (FIG. 2), pudiendo observar en ambas cinéticas (con y sin suero de conejo) que la D.O. aumenta a medida que avanzan las semanas de infección. Sin embargo, durante las primeras 2 semanas se puede apreciar que el ensayo en el que no se agregó el suero de conejo presenta lecturas hasta 1,5 veces más elevadas que las registradas en la cinética a la que se agregó dicho suero. Por otra parte, también se puede observar que a medida que avanza la infección, los valores de D.O. en ambos ensayos se hacen más similares, confirmando así los resultados obtenidos anteriormente en los que los valores de los sueros positivos no son alterados por la presencia del suero anti E. coli mientras que los sueros negativos si disminuyen en su D.O.
En esta FIG. 2, también se puede destacar como a los 21 días de infección comienzan a sintetizarse IgGs especificas contra la MSP5 en el bovino infectado experimentalmente, por lo que a la tercera semana de infección los valores de D.O comienzan a elevarse corroborando lo expresado en la literatura [ 5, 28]. A medida que avanzan la infección, la síntesis de anticuerpos aumenta, por lo que a partir de la cuarta semana se observa un incremento de D.O. de pendiente más elevada. Luego de este pico, el animal presenta una disminución de las bacterias en sangre y por tanto una disminución de anticuerpos, por ello a la séptima semana se comienza a observar una disminución de la D.O.
Determinación del punto de corte: Con el propósito de establecer un punto de corte, se procedió a realizar un ensayo inmunoenzimático con 20 sueros negativos provenientes de Carora, confirmados por inmunoelectrotransferencia [ 28], utilizando las diluciones de suero bovino, conjugado y suero anti E. coli seleccionados previamente.
A partir de este análisis (datos no mostrados), se estableció el promedio y la desviación estándar y se determinó el punto de corte según la fórmula X + 3 (DS)2, donde X el promedio y DS es la desviación estándar, es decir 0,344 + 3 (0,03) = 0,435 [ 6, 42]. Esto implica que bajo estas condiciones, las muestras problemas que registren una DO por debajo de ese valor serán negativos y los que no serán catalogados como positivos.
Análisis de los sueros bovinos obtenidos de la Estación Experimental La Iguana
ELISA: en la FIG. 3 se observa el resultado del análisis por ELISA de las 48 muestras obtenidas de la Estación Experimental La Iguana. En esta FIGURA se puede observar que 45 sueros fueron catalogados como positivos (93,7%) pues, su D.O. fue superior al punto de corte establecido, por otra parte, solo 3 sueros presentaron absorbancias por debajo de dicho punto, siendo catalogadas como negativas.
Naranja de acridina - bromuro de etidio: La tinción naranja de acridina-bromuro de etidio se basa en el uso de dos fluorocromos combinados. El bromuro de etídio se une a las bases del ADN de la bacteria, mientras que la naranja de acridina tiñe la membrana del eritrocito, permitiendo diferenciar las células sanguíneas en el campo visual, aumentando de esta manera la especificidad, debido a que disminuye el rango de error originado por falso positivos, tal y como puede ocurrir con otras tinciones como Giemsa. Sin embargo, esto se deduce teóricamente, pues la sensibilidad y especificidad de la técnica aún no ha sido evaluada. De acuerdo a esto, se realizó el frotis con la mezcla naranja de acridina -bromuro de etidio en las 48 muestras bovinas obtenidas de la Estación Experimental La Iguana, observándose el agente infeccioso en 26 frotis sanguíneos (54,16%), mientras que las otras 22 muestras resultaron negativas debido a que no se observó la rickettsia.
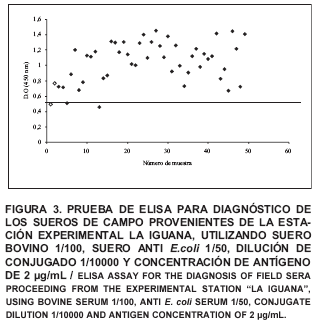
ELISA Vs naranja de acridina - bromuro de etídio: Al comparar los resultados de la prueba directa con los resultados obtenidos por ELISA, se pudo conocer que 25 bovinos son diagnosticados como positivos a A. marginale por ambas técnicas y solo 2 como negativos. De acuerdo a estos resultados se realizó una tabla de contingencia de doble entrada para determinar la sensibilidad y especificidad de la prueba de ELISA con respecto a la prueba directa, resultando 9% específica y 96,1% sensible (TABLA I), según la metodología descrita por Griner y col. [ 11] y Tizard [ 36, 37].
Los 21 bovinos restantes difieren en su diagnóstico, pues una de las muestras resultó positiva por naranja de acridina - bromuro de etidio y negativa por ELISA, y las 20 muestras restantes fueron negativas por naranja de acridina - bromuro de etidio y positivas por ELISA. El primer caso, podría deberse a que el animal se encuentra en las primeras semanas de infección, período en el que se liberan anticuerpos del tipo IgM [ 1, 31, 37], por lo que los anticuerpos no son detectados por el método de ensayo inmunoenzimático, pues éste solo detecta anticuerpos del tipo IgG.
En el segundo caso, en el que las muestras negativas por naranja de acridina-bromuro de etídio resultaron positivas por ELISA, pudiera deberse al hecho de que una vez que los animales sobreviven la fase aguda de la enfermedad, entran en un estado portador en el que la bacteria se hace imperceptible por métodos directos, sin embargo la síntesis de anticuerpos se mantiene, estableciendo un equilibrio entre el número de bacterias y la respuesta inmune [ 16, 17, 25].
Por otra parte, se cree conveniente correlacionar estos resultados con una prueba de reacción en cadena de la polimerasa (PCR), la cual se destaca por su alta sensibilidad y especificidad [ 13, 38], pudiendo detectar una rickettsemia de 10-6 % [ 38], reduciendo significativamente la posibilidad de falsos positivos o negativos, lo que permitiría una evaluación certera de las técnicas de ELISA y tinción con naranja de acridina - bromuro de etídio.
Una posible causa de la divergencia de los resultados entre ambas técnicas, fue que los animales antes de ser muestreados fueron sometidos a un tratamiento con dosis de 10 mg/kg de oxitetraciclina de acción prolongada (Oxitetraciclina L.A., Terralone), 20 días antes de tomar las muestras, por lo que probablemente este tratamiento causó una desaparición o disminución de los niveles de rickettsemia circulantes [ 26, 32] haciendo a la bacteria indetectable por métodos directos, no obstante, los anticuerpos se mantuvieron y fueron detectados por el ELISA.
Otro aspecto importante a reseñar en el presente estudio es la ineficiencia del uso de antibiótico en dosis incorrectas, lo que se demuestra al observar un 54% de animales positivos por la técnica directa de naranja de acridina - bromuro de etidio en animales que fueron tratados 20 días antes del muestreo. Este tratamiento demostró ser ineficiente y además trae como consecuencia, el posible desarrollo de resistencia a largo plazo de la bacteria al utilizar las dosis incorrectas de antibióticos.
Finalmente, es importante resaltar la alta prevalencia de la enfermedad en los llanos venezolanos, aunque en el presente trabajo se muestrearon pocos animales, el 93,7% de ellos resultó positivos a la anaplasmosis, lo cual da testimonio de la necesidad de encontrar un mecanismo de control para esta enfermedad, que trae consecuencias lamentables para la economía de Venezuela.
CONCLUSIONES
El suero anti E. coli de conejo, logró mejorar la prueba de ELISA al bloquear los epítopes de las proteínas contaminantes que eluyen conjuntamente a la MSP5r en su proceso de purificación. Esto se evidencia al disminuir las D.O. de los sueros negativos y afectando mínimamente a los sueros positivos, repercutiendo directamente en la mejora del ELISA, aumentando la diferencia entre los sueros positivos y negativos
AGRADECIMIENTO
Este trabajo fue financiado por los proyectos FONACIT G-98003462 y BID-FONACIT G-2004000400. Agradecemos también al BID-FONACIT por haber concedido la beca-estudio a la autora de este trabajo.
TABLA I. CUADRO DE CONTINGENCIA DE DOBLE ENTRADA PARA COMPARAR LOS RESULTADOS DE NARANJA DE ACRIDINA - BROMURO DE ETÍDIO CON LOS OBTENIDOS POR ELISA DE LOS BOVINOS MUESTREADOS EN LA ESTACIÓN EXPERIMENTAL LA IGUANA / contingency table of doble entrance to compare the results obtained with acridine orange - ethidium bromide techniques and the ELISA essay performed on the seraof the sampled bovines in the experimental station la iguana.
| | Naranja de acridina - Bromuro de etídio | |||
| | | positivo | negativo | totales |
| ELISA | positivo | 25 | 20 | 45 |
| negativo | 1 | 2 | 3 | |
| totales | 26 | 22 | 48 | |
Validación del ELISA referente a la técnica naranja de acridina - bromuro de etídio.
Sensibilidad del ELISA: 25 / 26 x 100 = 96,1 %
Especificidad del ELISA: 2 / 22 = 9 %
Valor predictivo: 25 / 39 = 55, 5%.
Referencias Bibliográficas
1. Abbas, A.K.; Lichtman, A.H.; Jordan, J.S. Inmunología Celular y Molecular. 4ta Ed, McGraw-Hill. Interamericana. España. 322-347 pp. 2002. [ Links ]
2. Aguirre, D.H.; Gaido, A.B.; Vinabal, A.E.; De Echaide, S.T.; Guglielmone, A.A. Transmisson of Anaplasma marginale with adult Boophilus microplus ticks fed as nymphs on calves with different levels of rickettsaemia. Parasite 1: 405-407. 1992. [ Links ]
3. Brayton, K.A.; Palmer, G.H.; Lundgren, A.; Jooyoung, Y.; Barbet, F. Antigenic variation of Anaplasma marginale msp2 occurs by combinatorial gene conversion. Mol. Microbiol. 43 ( 5): 1151-1159. 2002. [ Links ]
4. CABALLERO, H. A rapid sensititive, simple and economical method for detection of Anaplasma marginale by Fluorescent microscopy with acridine orange and ethidium bromide. . Proceedings of the Ninth International Veterinary Hemoparasite Disease Conference. Mérida- México 6-9 October. 1pp. 1993. [ Links ]
5. Cammili, A.; Reyna-Bello, A.; Aso, P.M.; Caballero, H. Caracterización de la respuesta celular y humoral inducida por antígenos potencialmente vacunales de Anaplasma marginale. V Congreso Nacional de Ciencias Veterinaria. 25-29 Septiembre 10pp. 2001. [ Links ]
6. De Savigny, D.; Voller, A. The Communication of ELISA data from Laboratory to Clinican. J. Immunoass. 1 ( 1): 105-128. 1980. [ Links ]
7. Dumler, J.S.; Barbet, A.F.; Bekker, C.P.J; Dash, G.A.; Palmer, G.H.; Ray, S.C.; Rikihisa, Y.; Rurangirwa, F.R. Reorganization of genera in the families Rickettsiaceae and Anaplasmataceae in the order Rickettsiales: unification of some species of Ehrlichia with Anaplasma, Cowdria with Ehrlichia and Erlichia with Neorickettsia, descriptions of six new species combinations and designation of Erlichia equi and HE agent as subjective synonyms of Ehrlichia phagocytophila. Int. J. Syst. Evol. Microbiol. 51: 2145-2165. 2001. [ Links ]
8. Garlick, N.L. National considerations in relation to anaplasmosis. J. Am. Vet. Met. Assoc. 147 ( 12): 1576-1579. 1965. [ Links ]
9. Giardina, S.; García, F. Seroepidemiología de los hemoparásitos bovinos en Venezuela. Hemoparásitos: Biología y Diagnóstico. Editorial Cuadernos. U.S.B. 51-72 pp. 1990. [ Links ]
10. Goodger, W.J.; Carpenter, T.; Rieman, H. Estimation of economic loss associated with anaplasmosis in California beef cattle. J. Am. Vet. Met. Assoc. 174 ( 12): 1333-1336. 1979. [ Links ]
11. Griner, P.F.; Mayewski, R.J.; Mushlin, A.I.; Greenland, P. Selection and interpretation of diagnostic tests and procedures. Principles and applications. Ann. Intern. Med. 94: 557-592. 1981. [ Links ]
12. Guglielmone, A.A. Epidemiology of babesiosis and anaplasmosis in South and Central América. Vet. Parasitol. 57: 109-119. 1995. [ Links ]
13. Harris, E. A Low-Cost Approach to PCR. Appropiate Transfer of Biomolecular Techniques. Oxford University Press. New York. USA. 8-15 pp. 1998.
14. James, M.A.; Coronado, A.; Lopez, W.; Melendez, R.; Ristic, M. Seroepidemiology of bovine anaplasmosis and babesiosis in Venezuela. Trop. Anim. Hlth. Prod. 17: 9-18. 1985. [ Links ]
15. Jones, E.W.; Brock, W.E. Bovine Anaplasmosis: Its diagnosis, treatment, and control. J. Am. Vet. Med. Assoc. 149 ( 12): 1625-1633. 1966. [ Links ]
16. Kieser, S. T.; Eriks, I. S.; Palmer, G.H. Cyclic rickettsemia during persistent Anaplasma marginale infection of cattle. Infect. Immun. 58 ( 4): 1117-1119. 1990. [ Links ]
17. Knowles, D.; Torioni de E, S.; Palmer, G.H.; McGuire, T.; Stiller, D.; McElwain, T. Antibody Against an Anaplasma marginale MSP5 epitope common to tick and erithrocyte stage identifies persistently infected cattle. J. Clin. Microbiol. 34: 2225-2230. 1996. [ Links ]
18. Kocan, K.M. Recent Advances in the Biology of Anaplasma spp. In Dermacentor andersoni ticks. Ann. NY Acad. Sci. 16 653: 26-32. 1992. [ Links ]
19. La Scola, B; Raoult, D. Laboratory diagnosis of rickettsioses: current approaches to diagnosis of old and new rickettsial diseases. J. Clin. Microbiol. 35 ( 11): 2715-27. 1997. [ Links ]
20. Molloy, J.B; Bowles, P.M.; Knowles, D.P.; McElwain, T.F.; Bock, R.E.; Kingston, T.G.; Blight, G.W.; Dalgliesh, R.J. Comparison of a competitive inhibition ELISA and the card agglutination test for detection of antibodies to Anaplasma marginale and Anaplasma centrale in cattle. Aust. Vet. J. 77 ( 4): 255-259. 1999. [ Links ]
21. Ndungu, L.W.; Aguirre, C.; Rurangirwa, F.R.; McElwain, T.F.; McGuire, T.C.; Knowles, D.P.; Palmer, G.H. Detection of Anaplasma ovis infections in goats by major surface protein 5 competitive inhibition enzyme-linked immunosorbent assay. J. Clin. Microbiol. 33: 675-679. 1995. [ Links ]
22. Nuñez, C.; Tavares, L.; Rey, C.; Reyna-Bello, A. Estandarización de un Ensayo Inmunoenzimático para el Diagnóstico de la anaplasmosis caprina en Venezuela, utilizando la MSP5 recombinante como antígeno. LII Convención Anual de ASOVAC. Barquisimeto-Venezuela 17 al 22 de noviembre. Acta Científ. Ven. 53 ( Sup 1): 34. 2002. [ Links ]
23. OFICINA INTERNACIONAL DE EPIZOOTIA. Bovine anaplasmosis. In: Manual of Standards Diagnostic Tests and Vaccines. 5a Ed. Editorial Office International des Epizooties. 1-33 pp. 2004.
24. Palmer, G.H.; McGuire, T.C. Inmune serum against Anaplasma marginale initial bodies neutralizes infectivity for cattle. J. Inmunol. 13 ( 2): 1010-1015. 1984. [ Links ]
25. Palmer, G.H.; Rurangriwa, F.R.; Kocan, K.M.; Brown, W.C. Molecular basis for vaccine development against the erlichial pathogen Anaplasma marginale. Parasitol. Today. 15 ( 7): 281-286. 1999. [ Links ]
26. Radostits, O.; GayClive, D.; Blood, K.; Hinchcliff, K.W. Anaplasmosis. In: Veterinary Medicine. A Textbook of the Diseases of Cattle, Sheep, Pigs, Goats and Horses. 9ª Ed. Editorial W.B. Sounders. 1261-1265 pp. 2004. [ Links ]
27. Richey, E.J; Palmer, G.H. Bovine anaplasmosis. The Compend. Food Anim. 12 ( 11): 1661-1665. 1990. [ Links ]
28. Reyna-Bello, A.; Cloeckaert, A.; Vizcaíno, N.; Gonzatti, M.I.; Aso, P.A.; Dubray, G.; Zigmunt, M.S. Evaluation of an enzyme-linked inmunoabsorbent assay using recombinant major surface protein 5 for serological diagnosis of bovine anaplasmosis in Venezuela. Clin. Diagn. Lab. Immun. 5 ( 2): 259-262. 1998. [ Links ]
29. Ristic, M. Anaplasmosis. Adv. Vet. Sci. 6: 111-192. 1960. [ Links ]
30. Rivera, M.A. Anaplasmosis. En: Hemoparasitosis Bovina. Editorial Universidad Central de Venezuela, Consejo de Desarrollo Científico y Humanístico. Caracas, Ediciones Anauco. 169-222 pp. 1996. [ Links ]
31. Roitt, I.M.; Delves, P.J. Anticuerpos En: Inmunología. Fundamentos. 10ma Ed. Editorial Médica Panamericana. España. 41-64 pp. 2003. [ Links ]
32. Soulsby, E.J.L. Orden: Rickettsiales Gieszczkiewicz, 1939. En: Parasitología y Enfermedades Parasitarias. 7ma. Ed. Editorial Interamericana. México. 764-767 pp. 1987. [ Links ]
33. Tavares, L.; Reyna-Bello, A. Detección de anticuerpos anti MSP5 de Anaplasma marginale en sueros ovinos utilizando un ensayo inmunoenzimático estandarizado con un suero ovino hiperinmune. LII Convención Anual de ASOVAC. Barquisimeto-Venezuela. 19-24 noviembre. Acta Científ. Ven. 53 ( Sup. 1): 28. 2000. [ Links ]
34. Tebele, N.; McGuire, T.C.; Palmer, G.H. Induction of protective immunity by using Anaplasma marginale initial body Membranes. Infec. Immun. 59 ( 9): 3199-9204. 1991. [ Links ]
35. Theiler, A. Anaplasma marginale. Un nouveau Protozoaire du Bétail. Bull. Soc. Phatol. Exot. (3): 135-137. 1910. [ Links ]
36. Tizard, I. Serologic Assays. J. Am. Vet. Met. Assoc. 181 ( 10): 1162-1165. 1982. [ Links ]
37. Tizard, I. Anticuerpos En: Inmunología Veterinaria. 4ta Ed. Editorial Interamericana. McGraw - Hill. México. 123-138 pp. 1995. [ Links ]
38. Torioni de E. S.; Knowles, D.P; McGuire, T.C.; Palmer, G.H.; Suarez, C.E; McElwain, T.F. Detection of cattle naturally infected with Anaplasma marginale in a region of endemicity by nested PCR and a competitive Enzyme Linked Immunoabsorbent Assay using recombinant Major Surface Protein 5. J. Clin. Microbiol. 36 (3): 777-782. 1998. [ Links ]
39. Vidotto, M.C.; McGuire, T.C.; McElwain, T.F.; Palmer, G.H.; Knowles, Jr D. P. Intermolecular relationships of Major Surface Proteins of Anaplasma marginale. Infect. Inmun. 7 (62) : 2940-2946. 1994. [ Links ]
40. Ville, C.; Solomon, E.; Berg, L.; Martin, D. Los virus y el Reino Prokaryotae. En: Biología de Ville. 3ra Ed. Editorial McGraw Hill. España. 473-492 pp. 1996 [ Links ]
41. Visser, E.S.; McGuire, T.C; Palmer, G.H; Davis, W.C.; Shkap, V.; Pipano, E.; Knowles, Jr D.P. The Anaplasma marginale msp5 gene encodes a 19 Kilodalton proteín conserved in all recognized Anaplasma species. Infect. Immun. 60 [ (12): 5139-5144. 1992. [ Links ]
42. Voller, A.; Draper, C.; Bidwell, D.E; Bartlett, A. Microplate Enzyme-Linked Immunoabsorbent Assay for Chagas disease. Lancet. 1: 426-428. 1975. [ Links ]












 uBio
uBio 
