Revista Científica
versión impresa ISSN 0798-2259
Rev. Cient. (Maracaibo) v.17 n.6 Maracaibo dic. 2007
Comportamiento natural de las fases no parasíticas de Rhipicephalus sanguineus (latreille, 1806) (acari: ixodidae) en un bioterio canino de Venezuela
Natural behavior of non-parasitic stages of Rhipicephalus sanguineus (LATREILLE, 1806) (Acari: Ixodidae) in a canine bioterio in Venezuela
María E. García 1; Elena Moissant 1; Arlett Pérez 1; Jessica Quijada 1; David Simoes 2 y Herakles García 1
1 Cátedra de Parasitología y Enfermedades Parasitarias. Facultad de Ciencias Veterinarias-Universidad Central de Venezuela. Apartado 2101A, Maracay, estado Aragua, Venezuela. E-mail: marielena_garcia2003@yahoo.com.
2 Cátedra de Parasitología. Facultad de Ciencias Veterinarias-Universidad del Zulia. Apto. 15252 Maracaibo 4005-A, estado Zulia, Venezuela.
RESUMEN
El presente estudio determinó la fluctuación poblacional de las fases no parasíticas de Rhipicephalus sanguineus durante octubre 2000 - septiembre 2001. Mensualmente se recolectaron todas las garrapatas presentes en los distintos ambientes identificados dentro de las instalaciones del Bioterio de la Facultad de Ciencias Veterinarias de la Universidad Central de Venezuela, Maracay, estado Aragua, Venezuela. Se recolectaron 16.065 ejemplares de R. sanguineus en diferentes fases de desarrollo: 5.981 larvas, 7.378 ninfas, 796 machos y 1.916 hembras; el mayor número se obtuvo en el interior de las jaulas (13.364), representando las ninfas la fase más abundante, tanto en el interior como en el exterior. El área pared/piso se destacó con el mayor número de ejemplares (6.830), seguida de huecos/grietas (6.068), ambas con predominio de ninfas; el análisis estadístico mostró significancia (P<0,05) solamente para los machos, demostrando que el área influyó en la presencia de esta fase. Las mayores poblaciones de garrapatas se obtuvieron en agosto, septiembre, enero y julio en el interior de las jaulas y en diciembre, en el exterior de las mismas. Se determinó significancia estadística (P<0,05) del ambiente interno sobre la presencia de los estadios larvas, ninfas y machos, no así para las hembras. En el ambiente externo, la presencia de garrapatas fue escasa (21) siendo las hembras la fase más recolectada (12); no hubo diferencias estadísticamente significativas (P>0,05) del ambiente externo sobre la presencia de hembras. Al correlacionar las distintas fases con la temperatura interna, se encontraron diferencias significativas (P<0,05); en relación con la humedad sólo se estableció significancia para la presencia de machos en el área huecos-grietas (P<0,05). Estos resultados confirman la adaptabilidad de R. sanguineus a las edificaciones urbanas y su alta prolificidad en microhábitats internos y externos, afectados por condiciones ambientales como humedad y temperatura.
Palabras clave: Rhipicephalus sanguineus, biología, fases no parasíticas.
ABSTRACT
This study determined poblational fluctuations of all non-parasitic forms in each developmental stage of Rhipicephalus sanguineus between October 2000 and September 2001. Through monthly sampling, all ticksfound in each identified area of the kennel at the Universidad Central de Venezuela, college of Veterinay Sciences, Maracay, Venezuela. A total of 16,065 specimens of R. sanguineus in all developmental stages were collected: 5,981 larvae, 7,378 nymphs, 796 adult and 1.916 females; the highest was found inside the dog as well outside the dog cage. The area between wall and floor had the highest number of specimens (6,830), followed by the area of holes and cracks (6,068); both showed prevalence of nymphs. Statistical analysis on developmental stage and internal environment was a significative association (P<0.05) only for males, indicating that the area affected the presence this stage. The largest populations of the ticks were found inside the cages in August, September, January and July and outside of them in December. Statistical tests showed significative differences in the internal environment for the presence of larvae, nymph and male stages, but not for female. In the external environment, ticks were scarcely present (21) being the females the most collected specimen (12). There was no significant effect (P<0.05) of external environment on the presence of females. Applying correlation tests between different stages and internal temperature, significant differences were found (P<0.05). Regarding humidity, there was only statistical significant differences for males found in holes and cracks (P<0.05). These results confirm R. sanguineus adaptability to urban buildings and its high rate of reproduction in internal and external microhabitats, both being affected by environmental conditions, such as humidity and temperature.
Key words: Rhipicephalus sanguineus, biology, non-parasitic forms.
Recibido: 11 / 10 / 2006. Aceptado: 22 / 03 / 2007.
INTRODUCCIÓN
Rhipicephalus sanguineus (Latreille, 1806) (Acari: Ixodidae) es un ectoparásito distribuido mundialmente [8]; parasita una gran variedad de especies domésticas, principalmente perros y gatos, animales silvestres, aves e incluso al humano. Por sus hábitos alimenticios, causa molestia, irritación, pérdida de sangre y desempeña un papel fundamental como vector de agentes virales, bacterianos y protozoarios hemotrópicos causantes de diversas enfermedades (Ehrlichia canis, Anaplasma platys, Hepatozoon canis, Babesia canis, Mycoplasma canis) [2,11]. Este ixódido puede ocasionar parálisis flácida ascendente en sus hospedadores por la inoculación de neurotoxinas presentes en sus glándulas salivales [3, 4, 5,7].
En las regiones tropicales y subtropicales se ha dificultado el control de R. sanguineus debido a que su alta tasa de reproducción, infestación y longevidad le ha permitido adaptar su ciclo biológico al ambiente doméstico y peri doméstico, donde las condiciones ecológicas les son favorables. R. sanguineus fue reportado por primera vez en Venezuela en 1936 [21] y es mencionada junto a las parasitosis gastrointestinales, como una de las afecciones más frecuentes en los perros [6]. Las infestaciones por este ixódido alcanzan niveles elevados en aquellos animales que permanecen mucho tiempo en el interior de las casas o apartamentos, así como en aquellos sometidos a confinamiento, como es el caso de los mantenidos en perreras y bioterios; bajo condiciones de un limitado manejo sanitario, estas instalaciones constituyen un albergue de una variedad de agentes patógenos, los cuales son transmitidos por ixódidos entre los diversos animales que potencialmente pueden convertirse en reservorios o fuentes de infección [7].
La sección canina del bioterio de la Facultad de Ciencias Veterinarias de la Universidad Central de Venezuela (FCV-UCV), durante mucho tiempo se ha visto severamente afectada por ixódidos, comprometiendo la salud de los animales y la función de dicha unidad. El presente trabajo tuvo como objetivo evaluar el comportamiento natural de poblaciones de fases no parasíticas o de vida libre de R. sanguineus, considerando los factores ambientales que pudiesen afectarla, de manera de aportar importantes observaciones sobre la conducta de esta especie de garrapata a los fines de permitir la elaboración de un programa de control integrado con bases racionales.
MATERIALES Y MÉTODOS
El estudio de las fases no parasíticas de R. sanguineus se realizó en la sección canina del bioterio de la FCV-UCV, ubicada en la ciudad de Maracay, estado Aragua, Venezuela. Para el momento del estudio, esta Sección contaba con una construcción de 1.064 m², dividida en: un área para alojar perros con 24 jaulas individuales; 16 jaulas colectivas de 24 m², subdivididas cada una en dos, con capacidad para 64 perros y una altura de 2,5 m. Todas con puertas y divisiones internas con cercas de alambre (tipo ciclón). Otra área para alojar gatos con dos jaulas colectivas de 12 m² cada una, ambas con capacidad para 15 gatos; con techo de asbesto, paredes y pisos de acabado poroso. Existen áreas de atención médica, aseo personal de obreros y empleados, oficina, un depósito de alimento concentrado y un área cubierta de vegetación. La limpieza y desinfección de la Sección se realizaba diariamente a primeras horas de la mañana, efectuando flameos y corte de maleza en algunos meses del año, sin una frecuencia definida.
El período de muestreo tuvo una duración de un año, comenzando en el mes de octubre 2000 y finalizando en el mes de septiembre de 2001. Para determinar la presencia de garrapatas en el ambiente interno de la sección, éste se dividió en dos regiones: interior y exterior de jaulas, las cuáles a su vez se dividieron en 3 áreas cada una: pared/piso, huecos/grietas, tubos/cercas. Se realizó inspección ocular y recolección de todos las garrapatas presentes en las distintas áreas, empleando pincel, pinza y manualmente, a intervalos mensuales durante el año de muestreo. Para el estudio de las fases de vida libre en la vegetación interna de la sección canina del bioterio, se empleó el método de bandereo (dragging o flagging) [18]. Se tomaron mediciones de temperatura y humedad relativa utilizando dos termohidrógrafos mecánicos colocados en el interior de la sección. Durante la evaluación del ambiente externo, se procedió a realizar el muestreo de las paredes y vegetación que circundan la sección, empleando la misma metodología descrita para el muestreo del ambiente interno. Así mismo, se tomaron los promedios mensuales de temperatura externa y precipitación, referidas de la Estación de Servicios Meteorológicos de la Sección de Agroclimatología de la Facultad de Agronomía de la UCV (FAGRO), ubicada adyacente a la sección canina del bioterio de la FCV-UCV.
Todos los ejemplares de garrapatas colectados se conservaron en tubos de ensayo, contentivos de alcohol isopropílico 70%, identificados según fecha y área de recolección, procediendo a procesarlas en el laboratorio de investigación de la Cátedra de Parasitología de la FCV-UCV, conjuntamente con el laboratorio del Instituto de Zoología Agrícola de FAGRO. El contaje del número de garrapatas, sexaje e identificación en los niveles taxonómicos de género y especie, se realizó mediante observación con lupa estereoscópica Carl Zeiss® modelo STEMI-SV8, a través de la observación de sus características morfológicas [6].
Una vez concluida la fase de procesamiento de las muestras, se procedió a realizar la base de datos la cual se sometió a pruebas no paramétricas mediante el paquete estadístico Statistix, versión 4,1 [20], a fin de establecer el grado de asociación o independencia entre las variables población y ambiente a través de un análisis de Ji- cuadrado.
RESULTADOS Y DISCUSIÓN
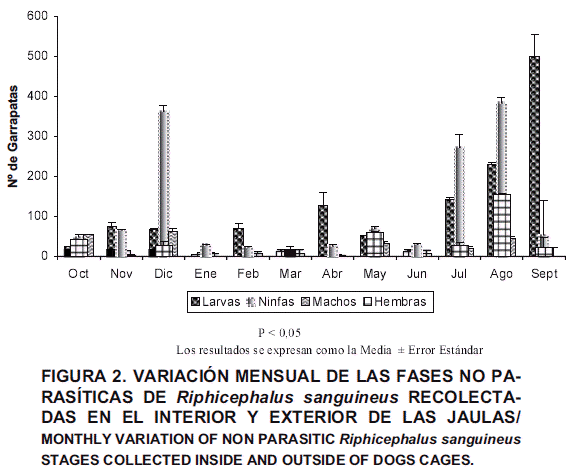
En el ambiente interno se colectaron 16.065 garrapatas de R. sanguineus, siendo relevante que la mayor cantidad provino del interior de las jaulas (13.364). Se obtuvieron ejemplares pertenecientes a los distintos estadíos, siendo las ninfas el más numeroso, tanto en el interior como el exterior de las jaulas (TABLA I). Al evaluar la presencia de garrapatas en el ambiente externo se observó que ésta fue escasa (21), siendo las hembras la fase evolutiva más frecuente (12). No hubo diferencia estadísticamente significativa al evaluar el efecto del ambiente externo e interno sobre las poblaciones de hembras (P>0,05), pero sí al evaluar las poblaciones de larvas, ninfas y machos (P<0,05), lo cual sugirió que, la presencia de estas fases está en relación directa con dichos ambientes.
ESPECIMENES DE Rhipicephalus sanguineus SEGÚN SU FASE DE DESARROLLO Y ÁREA, DETECTADOS EN EL AMBIENTE INTERNO/ Rhipicephalus sanguineus SPECIMENS ACCORDING TO STAGES AND AREA EVIDENCED AT THE INTERNAL ENVIRONMENT OF THE KENNELS.
|
| Ambiente | Interno |
|
| Fases de Desarrollo | Interior de Jaulas | Exterior de Jaulas | Total |
| Larvas (1) | 2244 | 227 | 2471 |
| (2) | 2778 | 189 | 2967 |
| (3) | 513 | 30 | 543 |
| (4) | (5535) | (446) | (5981) |
| Ninfas | 2435 | 251 | 2686 |
| 2039 | 1345 | 2384 | |
|
| 1258 | 50 | 1308 |
|
| (5732) | (1646) | (6378) |
| Machos | 239 | 236 | 475 |
| 263 | 0 | 263 | |
|
| 58 | 0 | 58 |
|
| (560) | (236) | (796) |
| Hembras | 879 | 319 | 1198 |
| 415 | 39 | 454 | |
|
| 243 | 39 | 282 |
|
| (1537) | (397) | (1934) |
| Total | 13364 | 2701 | 16065 |
(1) El primer valor corresponde al número de garrapatas de R. sanguineus recolectadas en el área pared-piso, (2) el segundo valor a las recolectadas en el área huecos-grietas, (3) el tercer valor a las recolectadas en el área tubos-cercas; (4) el valor entre paréntesis refleja el total obtenido por estadio evolutivo.
Al evaluar el comportamiento de las poblaciones de R. sanguineus en el ambiente interno, se observó que el mayor número de ejemplares se obtuvo en las áreas huecos-grietas y pared-piso, ambas con predominio de ninfas (5.732), luego larvas (5.535) y finalmente adultos hembras (1.537) y machos (560). La prueba de Ji-cuadrado para determinar el grado de asociación o independencia entre fase evolutiva y área en el medio ambiente interno, mostró diferencias estadísticamente significativas en el caso de los machos (P<0,05), reflejando que el área influyó en la presencia de este estadío; no así para las larvas, ninfas y hembras (P>0,05), corroborando los hallazgos de otros autores que han estudiado la diversidad de micro-ambientes de R. sanguineus [17].
La evaluación del exterior de jaulas en el ambiente interno, mostró un mayor número de ejemplares en el área huecos-grietas, con predominio de ninfas (1.646). Estos hallazgos sugieren que R. sanguineus tiene una manifiesta tendencia a trepar las paredes, donde las larvas y las ninfas se agrupan en dichos micro-ambientes, a fin de realizar las distintas mudas o bien, para protegerse de las condiciones que les son adversas, como ha sido sugerido por otros investigadores [16]. Así mismo, esta situación sugiere que esta especie de ixódido posee una gran capacidad de desplazamiento. La presencia de las fases de vida libre en las distintas áreas del medio ambiente es indicativa de la diversidad y abundancia de microhábitats donde se puede albergar R. sanguineus y sugiere que esta especie frecuenta penetrar en pequeños huecos, grietas y capas de pintura deteriorada en paredes y superficies de cemento en áreas cerradas [9] (FIG. 1); en áreas rurales, la disponibilidad de hábitats es limitada [10]. Los resultados evidencian la potencial adaptabilidad de R. sanguineus a los diferentes micro-ambientes existentes en las casas [13] y plantean la necesidad de considerar estos hallazgos al momento de diseñar y aplicar estrategias de control.
Al determinar la variación poblacional de R. sanguineus en el interior y exterior de las jaulas (ambiente interno de la sección canina) durante el período de estudio, se pudo comprobar la aparición de períodos puntuales de elevada presencia de larvas (agosto y septiembre), ninfas (diciembre y agosto), machos (diciembre) y hembras (agosto). Los meses con mayor número de especímenes fueron diciembre 2000 y agosto 2001 (FIG. 2). Estos hallazgos plantean igualmente la necesidad de tomar en consideración la época del año, a los fines de diseñar y aplicar estrategias de control.
El estudio de las fases de vida libre empleando el método del bandereo, no permitió colectar ningún ejemplar, hallazgos contrarios a los reportados por otros autores, quienes utilizando un método similar para el muestreo de pasturas, obtuvieron resultados satisfactorios, principalmente para estadíos juveniles, aunque para otras especies de ixódidos[15, 18, 19, 21].
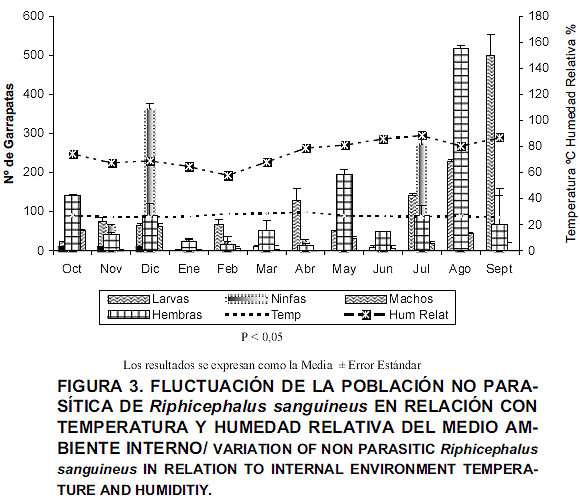
La determinación de las variables ambientales internas permitió registrar una temperatura que osciló desde un mínimo de 25,73 ± 0,27°C a un máximo de 29,65 ± 0,17°C, correspondientes a los meses de septiembre y abril, respectivamente. En relación con la humedad, se registró un valor mínimo de 57,74 % ± 1,06 y un máximo de 86,92 % ± 1,88, correspondientes a los meses de febrero y septiembre, de manera respectiva. Al evaluar la influencia de estas variables ambientales sobre la presencia de los diferentes estadíos de vida libre de R. sanguineus detectados en esta investigación, se determinó que hubo diferencias estadísticamente significativas con relación a la temperatura (P<0,05); mientras para la variable humedad sólo se estableció significancia estadística para los machos encontrados en las áreas huecos-grietas y tubos-cercas (P<0,05).
En la FIG. 3, se observa que la mayor presencia de R. sanguineus se correspondió con los meses de lluvia, altas temperaturas y elevado porcentaje de humedad relativa; así mismo, se destaca el mes de diciembre, con una alta infestación, a pesar que las variables antes señaladas no fueron las óptimas para un máximo desarrollo biológico; esta situación sugiere la necesidad de considerar tratamientos tácticos en épocas específicas del año, dentro de los programas de control de este ixódido. Estos hallazgos se corresponden con los de otros autores [9], quienes determinaron que el éxito de ecdisis y sobrevivencia de las distintas fases evolutivas de R. sanguineus, fue muy alto a temperaturas entre 20 y 35°C y humedades relativas entre 15 y 95%, valores dentro de los cuales estuvieron los obtenidos en el presente estudio; esta situación pudiese reflejar que R. sanguineus es capaz de tolerar altas temperaturas y condiciones extremas de humedad, como ha sido planteado por otros investigadores [9].
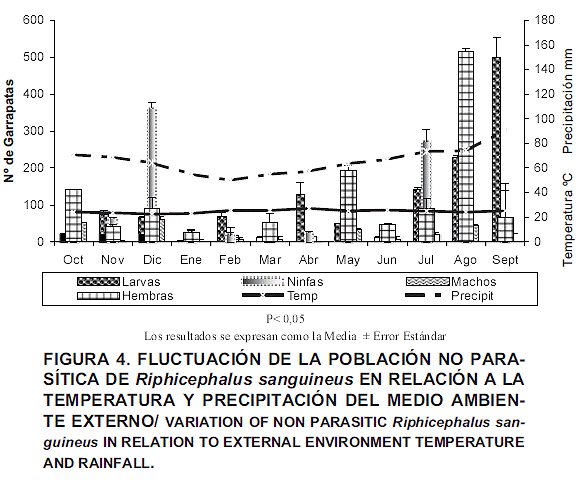
Los promedios de temperatura externa fluctuaron entre un mínimo de 22,7 ± 0,16°C a un máximo de 27,3 ± 0,28°C, extremos que se correspondieron a los meses de febrero y septiembre, respectivamente (FIG. 4). Se registraron promedios mensuales de precipitación que oscilaron entre 49 ± 0,88 mm3 y 91,4 ± 19,22 mm3, registrándose el mayor promedio en los meses de julio, agosto y septiembre. No se encontraron diferencias estadísticamente significativas en relación a la temperatura, pero sí con la precipitación (P<0,05) en relación con los machos en las áreas huecos-grietas.
Los resultados permiten inferir que los factores climáticos ejercen un impacto directo sobre la dinámica poblacional de R. sanguineus en el área y momento de estudio, situación que coincide con lo reportado por otros investigadores [1,12,14]. Las condiciones ambientales presentadas durante el año de estudio, permitieron el desarrollo de las fases no parasíticas de R. sanguineus, tanto en los meses de lluvia como en los de sequía, con una tendencia manifiesta en el período de lluvia, probablemente favorecida por la pluralidad de micro-ambientes encontrados por la garrapata en el área de estudio, condiciones éstas que ayudaron al mantenimiento de la población de garrapatas en el ambiente a lo largo de todo el período de observación.
CONCLUSIONES
Con base al comportamiento de R. sanguineus observado en esta investigación, es importante orientar estrategias de control basadas fundamentalmente en diseños de construcción de ambiente y en la frecuencia de aplicación de productos ixodicidas, los cuales pudiesen emplearse con mayor frecuencia durante los meses de mayor actividad parasítica y considerando la aplicación de tratamientos, tanto en hospedadores como en el ambiente interno y externo a los sitios de albergue canino; así mismo, de manera estratégica, cuando algunas condiciones particulares del ambiente pudiesen favorecer la formación de microhábitats idóneos para la multiplicación del ixódido. Conocer el comportamiento natural de las fases no parasíticas de R. sanguineus es indispensable, tanto para la instauración de tratamientos efectivos como para el diseño de estrategias de prevención y control. En el caso particular del bioterio canino de la Facultad de Ciencias Veterinarias de la UCV, estos hallazgos permitieron la instauración de medidas (sanitarias, infraestructura, entre otras) que han conducido a una reducción altamente significativa de las poblaciones de R: sanguineus.
REFERENCIAS BIBLIOGRÁFICAS
1. Alcaíno, H.; Gorman, T.; Jiménez, F. Ecología de Riphicephalus sanguineus (Ixodidae) en la región Metropolitana de Chile. Arch. Med. Vet. 22: 159-168. 1990. [ Links ]
2. Alcaíno, H.; Gorman, T.; Acosta, P.; Fredes, F. Evaluación de cinco esquemas de control con cipermetrina del Riphicephalus sanguineus en la Región Metropolitana de Chile. Arch. Med. Vet. 27(1): 45-51. 1995. [ Links ]
3. Bishopp, F.; Trembley, H. Distribution and hosts of certain North American ticks. J. Parasitol. 31: 1-3. 1945. [ Links ]
4. Fox, M.; Sykes, T. Establishment of tropical dogs tick, Riphicephalus sanguineus, in a house in London. Vet. Rec. 116: 661-662. 1985. [ Links ]
5. Groves, M.; Dennis, G.; Amyx, H.; y Huxoll, D. Transmission of Ehrlichia canis to Dogs by ticks (Rhipicephalus sanguineus). Am. J. Vet. Res. 36: 7. 1975. [ Links ]
6. Guerrero, R. Las garrapatas de Venezuela (Acarina: Ixodoidea). Listado de especies y claves para su identificación. Bol. Dir. Malariol. y San. Am. 36(1-2): 1-24. 1996. [ Links ]
7. Hoogstral, H.; Aeschlimann, A. Tick host specificity. Bull. Soc. Entomol. Suisse. 55: 5-32. 1982. [ Links ]
8. Jones, E.; Clifford, C.; Keirans, J.; Kohls, G. The Ticks of Venezuela (Acarina: Ixodoidea) with a key to the species of Amblyomma in the western hemisphere. Brigham Young University. Sci. Bull. Biological Series. XVII. Nº 4. 17: 1-40. 1972. [ Links ]
9. Koch, H.; Tuck, M. Molting and survival of the brown dog tick (Acari: Ixodidae) under different temperatures and humidities. Ann. Entomol. Soc. Am. 79: 11-14. 1986. [ Links ]
10. Labruna, M.; Souza, S.; Guimaràes Jr, J.; Pacheco, R.; Pinter, A.; Gennari, S. Prevalència de garrapatos em càes de areas rurais da regiào norte do Estado do Paraná. Arq. Bras. Med. Vet. Zootec. 53(5): 553-556. 2001. [ Links ]
11. Lewis, G.; Ristic, M.; Smith, R.; Lincoln, T.; Stephenson, E. The brown dog tick Rhipicephalus sanguineus and the dog as experimental host of Ehrlichia canis. Am. J. Vet. Res. 38:55. 1977. [ Links ]
12. Milutinovic, M.; Miscevic, Z.; Katic-Radivojevic, S. Ticks (Acarina, Ixodoidea) of Serbia: fauna and ecology. Act. Vet. 45(1): 37-48. 1995. [ Links ]
13. Moissant, E.; Vicente, M.; García, Y.; Armas, S. Estudio bioecológico de la garrapata del perro Rhipicephalus sanguineus (Acari: Ixodidae) en un criadero en el Limón (Estado Aragua), Venezuela. Rev. Fac. Cs. Vets. UCV. 40(2): 119-125. 1999. [ Links ]
14. Mumcuoglu, K.; Burgan, P.; Manor, O.; Uspensky, I. Rhipicephalus sanguineus: observations on the parasitic stage on dogs in the Negev Desert of Israel. Experim. and Appl. Acarol. 17(11): 793-798. 1993. [ Links ]
15. Oliveira, P.; Borges, L.; Lopes, C.; Leite, R. Population dynamics of the free-living stages of Amblyomma cajennense (Fabricius, 1787) (Acari: Ixodidae) on pastures of Pedro Leopoldo, Minas Gerais State, Brazil. Vet. Parasitol. 92: 295-301. 2000. [ Links ]
16. Racioppi, O.; Lombardero, O.; Moriena, R. Presencia de Rhipicephalus sanguineus Koch 1844 en perros de la ciudad de Corrientes. Gac. Vet. B. Aires. 43: 447-452. 1981. [ Links ]
17. Rhodes, A.; Norment, B. Hosts of Rhipicephalus sanguineus (Acari: Ixodidae) in northern Mississippi, USA. J. Med. Entomol. 16: 488-492. 1979. [ Links ]
18. Solberg, V.; Neidhard, K.; Sardelis, M.; Hildebrandt, C.; Hoffmann, F.; Boobar, L. Quantitative evaluation of sampling methods for Ixodes dammini and Amblyomma americanum (Acari: Ixodidae). J. Med. Entomol. 29(3): 451-456. 1992. [ Links ]
19. Souza, A.; Serra, N. Variaçâo da fase nao parasitária de Amblyomma cajennense e Boophylus microplus no município de Paracambi, Estado do Rio de Janeiro. Rev. Univ. Rural. Sér. Ciénc. Da Vida. 16(1-2): 57-65. 1994. [ Links ]
20. Torres de A, V. Sobre as äreas de ocorrência das especies da Familia Ixodidae conhecidas na Ilha da Madeira. Vet. Tec. 9: 36-40. 1995. [ Links ]
21. Vogelsang, E. Contribución al estudio de la parasitología animal en Venezuela: Ectoparásitos. Rev. de Policlínica. 30: 2122-2124. 1936. [ Links ]












 uBio
uBio