Revista Científica
versión impresa ISSN 0798-2259
Rev. Cient. (Maracaibo) v.17 n.6 Maracaibo dic. 2007
Hiperinmunización de ovinos contra veneno de Bothrops asper del Estado Zulia, Venezuela. estudio preliminar.
Hyperimmunization of Ovines Against Bothrops asper Venom from the Zulia State, Venezuela. Preliminary Study.
Juan R. Montilla F., María V. Álvarez de M., Elvira E. Díaz Z. y Saulo H. Urdaneta V.
Unidad de Investigaciones Ofidiológicas. Facultad de Ciencias Veterinarias, Universidad del Zulia, Apartado 15252. Maracaibo 4005-A, estado Zulia, Venezuela. E-mail: jumontilla@luz.edu.ve
RESUMEN
Un grupo de cuatro ovinos sanos se inmunizó con veneno de Bothrops asper, para estudiar el desarrollo de la respuesta inmune, inducida por la aplicación de un esquema de hiperinmunización. Se tomaron muestras de sangre cada siete días en nueve oportunidades, con el suero obtenido se realizaron pruebas de neutralización en ratones. Se determinó la DE50, la cual se expresó en µg de veneno neutralizado por ml de suero. Simultáneamente se observaron las condiciones generales de los ovinos durante el esquema de hiperinmunización, no presentándose alteraciones generales ni locales como consecuencia de la inoculación del veneno. En los resultados se observaron variaciones individuales en la magnitud de la elevación del título de anticuerpos y rasgos comunes en el comportamiento de las curvas desarrolladas. El título promedio óptimo (705,5 µg/ml), fue obtenido el día 21 posterior a la primera inoculación. Para ese momento, el ovino con título más alto fue de 840µg/ml y el más bajo, de 593 µg/ml. El promedio más bajo (308 µg/ml) fue observado el día 56. Se recomienda que los animales que serán utilizados en la producción comercial de antiveneno sean evaluados individualmente y seleccionados con base a una respuesta inmune satisfactoria.
Palabras clave: Bothrops asper, ovinos, hiperinmunización, DE50, antiveneno, veneno.
ABSTRACT
A group of four (4) healthy male sheep were immunized with Bothrops asper venom, in order to study the development of the immune response induced by the application of a hiperimmunization protocol. Blood samples were taken from the sheep every seven days in nine different opportunities. With the resultant serum, neutralization tests were done in mice. ED50 was calculated and expressed in µg of neutralized venom per ml of serum, at the same time, general health conditions of sheep were observed during the hiperimmunization protocol. No general or local alterations of health were present as consequence of venom inoculations. Individual variations in the magnitude of the increase of antibody titles were observed in the obtained results. None the less common features in the antibody title curves were also recorded. The mean optimal average (705,5 µg/ml) was obtained on day 21 after the first challenge. At that time, the individual sheep with the highest value was 840 µg/ml and the lowest was 593 µg/ml; the lowest average of all samples (308 µg/ml ) was observed on day 56. It is recommend that animals to be used in the commercial venom antiserum production need to be individually screened and selected based on a satisfactory immune response.
Key words: Bothrops asper, ovines, hyperimmunization, ED50, antivenom, venom.
Recibido: 03 / 04 / 2006. Aceptado: 16 / 04 / 2007.
INTRODUCCIÓN
El suero antiofídico fue producido por primera vez por Albert Calmette en 1894 [8]. A partir de entonces, éste ha contribuido en la disminución de la mortalidad por mordeduras de serpientes. Sin embargo, siguen habiendo muchos problemas asociados con la producción de antivenenos [71].
El envenenamiento ofídico representa un grave problema médico, social y económico en muchas partes de Asia, África y las Américas, y es considerado un problema de Salud Pública en toda América y gran parte del mundo [9, 17, 32, 36, 42, 45, 46, 49, 57, 75]. Venezuela como país tropical, no escapa de esta realidad debido a que es poseedora de una rica fauna, en la cual las serpientes ocupan un lugar preponderante [17, 54, 63, 65]. Por otra parte, la mayor distribución de las mismas en el mundo se presenta en las zonas tropical y subtropical, donde la combinación de la densidad poblacional de las serpientes, las actividades humanas al aire libre maximiza la probabilidad de que ocurra la mordedura de serpientes [54, 69]; el impacto de estos accidentes se une a la ausencia de servicios médicos modernos y apropiados entre las poblaciones humanas expuestas al más alto riesgo [9, 75].
Los estudios epidemiológicos más recientes de los accidentes ofídicos en el mundo sugieren que, al menos ocurren al año, 5 millones de mordeduras por serpientes con 2,5 millones de envenenamientos y 125.000 muertes [14, 69, 75, 76].
Debido a que las condiciones socio-económicas en Venezuela son deficientes, los datos epidemiológicos que se obtienen sobre el ofidismo no escapan de ser escasos e incompletos, de manera que la magnitud real del problema es muy difícil de determinar [17, 46, 54, 59].
Para el lapso comprendido entre 1998-2004 se reportaron en el país un promedio de 6.094 casos de mordeduras de serpientes por año [38].
En el estado Zulia, el riesgo de sufrir un accidente ofídico es muy elevado debido a la gran cantidad de actividades agrícolas y mineras que en él se desarrollan. La ocurrencia por mordeduras de serpientes para el estado Zulia en el período 1998-2004 fue de 717 casos al año, con un promedio de 5 muertes anuales [38].
Las publicaciones sobre las serpientes venenosas y sus problemas médicos en Venezuela, salvo por algunos autores, son escasas y carecen de estudios sistemáticos que den información sobre distribución de especies en el territorio nacional [57].
La falta de conocimiento de la fauna ofídica ofensiva al hombre, la acción de sus venenos sobre los tejidos humanos, los aspectos clínicos y terapéuticos, más que un descuido de la creación del conocimiento autóctono, se ha debido a los escasos investigadores venezolanos dedicados a estos temas y por supuesto, a los ínfimos recursos que dedica el Estado al referido problema [57].
En Venezuela, el mayor número de accidentes por mordeduras de serpiente es ocasionado por el género Bothrops, con una ocurrencia del 80%, esto debido a su amplia distribución en el territorio nacional, su agilidad y a la toxicidad de su veneno [17, 36, 54, 57, 59, 63, 65].
Los adelantos en materia de producción de antivenenos se basan principalmente en publicaciones científicas que evidencian el esfuerzo de los investigadores en producir propuestas para la mejora del suero antiofídico, no sólo tomando en cuenta el rendimiento, como se hacia hasta hace pocos años, sino, que más recientemente han enfocado otro problema de fondo, como es encontrar la forma de disminuir las reacciones adversas con que los antivenenos se manifiestan, mediante el desarrollo de nuevas técnicas que pueden ofrecer algunas soluciones [1-5, 12, 13, 15, 20, 21, 24, 25, 27-30, 33-35, 41, 47, 48, 52, 64, 66-68].
Finalmente, la limitación ha sido que las nuevas técnicas usadas por los investigadores en el área, son prohibitivas para los países donde este problema es más relevante, por ser países subdesarrollados, donde los recursos para este fin son limitados, por lo que el reto ahora es conseguir la manera de producir un antiveneno que sea inocuo, efectivo, económico y que se pueda distribuir ampliamente [75].
Existe una importante variabilidad en la composición del veneno de serpientes interfamilia, intergénero, interespecies, intersubespecies e intrasubespecie, variaciones geográficas, entre especímenes individuales, y en especímenes individuales debidas a variación estacional, dieta, hábitat, edad, dimorfismo sexual, esta variabilidad del veneno tiene impacto, tanto en la investigación del veneno como en el manejo de la mordedura de serpientes, incluyendo la selección de antivenenos y la selección de especímenes para la producción de antivenenos [10, 13, 19, 33, 41, 44, 46, 49, 73, 74]. Es necesario producir antiveneno ofídico restringiendo la especificidad de los anticuerpos contra los venenos provenientes de las serpientes autóctonas de las regiones, donde éste se va a aplicar, ya que reduce la cantidad a inyectar en los pacientes, por ser más específico [19, 73, 74].
El resultado severo y ocasionalmente fatal del envenenamiento ocasionado por la mordedura de serpientes venenosas se previene exclusivamente con la administración de suero antiofídico [8, 27, 31, 61, 76].
Desde hace más de un siglo, el caballo ha sido el animal utilizado para la producción de antivenenos debido a su fácil manejo, gran volumen sanguíneo y plasmaféresis. A pesar de estas ventajas, existen numerosos factores importantes a considerar en la producción de antivenenos, tales como: costos de adquisición y mantenimiento e inmunorespuesta local exacerbada, lo cual resulta en la formación de grandes abscesos, fístulas y fibrosis en el lugar de la inoculación [4, 8, 22, 23, 67]. La administración de inmunoglobulinas de origen equino con frecuencia causa una reacción de hipersensibilidad mediada por complejos inmunes tipo III, debido a la bivalencia de esas moléculas y al hecho de que los caballos inmunizados tienen niveles altos de IgGt circulantes, la cual no ha sido detectada en ovinos. Además muchos pacientes a quienes se les administra el antiveneno de origen equino manifiestan sensibilidad a sus proteínas debido a una exposición previa y pueden desarrollar una reacción anafiláctica tipo I [24, 40, 42, 43, 67].
El problema de contar con un tratamiento adecuado para los pacientes sensibles al suero equino ha conducido al desarrollo de técnicas de inmunización utilizando animales alternativos [16,53], tales como: conejos, caprinos, bovinos, gallinas, perros, ovejas; los cuales han mostrado buenos resultados a nivel experimental, enfatizando que la oveja, se utiliza en la producción de antiveneno comercialmente en la India, Australia, EUA y Reino Unido [33].
Los excelentes resultados obtenidos en ovinos para la producción de antivenenos se deben a su fácil manejo y mantenimiento, son económicos, buena respuesta inmunológica, son resistentes, ausencia de reacciones locales, permitiendo así la obtención de un antiveneno efectivo, de bajo costo y que provee buena protección [1, 5, 6, 24, 29, 33, 35, 37, 39, 42, 43, 56, 67, 68].
El objetivo del presente trabajo consistió en hiperinmunizar ovinos con venenos provenientes de serpientes Bothrops asper zulianas, para evaluar su respuesta humoral y contribuir en la producción de antivenenos autóctonos.
MATERIALES Y MÉTODOS
Ubicación del estudio
La investigación se realizó en la Unidad de Investigaciones Ofidiológicas (U.I.O) de la Facultad de Ciencias Veterinarias de la Universidad del Zulia en la ciudad de Maracaibo, estado Zulia, Venezuela. El clima es cálido-húmedo con una temperatura promedio de 26-30°C.
Veneno
El veneno se obtuvo de un lote de 20 serpientes Bothrops asper, colectadas en diferentes Municipios del estado Zulia: (2 de Cabimas, 2 de Lagunillas, 2 de Mene Grande, 2 de Machiques de Perijá, 2 de Rosario de Perijá, 3 de Burro Negro, 4 de Mara, 2 de La Cañada de Urdaneta, 1 de Colón) y mantenidas en cautiverio en el bioterio de serpientes de la U.I.O. Una vez extraído el veneno, se congeló, liofilizó, se determinó su DL50 (7,37 mg/kg de peso) y se mantuvo a una temperatura de -20°C [25].
Unidades Experimentales
Se utilizaron cuatro ovinos adultos, de 12 a 17 meses de edad, machos, sanos, raza mestizo criollo-West African, cuyos pesos oscilaron entre 30 y 40 Kg y nunca antes inoculados con ningún tipo de veneno. En dichos animales, la condición general y parámetros clínicos de salud eran normales. Previo a la inmunización, los ovinos se dejaron en un período de adaptación de dos meses, sometiéndose a un programa de control parasitario y de enfermedades infecciosas. Además, fueron evaluados clínicamente cada semana, mientras se aplicó el programa de inmunización. Su alimentación consistió en pasto de corte picado (Buffle), heno y una mezcla de alimento concentrado en pellets, reforzado con vitaminas y minerales en proporciones y calidades adecuadas a sus necesidades nutricionales.
Inóculos
A partir de una solución madre: 1% del veneno liofilizado en solución salina fisiológica (0,85% NaCl) y esterilizada por filtración (Millipore 0,22 µn), se prepararon los inóculos. Aquellos correspondientes a las dos primeras inoculaciones fueron elaborados preparando emulsiones con adyuvante Completo de Freund para la primera inoculación e Incompleto para la segunda inoculación; el inoculo fluido para las inoculaciones 3, 4 y 5, consistió en una mezcla de veneno en solución salina fisiológica. Las dosis administradas por animal se presentan en la TABLA I.
ESQUEMA DE INMUNIZACIÓN BÁSICO CON VENENO BOTHROPICO EN OVINOS/ BASIC INMUNIZATION SCHEDULE WITH BOTROPIC VENOM IN OVINES
| Días | Veneno mg | Adyuvante | Sangrías | Titulación de anticuerpos |
| 0 | 0,1 | FC | Sí | Sí |
| 7 | 0,1 | FI | Sí | Sí |
| 14 | 0,1 | SSF | Sí | Sí |
| 16 | 0,1 | SSF | No | No |
| 18 | 0,1 | SSF | No | No |
| 21 | - | - | Sí | Sí |
| 28 | - | - | Sí | Sí |
| 35 | - | - | Sí | Sí |
| 42 | - | - | Sí | Sí |
| 49 | - | - | Sí | Sí |
| 56 | - | - | Sí | Sí |
| FC: Adyuvante de Freund completo FI:Adyuvante de Freund incompleto SSF: Solución Salina Fisiológica. | ||||
Inmunización y Sangrías
Los ovinos fueron inoculados por vía subcutánea, previo rasurado y desinfección, en la tabla del cuello y en la porción dorso-lateral de la región costal y lumbar.
Las dosis aplicadas se basaron en los esquemas utilizados en el Instituto Butantan, Brasil [62] y en el Centro de Biotecnología de la Universidad Central de Venezuela [11], ajustando la dosis de veneno y la cantidad de adyuvante de acuerdo al peso del ovino y utilizando veneno de serpientes procedentes exclusivamente del estado Zulia.
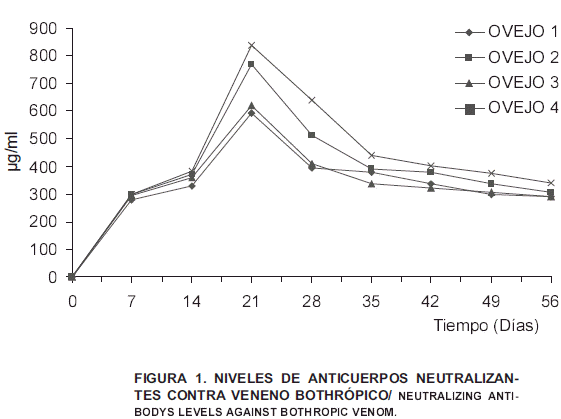
Antes de comenzar el esquema de inmunización, se extrajo una muestra de sangre a cada ovino con el objeto de demostrar, en ratones, la ausencia de anticuerpos neutralizantes contra el veneno bothrópico que se empleó, para su posterior inclusión en el programa de inmunización, TABLA II.
NEUTRALIZACIÓN DEL VENENO DE Bothrops asper DEL ESTADO ZULIA, EXPRESADO EN µg/ml.
NEUTRALIZATION OF Bothrops asper VENOM OF ZULIA STATE EXPRESSED IN µg/ml
|
| Ovejo 1 | Ovejo 2 | Ovejo 3 | Ovejo 4 |
| Sangría 0 | 0 | 0 | 0 | 0 |
| Sangría 7 | 280 | 300 | 296 | 300 |
| Sangría 14 | 330 | 372 | 360 | 384 |
| Sangría 21 | 593 | 770 | 619 | 840 |
| Sangría 28 | 395 | 514 | 409 | 641 |
| Sangría 35 | 379 | 390 | 336 | 440 |
| Sangría 42 | 336 | 379 | 320 | 403 |
| Sangría 49 | 300 | 336 | 305 | 375 |
| Sangría 56 | 292 | 308 | 292 | 340 |
De cada ovino se obtuvo 20 ml de sangre de la vena yugular en 9 oportunidades. La misma fue recogida en Erlenmeyers estériles, en solución de citrato de sodio al 17,5%, en proporción de 5 ml de citrato por cada, 100 ml de sangre. Se agitó suavemente durante la sangría. Luego el plasma se centrifugó a 7000 rpm por 30 minutos, una vez separado se hizo un pool del mismo y se colocó en baño maría a 56°C por 30 minutos para eliminar el fibrinógeno y el complemento. Se filtró con Millipore 0,22 µn y se preservó a una concentración final de 0,4% con una solución de éter-fenol al 50% [11], distribuido en alícuotas de 10 ml y mantenido a -20°C hasta ser usado [25].
Neutralización de la letalidad
La neutralización de la letalidad se determinó calculando la Dosis Efectiva Cincuenta (DE50) del suero de los ovinos hiperinmunizados utilizando el método de Spearman-Karber y se expresó en µg de veneno neutralizado por ml de suero [11, 46].
Se prepararon tubos de ensayo con una cantidad fija del suero problema y diluciones seriadas del veneno y la dilución control positivo, se incubaron durante 30 minutos a 37°C. Luego, cada una de las diluciones fue evaluada por triplicado en una cantidad no mayor de 1 ml, conteniendo 2 DL50 (280 µg) por ratón e inoculada intraperitonealmente a grupos de 5 ratones albinos no isogenéticos, de 19 a 21 g de peso corporal, [7]. Los ratones muertos y sobrevivientes se registraron durante 48 horas [22] y la data se utilizó para la determinación de la DE50. Con la media correspondiente del triplicado de cada dilución, se graficó el comportamiento de la respuesta inmunológica del conjunto de ovinos del grupo experimental durante 56 días.
Análisis Estadístico
Se resume la información a través de métodos estadísticos de posición y dispersión, entre ellos: media, error estándar, coeficiente de variación y número de muestras. Graficando, se obtiene la curva tiempo-respuesta para evidenciar el tiempo de aparición del título neutralizante óptimo.
Para analizar la relación entre el título de anticuerpos y el tiempo expresado en días, se ajustó un modelo de regresión no lineal. El paquete para estimar este modelo fue el Curve Expert en su versión 1,3 [18]; dicho software selecciona entre varios modelos, el modelo de mejor ajuste, basándose en el criterio de mayor coeficiente de correlación y menor error estándar de estimación. Entre varios modelos probados, el de mejor ajuste resultó ser el conocido como Función Racional cuya expresión es:
![]()
donde a, b, c y d representan los parámetros encontrados por el paquete y proporcionan la forma de la curva que mejor ajustó la data experimental dentro de un grupo de 30 modelos probados, x el tiempo en días e y la taza de neutralización expresada en µg de veneno neutralizado por ml de suero.
RESULTADOS Y DISCUSIÓN
En relación al estado general de los ovinos, no hubo alteraciones, determinando que todos estaban en buenas condiciones de salud. Tampoco hubo alteraciones locales en el sitio de inoculación del veneno.
La producción de anticuerpos contra el veneno de Bothrops asper del estado Zulia, determinada por su capacidad para neutralizar la letalidad en ratones, mostró diferencias individuales en la magnitud de las respuestas de los 4 ovinos sometidos al esquema de hiperinmunización, observándose un incremento paralelo de µg de veneno neutralizado por ml de suero antiofídico, desde el día 0 al día 14 del esquema, TABLA II y FIG. 1; a partir de este momento, se notan marcadas diferencias individuales en el aumento de los niveles de respuesta. A pesar de esta variabilidad, se evidencian rasgos comunes en el comportamiento de las cuatro curvas.
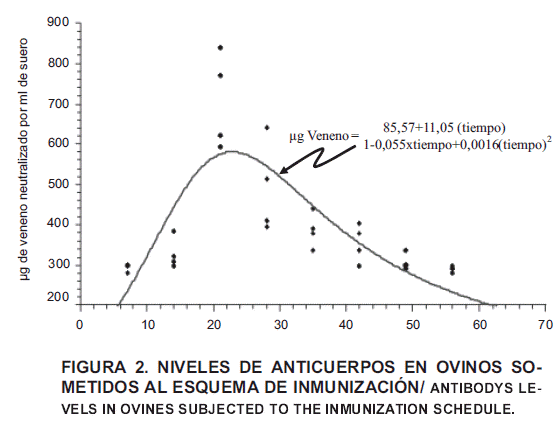
Según el modelo utilizado, resultó una curva característica, mostrando un título promedio, máximo y óptimo en las muestras correspondientes al día 21 posterior a la primera inoculación; luego se observa un descenso paulatino del título neutralizante hasta el día 56, última sangría, donde muestra el título promedio más bajo, FIG. 2, con un coeficiente de correlación r = 0,7626, lo cual evidencia que, aproximadamente el 76% de la variabilidad de la respuesta total (título de neutralización) se puede explicar por el tiempo en días trascurrido desde el día 0 al 56. El 24% restante de la variabilidad, puede estar representada por la zona geográfica, razones climatológicas, raza, factores de especie, factores individuales, ambientales y esquemas de inmunización, incidiendo en forma definitiva sobre la respuesta; los mismos fueron estrictamente controlados en el presente trabajo, pero no se obtuvo reportes de observaciones de este tipo para poder comparar.
De acuerdo a la magnitud de las medias de las sangrías por día, TABLA III, se aprecia que el título de anticuerpos óptimo fue de 705,5 µg/ml de suero, alcanzado en la sangría del día 21, después de la primera inoculación y la más baja fue de 308 µg/ml de suero en la sangría del día 56.
RESUMEN DE ESTADÍSTICA DESCRIPTIVA/ DESCRIPTIVE STATISTICS SUMMARY
| Día de Sangría | X | ES | CV | N |
| 0 | 0 | 0 | 0 | 4 |
| 7 | 294,00 µg/ml | 4,761 | 3,2387 | 4 |
| 14 | 361,50 µg/ml | 11,587 | 6,4103 | 4 |
| 21 | 705,50 µg/ml | 59,434 | 16,849 | 4 |
| 28 | 489,75 µg/ml | 56,982 | 23,270 | 4 |
| 35 | 386,25 µg/ml | 21,371 | 11,066 | 4 |
| 42 | 359,50 µg/ml | 19,116 | 10,635 | 4 |
| 49 | 329,00 µg/ml | 17,277 | 10,503 | 4 |
| 56 | 308,00 µg/ml | 11,314 | 7,3466 | 4 |
X: Media ES: Desviación Estándar CV: Coeficiente de Variación N: Numero de animales.
Aún cuando la producción de Suero Antiofídico se sigue haciendo con la metodología tradicional en equinos usando protocolos de producción derivados del método básico descrito por Pope [50,51] y modificado por Harms [26], el cual se basa en digestión con pepsina a pH bajo y precipitación con sulfato de amonio [55, 74]; durante los últimos diez años, hay grupos de investigadores que han publicado propuestas diferentes utilizando cambios en el proceso de concentración y purificación de anticuerpos [29, 37, 47, 55, 58, 60], en los esquemas de inmunización [15,52,71], en el tipo de adyuvante [24, 30, 34, 52], modificación del veneno [13, 25, 34, 70, 71] y uso de otras especies diferentes al equino [20, 24, 27, 53, 70, 72], para tratar de minimizar los problemas adversos que con este producto manifiestan los pacientes. El resultado de este trabajo se considera como una alternativa en la producción de antivenenos en otras especies animales.
Existe muy poca información en la literatura científica revisada, relacionada con el desarrollo de la respuesta inmune en animales inmunizados para la producción de antivenenos, lo cual coincide con lo reportado por Estrada y cols. [22, 23].
El estudio de la respuesta de anticuerpos neutralizantes en animales utilizados en la producción de suero antiofídico, se ha efectuado investigando la capacidad del suero para neutralizar el efecto letal de un determinado veneno [22].
En este trabajo se evaluó la respuesta inmunológica de cuatro ovinos inyectados con veneno de la serpiente Bothrops asper del estado Zulia, midiendo la producción de anticuerpos contra los componentes responsables de la letalidad del veneno, observándose una marcada variabilidad individual en la respuesta de anticuerpos, excepto durante la primera etapa del esquema de inmunización, donde la respuesta fue homogénea, concordando con Estrada y cols., Gutiérrez y cols. y Montilla y cols. [23, 25, 39].
Al inocular ovinos con veneno bothrópico, se obtuvo un título neutralizante óptimo a los 21 días después de la primera inoculación, coincidiendo con lo reportado por Montilla y cols. [39], inoculando ovinos con veneno crotálico y difiriendo con lo reportado por Rolim y cols. [62], al inocular veneno crotálico y con el Centro de Biotecnología de la Universidad Central de Venezuela (U.C.V) [11], inoculando un pool de veneno crotálico y bothrópico, los que inmunizando equinos, encontraron respuestas máximas de anticuerpos a los 28 días, diez días después de la última inoculación. Estrada y cols. [22] reportaron en equinos inoculados con un pool de veneno bothrópico, crotálico y lachésico, títulos neutralizantes máximos de la actividad de la fosfolipasa A a los 110 días. Bolaños y Cerdas [7], reportaron en ovinos y equinos, entre los 230 y 255 días, la obtención de una respuesta máxima de anticuerpos neutralizantes para venenos de la subfamilia crotalinae. Ferreira y cols. [24] reportaron en ovinos inmunizados con veneno bothrópico, un título máximo de anticuerpos neutralizantes entre 30 y 40 días después de la primera inoculación.
El título neutralizante óptimo en suero crudo obtenido en el presente estudio fue de 705,5 µg /ml de suero, mientras que Bolaños y Cerdas [7] reportan que, el suero crudo preparado en ovinos presenta una actividad neutralizante frente al veneno de Bothrops asper de 1000 a 2000 µg/ml y en equinos reportan los mismos valores que en los ovinos en la actividad neutralizante de los venenos de la subfamilia crotalinae. Rolim y cols. [62] reportan contra veneno bothrópico 1000 µg/ml de suero de origen equino como títulos considerados satisfactorios en el Instituto Butantan en Brasil. Es posible que la diferencia de los resultados reportados se deba a que dichos autores han trabajado con otras especies animales de distintas zonas geográficas, diferentes venenos y/o esquemas de inmunización.
Si se compara los resultados obtenidos en el presente estudio, con los reportados por Montilla y cols. [39], en un estudio similar pero utilizando veneno crotálico, se puede ver que a los 21 días, en el caso del veneno crotálico, el suero crudo de ovinos hiperinmunizados fue capaz de neutralizar 40 DL50, mientras que en el caso del veneno bothrópico el suero crudo de ovinos hiperinmunizados neutralizó 5 DL50; esta diferencia puede ser debida probablemente, a que el veneno Bothrópico, utilizado sea menos antigénico que el veneno crotálico o a cualquier otro factor inherente a la gran variabilidad de los venenos ofídicos, como lo reporta Chippaux [14].
Existen pocos reportes relacionados con alteraciones de los animales inoculados con venenos de serpientes para la producción de antivenenos.
Durante la realización de este trabajo, no se presentó ningún tipo de alteración aparente en la salud de los ovinos sometidos al esquema de inmunización, todos estaban en muy buenas condiciones, a excepción de unos pequeños nódulos que aparecieron a nivel del cuello en los puntos de inoculación del veneno cuando el preparado tenía adyuvante, desapareciendo espontáneamente sin tratamiento alguno, coincidiendo con Ferreira y cols. [24], Landom y cols. [33], Netto y cols. [42, 43] y Sjostrom y cols. [67], lo que sugiere una mayor resistencia del ovino al ser sometido a inoculaciones de veneno de serpientes en comparación con el equino, el cual presenta un exacerbada respuesta local que resulta en grandes abscesos, fístulas y fibrosis en el sitio de inoculación del veneno [4, 22, 23, 42, 43, 67].
CONCLUSIONES
La evaluación de la respuesta inmunológica de los animales sometidos a protocolos de hiperinmunización por primera vez, debe hacerse en forma individual, para facilitar la selección de los animales con buena respuesta, asegurando que mediante la aplicación de esta medida, se mejorará el rendimiento en cualquier centro de producción de suero antiofídico.
El ovino es un animal potencial para ser usado en la producción de suero antiofídico por constituir una especie económica, resistente, de fácil manejo, buenos productores de anticuerpos y representa una alternativa para los pacientes alérgicos al suero antiofídico equino.
Los resultados obtenidos en esta investigación aportan datos de interés para investigaciones futuras y para investigadores en el área de producción de sueros hiperinmunes en la región y en el país, ya que existen pocos reportes al respecto.
Esta investigación sirve de apoyo al desarrollo de un suero antiofídico autóctono de gran especificidad, ya que los ovinos se inocularon con venenos de serpientes propias de la región.
RECOMENDACIONES
Debido a la excelente resistencia de los ovinos a las inoculaciones con el veneno utilizado, se recomienda para futuras investigaciones elevar la dosis y el número de inoculaciones de éste con el fin de incrementar el título de anticuerpos.
AGRADECIMIENTO
Los autores desean agradecer al Consejo de Desarrollo Científico y Humanístico de la Universidad del Zulia (CONDES), por el financiamiento de la presente investigación.
REFERENCIAS BIBLIOGRÁFICAS
1. AL-ABDULA, I.; GARNVWA, J.; RAWAT, S.; SMITH, D.; LANDON, J.; NASIDI, A. Formulation of a liquid ovine Fab-based antivenom for the treatment of envenomation by the Nigerian carpet viper (Echis ocellatus). Toxicon. 42(4): 6, 399. 2003. [ Links ]
2. AL-ASMARI, A.; AL-ABDULA, I.; CROUCH, R.; SMITH, D.; SJOSTROM, L. Assessment of an ovine antivenom raised against venom from the desert black cobra (Walterinnesia aegyptia). Toxicon. 35(1): 141-145. 1997. [ Links ]
3. Almeida, C.; Kanashiro, M.; Rangel, F.; Mata, K.; Da Silva, W. Development of snake antivenom antibodies in chickens and their purification from yolk. Vet. Rec. 143(21): 579-584. 1998. [ Links ]
4. Angulo, Y.; Estrada, R.; Gutiérrez, J. Clinical and laboratory alterations in horses during immunization with snake venoms for the production of polyvalent (Crotalinae) antivenom. Toxicon. 35(1): 81-90. 1997. [ Links ]
5. Ariaratnam, C.; Meyer, W.; Perera, G.; Eddleston, M.; Kulerane, S.; Attapattu, W.; Sheriff, R.; Richards, A.; Theakston, R.; Warrell, D. A new monoespecific ovine Fab fragment antivenom for treatment of envenoming by the Sri Lanka Russell´s viper (Daboia Russelli Russelli): a prelimining dose-finding and pharmacokinetic study. Am J Trop Med Hyg. 61(2): 259-265. 1999. [ Links ]
6. ARIARATNAM, C.; SJUSTRUM, L.; RAZIEK, Z.; KULARATNE, S.; ARACHCHI, R.; SHERIFF, M.; THEAKSTON, R.; WARRELL, D. An open randomized comparative trial of two antivenoms for the treatment of envenoming by Sri Lankan Russells viper (Daboia russellii russellii). Trans R Soc Trop Med Hyg. 95(1): 74 –80. 2001. [ Links ]
7. Bolaños, R.; Cerdas, L. Producción y control de sueros Antiofidicos en Costa Rica. Bol de la Ofic Sanit Panam. LXXXVIII(3): 188-196. 1980. [ Links ]
8. Brazil, V. History of the primordia of snake-bite accident serotherapy. Mem do Instit Butantan. 49(1): 7-20. 1987. [ Links ]
9. BURNOUF, T.; GRIFFITHS, E.; PADILLA, A.; SEDDIK, S.; STEFANO, M.A.; GUTIÉRREZ, J.M. Assessment of the viral safety of antivenoms fractionated from equine plasma. Biol. 32: 115-128. 2004. [ Links ]
10. Cavinato, R.; Remold, H.; Kipnis, T. Purification and variability in trombine-like activity of Bothrops atrox venom from diferent geographic regions. Toxicon. 36(2): 257-267. 1998. [ Links ]
11. Centro de Biotecnología. Suero antiescorpiónico, elaboración y control. Facultad de Farmacia. Universidad Central de Venezuela. Manual de Laboratorio. 7-24 pp 1994. [ Links ]
12. CHANHOME, L.; PUEMPUNPANICH, S.; OMORI-SATOH, T.; CHAIYABUTR, N.; SITPRIJA, V. A pilot exoeriment for production of Malayan krait antivenom: immunization of rabbits with Bungarus candidus venom. J Nat Toxins. 11(4): 353-356. 2002. [ Links ]
13. CHIPPAUX, J.; WILLIAMS, V.; WHITE, J. Snake venom variability: methods of study, results and interpretation. Toxicon. 29(11): 1279-1303. 1991. [ Links ]
14. CHIPPAUX, J. Snake-bites: appraisal of the global situation. Bull of the World Health Organiz. 76(5): 515-524. 1998. [ Links ]
15. Chotwiwatthanakun, C.; Pratanaphon, R.; Akesowan, S.; Sriprapat, S. Production of potent polyvalent antivenom against three elapid venoms using a low dose, low volume, multi-site immunization protocol. Toxicon. 39(10): 1487-1494. 2001. [ Links ]
16. Christensen, P. The preparation and purification of antivenoms. Mem do Instit Butantan. Simposio internacional. 33(1): 245-250. 1996. [ Links ]
17. Colimodio, H.; Aguilar, M. Envenenamiento ofídico en Venezuela. Med. Crít. Venez. 8(1): 23-38. 1993. [ Links ]
18. CURVE EXPERT package V 1,3 for Window 2005. [ Links ]
19. DE ROODT, A.; DOLAB, J.; HAJOS, S.; FERNÁNDEZ, T.; SEGRE, l. Capacidad neutralizante de los sueros antiofidicos frente al veneno de Bothrops moojeni (caisaca, lanzadera). Med (B Aires). 57(6): 667-676. 1997. [ Links ]
20. DEVI, CM.; BAI, MV.; KRISHNAN, LK. Development of viper-venom antibodies in chicken egg yolk and assay of their antigen binding capacity. Toxicon. 40(7): 857-861. 2002. [ Links ]
21. DEVI, CM.; BAI, MV.; LAL, AV.; UMASHANKAR, PR.; KRISHNAN, LK. An improved meted for isolation of anti-viper venom antibodies from chicken egg yolk. J. Biochem Biophys Meth. 51(2): 129-38. 2002. [ Links ]
22. Estrada, R.; GutiÉrrez, J.; Alvarado, J.; Robles, A.; Ávila, C.; González, N. Desarrollo de anticuerpos antifosfolipasa A2 en caballos inoculados con veneno para la producción de suero antiofídico polivalente en Costa Rica. Rev de Biol Trop 37(2):187-191. 1989. [ Links ]
23. ESTRADA, R.; ROBLES, A.; ALVARADO, J.; ROJAS, E.; GONZALEZ, N.; SEGURA, E.; GUTIERREZ, J. Development of antibody response and clinical and hematological alterations in horses immunized with snake venoms for the production of antivenom in Costa Rica. Mem Instit Butantan. 53(2): 181- 190. 1991. [ Links ]
24. FERREIRA, J.; BASTOS, M.; PELIZON, A.; PERES, C.; CAVALCANTE, D.; SARTORI, A. Assessment of the neutralizing potency of ovine antivenom in a swiss mice model of Bothrops jararaca envenoming. J of Venom Anim and Toxins including Trop Dis. 11(3): 336-349. 2005. [ Links ]
25. GutiÉrrez, J.; ChÁvez, F.; Elizondo, J.; Ávila, C.; Cerdas, L. Producction of monovalent anti-Bothrops asper antivenom: development of immune response in horses and neutralizing ability. Rev de Biol Trop. 36(2B): 511-517. 1988. [ Links ]
26. HARMS, A. The purification of antitoxic plasmas by enzyme treatment and heat denaturation. Biochem J. 42: 390-7. 1948. [ Links ]
27. HARRISON, M.; MOURA-DA-SILVA, AM.; LAING, GD.; WU, Y.; RICHARDS, A.; BROADHEAD, A.; BIANCO, AE.; THEAKSTON, RD. Antibody form mice immunized with DNA encoding the carboxyl- disintegrin and cysteine-rich domain (JD9) of the haemorrhagic metalloprotease, Jararhagin, inhibits the main lethal component of viper venom. Clin. Exp. Immunol. 121(2): 358-63. 2000. [ Links ]
28. HARRISON, R.; RICHARDS, A.; LAING, G.; THEAKSTON, R. Simultaneus GeneGun immunization with plasmids encoding antigen and GM-CSF: significant enhancement of murine antivenom IgG1 titres. Vaccine. 20(13-14): 1702-1706. 2002. [ Links ]
29. Karlson, S.; Persson, H.; Heath, A.; Smith, D.; alAbdula, I.; Sjostrom, L. First Clinical experiences with specific sheep Fab fragment in snake bite. J Intern Med. 24(1): 53-58. 1997. [ Links ]
30. LAING, GD.; THEAKSTON, RD. Immunization against Echis ocellatus (carpet viper) venom using liposomes incorporating immunostimulants: role of lipopolysaccharide in coferring protection in a mouse model. Toxicon. 31(5): 615-26. 1993. [ Links ]
31. LAING, G.; LEE, L.; SMITH, D.; LANDON, J.; THEAKSTON, R. Experimental assessment of a new lost cost antivenom for treatment of carpet viper ( Echis ocellatus) envenoming. Toxicon. 33(3): 307-313. 1995. [ Links ]
32. LANCINI, A. Prevención del ofidismo. Serpientes de Venezuela. Ernesto Armitano Editor. 2da Ed. 233-234 pp. 1986. [ Links ]
33. LANDOM, J.; SMITH, D. Merits of Sheep Antisera for Antivenom Manufacture. J of Toxicol. 22(1): 15-22. 2003. [ Links ]
34. LEON, G.; ESTRADA, R.; CHAVES, F.; ROJAS, G.; OVADIA, M.; GUTIERREZ, JM. Inhibition by CaNa2EDTA of local tissue damage induced by Bothrops asper (terciopelo) venom: application in horse immunization for antivenom production. Toxicon. 36(2): 321-331. 1998. [ Links ]
35. León, G.; Valverde, J.; Rojas, G.; Lomonte, B.; Gutiérrez, J. Comparative study on the ability of IgG and Fab sheep antivenoms to neutralize local hemorrhage, edema and myonecrosis induced by Bothrops asper (terciopelo) snake venom. Toxicon. 38(2): 233-244. 2000. [ Links ]
36. MACHADO, A.; RODRÍGUEZ, A. Animales Terrestres. Animales venenosos y ponzoñosos de Venezuela. Universidad Central de Venezuela. CONDES. Caracas. 71-76 pp. 1997. [ Links ]
37. Meyer, W.; Habid, A.; Onayade, A.; Yakubu, A.; Smith, D.; Nasidi, A.; Daudu, Y.; Warrell, D.; Theakstons, R. First Clinical experiences with a new ovine Fab Echis ocelatus snake bites antivenom in Nigeria: randomized comparative trial with Institute Pasteur Serum (IPSER) Africa antivenom. Am J Trop Med Hyg. 56(3): 291-300. 1997. [ Links ]
38. MINISTERIO DE SALUD Y DESARROLLO SOCIAL Dirección de Vigilancia Epidemiológica. Mordeduras de serpientes y Morbilidad según entidad federal. 1-9 pp. 2005. [ Links ]
39. Montilla, J.; AlvareZ, M.; Díaz, E.; Añez, M.; Villavicencio, J. Hiperinmunización de Ovinos contra veneno de Crótalus durissus cumanensis del Estado Zulia, Venezuela. Rev. Científ Fac. Cs. Vet. LUZ. IX(5): 388-394. 1999. [ Links ]
40. Moran, N.; Newman, W.; Thekaston, R.; Warrell, D.; Wilkinson, D. High incidence of early anaphylactoid reaction to SAIMR polyvalent snake antivenom. Trans R Soc Trop Med Hyg. 92(1):69-70. 1998. [ Links ]
41. Muniz, E.; Maria, W.; Estevao-Costa, M.; Buhrnheim, P.; Chávez-Olórtegui, C. Neutralizing potency of horse antibothropic Brazilian antivenom against Bothrops snake venom from the Amazonian rain forest. Toxicon. 38(12): 1859-1863. 2000. [ Links ]
42. NETTO, D.; CHIACCHIO, S.; BICUDO, P.; ALFIERI, A.; NASCIMENTO , N. Humoral response and neutralization capacity of sheep serum inoculated with natural and cobalt 60- irradiated Crótalus durissus terrificus venom (Laurenti, 1768). J of Venom Anim and Toxins. 8(2): 297-314. 2002. [ Links ]
43. NETTO, D.; CHIACCHIO, S.; BICUDO, P.; ALFIERI, A.; BALARIM, M.; NASCIMENTO, N. Hematological changes in sheep inoculated with natural and cobalt 60- irradiated Crótalus durissus terrificus venom (Laurenti, 1768). J of Venom Anim and Toxins including Trop Dis. 10(1):34-52. 2004. [ Links ]
44. NKININ, S.; CHIPPAUX, J.; PIETIN, D.; DOLJANSKY, Y.; TREMEAU, O.; MENEZ, A. Genetic origin of venom variability: impact on the preparation of antivenin serums. Bull Soc Pathol Exot. 90(4):277-281. 1997. [ Links ]
45. Organización Mundial de la Salud. II Curso internacional sobre producción y control de productos biológicos. Manual de Laboratorio. México. 1-16 pp. 1978. [ Links ]
46. Organización Mundial de la Salud. Progress in the characterization of venoms and standarization of antivenoms. Laboratory Mannual. Geneva. 5-44 pp. 1981. [ Links ]
47. Otero, R.; Cardoso, J.; Higashi, H.; Núñez, V.; Díaz, A.; Toro, M.; GarcÍa, M.; Sierra, A.; Garcia, L.; Moreno, A.; Medina, M.; Castañeda, N.; Silva, J.; Murcia, M.; CÁrdenas, S.; Dias, W. A randomized, blinded, comparative trial of one pepsin-digested and two whole IgG antivenoms for Bothrops snake bites in Uraba, Colombia. The Regional Group on Antivenom Therapy Research (REGATHER) Am J Trop Med Hyg. 58(2): 183-189. 1998. [ Links ]
48. Otero, R.; Gutiérrez, J.; Rojas, G.; Núñez, V.; Díaz, A.; Miranda, E.; Uribe, A.; Silva, J.; Ospina, J.; Medina, Y.; Toro, M.; García, M.; León, G.; García, M.; Lizano, S.; De La Torre, J.; Marquez, J.; Mena, Y.; González, N.; Arenas, L.; Puzón, A.; Blanco, N.; Sierra, A.; Espinal, M.; Lozano, R. A randomized blinded clinical trial of two antivenoms, prepared by caprylic acid or ammonium sulphate fractionation of IgG, in Bothrops and Porthidium snake bites in Colombia: correlation between safety and biochemical characteristics of antivenoms. Toxicon. 37(6): 895-908. 1999. [ Links ]
49. Perri, V. Relaciones con el hombre y Descripción de las serpientes. El libro de las serpientes de todo el mundo. Editorial, de Vecchi S.A. 23-25, 55 pp. 1992. [ Links ]
50. POPE, C. The action of proteolytic enzymes on the antitoxins and proteins in immune sera. I. True digestion of the proteins. Br J Exp Pathol. 20: 132. 1939. [ Links ]
51. POPE, C. The action of proteolytic enzymes on the antitoxins and proteins in immune sera. II. Heat denaturation after partial enzyme action. Br J Exp Pathol. 20: 201-12. 1939. [ Links ]
52. PRATANAPHON, R.; AKESOWAN, S.; KHOW, O.; SRIPRAPAT, S.; RATANABANANGKOON, K. Producction of highly potent horse antivenom against the Thai cobra (Naja kaouthia). Vaccine. 15(14): 1523-1528. 1997. [ Links ]
53. Quanzhi, L.; Charlotte, L. Evaluation of four different immunogenes for the production of snake antivenoms. Toxicon. 30(11): 1319-1330. 1992. [ Links ]
54. QUINTERO, S. Serpientes Venenosas. Mordeduras de Serpientes Venenosas. Universidad Nacional Experimental de los Llanos Occidentales Ezequiel Zamora. 9-11 pp. 1975. [ Links ]
55. RAW, I.; GUIDOLIN, R.; HIGASHI, HG.; KELEN, EMA. Antivenins in Brazil: preparation. In: TU AT (Ed). Handbook of natural toxins. New York: Marcel Dekker. 557-81 pp. 1991. [ Links ]
56. Rawat, S.; Laing, G.; Smith, D.; Theakston, D.; Landon, J. A new antivenom to treat Eastern coral snake (Micrurus fulvius fulvius) envenoming. Toxicon. 32(2): 185-190. 1994. [ Links ]
57. RODRÍGUEZ, A.; MONDOLFI, A.; ORIHUELA, R.; AGUILAR, M. ¿Qué hacer frente a un accidente ofídico?. 1ª Ed. Caracas. 13-23 pp. 1995. [ Links ]
58. Rodrigues, S.; Martins, M.; Magalhaes, A.; Santoro, M. Purification and stability studies of inmunoglobulins from Lachesis muta muta antivenom. Toxicon. 35(8): 1229-1238. 1997. [ Links ]
59. RODRÍGUEZ, A.; UZCATEGUI, W.; AZUAJE, I.; GIRON, M. Análisis clínico y epidemiológico de los accidentes por mordeduras de serpientes del genero Bothrops en Venezuela. Rev. Cub Med. Trop. 52(2): 90-94. 2000. [ Links ]
60. ROJAS, G.; JIMENEZ, JM.; GUTIERREZ, JM. Caprylic acid fractionatión of hiperimmune horse plasma: description of a simple procedure for antivenom production. Toxicon. 32(3): 351-63. 1994. [ Links ]
61. ROJAS, E.; QUESADA, L.; ARCE, V.; LOMONTE, B.; ROJAS, G.; GUTIERREZ, JM. Neutralization of four Peruvian Bothrops sp. Snake venoms by polyvalent antivenoms produced in Perú and Costa Rica: preclinical assessment. Acta Trop. 93(1): 85-95. 2005. [ Links ]
62. Rolim, R.; Gomes, E.; Silles, M.; Queiroga, Y.; Iizuka, H. Analise comparativa entre os diferentes esquemas de hiperinmunizacao empregados na producao de soros antiofídicos pelo Instituto Butantan (1957-1979). Mem do Instit Butantan. 44/45: 259-270. 1980/81. [ Links ]
63. Roze, J. Familia Viperidae. La taxonomía y zoogeografía de los ofidios en Venezuela. Universidad Central de Venezuela, Caracas. 273-276 pp. 1966. [ Links ]
64. Saetang, T.; Treamwattana, N.; Suttijitpaisal, P.; Ratanabanangkoon, K. Quantitative comparison on the refinement of horse antivenom by salt fractionation and ion-exchange chromatography. J Chromat. B Biomed Sci Appl. 700(1 y 2): 233-239. 1997. [ Links ]
65. Sandner, M. Mortalidad por mordedura de ofidios21|. Manual de las serpientes ponzoñosas de Venezuela. Ed. Miguel A. García e Hijo. Caracas. Venezuela. 20-21 pp. 1975. [ Links ]
66. SELLS, PG.; RICHARDS, AM.; LAING, GD.; THEAKSTON, RD. The use of hen´s eggs as an alternative to the conventional in vivo rodent assay for antidotes to haemorrhagic venoms. Toxicon. 35(9): 1413-21. 1997. [ Links ]
67. Sjostrom, L.; Abdulla, I.; Rawat, S.; Smith, D.; Landom, J. A comparison of ovine and equine antivenoms. Toxicon. 32(4): 427-433. 1994. [ Links ]
68. Smith, D.; Reddi, K.; Laing, G.; Theakston, D.; LANDOM, L. (1992). An affinity purified ovine antivenom for the treatment of Vipera berus envenoming. Toxicon. 30(8): 865-871. 1992. [ Links ]
69. SMITH, A.; ISBISTER, G. Antivenoms: Editorial Commentary. J of Toxicol Clin Toxicol. 42(3): 261-262. 2003. [ Links ]
70. SOARES, AM.; SESTITO, WP.; MARCUSSI, S.; STABELI, RG.; ANDRIAO-ESCARSO, SH.; CUNHA, OA.; VIEIRA, CA.; GIGLIO, JR. Alkylation of myotoxic phospholipases A2 in Bothops moojeni venom: a promising approach to an enhanced antivenom production. Int. J. Biochem Cell Biol. 36(2): 258-70. 2004. [ Links ]
71. SRIPRAPAT, S.; AKESOWAN, S.; SAPSUTTHIPAS, S.; CHOTWIWATTHANANAKUN, C.; SUTTIJITPAISAL, P.; PRATANAPHON, R.; KHONW, O.; SITPRIJA, V.; RATANABANANGKOON, K. Tha impact of a low dose , low volume, multi-site inmunization on the producction of therapeutic antivenoms in Thailand. Toxicon. 41(1): 57-64. 2003. [ Links ]
72. Thalley, D.; Caroll, S. Rattlesnake and scorpion antivenoms from the egg yolks of immunized hens. Bio-Technol. 8(10): 934-938. 1990. [ Links ]
73. Theakston, R. An objetive approach to antivenom therapy and assessment of first-aid measures in snake bite. Ann Trop Med Parasitol. 91(7): 857-865. 1997. [ Links ]
74. THEAKSTON, R.; WARREL, D.; GRIFFITHS, E. Report of a WHO workshop on the standardization and control of antivenoms. National Library of Medicine. Toxicon. 41(5): 541-557. 2003. [ Links ]
75. WHITE, J.; WARREL, D.; EDDLESTON, M.; CURRIE, B.; WHYTE, I.; ISBISTER, G. Where are we now?. J of Toxicol Clin Toxicol. 41(3): 263-276. 2003. [ Links ]
76. WHITE, J. Snake venoms and coagulopathy. Toxicon. 45(8): 951-967. 2005. [ Links ]












 uBio
uBio