Revista Científica
versión impresa ISSN 0798-2259
Rev. Cient. (Maracaibo) v.18 n.1 Maracaibo feb. 2008
Efecto de concentraciones crecientes de Fósforo Fítico sobre la actividad de las enzimas fitasa y fosfatasa alcalina en el epitelio intestinal de ovinos jóvenes.
Pablo Pizzani 1, Susmira Godoy 2, Milagro León 3, Emma Rueda 3, María Virginia Castañeda 3 y Adelis Arias 4
1 Universidad Rómulo Gallegos, Área Agronomía, Apartado 4563, San Juan de los Morros, estado Guárico, Venezuela. E-mail: pablopizzani@yahoo.com
2 Instituto Nacional de Investigaciones Agropecuarias (INIA), Laboratorio de Nutrición Animal, Maracay, estado Aragua, Venezuela.
3 Universidad Central de Venezuela, Facultad de Ciencias Veterinarias, Laboratorio de Enzimología y Toxicología. Maracay, estado Aragua, Venezuela.
4 Universidad Nacional Experimental de los Llanos Centro Occidentales Ezequiel Zamora. Venezuela
RESUMEN
Con el objetivo de conocer el efecto del suministro de concentraciones crecientes de fósforo fítico sobre la actividad de las enzimas fitasa y fosfatasa alcalina en el epitelio intestinal de ovinos jóvenes, se realizó un experimento con concentraciones crecientes de fósforo fítico: 0% (T1), 40% (T2), 60% (T3) y 80% (T4). Los animales consumieron las dietas a razón del 4% del peso vivo durante cuatro semanas. Transcurrido este período, se sacrificaron todos los animales del ensayo, y se determinó la actividad de las enzimas en homogenados del epitelio de las diferentes secciones del intestino delgado (duodeno, yeyuno e ileon). Los resultados muestran valores de actividad fitásica a nivel del duodeno de: 1,43; 1,85; 1,82 y 0,69 (nmoles/min/mg de proteína) para concentraciones de T1, T2, T3 y T4, respectivamente, con una disminución significativa (P<0,05) cuando el 80% del fósforo de la ración estaba bajo la forma de fósforo fítico. En el yeyuno se mantuvo la misma tendencia con actividades de: 0,40; 1,75; 1,31; 0,55 (nmoles/min/mg de proteína), con las mismas concentraciones de fósforo fítico. Así mismo, los valores de actividad de la fosfatasa alcalina a nivel del duodeno fueron de: 890; 1550; 1395 y 472 (µmoles timoltafleina/min./mg proteína) para concentraciones de fósforo fítico antes mencionados. Cuando la proporción de fósforo fitico en la ración fue de 80% del fósforo total, los valores de actividad enzimática disminuyeron significativamente (P<0,05). Esta tendencia fue similar a nivel del yeyuno: 632; 1151; 749 y 405 (µmoles timolftaleina/min/mg de proteína) e ileón: 107; 225; 157 y 71 (µmoles timolftaleina/min/mg de proteína) a las mismas concentraciones de fósforo fítico. Estos resultados muestran que la actividad de las fitasas y de la fosfatasa alcalina a nivel del epitelio intestinal se incrementa, cuando el contenido de fósforo fítico con respecto al fósforo total está entre 40 y 60%. Sin embargo, cuando la proporción es igual o superior al 80% se reduce la actividad de ambas enzimas. Esto podría ser explicado por la saturación relativa de las enzimas fitasas y fosfatasa alcalina por el sustrato.
Palabras clave: Fitasa, fosfatasa alcalina, fósforo fítico, homogenado intestinal, ovinos.
Effect of Incresing Concentrations of Phytic Phosphorus on the Activity of the Phytase and Alkaline Phosphatase Enzymes in the Intestinal Epithelium of Young Sheep.
ABSTRACT
With the objective to know the effect of supply in growing concentrations of phytic phosphorus on the activity of the enzymes phytase and alkaline phosphatase in the intestinal epithelium of young sheep, it was carried out an experiment with incresing concentration of phytic phosphorus: 0% (T1), 40% (T2), 60% (T3), and 80% (T4). The animals consumed the diets as for 4% of the body weight during four weeks. Lapsed this period, all the animals of the rehearsal were sacrificed, and the activity of the enzymes was determined in homogenates of the epithelium of the different sections of the thin intestine (duodenum, jejunum and ileum). The results showed values of phytase activity at level of the duodenum of: 1.43; 1.85; 1.82 and 0.69 nmoles/min/mg protein for concentrations of T1, T2, T3, and T4, respectively, with a significant decrease (P<0.05) when 80% of the phosphorus of the portion was as phytic phosphorus. In the jejunum it stayed the same tendency with activities: 0.40; 1.75; 1.31 and 0.55 (nmoles/min/mg protein) with the same concentrations of phytic phosphorus. Likewise, the activity values of the alkaline phosphatase at level of the duodenum were of: 890; 1550; 1395 and 472 (µmoles thymolphthalein/min/mg protein) for concentration of phytic phosphorus mentioned. When the proportion of phytic phosphorus in the diet was 80% of the total phosphorus, the values of enzymatic activity diminished significantly (P<0.05). This tendency was similar at the jejunum: 632; 1151; 749 and 405 (µmoles thymolphthalein /min/mg protein) and ileum: 107; 225; 157 y 71 (µmoles thymolphthalein/min/mg protein) with the same concentrations of phytic phosphorus. These results show that the activity of the phytase and of the alkaline phosphatase at the intestinal epithelium increased, when the content of phytic phosphorus with regard to the total phosphorus was between 40 and 60%. However, when the proportion is the same or superior to 80% decreases the activity of both enzymes. This could be explained by the relative saturation of the enzymes phytase and alkaline phosphatase by the sustrate.
Key words: Phytase, alkaline phosphatase, phytic phosphorus, intestinal homogenates, sheep.
Recibido: 05 / 03 / 2007. Aceptado: 24 / 05 / 2007.
INTRODUCCIÓN
Las fitasas presentes en el tracto digestivo son enzimas que hidrolizan el inositol hexafosfato, liberando inositol fosfato, ortofosfatos inorgánicos y mioinositol, permitiendo que una mayor fracción del fósforo orgánico sea transformada en una forma aprovechable para el animal.
La actividad fitásica en el intestino fue demostrada por primera vez en ratas por Patwarthan [10]. Posteriormente se comprobó que la actividad fitásica está presente en la mucosa del duodeno de cerdos, conejos, becerros y pollos [1,8], bajo la forma de meso-inositol-hexafosfato fosfohidrolasa. Aún cuando, se ha trabajado sobre la actividad fitásica en varias especies, existen muy pocos trabajos en rumiantes [14].
En un principio, existió mucha controversia con relación a si la fitasa es una enzima independiente o si su actividad se atribuye a una fosfatasa alcalina, ya que, al igual que las fitasas, la fosfatasa alcalina hidroliza también ácido fítico. Además, la actividad de ambas enzimas tienen similar distribución subcelular, tienen el mismo pH óptimo y son modificadas por la presencia de vitamina D3 o por bajas concentraciones de fósforo en la dieta. Más recientemente, Yang y col. [21] purificaron una proteína de la mucosa intestinal de ratas que presentó actividad de las enzimas fitasa y de fosfatasa alcalina, las cuales mostraron propiedades diferentes, lo que sugiere la presencia de dos sitios activos diferentes en una misma enzima, por lo que, es probable que la fitasa y la fosfatasa alcalina sean partes de una misma entidad. Sin embargo, la actividad de ambas enzimas difieren en su magnitud, es decir, la fosfatasa alcalina tiene mayor actividad que la fitasa.
Otras evidencias soportan la hipótesis de que la fitasa y la fosfatasa alcalina son enzimas independientes [1].
La actividad de la fitasa está afectada por factores genéticos y nutricionales (vitamina D3, iones metálicos Fe3+2+, Ca2+, Zn2+, Mg2+, proporción de fósforo inorgánico, relación Ca:P, fibra etc.) [16], por lo que, existen diferencias en la habilidad de utilizar fósforo fítico entre especies y entre razas. Por otro lado, los fitatos son hidrolizados en el tracto intestinal por las fitasas de las células de la mucosa pero también por las enzimas presentes en la microflora [20], lo que determina que las diferencias entre especies y edades se deban a la actividad fitásica bacteriana.
A bajas concentraciones de fosfato en la dieta se incrementa las actividades de la fosfatasa alcalina y de las fitasas y, en mayor grado, de fitasas en la mucosa duodenal de aves [6]. Por el contrario, en ratas y cerdos no hay adaptación a bajas concentraciones de fosfatos en la dieta y no se ha reportado el efecto de concentraciones de fitatos sobre las actividades de fosfatasa alcalina y fitasas [11].
En animales rumiantes, Yanke y col. [22] determinaron la actividad fitásica de cultivos puros de bacterias bajo diferentes condiciones de alimentación, y demostraron que la actividad fitásica del rumen es principalmente de origen bacterial, confirmando los resultados de Raun y col. [13]. No obstante, cuando se aplican regímenes alimenticios que exigen la incorporación de altos concentraciones de concentrado (>70%), la actividad fitásica de los microorganismos es limitante, probablemente debido a una saturación de su capacidad de hidrolizar el sustrato [4,7]. Para evaluar el efecto de dietas altas en fitato sobre la actividad fitásica en la mucosa de los diferentes segmentos del intestino delgado en rumiantes alimentados con concentraciones crecientes de fósforo fítico.
MATERIALES Y MÉTODOS
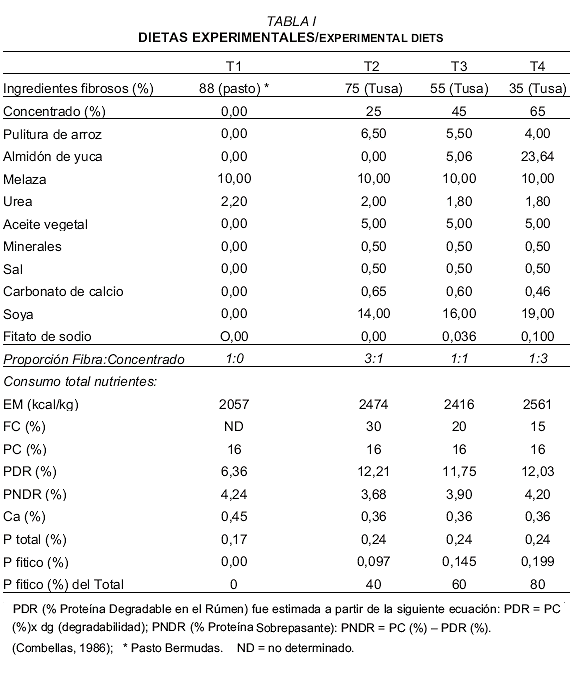
Dieciséis ovinos jóvenes (4 meses de edad) fueron distribuidos de acuerdo a un diseño completamente aleatorizado en cuatro grupos de cuatro animales cada uno. Los animales fueron alimentados con concentraciones crecientes de fósforo fitico 0% (T1), 40% (T2), 60% (T3) y 80% (T4) (TABLA I). El suministro de alimento duró 4 semanas, a razón del 4% del peso vivo del animal.
Transcurrido este período, se sacrificaron todos los animales del ensayo, después de un ayuno de ocho horas, los animales fueron sacrificados por punción en la vena yugular, desangrándose e inmediatamente se extrajo todo el intestino delgado, desde el duodeno hasta el ileon, haciendo una ligadura doble en cada órgano y segmento bajo estudio. Una vez vaciado el contenido y lavado el tejido de cada sección del tracto digestivo con una solución de NaCl al 0,9%, se pesaron nuevamente y se tomaron muestras de mucosa que se colocaron en una solución fisiológica refrigerada a pH neutro, y se almacenaron en un tanque con nitrógeno líquido hasta su análisis [2,5,11].
Preparación del homogenado de la mucosa intestinal
Todo el procedimiento se realizó entre 0 y 4°C. Los segmentos intestinales fueron separados de acuerdo a la metodología descrita por Siddons [17], perfundidos con solución salina fisiológica, separados, pesados y posteriormente cortados longitudinalmente y colocados sobre una placa de vidrio y la mucosa raspada suavemente con una lámina porta objeto. La mucosa fue sumergida en una solución buffer (50 mM de Manitol y 2 mM de HEPES a pH 7,1) con una relación de 20 ml de buffer por cada gramo de mucosa. Homogenizado a máxima velocidad por 1 minuto, empleando un homogenizador de tejido (Power, modelo 700, EUA). Se almacenaron alícuotas del homogenado en un tanque de nitrógeno líquido hasta su análisis.
Determinaciones enzimáticas
Fitasa: La actividad de la enzima fitasa (EC 3.1.3.8) fue determinada por la metodología propuesta por Maenz y Classen [5] con modificaciones. Fueron incubados 40ul del homogenado a 37°C, con 200 µL de la sal sódica de inositol hexafosfato 1 mM como sustrato, y 160 µL del buffer conteniendo 25 mM de MgCl2 y 50mM de buffer MES a pH 6,0 luego de 15 minutos de incubación, la reacción se detuvo agregando 3600µL de una solución que contenía 0,28% de molibdato de amonio, SDS al 1,1% y acido ascórbico al 1%. La concentración de fosfato liberado fue determinada por espectrofotometría a 820nm en un espectrofotómetro Perkin-Elmer, modelo Lambda 11, EUA), el equipo fue calibrado contra blanco conteniendo todos los reactivos pero en el cual la muestra de homogenado fue agregada después de detener la reacción. Los valores de absorbancia obtenidos fueron comparados con los de una curva estándar (0,05 – 0,30 mM) elaborada a partir de una solución 0,5 mM de KH2PO4. La actividad de la fitasa se expresó como nmoles de PO4 hidrolizados por minuto por miligramos de proteína.
Fosfatasa alcalina: La actividad de la enzima fosfatasa alcalina (EC 3.1.3.1) se determinó mediante la utilización de un Kit (Labtest Diagnóstica S.A, Brasil), el cual se fundamenta en la capacidad que tiene la fosfatasa alcalina de hidrolizar la timolftaleina monofosfato (C28 H29 O7 P Mg). Durante el proceso de hidrólisis se libera timolftaleina, que tiene color azul en medio alcalino. El color formado es directamente proporcional a la actividad enzimática.
Procedimiento: Se adicionó 0,05 mL del sustrato (timolftaleina monofosfato, 22 mmol/L) y 0,5mL tampón (300mmol/L, pH10,1), a los tubos del patrón, blanco y muestras, preincubándose en baño de agua a 37°C por 2 minutos. Luego se agregó 0,05 mL del patrón (45 U/L), y 0,05 mL de la muestra a los tubos correspondientes, se mezcló y se incubó por 10 minutos. Luego se adicionó 2 mL del reactivo de color (carbonato de sodio 94 mmol/L y hidróxido de sodio 250 mmol/L), se mezcló retirándose del baño y se leyó la absorbancia a 590nm, llevando el espectrofotómetro (Perkin Elmer, modelo Lambdall, EUA) a cero con agua destilada.
Cálculos: Fosfatasa alcalina (U/L)= Absorbancia de la muestra / Absorbancia del patrón
1 Unidad Internacional (U) = 1 µmol/min./L
La actividad de la fosfatasa alcalina se expresó como nmoles de Pi hidrolizados de la timolftaleina por minuto por mg de proteína.
Análisis estadístico
Los resultados de las actividades enzimáticas fueron analizados de acuerdo a un diseño completamente aleatorizado con arreglo factorial. Cuando en el ANOVA se detectó diferencias estadísticas significativas entre los distintos tratamientos evaluados, los promedios fueron separados de acuerdo a la prueba de Tukey [18].
RESULTADOS Y DISCUSIÓN
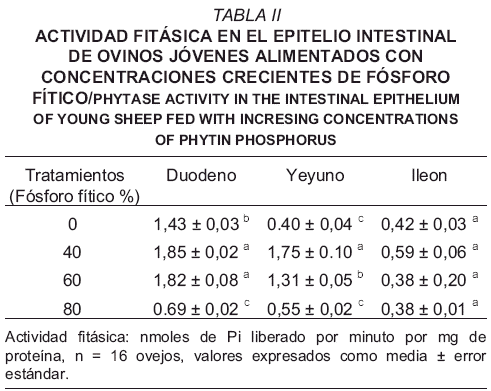
En la TABLA II se presenta la actividad de la enzima fitasa (nmoles/min/mg de proteína) en homogenados del epitelio de los segmentos duodeno, yeyuno e ileon en los corderos alimentados con concentraciones crecientes de fósforo fítico: 0 % (T1), 40% (T2), 60% (T3) y 80% (T4). Los valores de actividad fitásica estuvieron comprendidos en un rango de 0,38 a 1,85 (nmoles/min/mg de proteína), los mayores valores correspondieron al duodeno (entre 0,69 y 1,85 unidades), seguido por yeyuno (entre 0,40 y 1,75 unidades) y finalmente el ileon (entre 0,38 y 0,59 unidades). En concordancia con lo antes expuesto, Park y col. [9] señalan que los fitatos que escapan a la degradación ruminal pueden ser hidrolizados en el intestino delgado de los ovejos.
La actividad de la fitasa presentó valores a nivel del duodeno de: 1,43; 1,85; 1,82 y 0,69 (nmoles/min/mg de proteína) para los tratamientos T1, T2, T3 y T4 respectivamente. La actividad fitásica disminuyó significativamente (P<0,05) cuando el 80% del fósforo de la ración estaba bajo la forma de fósforo fítico. Esta tendencia fue similar a nivel del yeyuno: 0,40; 1,75; 1,31 y 0,55 (nmoles/min/mg de proteína) e ileón 0,42; 0,59; 0,38 y 0,38 (nmoles/min/mg de proteína) con las mismas concentraciones de fósforo fítico (TABLA II). Estos resultados pueden ser consecuencia de que esta enzima tiende a ser fuertemente inhibida por exceso de substrato (fitato) y el producto (fósforo inorgánico) de la reacción [12].
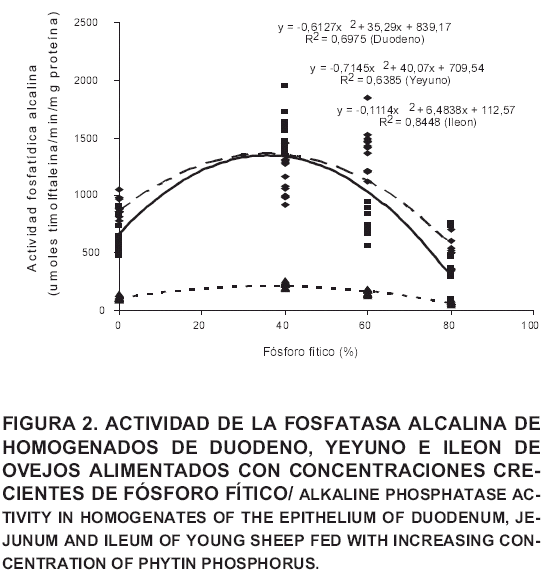
La TABLA III presenta los valores de la actividad de la fosfatasa alcalina (µmoles timolftaleina/min/mg de proteína) de homogenado del epitelio de los segmentos duodeno, yeyuno e ileón de los ovejos de los diferentes tratamientos. Los valores de la actividad de la fosfatasa alcalina estuvieron comprendidos en un rango de 71 a 1550, y los mayores valores correspondieron al segmento duodeno con valores entre 472 y 1550 unidades, seguido por yeyuno (entre 405 y 1151 unidades) y finalmente el ileon (entre 71 y 225 unidades).
Los valores de actividad de la fosfatasa alcalina a nivel del duodeno fueron de: 890; 1550; 1395 y 472 (µmoles timolftaleina/min/mg proteína) para concentraciones de fósforo fitico de 0, 40, 60 y 80%. Esta tendencia fue similar a nivel del yeyuno: 632; 1151; 749 y 405 (µmoles timolftaleina/min/mg de proteína) e ileon: 107; 225; 157 y 71 (µmoles timolftaleina/min/mg de proteína) a las mismas concentraciones de fósforo fitico. La actividad de esta enzima disminuyó significativamente (P<0,05) cuando el porcentaje de fósforo fítico fue de 80%. Por su parte, Yoshio [23], cuando determinó la actividad de la fosfatasa alcalina en el contenido gastrointestinal de varios segmentos del intestino delgado, de ovinos y bovinos alimentados con afrecho de trigo, remolacha azucarera y pasto, encontró valores de actividad de la fosfatasa alcalina superiores a los reportados en este trabajo. Probablemente, ello es debido a que la fosfatasa alcalina es una enzima que se encuentra unida a la superficie de las células del epitelio intestinal [19], y cualquier incremento en su actividad a nivel de contenido gastrointestinal, posiblemente sea de origen microbial.
Por otra parte, Rueda [15] reportó valores de actividad de la fosfatasa alcalina de homogenado de epitelio duodenal de 15,9 y 10,2 (nmoles de p-nitrofenol/min/mg proteína) en pollos de 3 y 6 semanas de edad respectivamente. Davies y Flett [3] obtuvieron actividades de la fosfatasa alcalina en el intestino delgado de ratas en un rango de 0,017 a 0,15 umoles/min/mg de proteína. Todos estos valores son inferiores a los reportados en rumiantes.

CONCLUSIONES
Los resultados de este trabajo señalan que proporciones de fósforo fítico igual o superior a 80% con respecto al fósforo total, produjo una reducción, tanto de la actividad fitásica como de la fosfatasa alcalina, a nivel del epitelio de los segmentos intestinales: duodeno, yeyuno e ileon. Esto probablemente esté asociado con una saturación de las enzimas por su sustrato o una inhibición de las mismas por el producto de la hidrólisis de los fitatos. Sin embargo, cuando el porcentaje de fósforo fítico con respecto al fósforo total fue menor a 60% la actividad de ambas enzimas, fueron significativamente superiores al control.
REFERENCIAS BIBLIOGRÁFICAS
1. BITAR, K.; REINHOLD, H. Phytase and alkaline phosphatase activities in intestinal mucosa of rat, chicken, calf and man. Biochem. Biophys. Acta 268: 442-452. 1972. [ Links ]
2. COOPER, J.; GOWING, H. Mammalian small intestinal phytase (EC 3.1.3.8). Brit. J. of Nutr. 50:673-678. 1983. [ Links ]
3. DAVIES, N.T.; FLETT, A.A. The similarity between alkaline phosphatase (EC 3.1.3.1) and phytase (EC 3.1.3.8) activities in rat intestine and their importante in phytate induced zinc deficiency. Brit. J. of Nutr. 39:303-316. 1978. [ Links ]
4. GODOY, S.; MESCHY, F. Utilisation of phytic phosphorus by rumen bacteria in a semi-continuous culture system (RUSITEC). S. Afr. J. Anim. Sci. 29: 148-149. 2001. [ Links ]
5. MAENZ, D.; CLASSEN, H. Phytase activity in the small intestinal brush border membrana of the chicken. Poult. Sci. 77: 357-363. 1998. [ Links ]
6. MCCUAIG, L.W.; DAVIES, M.I.; MOTZOK, I. Intestinal alkaline phosphatase and phytase of chicks: effect of dietary magnesium, phosphorus and thyroactive casein. Poult Sci. 51:526-530. 1972. [ Links ]
7. MESCHY, F.; GUEGUEN, L. Les recommandations d´apport alimentaire en éléments minéraux : analyse et perspectives. Renc. Rech. Rumin 5: 237-240. 1998. [ Links ]
8. MORSE, D.; HEAD, H.H.; WILCOX, C.J.; VAN HORN, H.H.; HISSEM, C.D.; HARRIS JR, B. Effects of concentration of dietary phosphorus on amount and route of excretion. J. Dairy Sci. 75: 3039-3049. 1992. [ Links ]
9. PARK, W. Y.; MATSUI, T.; YANO, F.; YANO, H. Heat treatment of rapeseed meal increases phytate flow into the duodenum of sheep. Anim. Feed. Sci. Technol. 88: 31-37. 2002. [ Links ]
10. PATWARTHAN, V.N. The occurrence of phytic-splitting enzyme in the intestine of albine rats. Biochem. J. 31:560-563. 1937. [ Links ]
11. POINTILLART, A.; FONTAINE, N.; THOMASSET, M.; JAY, M.E. Phosphorus utilization and intestinal phosphatase and hormonal control of calcium metabolism in pig fed phytic phosphorus:soybean of rapessed diets. Nutr. Rep. Int. 32:155-167. 1985. [ Links ]
12. POWER, R.; KHON, N. PHYTASE: The limitations to its universal use and how biotechnology is responding. Biotechnology in the feed industry. Proceedings of Alltech´s. Nicholasville, Kentucky. 335-367pp. 1993. [ Links ]
13. RAUN, A.; CHENG, E.; BURROUGHS, W. Phytate phosphorus hydrolysis and availability to rumen microorganisms. J. Agric. Food Chem. 4: 869-871. 1956. [ Links ]
14. REID, R.L.; FRANKLIN, M.C.; HALLSWORTH, E.G. The utilization of phytate phosphorus by sheep. Aust. Vet. J. 23: 136. 1947. [ Links ]
15. RUEDA, E. Efecto de la Concanavanina A sobre las enzimas digestivas en pollos de engorde. FCV. UCV. Maracay. Trabajo de Ascenso. 64 pp. 2004. [ Links ]
16. SALLE, P.H.; RAVINDRAN, V. Microbial phytase in poultry nutrition. Review. Anim. Feed. Sci. Technol. 135: 1-41. 2007. [ Links ]
17. SIDDONS, R.C. Intestinal disaccharidase activities in the chick. Biochem. J. 112: 51-59. 1969. [ Links ]
18. STEEL, R.; TORRIE, T. Comparaciones múltiples. Bioestadística: principios y procedimientos, 2da Ed. Mc Graw-Hill. México. 622 pp. 1990. [ Links ]
19. WEISER, M.M. Intestinal epithelial cell surface membrane glycoprotein synthesis. J. of Biol. Chem. 248 (7): 2536-2541. 1973. [ Links ]
20. WISE, A.; GILBURT, D.J. Phytate hydrolysis by germfree and conventional rats. Appl. Environ. Microbiol. 43:753-756. 1982. [ Links ]
21. YANG, W. J.; MATSUDA, Y.; SANO, S.; MASUTANI, H.; NAKAGAWA, H. Purification and characterizatión of phytase from rat intestinal phytase. Bioch. Bioph. Acta 1075:83-87. 1991. [ Links ]
22. YANKE, L.J.; BAE, H.D.; SELINGER, L.B.; CHENG, K.J. Phytase activity of anaerobic ruminal bacteria. Microbiol. 144:1565-1573. 1998. [ Links ]
23. YOSHIO, Ô. Digestibility of phytin phosphorus and intestinal phytase in dairy cows ans sheep. Jap. J. Vet. Res. 8 (2): 162-172. 1960. [ Links ]












 uBio
uBio