Revista Científica
versión impresa ISSN 0798-2259
Rev. Cient. (Maracaibo) v.18 n.1 Maracaibo feb. 2008
Efecto del consumo de cultivo de levaduras Saccharomyces cerevisiae y/o selenio en pollos de engorde expuestos a bajos niveles de aflatoxina B1 en la dieta. 2: Morfología hepática.
Darwuin Arrieta 1*, María L. Pérez 2, Juan Hernández 3, María G. Oviedo 2, Silvio Miranda 2 y Amelia Luengo 2
1 Cátedra de Farmacología y Toxicología, Facultad de Ciencias Veterinarias, Universidad Central de Venezuela.
2 Facultad de Ciencias Veterinarias, Universidad del Zulia. Venezuela.
3 Instituto de Investigaciones Biológicas, Universidad del Zulia. Venezuela.
* Facultad de Ciencias Veterinarias/UCV. Apartado postal 4563/2101-A/ Maracay, estado Aragua, Venezuela. Móvil: 58-0414-9669918/Fax: 58-243-5506250. E-mail: darwuinarrieta@yahoo.es
RESUMEN
El presente estudio fue conducido para determinar el efecto de 0,1% de cultivo de levaduras Saccharomyces cerevisiae1026 (Sc) y/o 2mg/kg de selenio (Se) en el alimento contaminado con 0,07mg/kg (70 ppb) de aflatoxina B1 (AFB1), sobre la morfología hepática de pollos de engorde. Un total de 480 pollos Hubbar x Hubbar, machos, de un día de nacidos, fueron asignados al azar para recibir 8 tipos de dietas durante 42 días, cada una con 4 replicas de 15 pollos, estas correspondieron a los siguientes tratamientos (T) T1: grupo control que consiste en alimento comercial (AC) sin niveles detectables de aflatoxina; T2: AC + AFB1; T3: AC + Sc; T4: AC + AFB1 + Sc; T5: AC + Se; T6: AC + AFB1 + Se; T7: AC + Sc + Se; T8: AC + AFB1 + Sc + Se. La ingestión de Sc y/o Se en el alimento sin o con AFB1, no causaron lesiones macroscópicas en los hígados. Se observó un incremento (P<0,05) del peso relativo del hígado en el T4 comparado con el T1 y T3 y en los pollos del T5 y T6 (P<0,01) con relación al T1. Los T con Sc y/o Se en el alimento sin y con AFB1, presentaron una significativa frecuencia de lesiones hepatotóxicas con respecto al T1, sin embargo la combinación de Sc + Se en el alimento con AFB1 (T8), disminuyó el grado de severidad de las lesiones hepatotóxicas, en comparación al grado de hepatotoxicidad de las aves que recibieron estos aditivos por separado (T4 y T6). Estos resultados indican un aparente sinergismo de ambos aditivos para disminuir la hepatotoxicidad causada por la ingestión de alimento con AFB1.
Palabras clave: Aflatoxina, levadura, selenio, hígado, pollo.
Effect of Saccharomyces cerevisiae Culture and/or Selenium Intake on Broiler Exposed to Low Levels of Aflatoxin B1 in the Ration. 2: Hepatic Morphology.
ABSTRACT
This trial was undertaken to determine the effects of 0.1% the yeast culture Saceharonyces cerevisiae1026 (Sc) and/or 2mg/kg of selenium (Se) added to contaminated foodstuff with 0,07mg/kg (70 ppb) of aflatoxin B1 (AFB1), on hepatic morphology of broiler chickens. 480 1-day-old male Hubbar x Hubbar chickens were chosen randomly to receive 8 sorts of diets for 42 days, each diet with 4 replicates of 15 chickens. Those diets corresponded to the fallowing treatments (T): T1: control group receiving commercial food (CF) without detectable aflatoxin levels; T2: CF + AFB1; T3: CF + Sc; T4: CF + AFB1 + Sc; T5: CF + Se; T6: CF +AFB1 + Se; T7: CF + Sc + Se; T8: CF + AFB1 + Sc + Se. Neither Sc or Se added to foodstuff alone or in combination with or without AFB1, caused macroscopic lesions in liver. A relative liver weight increase was observed in T4 compared with T1 and T3 (P<0.05) and in chickens from T5 and T6 (P<0.01) compared with T1. Treatments with Sc and/or Se were shown to have a significative higher frequency of hepatotoxic lesions compared with that of T1. However, Sc + Se added together to AFB1 contaminated food (T8) diminished the hepatotoxic lesions severity grading compared to the hepatotoxcity grade found in T4 and T6. This result indicates an apparent synergistic effect of both additives as for diminishing hepatotoxicity caused by AFB1-contaminated foodstuff Ingestion.
Key words: Aflatoxin, yeasts, selenium, liver, broiler.
Recibido: 02 / 10 / 2006. Aceptado: 15 / 05 / 2007.
INTRODUCCIÓN
Las aflatoxinas son metabolitos secundarios producidos principalmente por algunas cepas de hongos del género Aspergillus, describiéndose generalmente la aflatoxina B1 como un compuesto altamente hepatóxico [24] y carcinogénico [13]. Frecuentemente se detecta en semillas o materias primas vegetales [16,22], son muy termoestables y la peletización de alimentos para animales elaborados con materias primas contaminadas no las destruyen [47], por lo que su presencia en alimentos se considera un problema de seguridad alimentaria [7,8].
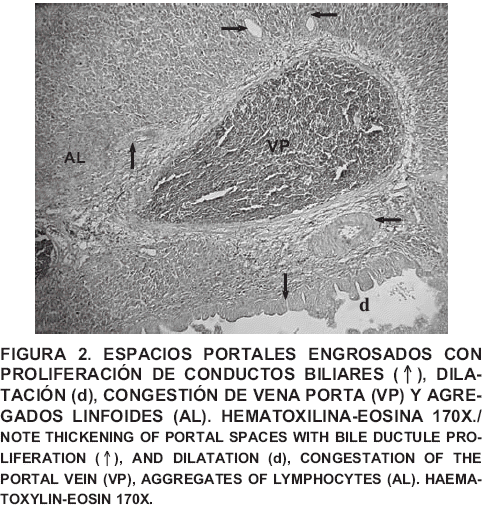
En pollos de engorde, las aflatoxicosis afectan el sistema inmunitario [35] alterando su salud e índices productivos provocando perdidas económicas importantes [24]. Frecuentemente se reportan cambios macroscópicos y microscópicos en hígado, tales como hepatomegalia, hemorragias petequiales, palidez, degeneración hidrópica, aumento de lípidos hepáticos, proliferación y dilatación de conductos biliares, fibrosis periportal [13, 15,23,40] y alteraciones funcionales [31]. Estos efectos hepatotóxicos dependen principalmente del tiempo de exposición y la dosis [24].
En pollos de engorde las investigaciones con bajas concentraciones de aflatoxina por amplios períodos de exposición, generalmente reportan efectos subclínicos o leves y no por ello menos nocivos, los cuales no suelen causar cambios macroscópicos evidentes en órganos y frecuentemente requieren ser demostrados por examen microscópico del hígado y otros tejidos [33] o pruebas muy sensibles que permitan detectar la autentica severidad de la aflatoxicosis por bajas concentraciones [12,27,31]. En la actualidad las investigaciones se han enfocado a inducir aflatoxicosis crónicas por bajas concentraciones de toxina en la dieta, debido a que estos casos se pueden presentar naturalmente en condiciones de campo [31,32,33].
En respuesta a esta situación se ha utilizado el cultivo de levaduras Saccharomyces cerevisiae1026, cuya pared celular al parecer tiene propiedades que contribuyen secuestrando la aflatoxina en el alimento produciendo resultados productivos satisfactorios en pollos de engorde [2, 10, 43]. Una situación semejante ocurre con el uso del selenio como protector de los efectos hepatotóxicos de la aflatoxina B1 en aves de corral [6]. En el país se han utilizado estos productos, pero aún existe escasa documentación de tipo clínica y patológica en el sector avícola para distinguir los verdaderos beneficios de ambos aditivos ante esta hepatotoxina.
Por dichos motivos y con el fin de contribuir en la salud y economía avícola, el presente experimento tuvo el objetivo de determinar el efecto del consumo de alimento contaminado con 0,07mg/kg de aflatoxina B1 (AFB1) durante 42 días y evaluar la eficacia de la inclusión del cultivo de levadura S. cerevisiae1026 (Sc) y/o selenio (Se) en la prevención de los posibles efectos de la AFB1 sobre la morfología hepática en pollos de engorde.
MATERIALES Y MÉTODOS
Ubicación Geográfica del Estudio y Manejo de las Aves
El experimento se realizó en el Centro Experimental de Producción Animal de la Facultad de Ciencias Veterinarias de la Universidad del Zulia (L.U.Z), ubicado en el municipio La Cañada de Urdaneta, estado Zulia, Venezuela; zona clasificada como bosque seco tropical con temperatura promedio de 30°C. Se utilizaron 480 pollitos híbridos Hubbar x Hubbar, machos, de un día de edad, seleccionados y vacunados según programa de vacunación reportado en ensayos anteriores [3]. Las aves fueron separadas y pesadas en 32 lotes de 15 pollitos cada uno y fueron distribuidos al azar en 32 corrales de tres metros cuadrados (2 x 1,5 mts) cada uno, a razón de 5 aves/m2 con divisiones de 0,70 mts de altura. Las medidas de bioseguridad y condiciones de alojamiento para la permanencia durante 42 días de las aves son descritas en la primera fase de este ensayo [4].
Experimento
El experimento se realizó con un diseño completamente al azar, donde se emplearon 8 tipos de dietas cada una con un total de 60 pollos distribuidos al azar en 4 replicas de 15 aves por corral. Estas dietas correspondieron a los siguientes tratamientos (T) T1: grupo control que consiste en alimento comercial (AC) sin aflatoxina; T2: AC + AFB1; T3: AC + Sc; T4: AC + AFB1 + Sc; T5: AC + Se; T6: AC + AFB1 + Se; T7: AC + Sc + Se; T8: AC + AFB1 + Sc + Se.
Alimento
El alimento comercial (AC) de la dieta control fue producido en una fábrica de alimento (a base de Maíz, Sorgo y Harina de soya) sin niveles detectables de aflatoxinas. Se emplearon dos tipos de alimentos balanceados: iniciador (Proteína: 23,2%; Grasa: 8,4%; Fibra: 2,8%; Energía Metabolizable EM/kg MS: 3150 Kcal y selenio: 0,1726 mg/kg) que se ofreció a las aves desde el día 1 hasta el día 21 y el alimento terminador (Proteína: 19%; Grasa: 10,5%; Fibra: 2,9%; Energía Metabolizable EM/kg MS: 3000 Kcal y selenio: 0,3027 mg/kg) desde el día 22 al día 42 del experimento. Estos se elaboraron en función a requerimientos de la línea genética de las aves y suplementados con aminoácidos, vitaminas y minerales según National Research Council [30]. Se tomaron muestras de estos alimentos por duplicado para análisis bromatológicos y nutricional según la metodología descrita en otros estudios [18].
El cultivo de levaduras utilizado estuvo compuesto por células de la cepa 1026 de levadura de S. cerevisiae, liofilizado y microencapsulado en b-glucano para protegerlo y preservar su viabilidad, según las especificaciones de los fabricante (Alltech® Corporate Headquarters, EUA.). Su inclusión se hizo a la concentración de 0,1% del alimento balanceado considerando estudios previos [9]. La fuente de selenio utilizada para suplementar fue selenito de sodio (Na2SeO3.5H2O) adicionando 2mg/kg del mismo en las respectivas dietas experimentales, según las concentraciones utilizadas en estudios anteriores [19].
El alimento balanceado fue contaminado de manera artificial con aflatoxina B1 purificada (98 %) procedente de A. flavus de Laboratorios Sigma (elaborado en Israel, catalogo Nº A6536/4). La contaminación del alimento con AFB1 y la adición de los dos aditivos (Sc y Se) se realizó mediante la metodología descrita en estudios anteriores [4], obteniendo una concentración final de 0,07mg/kg en los tratamientos contaminados. Esta concentración se basó en los resultados de experimentos con pollos de engorde sometidos a bajos niveles de aflatoxina en la dieta [3,11].
Detección de Aflatoxina en Alimento y Prueba de Recuperación de Aflatoxina
Se tomaron 4 muestras de alimento por cada tratamiento antes y después de la contaminación con AFB1. La detección se efectuó utilizando metodología descrita en previos ensayos [4], según AOAC [1]. La prueba de recuperación de AFB1 se ejecutó con métodos descritos en estudios anteriores [3].
Toma y Procesamiento de Muestras
El cálculo del tamaño de la muestra se determinó mediante la distribución no central de F según Martin [26]. Cuando se cumplieron 42 días en el ensayo, se tomaron 16 aves al azar por cada dieta experimental (4 por cada réplica), las cuales fueron separadas, pesadas y sacrificadas por dislocación cervical para hacer la necropsia y toma de muestra. La evaluación macroscópica se ejecutó mediante la observación del órgano y el cálculo del peso relativo del mismo [43]. Posteriormente se tomaron cortes de cada hígado, fijados y procesados con tinciones de Hematoxilina/Eosina para identificar lesiones por estudios histopatológicos [3].
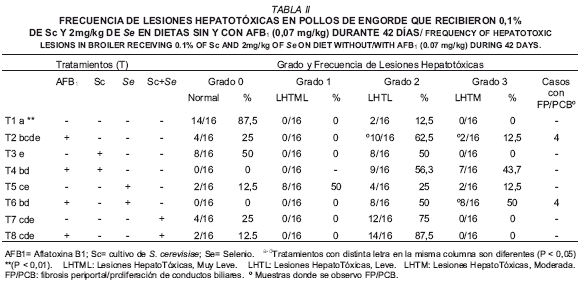
Las lesiones se clasificaron de acuerdo al grado de severidad en escala ordinal [3,33] de la siguiente manera: Grado 0= normal; Grado 1= Lesión hepatotóxica muy leve (LHTML): escasos hepatocitos vacuolados con núcleos conservados, presencia de agregados linfoides, con o sin fibrosis periportal/proliferación de conductos biliares (FP/PCB); Grado 2= Lesión hepatotóxica leve (LHTL): hepatocitos vacuolados con escasa necrosis (ausencia de núcleo), incremento de agregados linfoides, sinusoides obliterados con o sin FP/PCB; Grado 3= Lesión hepatotóxica moderado (LHTM): incremento de hepatocitos vacuolados con necrosis moderada (ausencia de núcleo), incremento de agregados linfoides, sinusoides obliterados con o sin FP/PCB.
Adicionalmente, se procedió a tomar al azar 3 pollos de cada tratamiento y se sacrificaron por dislocación cervical para extraerles el hígado, los cuales se les realizó un corte (1x1 mm aproximadamente) a cada órgano con hojilla estéril y se incluyeron de inmediato en gluteraldehído a temperatura de refrigeración. Estas muestras se procesaron [28] para observar la ultraestructura hepática mediante microscopía electrónica de transmisión.
Análisis Estadístico
La base de los datos se procesó y analizó en el paquete estadístico S.A.S [37]. En los pesos hepáticos relativos se ejecutó la prueba de t para comparar y detectar la diferencia entre los grupos. La diferencias entre tratamientos (grupo control versus el resto de los grupos experimentales) en relación a lesiones histopatológicas se realizó la prueba de Kruskal-Wallis y para detectar la diferencia entre tratamientos individúales (comparando dietas contaminadas y no contaminadas) se utilizó la prueba de la suma de los rangos de Wilcoxon.
RESULTADOS Y DISCUSIÓN
Lesiones Macroscópicas
En todos los tratamientos al hacer la necropsia los hígados de los pollos se observaron sin lesiones macroscópicas y con su vesícula biliar sin lesiones aparentes.
Pesos Relativos de los Hígados
En la TABLA I se presentan las medias de los pesos hepáticos relativos del experimento. La ingestión de AFB1 (T2), no alteró (P>0,05) el peso hepático relativo con respecto al control (T1), estos resultados coinciden con otros ensayos en pollos sometidos a dietas con bajos niveles de aflatoxina [3,33]. La media de los pesos hepáticos del grupo con Sc + AFB1 (T4) incrementó (P<0,05) con respecto al control (T1) y al grupo que consumió alimento con Sc (T3). Este incremento no se esperaba en razón de que otros autores [9,10,43], han obtenido una significativa disminución del peso hepático relativo, en pollos de engorde que recibieron Sc en dietas con mayores concentraciones de aflatoxina en comparación con las empleadas en el presente estudio.
La media de los pesos hepáticos de los tratamientos con Se en dietas sin y con AFB1 (T5 y T6), no presentaron variación significativa, indicando similitud entre estos tratamientos, pero con relación al control ambos incrementaron significativamente el peso hepático relativo (TABLA I). Estudios en pavos que recibieron dietas con aflatoxina y la misma fuente de Se (5 y 10 mg/kg de Na2SeO3) utilizada en el presente ensayo, describen un significativo incremento del peso hepático relativo [6]. En patos que recibieron dietas con aflatoxina y Se reportan que el significativo incremento del peso hepático relativo causado por el consumo de aflatoxina, disminuyó en la medida que aumentó la concentración de esta fuente de selenio (0,5, 1 y 2mg/kg de Na2SeO3) en la dieta [48].
Al comparar los tratamientos que combinan Sc + Se en una dieta sin y con AFB1 (T7 y T8), no se detectó diferencia significativa entre los pesos hepáticos relativos, pero con respecto al grupo control (T1) en ambos tratamientos (T7 y T8) incrementó significativamente el peso hepático (TABLA I). Existe poca documentación sobre la acción combinada del Sc + Se en dietas con aflatoxina sobre el peso hepático en aves, pero estos hallazgos indican que la levadura combinada con esta fuente de Se en alimento contaminado con AFB1 (T8), no provocaron variación importante del peso hepático comparado con el grupo con ambos aditivos (Sc + Se) sin AFB1 (T7).
Lesiones Microscópicas
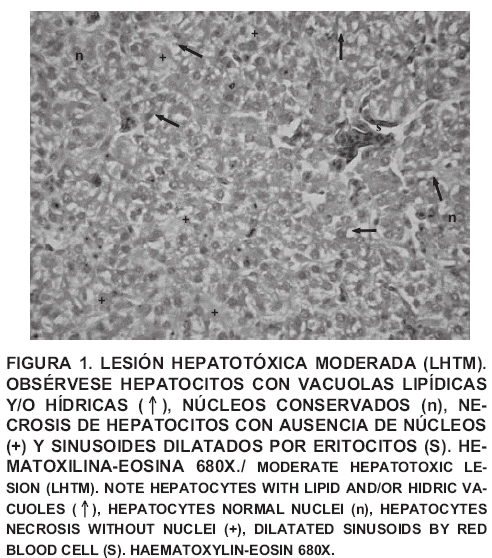
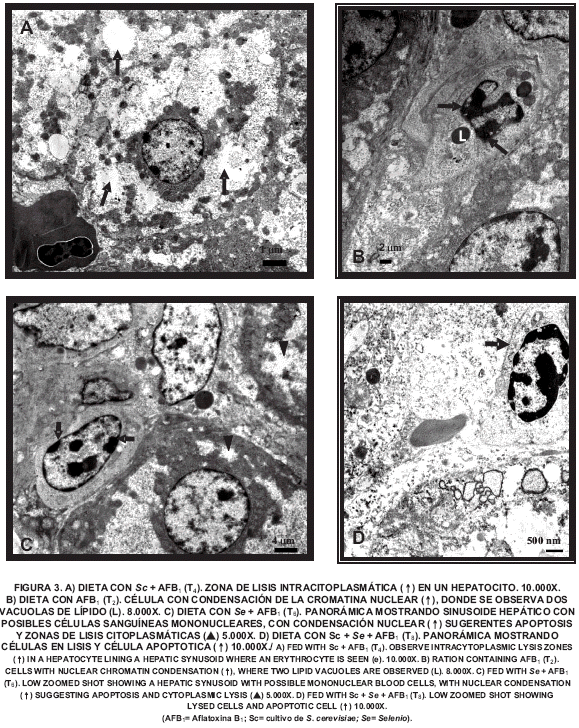
La TABLA II presenta la frecuencia de lesiones hepatotóxicas observadas en el estudio histológico. En el grupo control (T1) histológicamente las muestras se observaron normales con excepción de dos muestras que presentaron LHTL, el resto de los grupos experimentales presentaron lesiones hepatotóxicas variando su grado de severidad. En el grupo que recibió AFB1 en la dieta (T2) se observaron muestras con LHTL y LHTM (FIG. 1), identificándose en este grupo 4 casos de FP/PCB (FIG. 2). En la ultraestructura del T1 los hepatocitos presentaron núcleos con aspecto normal de la cromatina y citoplasma sin alteraciones visibles. La ultraestructura de la muestra del T2, reveló hepatocitos con vacuolas intracitoplasmaticas, alguna célula endotelial con dilatación focal del perinúcleo y células hepáticas en apoptosis (FIG. 3B).
Comparando el grupo control (T1) con el resto de los tratamientos se demostró diferencia significativa. No obstante, al hacer comparaciones entre los tratamientos con Sc en dietas sin y con AFB1 (T3 y T4) se detectó diferencia (P<0,05). La comparación entre grupos con Se en dietas sin y con AFB1 (T5 y T6) también presentaron diferencia (P<0,05). En estas comparaciones se evidenció mayor grado y frecuencia de lesiones hepatotóxicas (TABLA II) en los grupos que recibieron dietas con AFB1 (T4 y T6). Al comparar entre los tratamientos que recibieron ambos aditivos (Sc + Se) combinados en dietas sin y con AFB1 (T7 y T8), no se observaron diferencias (P>0,05) indicando similitud en la frecuencia de lesiones histopatológicas de ambos tratamientos.
La frecuencia de lesiones histopatológicas del T4, indica que la toxicidad sobre la morfología hepática producida por AFB1, al parecer no fue contrarrestada totalmente por la inclusión de 0,1% de Sc en la dieta contaminada. En la ultraestructura del tratamiento con Sc en el alimento (T3), se observaron algunos hepatocitos con vacuolas lipídicas intracitoplasmáticas, mientras que en la muestra del T4 (FIG. 3A), principalmente se observó hepatocitos con varias zonas de lisis intracitoplasmáticas. A pesar de la mayor severidad y frecuencia de lesiones histopatológicas observadas en el T4 (TABLA II), hay que hacer notar que este grupo no presentó cambios histopatológicos de FP/PCB, que ocurren frecuentemente en hígados afectados por aflatoxicosis (Fig. 2) los cuales si se manifestaron en la dieta con AFB1 (T2), lo que sugiere un posible efecto protector de esta levadura contra AFB1. Se han reportado efectos atenuantes del Sc sobre las lesiones anatomopatológicas hepáticas en pollos de engorde y patos [9], causadas por elevados niveles de aflatoxina en la dieta en comparación al nivel utilizado en el presente estudio.
Sin embargo, los hígados del grupo con Sc + AFB1 (T4), presentaron un mayor grado de lesión histopatológica (TABLA II) que no se observó en la aflatoxicosis experimental (T2), ni en aves que sólo recibieron dietas con Sc (T3), al parecer esto indica un posible efecto de Sc para inducir hepatopatía independientemente de la hepatotoxicidad (FP/PCB) que provocó los bajos niveles de AFB1 en el alimento. Los mecanismos de los componentes de la pared del Sc para contrarrestar la toxicidad de la aflatoxina aún no están claros [2,9]. Otros estudios sugieren que está levadura esta asociada en la etiología de enfermedades hepáticas autoinmunes en humanos [29,46]. Estos reportes podrían sugerir una posible explicación al incremento (P<0,05) del peso hepático relativo del grupo con Sc + AFB1 (T4), con respecto al T1. Asimismo también explicaría el mayor grado y frecuencia de lesiones hepatotóxicas de este grupo (T4), con respecto al que sólo recibió AFB1 en la dieta (T2).
La comparación de las frecuencias y grados de lesiones histopatológicas entre las aves que reciben Se en dietas sin y con AFB1 (T5 y T6), revelan diferencia (P<0,05) entre los mismos y permite ver en el ámbito microscópico, que la inclusión de esta fuente de selenio (Na2SeO3) en la dieta con AFB1 no disminuyó el efecto hepatotóxico de la AFB1, evidenciándose 4 casos con FP/PCB (TABLA II). La microscopia electrónica del T5 y T6 reveló hepatocitos con lisis celular y células mononucleares con signos de apoptosis, siendo mas frecuentes estos cambios en el T6 (FIG. 3C).
Estos resultados difieren de otros ensayos [48] en patos, donde la suplementación con Se en forma de Na2SeO3 (0,5, 1 y 2 mg/kg) redujo el 75% de las lesiones pre-neoplásicas hepáticas, causadas por consumo de alimento con aflatoxina. Igualmente en pavos que recibieron dietas con Se (0,2, 2 y 4 mg/kg de Na2SeO3), se evidenció que este promueve la destoxificación de la AFB1, sugiriendo que la suplementación con esta fuente de selenio contribuye con la eliminación de aflatoxina [19]. En ratas el Na2SeO3 inhibió uniones y aducciones ADN-Aflatoxina B1 [39]. Sin embargo, en otros reportes se discute que las aflatoxicosis experimentales previamente descritas en aves y mamíferos, presentaron una respuesta positiva en la mayoría de los casos cuando se suplementaron con esta fuente de Se (Na2SeO3), pero se considera que sus concentraciones fueron altas excediendo los requerimientos fisiológicos con limites tóxicos en algunos casos [44].
En el estudio histopatológico los grupos con Sc + Se en dietas sin y con AFB1 (T7 y T8), no presentaron diferencia entre ellos (P>0,05). En la ultraestructura de T7 y T8 se observó algunos hepatocitos con lisis celular y células mononucleares apoptóticas en los sinusoides, con mayor grado de lisis citoplasmática en el T8 (FIG. 3D), probablemente causado por la inclusión de AFB1 en esta dieta. Sin embargo, a pesar de la frecuencia (P<0,01) de lesiones del T8 con respecto al control, hay que destacar que su grado de severidad histopatologico, no fue mayor que en los grupos que incluyen ambos aditivos por separado en dietas con AFB1 (T4 y T6), asimismo este tratamiento (T8) no presentó FP/PCB, lo cual se reporta frecuentemente en aflatoxicosis [13,15]. Estos hallazgos indican menor grado de hepatotoxicidad cuando ambos aditivos se incluyen en dietas con AFB1.
Los mecanismos de acción de los componentes de la pared del Sc para disminuir los efectos tóxicos de las aflatoxinas, aún no están claros [2, 9, 36] y existen escasas referencias sobre la interacción de estos dos aditivos para contrarrestar la toxicidad de la AFB1 sobre la morfología hepática. Otros autores mencionan que las propiedades pro-oxidantes de fuentes de Se como el selenito de sodio (Na2SeO3) [42], también pueden tener actividad anticancerígena, antibacterial y antifungal [41].
Esta información permite sugerir que si la levadura de S. cerevisiae es un microorganismo incluido en el grupo de los hongos y considerando que el Na2SeO3 pudo tener algún efecto antimicrobiano para la misma, es probable que las células liofilizadas de esta levadura en el alimento pudieran haberse afectado por esta propiedad del Na2SeO3, tomando en cuenta que este alimento tenía un bajo porcentaje de humedad (10 a 11%), lo cual favorece la rápida difusión y alta concentración de oxigeno en el alimento [14] y consecuentemente la actividad pro-oxidante del Na2SeO3 que contenía el mismo [42], afectando probablemente la estructura de la levadura limitando su actividad y viabilidad en el tracto gastrointestinal del ave.
La hipótesis descrita anteriormente, sólo estaría dejando la combinación experimental que se ejecutó en el ensayo con Se + AFB1 en la dieta sin la levadura (T6), la cual presentó un mayor grado de lesión y se observó 4 casos con FP/PCB (TABLA II), pero considerando la propiedad secuestrante o ligante de aflatoxina que algunos autores le atribuyen a la pared celular del S. cerevisiae [2, 36, 49], es probable suponer que si la levadura fue afectada por el Na2SeO3, las propiedades secuestrantes de su pared pudieran haberse conservado, aún cuando no estuviese viable en el tracto gastrointestinal de las aves que recibieron ambos aditivos (Sc + Se) en la dieta con AFB1 (T8). Estas inferencias podrían explicar el menor grado de severidad histopatológica observado en los hígados del T8, con respecto a los tratamientos que incluyen los 2 aditivos (Sc y Se) por separado en la dieta con AFB1 (T4 y T6).
Adicionalmente, la peroxidación lipídica, genotoxicidad [38] y alteraciones en el balance antioxidante/pro-oxidante por aumento o disminución de la actividad de enzimas antioxidantes [45], son importantes efectos de la aflatoxina en el hígado, igualmente al Se sé le atribuyen efectos protectores contra AFB1 al contribuir con el balance antioxidante/pro-oxidante como cofactor de la glutatión peroxidasa [5,19,34] y por actuar en conjunto con la vitamina E [25]. Estas propiedades del Se han sido motivo para utilizarlo en la disminución del estrés oxidativo inducido por la aflatoxicosis [17], pero otros ensayos indican que algunas fuentes de Se poseen efecto pro-oxidante en altos niveles en presencia de O2 incrementando la producción de formas reactivas de oxígeno, excediendo las defensas antioxidantes hepáticas pudiendo provocar citotoxicidad en aves, tanto con Se en forma de Na2SeO3 [42], como en forma de selenio-levaduras [20,21]
Esta información podría explicar la diferencia (P<0,05) histopatológica (TABLA II), entre los pollos que recibieron Se (Na2SeO3) en dietas sin/con AFB1 (T5 y T6) y también explicaría el significativo incremento del peso hepático relativo con respecto al control (TABLA I), en los pollos de todos aquellos tratamientos que recibieron esta fuente de Se (T5, T6, T7, T8) en la dieta. Asimismo, podría ser una de las posibles causas del significativo descenso en la actividad enzimática sérica (aspartatoaminotransferasa) con respecto al grupo control, en aves que recibieron la combinación Sc + Se en dietas sin y con AFB1 (T7 y T8), cuyos valores fueron previamente reportados [4].
La evaluación de la morfología hepática en este ensayo, reveló un significativo incremento en el peso relativo hepático en los tratamientos que incluyeron Se (T5, T6, T7 y T8) y Sc + AFB1 (T4), con frecuentes (P<0,05) lesiones microscópicas que variaron su grado de severidad en los grupos experimentales. Sin embargo, a pesar de la significancía estadística de estos resultados, hay que destacar que ensayos ejecutados simultáneamente con este estudio demostraron que las aves de estos tratamientos no presentaron diferencia significativas sobre índices productivos (peso, conversión de alimento, ganancia de peso corporal) [18], actividad enzimática sérica (alanitoaminotransferasa) y concentración de proteínas séricas a los 42 días [4].
Estos hallazgos indican que las lesiones hepáticas observadas en estas aves, al parecer tuvieron un efecto muy sutil en este órgano, lo que aparentemente no causó variación importante en el desempeño zootécnico de los pollos de engorde. Sin embargo, estos resultados también confirman que no es conveniente considerar este nivel de AFB1 (0,07 mg/kg) como inocuo para pollos de engorde, debido a que estas alteraciones hepáticas aumentarían la susceptibilidad de las aves, en presencia de factores negativos de origen alimentario y/o ambiental que contribuirían a incrementar la toxicidad de la AFB1 ingerida en la dieta, incidiendo con mayores consecuencias sobre la salud de las aves y su parámetros productivos.
CONCLUSIONES Y RECOMENDACIONES
La hepatotoxicidad causada por bajos niveles (0,07 mg/kg) de AFB1, en las aves que recibieron cultivo de levaduras S. cerevisiae1026 + Se (Na2SeO3) en la dieta contaminada, fue menos severa en comparación con las aves de aquellos tratamientos que incluyen ambos aditivos por separado en la dieta contaminada. Estos resultados indican un aparente sinergismo de ambos aditivos para disminuir la hepatotoxicidad (lesiones histopatológicas) causada por la ingestión de alimento con AFB1.
Es recomendable comparar los efectos entre la inclusión dietética del cultivo de levaduras S. cerevisiae1026 y los derivados de su pared celular, así como, entre el selenito de sodio (Na2SeO3) y otras fuentes de selenio utilizadas en la nutrición avícola, evaluando la morfología de varios órganos de pollos de engorde que consuman dietas con bajos niveles de AFB1 y determinado los niveles de residuos de dicha toxina en los tejidos de estas aves.
AGRADECIMIENTO
A los Institutos de Investigaciones Biológicas Dres. Orlando Castejon y Haydee V. Castejon / Investigaciones Clínicas Dr. Americo Negrette ambos de la Facultad de Medicina de LUZ, al laboratorio de Farmacología y Toxicología de la Facultad de Ciencias Veterinarias de la Universidad Central de Venezuela y al CONDES-LUZ, por su apoyo en esta investigación. Igualmente los autores queremos agradecer a la entidad Laboratorio de Diagnóstico Veterinario en Maracaibo, estado Zulia, por realizar la descripción histopatológica en este ensayo.
REFERENCIAS BIBLIOGRÁFICAS
1. ASSOCIATION OF OFFICIAL ANALYTICAL CHEMISTS (AOAC). Official methods of analysis. food and drug administration. In: Natural Toxins. M. W. Trucksess, Ed. Chapter 49. 38-40pp. 2000. [ Links ]
2. ARAVIND, K.L.; PATIL, V.S.; DEVEGOWDA, G.; UMAKANTHA, B.; GANPULE, S.P. Efficacy of esterified glucomannan to counteract mycotoxicosis in naturally contaminated feed on performance and serum biochemical and hematological parameters in broilers. Poult Sci. 82(4):571-6. 2003. [ Links ]
3. ARRIETA, D.M.; PÉREZ, A.M.; GÓMEZ, C.; MOLERO, G.; NOVOA, E.; RINCÓN, H.; ASCANIO, E. Efecto del alimento contaminado con aflatoxina B1 (0,07 mg/kg) sobre la morfología hepática y actividad enzimática sérica (AST y ALT) en pollos de engorde. Rev Científ FCV-LUZ. XVI(1):39-47. 2006. [ Links ]
4. ARRIETA-MENDOZA, D.; PÉREZ, M.L.; GÓMEZ, C.; ASCANIO, E.; IRAUSQUIN, B.; MOLERO, G. Efecto del consumo de cultivo de levadura Saccharomyces cerevisiae1026 y/o selenio en pollos de engorde expuestos a bajos niveles de aflatoxina B1 en la dieta. 1: Valores de proteínas séricas y actividad enzimática en suero. Rev Científ FCV-LUZ. XVI(6):613-621. 2006. [ Links ]
5. BARTHOLOMEW, A.; LATSHAW, D.; SWAYNE, D.E. Changes in blood chemistry, hematology, and histology caused by a selenium/vitamin E deficiency and recovery in chicks. Biolog Trace Elem Res. 62:7-16. 1998. [ Links ]
6. BURGUERA, J.A.; EDDS, G.T.; OSUNA, O. Influence of selenium on aflatoxin B1 or crotalaria toxicity in turkey poults. Am J of Vet Res. 44(9):1714 -1717. 1983. [ Links ]
7. CALVALHEIRO, A.C.L. Aflatoxinas y Aflatoxicosis: Revisión. Rev. Avic. 27:77-81. 1983. [ Links ]
8. COMISIÓN VENEZOLANA DE NORMAS INDUSTRIALES (COVENIN). Normas Venezolana Alimento Completo para Aves. Ministerio de Fomento. Método de Ensayo para Determinar Aflatoxina (1603). Caracas, Venezuela 1181-83pp. 1980. [ Links ]
9. DEVEGOWDA, G.; ARAVIND, B.I.R.; RAJENDRA, K.; MORTON, M.G.; BABURATHNA, A.; SUDARSHAN, C.A. biological approach to counteract aflatoxicosis in broiler chickens and ducklings by the use of Saccharomyces cerevisiae cultures added to feed. In: Proc. Alltechs 10th Annual Symposium on Biotechnology in the Feed Industry (Eds: T.P. Lyons y K. A. Jacques). Nottingham University Press, Loughborough, Leic Uk. 235-245pp. 1994. [ Links ]
10. DEVEGOWDA, G.; ARAVIND, B.I.R.; MORTON, M.G. Inmunosupression in poultry caused by aflatoxins and its alleviation by Saccharomyces cerevisiae (Yea-Sacc1026), and mannanoligosaccharides (Micosorb). Biotechnology in the Feed Industry. Nottingham University Press. Nottingham, United Kingdom: 205-215pp. 1997. [ Links ]
11. DOERR, J.A.; HUFF, W.E.; WABECK, C.J.; CHALOUPKA, G.W.; MAY, J.D.; MERKLEY, J.W. Effects of low level chronic aflatoxicosis in broiler chickens. Poult Sci 62(10):1971-7. 1983. [ Links ]
12. ESPADA, Y.; DOMINGO, M.; GÓMEZ, J.; CALVO, M.A. Pathological lesions following an experimental intoxication with aflatoxin B1 in broiler chickens. Res Vet Sci. 53:275-279. 1992. [ Links ]
13. FAO/OMS. Contaminantes: aflatoxinas. En: El 49vo Informe Técnico del Comité Mixto (FAO/OMS) de Expertos en Aditivos Alimentarios. OMS-Ginebra. 73-87pp. 1999. [ Links ]
14. FENNEMA, O.R. Relative vapor pressure and food stability. En: Food Chemistry. 3ra Ed. Marcel Dekker Inc, New York. 52-54pp. 1996. [ Links ]
15. FERNÁNDEZ, A.T.; VERDE, T.; GASCÓN, M.; RAMOS, J.; GÓMEZ, J.; LUCO, D.; CHAVEZ, G. Variations of clinical biochemical parameters of laying hens and broiler chicken fed aflatoxin-containing feed. Avian Pathol. 23:37-47. 1994. [ Links ]
16. FERNÁNDEZ, G.; NEGRÓN, G.; ISEA, G.; SÁNCHEZ, E. Reporte de análisis cuantitativo de aflatoxinas por el método de ELISA en muestras de materias primas de alimento balanceado para aves provenientes de una planta ubicada en el municipio Mara del estado Zulia, Venezuela. Rev Científ FCV-LUZ. X (1):63-68. 2000. [ Links ]
17. GALVANO, F.; PIVA, A.; RITIENI, A.; GALVANO, G. Dietary strategies to counteract the effects of mycotoxins: a review. J. of Food Prot. 64: 120-131. 2001. [ Links ]
18. GÓMEZ, C.C. Influencia del cultivo de levaduras Saccharomyces cerevisiae1026 y selenio sobre la toxicidad de la aflatoxina B1 en pollos de engorde. La Universidad del Zulia, Facultad de Ciencias Veterinarias, División de Postgrado. (Trabajo de Grado). 25-59pp. 2003. [ Links ]
19. GREGORY, J.F. 3RD; EDDS, G.T. Effect of dietary selenium on the metabolism of aflatoxin B1 in turkeys. Food Chem Toxicol. 22(8):637-42. 1984. [ Links ]
20. HOFFMAN, D.J. Role of selenium toxicity and oxidative stress in aquatic birds. Aquat Toxicol. 57(1-2):11-26. 2002. [ Links ]
21. HOFFMAN, D.J.; HEINZ, G.H.; LECAPTAIN, L.J.; EISEMANN, J.D.; PENDLETON, G.W. Toxicity and oxidative stress of different forms of organic selenium and dietary protein in mallard ducklings. Arch Environ Contam Toxicol. 31(1):120-7. 1996. [ Links ]
22. HUA, SS.; BAKER, JL.; ESPIRITU, MF. Interactions of saprophytic yeasts with a nor mutant Aspergillus flavus. Appl Environ Microbiol. 65(6):2738-3740. 1999. [ Links ]
23. LEDOUX, D.R.; ROTTIMGHAUS, G.E.; BERMUDEZ, A.J.; ALONSO-DEOLT, M. Efficacy of a hydrated sodium calcium aluminosilicate to ameliorate the toxic effects of aflatoxin in broiler chickens. Poult Sci. 78:204-210. 1999. [ Links ]
24. LEESON, S.; DIAZ, G.J.; SUMMERS, J.D. Aflatoxins. In: Poultry Metabolic Disorders and Mycotoxins. University Books. Guelph, Ontario, Canada. 249-298pp. 1995. [ Links ]
25. LEESON, S.; SUMMERS, J.D. Minerals. In: Nutrition of the Chicken. University Book. Guelph, Ontario, Canada. 399-408pp. 2001. [ Links ]
26. MARTIN, F.G. Statistical Design and Analysis. University of Florida, Copy Center. UF. 2-4 a 2-7pp. 1995. [ Links ]
27. MAURICE, D.V.; BODINE, A.B.; REHRER, N.J. Metabolic effects of low aflatoxin B1 levels on broiler chicks. Appl Environ Microbiol 45(3):980-4. 1983. [ Links ]
28. MOSQUERA, J. A.; HERNANDEZ, J. P.; VALERO, N.; ESPINA, L. M.; AÑEZ, G. Ultrastructural studies on dengue virus type 2 infection of cultured human monocytes. Virol J. 2:26. 2005. [ Links ]
29. MURATORI, P.; MURATORI, L.; GUIDI, M.; MACCARIELLO, S.; PAPPAS, G.; FERRARI, R.; GIONCHETTI, P.; CAMPIERI, M.; BIANCHI, F.B. Anti- Saccharomyces cerevisiae antibodies (ASCA) and autoimmune liver diseases. Clin Exp Immunol. 132:473-476. 2003. [ Links ]
30. NATIONAL RESEARCH COUNCIL (NRC). Nutrient Requirements of Poultry. 9th Ed. National Academy Press, Washington D.C. 11-15pp.1994. [ Links ]
31. OGUZ, H.; KURTOGLU, F.; KURTOGLU, V.; BIRDANE, Y.O. Evaluation of biochemical characters of broiler chickens during dietary aflatoxin (50 and 100 ppb) and clinoptilolite exposure. Res Vet Sci. 73(1):101-3. 2002. [ Links ]
32. OGUZ, H.; HADIMLI, H.H.; KURTOGLU, V.; ERGANIS, O. Evaluation of humoral immunity of broilers during chronic aflatoxin (50 and 100 ppb) and clinoptilolite exposure. Rev Med Vet 154:483–486. 2003. [ Links ]
33. ORTATATLI, M.; OGUZ, H.; HATIPOGLU, F.; KARAMAN, M. Evaluation of pathological changes in broilers during chronic aflatoxin (50 and 100 ppb) and clinoptilolite exposure. Res Vet Sci. 78(1):61-8. 2005. [ Links ]
34. PATON, D.N.; CANTOR, H.A.; PESCATORE, J.A.; FORD, J.M.; SMITH, A.C. Absorption of selenium by developing chick embryos during incubation. In: Proc. Alltechs 18th Annual Symposium on Nutritional Biotechnology in the Feed and Food Industries (Eds: T.P. Lyons y K. A. Jacques). Nottingham University Press. Nottingham, United Kingdom. Inglaterra.108-120pp. 2002. [ Links ]
35. QURESHI, M.A.; BRAKE, J.; HAMILTON, P.B.; HAGLER, W.M.; NESHEIM, S. Dietary exposure of broiler breeders to aflatoxin results in immune dysfunction in progeny chicken. Poult Sci 77(6):812-9. 1998. [ Links ]
36. RAJU, M.V.L.N.; DEVEGOWDA, G. Influence of esterified-glucomannan on performance and organ morphology serum biochemistry and Hematology in broilers exposed to individual and combined mycotoxicosis (Aflatoxin, Ochratoxin and T-2 toxin). Br Poult Sci. 4:640-650. 2000. [ Links ]
37. STATISTICAL ANÁLISIS SYSTEM ISTITUTE (SAS). Users Guide. Version 6,12. Cary, NC. 1994. [ Links ]
38. SHEN, H.M.; SHI, C.Y.; LEE, H.P.; ONG, C.N. Aflatoxin B1-induced lipid peroxidation in rat liver. Toxicol Appl Pharmacol. 127: 145-150. 1994. [ Links ]
39. SHI, C.Y.; CHUA, S.C.; LEE, H.P.; ONG, C.N. Inhibition of aflatoxin B1-DNA binding and adduct formation by selenium in rats. Cancer Lett. 82 (2):203-8. 1994. [ Links ]
40. SMITH, JW.; HAMILTON, PB. Aflatoxicosis in the broiler chicken. Poult Sci. 49(1): 207-215. 1970. [ Links ]
41. SPALLHOLZ, J.E. Free radical generation by selenium compounds and their prooxidant toxicity. Biomed Environ Sci. 10(2-3):260-70. 1997. [ Links ]
42. SPALLHOLZ, J.E.; HOFFMAN, D.J. Selenium toxicity: cause and effects in aquatic birds. Aquat Toxicol. 57(1-2):27-37. 2002. [ Links ]
43. STANLEY, VG.; OJO, R.; WOLDENSENBET, S.; HUTCHINSON, DH. The use of Saccharomyces cerevisiae to suppress the effects of aflatoxicosis in broiler chicks. Poult. Sci. 72: 1867-1872. 1993. [ Links ]
44. SURAI, F.P. Organic selenium: benefits to animals and humans, a biochemists view. In: Biotechnology in the Feed Industries, Proc. Alltechs 16th Annual Symposium (Eds: T.P. Lyons y K. A. Jacques). Nottingham University Press. Nottingham, United Kingdom. Inglaterra. 205-260pp. 2000. [ Links ]
45. SURAI, F.P.; DVORSKA, E.J.; SPARKS, H.N.; JACQUES, A.K. Impact of mycotoxins on the bodys antioxidant defense. In: Proc. Alltechs 18th Annual Symposium on Nutritional Biotechnology in the Feed and Food Industries (Ed: T.P. Lyons y K. A. Jacques). Nottingham, United Kingdom. Inglaterra.131-141pp. 2002. [ Links ]
46. TEOH, K L.; MACKAY, I R.; ROWLEY, M J.; FUSSEY, S P. enzyme Inhibitory autoantibodies to pyruvate dehydrogenase complex in primary biliary cirrhosis differ for mammalian, yeast and bacterial enzymes: implications for molecular mimicry. Hepatol. 19(4):1029-1033. 1994. [ Links ]
47. VAAMONDE, G. Micotoxinas. En: Toxicología de los Alimentos (Ed. A. A. Silvestre), 2da Ed. Editorial Hemisferio Sur. Argentina. 153-193pp. 1996. [ Links ]
48. YU, SY.; ZHU, YJ.; LI, WG. Protective role of selenium against hepatitis B Virus and primary liver cancer in Qidong. Biol Trace Elem Res. 56(1):117-24. 1997. [ Links ]
49. ZAGHINI, A.; RONCADA, P.; ANFOSSI, P.; RIZZI, L. Aflatoxin B1 oral administration to laying hens: effects on hepatic MFO activities and efficacy of a zeolite to prevent aflatoxicosis. Rev. Med. Vet. 6:668. 1998. [ Links ]












 uBio
uBio