Revista Científica
versión impresa ISSN 0798-2259
Rev. Cient. (Maracaibo) v.18 n.3 Maracaibo jun. 2008
Estudio de Infección Sistémica por Herpesvirus Complicada con Cryptosporidium spp., en un Delfín Manchado del Atlántico (Stenella frontalis. Cuvier, 1829).
Gabriela Arias León 1,2, Miguel A. Mariani di Lena 1,3, Luis Cornejo Uzcátegui 1,4, Víctor Bermúdez García 5 y Oneyda J. Ramírez Medina5
1 Centro de Investigación de Cetáceos, Capítulo Centro-Occidente. Venezuela.
2 Médica Veterinaria F.C.V.-U.C.V.
3 Estudiante Facultad de Agronomía.
4 Estudiante Postgrado de Botánica, Facultad de Agronomía.
5 Profesores Cátedra de Patología, Facultad de Ciencias Veterinarias. Universidad Central de Venezuela, Núcleo Maracay, Estado Aragua. Apartado Postal Nº 4563. Maracay 2101. Venezuela. E-mail: cic-c-o@cantv.net . Telf.: 0416-7054639, Fax: 58 212-9614464.
RESUMEN
El presente estudio se realizó a partir de un caso de varamiento de delfín Stenella frontalis, hembra cría, reportado el 30/07/02 para Playa Dorada, Boca de Aroa, estado Falcón, Venezuela. Se mantuvo en una instalación marina por un período de tres días, tiempo durante el cual se le realizaron evaluaciones periódicas no invasivas y toma de datos morfométricos. Murió el 01/08/02 por paro cardiopulmonar. Se practicó estudio macroscópico postmortem, preservándose muestras en formaldehído al 10% para estudios histopatológicos de los siguientes órganos: corazón, pulmón, estómago, intestino grueso, hígado, riñon y lesiones de piel con capa grasa, fueron procesados en el laboratorio de Anatomía Patológica de la Universidad Central de Venezuela. Por los resultados obtenidos en el estudio microscópico se determinó que el individuo presentó una infección sistémica producto de una infección primaria por Herpesvirus spp., concominante con parasitismo secundario por Cryptosporidium spp., cuadro clínico que se vio complicado por las condiciones de estrés a las que se encontró sometido, producto del varamiento. Según la revisión bibliográfica realizada, la parasitosis por Cryptosporidium spp. no aparece reportada en Venezuela para el orden: Cetácea, lo cual se evidencia en la información recopilada acerca de parásitos estudiados para dicho orden. La osamenta se encuentra en Museo Científico de la Estación Biológica. Rancho Grande - MARNR.
Palabras clave: Delfín, S. frontalis, Herpesvirus, Cryptosporidium.
Study of Systemic Infection by Herpesvirus Complicated With Cryptosporidium spp. in a Gulf Stream Spotted Dolphin (Stenella frontalis. Cuvier, 1829).
ABSTRACT
The present study was made, in the event of a young female dolphin of the specie Stenella frontalis, that was found stranded in Playa Dorada, in Boca de Aroa, in the Falcón State, the 07/30/02, in Venezuela. She was kept in a facility for a period of three days, during this period of time, she was evaluated periodically whit not invasive technique, and morphometry data recollection. She died the 08/01/02 due to respiratory arrest, which caused a cardiac arrest. A macroscopic postmortem study was made, taking samples and keeping them in formaldehyde 10% for histopathology study of the following organs: heart, lungs, stomach, large intestine, liver, kidney and lesions of the skin with a fat layer, they were processed in the Pathologic Anatomy laboratory of the Universidad Central de Venezuela. Because of the results of the microscopic study, it was determined that the dolphin presented a systemic infection, because of a primary infection by Herpesvirus spp., related with a secondary infection by Cryptosporidium spp., which was complicated with stress due to the beaching. The bibliographic revue reports that the parasitosis by Cryptosporidium spp. is not present to Venezuela in the Cetacean order, according to the compiled information about the studied parasites for this order. The skeleton is currently in the Scientific Museum of the Biological Station Rancho Grande - MARNR.
Key words: Dolphin, S. frontalis, Herpesvirus, Cryptosporidium.
Recibido: 11 / 05 / 2006. Aceptado: 22 / 05 / 2007.
INTRODUCCIÒN
La aparición en las costas venezolanas de cetáceos varados, es una oportunidad única para realizar estudios científicos sobre estas especies. Los varamientos han ocurrido de forma natural a través del tiempo, sin descartar que también existan efectos antrópicos implicados en ello [10], pero en ambos casos se deben realizar todos los esfuerzos necesarios para tratar de devolver el animal a su medio natural, el mar. Pero, si los animales ya están muertos o mueren durante el rescate, la toma de las muestras biológicas debe ser obligatoria, a fin de determinar la causa de muerte del espécimen, el posible estado de salud de la población cercana al (los) individuo(s) y los posibles agentes etiológicos causantes de enfermedades en los mismos [10]. Todos los datos obtenidos a partir de la actividad de rescate, estudios vivos y postmortem del (los) ejemplar(es) permiten establecer registros del estatus sanitario de los ecosistemas nacionales, en este caso el marino, así como el nivel de salud del que gozan las poblaciones de cetáceos, los posibles agentes contaminantes de las aguas y su efecto en estas especies y en las poblaciones de animales asociados, tanto a su alimentación como al mismo sistema ecológico al que pertenecen y/o se distribuyen.
Los cetáceos son mamíferos que pueden vivir en cuerpos de agua dulce o mares según la especie a la que pertenezcan, lo cual crea interacción con todos los elementos que rodean a especies animales, tanto de vida silvestre como doméstica, así como la exposición directa o no a sus enfermedades, ya que al igual que los mamíferos terrestres, poseen sistemas orgánicos estructurados morfológicamente similares, con algunas variantes de organización, conformación, tamaño y ultra estructura orgánica específica de las adaptaciones a su medio de vida. Por esta razón, presentan patologías de etiología parasitaria, bacteriana, virológica, fúngica y neoplásica entre otras [8, 16, 19], en la misma medida a los animales de vida terrestre, e inclusive, muchas de estas enfermedades están asociadas a infecciones de tipo zoonóticas y sus variantes (zoonosis, ciclozoonosis, metazoonosis, saprozoonosis, amphixenosis, etc.) [20].
La especie Stenella frontalis, mejor conocida como Delfín manchado del Atlántico, se encuentra ampliamente distribuida en todas las costas de Venezuela, mantiene hábitos principalmente oceánicos y costeros, su movimiento y agrupación familiar están relacionados con sus hábitos alimenticios (peces, calamares y otros invertebrados). Vive en grupos, cuya cantidad puede variar según las costumbres de distribución, reportándose desde 5-15 hasta 50 individuos para poblaciones cercanas a las costas y, de más de 50 individuos para poblaciones oceánicas [2, 13]. Debido a esto, es poco probable que una cría o juvenil de esta especie supere con éxito un episodio de varamiento, lo cual depende en gran medida a las razones por las cuales el individuo haya perdido al grupo familiar y, al estado de salud del mismo.
Puesto que el sistema inmunológico juega un papel fundamental en la protección frente a las infecciones, la alteración de sus componentes por los virus puede exacerbar la gravedad de la infección o predisponer a superinfecciones por otros agentes víricos y no víricos. En las infecciones víricas pueden presentarse una inmunodeficiencia adquirida específica y una inmunosupresión generalizada. Muchos virus son capaces de replicarse en los macrófagos y se ha demostrado que otros se replican en las células T, específicamente células T activadas. Algunos Herpesvirus se replican improductivamente en las células B, transformándolas y alterando sus funciones. Igualmente, cuando el sistema inmune está inhibido por factores endógenos o exógenos se pueden reactivar infecciones latentes por Herpesvirus, Adenovirus o Parvovirus [7].
Son muchos los casos en los cuales se han descrito infecciones por Herpesvirus spp. en cetáceos, siendo su principal vía de transmisión el contacto directo entre animales, y se ha demostrado como partículas de tipo herpesviral en lesiones de piel principalmente, así como en sistema respiratorio (neumonía intersticial en focos) e infecciones sistémicas. Las lesiones herpéticas en piel de delfines se describen como generalmente circulares, de hasta 2 cm. de diámetro, y pueden parecer levemente deprimidas con un aspecto blanquecino o estar elevadas y proliferantes. Los centros de algunas lesiones están necróticos o pueden contener crecimientos verrugosos [8].
El Cryptosporidium es un protozoario de distribución cosmopólita y comprende organismos que se desarrollan y multiplican en las células epiteliales de los sistemas digestivo y respiratorio de vertebrados, habiéndose descrito infecciones en más de 170 especies de vertebrados [3]. Se encuentra clasificado como: phylum: Apicomplexa, clase: Sporozoa, subclase: Coccidia, orden: Eucoccidiida, suborden: Eimeriina, familia: Cryptosporidiidae y, hasta el momento y según su especificidad de hospedador, morfología de los ooquistes y lugar de infección, se consideran seis (6) especies dentro del género Cryptosporidium: C. nasorum (peces), C. serpentis (reptiles), C. meleagridis (intestino de aves), C. baileyi (tráquea, bolsa de Fabricio y cloaca de aves), C. muris (estómago de mamíferos; descrita principalmente para el ratón) y C. parvum (intestino de mamíferos) [3]. Sin embargo, existe bibliografía que se refiere al parásito como no especie-específico, que puede transmitirse de una especie animal a otra, por lo cual se le considera Cryptosporidium como un género de una sola especie [1]. Se ha reportado para especies nativas del océano, especialmente para cetáceos de localidades extranjeras, lo cual confirma la factibilidad del paso del protozoario entre especies, sin importar las condiciones ambientales [6].
El Cryptosporidium parvum cuenta con fases reproductivas sexuales y asexuales, tales como: ooquiste, esporozoito, trofozoito, merontes, merozoito, microgamonte y macrogamonte. Los ooquistes son redondeados y miden 4,5 - 5 mm., pueden ser demostrados en intestino delgado y grueso, a través de práctica de reacción en cadena de la polimerasa (P.C.R.) en tejido fresco (debidamente conservado) y uso de microscopio fluorescente, adyacente a las lesiones, considerándose como responsable en cuadros diarreicos de mamíferos. Según los estudios, esta patología causa alta morbilidad (casi 100%) y la mortalidad es dependiente del nivel de gravedad de la enfermedad, la edad del hospedador y la presencia de otros patógenos, pudiendo ser autolimitante en individuos inmunocompetentes y fatal en aquellos individuos inmunosuprimidos o en condiciones de estrés. También se ha reportado como una amphixenosis y zoonosis, por lo cual puede infectar, tanto animales mamíferos de diferentes especies como al humano [3, 15]. La infestación por Cryptosporidium spp., no es dependiente de la dosis infectante y los valores de anticuerpos calostrales producidos en respuesta de la madre a la infeccón natural, no tienen efecto protector ante la infección neonatal en rumiantes [3].
Según la bibliografía revisada [4 - 6, 11, 12, 16 - 19], la parasitosis por Cryptosporidium spp. aparece reportada para el orden Cetácea a partir de estudios recientes que se hacen evidentes después del año 2000, considerando el ciclo alimenticio como el principal foco de ingestión a partir de peces e invertebrados contaminados, en un ciclo permanente que ubica a los mamíferos marinos como reservorio y huéspedes de estos parásitos y muchos otros aún en estudio, con lo cual se encuentran reportados para el orden cetácea los siguientes endoparásitos: Nemátodes (Anisakis spp., Contrasecum osculatum, Crassicauda spp., Delamurella spp., Halocercus spp., Mastigonema stenellae, Pharurus payais, Phocanema spp., Pseudalius spp., Pseudoterranova spp., Stenurus spp., Trichomona spp.); Céstodes (Diphyllobothrium spp., Diplogonoporaus spp., Monorygma grimaldi, Phyllobothrium delphini, Prioprocephalus spp., Strobilocephalus triangularis, Tetrabothrium forsteri); Tremátodes (Braunina cordiphormis, Campula oblonga, Campula spp., Hunterotroma spp., Leucasiella arcaica, Lesithodesmus spp., Nasitrema spp., Odhnerilla spp., Oschmarinella spp., Pholeter gastrophilus, Synthesium spp., Zalophotrema hepaticum, Zalophotrema pacificum); Acantocephalos (Bolbosoma spp., Coynosoma spp.); Protozoos (Ciliados: Chilodonella spp., Haematophagus megapterae, Kyaroikeus cetarius; Apicomplexos: Cryptosporidium spp., Cystoisospora delphini, Giardia spp., Sarcocystis spp., Toxoplasma gondii; Flagelados: Bodonidae flagelados, Chilomastrix spp., Hexamita spp.; Sarcodina: Entamoeba spp.)
MATERIALES Y MÉTODOS
El caso fue reportado el día 30/07/02 a las 10:15 a.m., por la Capitanía de Puertos de la Armada - Tucacas, quien notificó al Centro de Investigación de Cetáceos (C.I.C.) Capítulo Centro-Occidente, la presencia de una cría de delfín en Playa Dorada, ciudad de Boca de Aroa, la cual fue trasladada al Refugio de Fauna Silvestre de Cuare (ciudad de Chichiriviche).
Se obtuvo información de que el ejemplar fue hallado por un grupo de turistas en las inmediaciones de la zona intermareal de Playa Dorada, quienes lo reportaron, intentaron devolverlo mar adentro y, al comprobar que la cría se devolvía hacia la zona de arena, lo mantuvieron a flote hasta la llegada de los funcionarios al lugar.
En la secuencia de identificación descendente, el ejemplar fue ubicado como miembro de la Familia Delphinidae, relacionándose por la ubicación de la aleta dorsal prominente en el medio del cuerpo y por la morfología general del cuerpo del animal, con un melón bien definido y un hocico alargado, de distribución primariamente oceánica. Seguidamente se cotejó con las características del género Stenella el cual se expresa en la presencia de aletas pectorales de extremos aguzados de un color gris en ambas caras como el del dorso, situadas en porción media lateral en la regiún de coloración más clara del cuerpo, conformación fusiforme elongada, aleta dorsal prominente en el tercio medio corporal, medianamente falcada y conteo dentario aproximado de 34 dientes en cada hemimandíbula. El patrón de coloración del cuerpo estaba delimitado a un dorso gris claro, desde el hocico hasta la cola, una segunda franja más clara en los flancos sin patrón o figura delimitada y, una coloración rosada a lo largo de todo el cuerpo en su porción ventral. Las manchas en formas de lunares descritas en la bibliografía como características de la especie Stenella frontalis, no estaban presentes para el ejemplar, debido a que ellas tienden a aparecer y crecer sólo en los ejemplares juveniles y adultos [2, 13].
El delfín fue mantenido en una facilidad (enmallado artificial) en mar, en un espacio oval construido con malla plástica estructural, de aproximadamente 6 x 9 mts. de diámetro, con observación permanente. Las primeras 24 horas se mantuvo en ayuno obligatorio. El patrón de nado fue errático, de forma lateral girado decúbito lateral derecho, tomando posición normal sólo para respirar fuera del agua. No abría los ojos al salir del agua, y eventualmente los abría dentro de ella. Durante la primera noche, el delfín se hundió en el fondo, dando señales de broncoaspiración, al presentar apertura del orificio respiratorio dentro del agua, evidenciado por un burbujeado espeso y blanco que salía del agua. Inmediatamente se procedió a mantenerse a flote forzado, de forma manual, y a través del contacto directo con el ejemplar. La frecuencia respiratoria se encontraba alterada y variable (4 - 11 rpm.), al igual que la frecuencia cardiaca (60 - 120 lpm.). Se trabajó de esta manera durante toda la madrugada dentro del cercado, con el objeto de evitar que la cría chocara con las paredes de la malla, y verificar que mantuviera un ritmo respiratorio constante y fuera del agua.
Pasadas 24 horas se procedió a hidratar al delfín por medio de sonda oral hasta la primera cámara estomacal, con una preparación de oralite en agua mineral de consumo humano (1 sobre por litro agua), practicándose este método tres (3) veces al día. La cría demostró franca mejoría, ya que su frecuencia de nado aumentó, manteniendo un patrón de nado normal y con mayor ánimo, así como una frecuencia respiratoria (4 - 8 rpm.) y cardiaca (60 - 88 lpm.) satisfactorias. Sin embargo, a la evaluación física, la cría presentó tos con evidencia de mucosidad sin olor aparente y de aspecto seroso a través del respiradero, producto de broncoaspiración. Igualmente se evaluaron todos sus sistemas orgánicos, lo cual puede apreciarse en los resultados de este trabajo.
Posteriormente se procedió a la toma de datos morfométricos con una cinta métrica flexible de carrete, especificados en la TABLA I. Las medidas expresadas a continuación son de vital importancia para la determinación de edad del ejemplar, para el levantamiento de la ficha técnica que se maneja a nivel nacional, para el desarrollo de estudios y el reporte de varamientos de mamíferos marinos a nivel internacional, así como la ficha técnica de museo científico, en los casos que se hace ingreso de osamentas de los ejemplares en estudio.
El día jueves 01/07 a las 7:30 p.m. el ejemplar falleció, estando presentes para ese momento los funcionarios del Ministerio de Ambiente y del C.I.C.-Capítulo Centro-Occidente. La causa de muerte del ejemplar fue: Paro cardiopulmonar. Debe acotarse que no fue posible evidenciar en el animal cuadros de diarrea, ya que las condiciones no fueron aptas para realizar este tipo de medición.
Se practicó necropsia del ejemplar, bajo las normas sanitarias de procedimiento veterinario; la recolección de muestras se realizó bajo los estándares científicos de procedimiento diagnóstico valorados para la Facultad de Ciencias Veterinarias de la Universidad Central de Venezuela - Cátedra de Patología y laboratorio de Anatomía Patológica. El número de protocolo asignado fue el N-195-02. Se tomaron muestras de los siguientes órganos: corazón, pulmón, estómago, intestino grueso, hígado, riñón y lesiones de piel con capa grasa, las cuales fueron preservadas en formaldehído al 10% para su estudio microscópico. Las muestras obtenidas fueron procesadas para diagnóstico histopatológico con coloración básica de hematoxilina-eosina (H-E), a fin de realizar la lectura correspondiente a nivel microscópico.
Para la observación y fotografía microscópica se utilizó un microscopio de cinco (5) objetivos marca Nikkon, modelo 234913, Japón, con adaptación de cámara fotográfica Sony CCD-IRIS (color video camera and adaptor), modelo DXC - 107A, Japón, y un Procesador Pentium III para digitalización de imágenes, EUA. Los objetivos usados para el presente trabajo fueron 100X y 200X (con algunas imágenes en 400X).
El ejemplar era una cría, debido a su longitud total de 1440 mm y ausencia de manchas características de la especie, sexado como hembra por la verificación de los órganos genitales durante la necropsia. El cadáver fue clasificado como Código dos (2): ejemplar recientemente muerto, extremadamente fresco, no hinchado; carne de aspecto comestible [12].
La disposición final de los restos del animal se gestionó a través de la Dirección de Fauna Aragua-Falcón, con el fin de preservar la osamenta completa del ejemplar para fines de estudios científicos, resguardóndose en el Museo Científico de la Estación Biológica Rancho Grande - Ministerio de Ambiente y Recursos Naturales Renovables.
RESULTADOS Y DISCUSIÒN
Los resultados del examen físico practicado al delfín se especifican a continuación, detallando todas las características que permitieron evaluar el estado de salud del mismo:
-
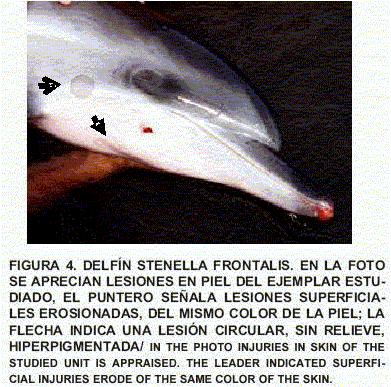
Sistema tegumentario: Se evalúa deshidratación a partir del grado de resequedad en mucosa oral y mediciones orgánicas, en conjunto con la flacidez (formación de arrugas) de la piel del animal, evidenciándose un 5% de deshidratación (resequedad en la mucosa oral sin modificaciones de la frecuencia cardiaca ni flacidez en la piel); lesiones en extremo craneal de la mandíbula y bordes de las aletas dorsal y pectorales, producto del roce con las paredes de la malla; lesiones en extremo craneal del vientre en forma erosiva, posiblemente producto del roce con la arena durante el varamiento; dos (2) lesiones superficiales sin relieve en la piel del dorso, craneal a la aleta dorsal, en forma de manchas atípicas.
-
Sistema músculo-esquelético: Buen tono muscular; correctos movimientos de las aletas pectorales; correctos movimientos de aleta caudal; columna vertebral; respiratorios (caja torácica - orificio respiratorio); buen estado de la articulación del cuello; y de la mandíbula.
-
Sistema circulatorio: Durante el 30/07/02 se presentó pulso variable hasta 120 lpm., con un ritmo cardíaco variable, sin poder verificar la presencia o no de sonidos cardíacos. Durante el 31/07/02 se mantuvo estable el pulso y el ritmo cardíaco a una frecuencia de 60-88 lpm.
-
Membranas mucosas: Mucosa bucal pálida; mucosa respiradero de color rosada.
-
Sistema respiratorio: Descarga respiradero positiva, de tipo mucosa-serosa sin olor aparente, con presencia de tos; respiración con taquipnea (frecuencia respiratoria rápida y superficial, indicativa en mamíferos terrestres de neumotórax, hernia diafragmática, efusiones torácicas) alternada con hipernea (frecuencia respiratoria rápida y profunda, indicativo en mamíferos terrestres de acidosis metabólica, fiebre, ejercicio y excitación); presencia de sonidos pulmonares estertores (por presencia de agua en vías respiratorias altas y bajas); no se evidenciaron parásitos en orificio respiratorio ni dolor al respirar.
-
Sistema digestivo: Se apreciaron normales la boca, labios, encías, lengua, glándulas salivales y dientes completos. No se revisaron las tonsilas; presencia de borborigmo; olor del aliento es sui géneris; esfínter anal normal con reflejo positivo; no se evidencia dolor en las partes especificadas. Durante la segunda alimentación realizada el día 01/08/02 se evidencia vómito al introducir la sonda oral hasta la primera cámara estomacal, con presencia de preparado lácteo y coágulos de leche sin terminar de digerir, por lo cual se cambió la administración a hidratación con oralite en agua mineral; presencia de gases con olor lácteo.
-
Sistema nervioso: El sistema locomotor presentó características de nado para el 30/07/02 decúbito lateral derecho al nadar. Durante el 31/07/02 el patrón de nado fue con tendencia a adoptar una posición normal. Durante el día 01/08/02 retomó el nado decúbito lateral derecho con mayor frecuencia. El nado en posición lateral (nado errático y flotabilidad errática o bollarismo) es reflejo de broncoaspiración, estrés, padecimientos gastro-intestinales y malestar generalizado; estado de conciencia positivo permanente; reflejo pupilar no pudo ser verificado; los reflejos palpebral; cutáneo; arco reflejo y reflejo nociceptivos fueron positivos; reflejo de dolor no evidenciado; se determinó que no hubo presencia de paresis, paraparesis, parálisis, convulsiones, síncope ni ataxia. Buena reacción de sensibilidad a la palpación.
-
Sistema urogenital: No pudo ser examinado; sin embargo, no se apreciaron secreciones.
-
Ojos: Aparentemente normales, pero no pudieron ser examinados en todas sus partes.
-
Audición: Aparentemente normal; reacción positiva a estímulos sonoros, como: palmadas suaves en el agua, llamado.
-
Vocalización: Positiva, en diversos momentos del día, durante todo el período de observación.
Luego de la muerte del ejemplar, pudo apreciarse durante el examen macroscópico realizado a los órganos, los siguientes detalles: Tracto gastro-intestinal con evidencia de gases a todo lo largo de sus componentes, no se evidenciaron parásitos; ausencia de heces en intestino grueso; presencia de nódulos en pulmones y prueba de flotabilidad negativa (presencia de exudado y agua en bronquios y alvéolos); hígado con coloración atípica, con tendencia hacia color ladrillo, heterogénea, de consistencia friable, con presencia de nódulos en diversas porciones; corazónn de tamaño, coloración y conformación normal, correcta conformación de epicardio, miocardio, endocardio, válvulas y sus estructuras; riñones de conformación y coloración normal; piel en región dorsal y ventral, craneal a la aleta dorsal evidenció dos (2) marcas atípicas, superficiales sin relieve al tacto, que al ser colectadas dieron muestra de daño en la capa grasa, circunscrito a la región de las marcas antes descritas; bazo de conformación, consistencia y coloración normal.
Los hallazgos histopatológicos en cada órgano revelaron:
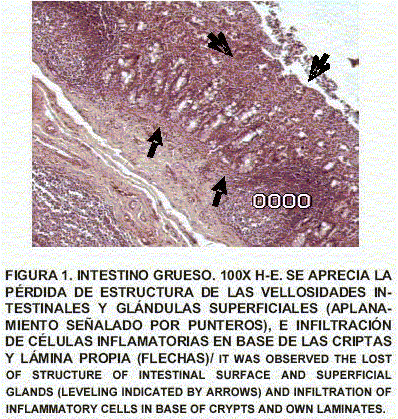
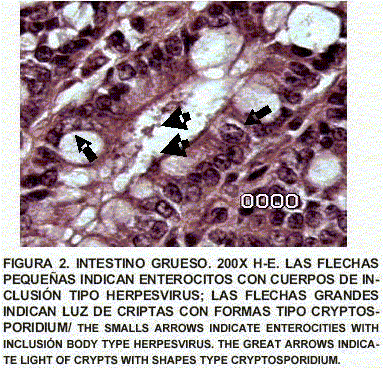
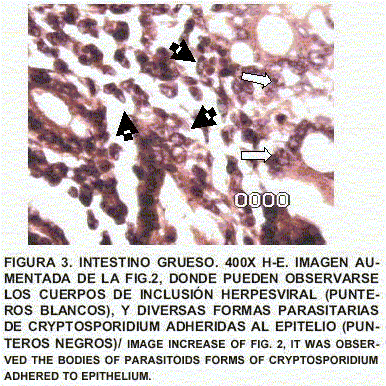
Intestino grueso: Se observa inflamación severa de la mucosa con destrucción glandular superficial y pérdidas glandulares importantes. Las bases de las criptas y la lámina propia revelan importante inflamación celular linfoplasmocítica, eritrocitos basales e intermedios muestran cuerpos de inclusión intranucleares tipo hiperviral. La luz de las glándulas muestran formas tipo Cryptosporidium adherentes a ellas (FIGS. 1, 2 y 3).
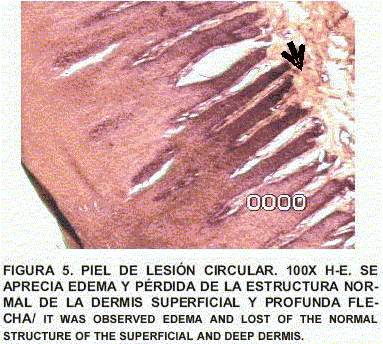
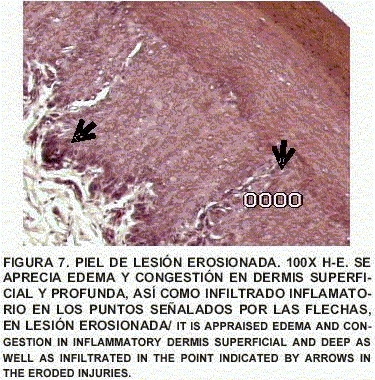
Piel: Se aprecia importante inflamación y edema de la dermis superficial y profunda con celulitis necrotizante subaguda con trombosis. No hay lesiones virales o de otra índole en la epidermis (FIGS. 4, 5, 6 y 7).
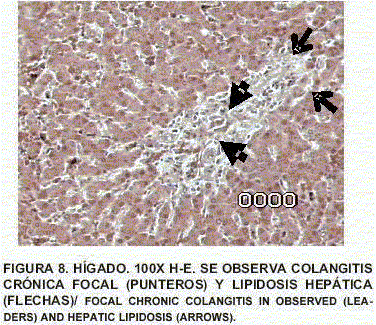
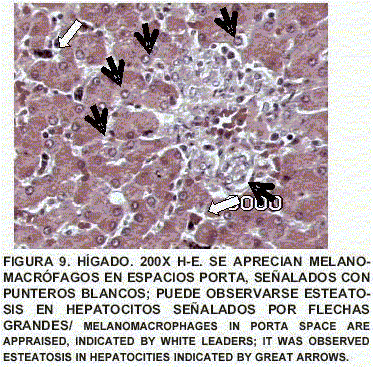
Hígado: Colangitis crónica focal. Hay esteatonecrosis. Presencia de melanomacrófagos en espacios porta. Presencia de lipidosis hepática, anormal en caso de crías de alimentación mixta (aún lactantes) (FIGS. 8 y 9).
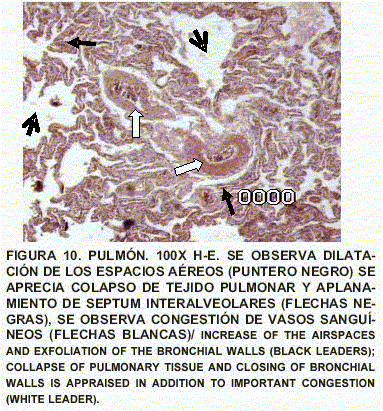
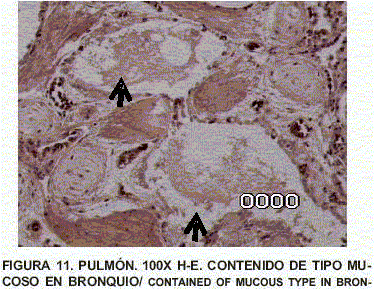
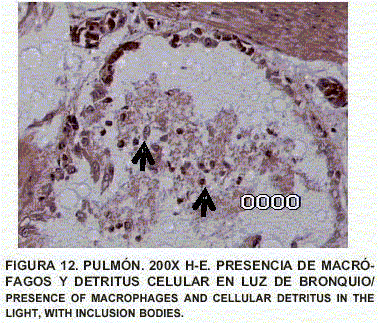
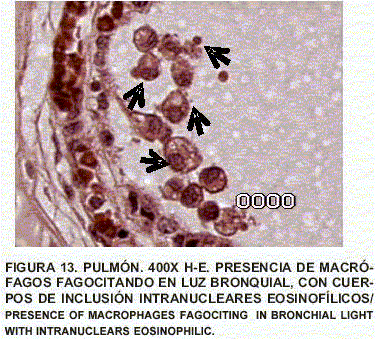
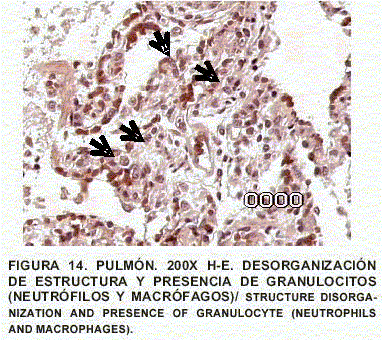
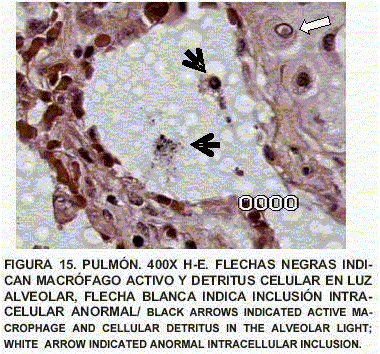
Pulmón: Enfisema y atelectasia bronquial y alveolar. Congestión generalizada. Presencia de células inflamatorias. Presencia de macrófagos reactivos con cuerpos de inclusión intranucleares eosinofólicos, de tipo viral, fagocitando en luz de bronquios y detritus celulares. Contenido de tipo mucoso en bronquios (FIGS. 10, 11, 12, 13, 14 y 15).
Corazón: Sin lesión aparente.
Riñon: Sin lesión aparente.
Como diagnóstico definitivo se reportó enterocolitis ulcerativa severa subaguda, con acción tipo viral y oportunista protozoal tipo Cryptosporidium. Dermatitis y celulitis gangrenosa severa focal y multifocal. Enfisema pulmonar y atelectasia obstructiva (neumonía por aspiración); congestión aguda y bronquiolo-alveolitis descamativa. Macrófagos alveolares con acción tipo viral. Estas lesiones evidencian enteritis viral tipo herpetiforme con lesiones de piel secundarias, endotoxómicas por ulceración o por rickettsiasis oportunista [9, 14, 15].
Además de los efectos adversos directos, las infecciones víricas de las vías respiratorias o del aparato digestivo predisponen frecuentemente a los animales al padecimiento de infecciones bacterianas y parasitarias secundarias. La infección vírica aumenta la susceptibilidad de las vías respiratorias a bacterias comensales habituales de la nariz y la garganta, así como reduce la resistencia natural a parásitos. De modo similar, las infecciones intestinales por virus pueden dar lugar a un incremento de la susceptibilidad a Escherichia coli patógena y el efecto sinérgico causa una diarrea grave, lo cual puede complicarse con parasitosis oportunistas. A fin de establecer el mecanismo de patogenia que se evidenció en los resultados obtenidos, se exponen a continuación las particularidades de los agentes causales del cuadro patológico del espécimen en estudio.
Las partículas víricas de tipo Herpesvirus son lábiles y no tienen una buena supervivencia fuera del organismo infectado. En general, su transmisión requiere un contacto directo, principalmente un contacto físico que conlleve la aposición de epitelios húmedos, así como la entrada directa a mucosa, especialmente los estornudos y aerosoles de corto alcance, que son importantes sistemas de transmisión en delfines. Los Herpesvirus sobreviven de una generación a la siguiente mediante el establecimiento de infecciones latentes, a partir de las cuales los virus se reactivan y diseminan periódicamente, y en el caso de algunos Betaherpesvirus y Gammaherpesvirus, la diseminación vírica puede ser continua. Muchos Alphaherpesvirus producen lesiones localizadas, principalmente de la mucosa de los tractos respiratorio y genital o de la piel, caracterizada por la producción secundaria de vesículas, póstulas y úlceras superficiales que se recubren de una pseudomembrana y curan de 10 a 14 días, normalmente sin que se formen costras. Al parecer, en todas las infecciones producidas por Herpesvirus existe una infección persistente y una eliminación de virus periódica o continua. Durante las infecciones por Herpesvirus se generan respuestas inmunes mediadas, tanto por anticuerpos (Ac) como por células. Los Ac neutralizantes están dirigidos principalmente contra la glucoproteína de la envoltura. Los antógenos víricos expresados sobre la superficie de las células infectadas son el objetivo de la lisis inmunomediada por células [7].
El Cryptosporidium parvum en mamíferos, se sitía en intestino delgado y grueso, con predilección por ciego y colon. En estados endógenos se ubica en borde luminar de enterocitos (intracelular extracitoplasmática). El período de prepatencia tiene una duración promedio de 3 a 4 días, y el período de incubación va de 3 hasta 8 días. El principal signo clínico es la diarrea, asociada a la excreción de gran cantidad de ooquistes en las heces; dependiendo de factores como la edad, estado inmunitario y condiciones ambientales se pueden presentar otros signos clínicos como: anorexia, pérdida de peso, postración, fiebre y dolor abdominal. La actividad de la lactasa intestinal parece estar disminuida, observándose restos de leche sin digerir en las heces de los animales. La ruta de entrada es oral-fecal y las lesiones son: acumulo de gas en ciego y colon con disminución de las vellosidades intestinales, fusión de las vellosidades que tienden a formar puentes de naturaleza epitelial simples o múltiples, que por los estudios se sabe que la integridad se mantiene mediante la formación de desmosomas. La parte apical de las vellosidades presenta zonas con agregados en diversos estados de degeneración y con frecuencia incluyen formas endógenas del parásito. La lámina propia está, generalmente, infiltrada de polimorfonucleares y mononucleares (macrófagos y linfocitos). Microscópicamente hay degeneración en la célula hospedadora que incluye vacuolización y acumuló de cuerpos esféricos en parte apical del citoplasma. Infecciones secundarias asociadas a estados de inmunodeficiencia previa [3, 15].
Tomando en cuenta los resultados obtenidos, las caracterésticas de los tejidos afectados se corresponden con una Infección viral primaria por Herpesvirus spp. que se hallaba latente en el individuo, concominante con una infección parasitaria secundaria por Cryptosporidium spp., que al ejemplar encontrarse en situación de varamiento presentó un cuadro de estrés e inmunosupresión elevado, lo cual generó infección sistémica, y la muerte por paro cardiopulmonar.
CONCLUSIONES
Por los resultados obtenidos en este estudio, se determinó que el individuo perteneciente a la especie Stenella frontalis, cría hembra, presentó una infección sistémica producto de una infección primaria por Herpesvirus spp., concominante con parasitismo secundario por Cryptosporidium spp., cuadro clínico que se vio complicado por las condiciones de estrés a las que se encontró sometida producto del varamiento.
La evaluación del estado de salud previo a la muerte y los resultados obtenidos, no se pueden separar de los factores naturales o antrópicos, los cuales impactan negativamente a nivel del ecosistema, y se traducen en la aparición de patologías que rigurosamente analizadas por estudios clínicos y/o postmortem, son señal inequívoca de un desequilibrio natural del hábitat de los cetáceos.
Las diferencias adaptativas de estos animales a su medio hacen que no sean extrapolables los datos de otras especies más conocidas como gran parte de las terrestres. En este contexto resulta importante aproximarse al medio en el cual los cetáceos desarrollan su actividad diaria, controlando las emisiones de contaminantes y, en consecuencia, su repercusión en la salud de estos animales. Por esta razón sería recomendable hacer estudios de posibles enfermedades en las poblaciones de cetáceos que transitan y/o habitan en aguas venezolanas, a través de seguimiento a varamientos vivos y muertos de estos especimenes en las costas y ríos, así como estudios de impacto ambiental en los ecosistemas acuáticos.
REFERENCIAS BIBLIOGRÁFICAS
1. ACHA, P.; SZYFRES, B. Zoonosis parasitaria. Zoonosis y enfermedades transmisibles comunes al hombre y a los animales. Publicación Científica OPS-OMS Nº 503. Ediciones de la OPS-OMS. 2da Ed. Washington, U.S.A. 585-589 pp. 1989. [ Links ]
2. CARWARDINE, M. Manual de Identificación: Ballenas, Delfines y Marsopas. Ediciones Omega, S.A. 1era Ed. en español. Barcelona, España. 256 pp. 1998. [ Links ]
3. CORDERO DEL C., M.; ROJO V., F.A. Diagnóstico de los parásitos. Parasitología Veterinaria. Editorial McGraw-Hill Interamericana. 1era Ed. Madrid, España. 968 pp. 2001. [ Links ]
4. DAILEY, M.D.; PERRIN, W.F. Helminth parasites of porpoises of genus Stenella in the eastern tropical pacific, with descriptions of two new species: Mastigonema stenellae gen. ET SP. N. (Nematoda: Spiruroidea) and Zalophotrema pacificum sp. N. (Trematoda: Digenea). Fish Bull. 71 ( 2): 455-471. 1973. [ Links ]
5. DENG, M.; PETERSON, R.P.; CLIVER, D.O. First findings of cryptosporidium and giardia in California Sea Lions (Zalophus californianus). J. of Parasitol. 86 (3): 490-494. 2000. [ Links ]
6. FAYER, R.; DUBEY, J.P.; LINDSAY, D.S. Zoonotic protozoo: from land to sea. Trends in Parasitol. 20 (11): 531-536. 2004. [ Links ]
7. FENNER, F.; BACHMANN, P.A.; GIBBS, E.P.; MURPHY, F.A., STUDART, M.J.; WHITE, D.O. Herpesviridaes. Virología Veterinaria. Editorial Acribia, S.A. 1era Ed. en español. Zaragoza, España. 691 pp. 1992. [ Links ]
8. FRASER, C.M. Manejo, cría y enfermedades de los mamíferos marinos. Manual Merck de Veterinaria. Editorial Océano/Centrum. 4ta Ed. en español. Barcelona, España. 1194-1205. pp. 1993. [ Links ]
9. GAZQUEZ O., A. Introducción a la Anatomía Patológica Veterinaria. Patología Veterinaria. Editorial Interamericana McGraw-Hill. 1era Ed. Madrid, España. 501 pp. 1991. [ Links ]
10. GONZÁLEZ-FERNÁNDEZ, M. Actividades realizadas sobre cetáceos 1998-2000. Serie Informes Técnicos DGF/IT/396, Dirección General de Fauna-MARNR. Caracas, Venezuela. 30 pp. 2001. [ Links ]
11. HUGHES H., J.M.; RICKARD, L.G.; PANUSKA, C.; SAUCIER, J.R.; O'HARA, T.M.; DEHN, L.; ROLLAND, M. J. of Parasitol. (91)5: 1225-1228. 2005. [ Links ]
12. KUIKEN, T.; GARCÍA H, M. Cetacean Pathology: Dissection Techniques and Tissue sampling. ECS Newslett. Nº 17 Special Issue: 1-39. 1991. [ Links ]
13. LEATHERWOOD, S.; REEVES, R.R.; FOSTER, L. Suborden odontoceti. The toothed whale, dolphins and porpoise. The Sierra Club Handbook of Whales and Dolphins. Sierra Club Books. 1st Ed. California, U.S.A. 302 pp. 1983. [ Links ]
14. MARCATO, P.S. Aparato digestivo. Anatomía e histologí patolígica especial de los mamíferos domésticos. Editorial Interamericana McGraw-Hill. 2da Ed. en español. Madrid, España. 384 pp. 1990. [ Links ]
15. McGAVIN, M.D.; CARLTON, W.W.; ZACHARY, J.F. Alimentary system. Thomson's Special Veterinary Pathology. Mosby, Inc. 3th Ed. Missouri, U.S.A. 755 pp. 2001. [ Links ]
16. MONTOYA O., R.A; MIGNUCCI G., A.A. Protocolos sobre varamientos y necropsias de mamíferos acuáticos. Red Caribeña de Varamientos. Laboratorios Marinos de Isla Magueyes. Universidad de Puerto Rico. Lajas, Puerto Rico. 52 pp. 1993. [ Links ]
17. MOSER, M.; RHINEHART, H. The Lungworm, Halocercus spp. (Nematoda: Pseudaliidae) in Cetaceans from California. J. of Wildlife Dis. 29(3): 507-508. 1993. [ Links ]
18. PARSONS, E.C.M.; JEFFERSON, T.A. Post-mortem investigations on stranded dolphins and porpoises from Hong Kong waters. J. of Wildlife Dis. 36 (2): 342-356. 2000. [ Links ]
19. REIDARSON, T.H. Medicine in Cetacean. In: Fowler, M.E. and R.E. Miller (Eds.), Zoo and Wild Animal Medicine. W.B. Saunders Company. 5th Ed. Pennsylvania, U.S.A. 782 pp. 2003. [ Links ]
20. SAIZ M., L. Aspectos Generales de la Zoonosis. Las Zoonosis. Editorial Aedos. 1era Ed. Barcelona, España. 371 pp. 1976. [ Links ]












 uBio
uBio