Revista Científica
versión impresa ISSN 0798-2259
Rev. Cient. (Maracaibo) v.18 n.3 Maracaibo jun. 2008
Asociación Entre la Concentración Sérica de Testosterona y la Actividad de la Enzima Glutatión Peroxidasa en Testículos de Ratones de Diferentes Edades.
Nyurky Matheus-Cortéz 2* y Aura López-Ortega 1
1 Unidad de Investigación en Ciencias Funcionales Dr. Haity Moussatché (UNIHM), Decanato de Ciencias Veterinarias, Universidad Centroccidental Lisandro Alvarado. Venezuela.
2 Área Fisiología Animal. Apartado Postal 267, Barquisimeto, Lara-Venezuela. Fax: 0251-2592404. E-mail: nyurkym@ucla.edu.ve
RESUMEN
Existen evidencias que durante la síntesis de testosterona hay producción de radicales libres, lo que podría incrementar la respuesta antioxidante testicular para evitar el daño oxidativo celular. El objetivo de esta investigación fue determinar si existe asociación entre la concentración sérica de testosterona libre (Tl) y la actividad testícular de la enzima glutatión peroxidasa (GPx) en ratones de diferentes edades. Se seleccionaron 40 ratones machos de la cepa NMRI procedentes del Bioterio Central de la Universidad Centroccidental Lisandro Alvarado, y se dividieron en 5 grupos de 8 animales, de acuerdo a la edad en días (d). Grupo (1): 21d, (2): 28d, (3): 35d, (4): 42d y (5): 49d. Bajo ligera eterización se sacrificaron, se recolectó la sangre y en el suero se determinó la concentración de Tl por electroquimioluminiscencia. Los testículos se disecaron, pesaron y se colocaron a 4°C en una solución buffer 50 mM Tris-HCl y 5 mM EDTA a pH 7,6 para obtener un homogenizado en el cual se determinó la actividad de la GPx y la concentración de proteínas. A los resultados expresados en mU/ml y mU/mg proteínas, se les aplicó una prueba de comparaciones múltiples (DMS) y correlación de Pearson. La concentración sérica de Tl como la actividad catalítica y específica de la GPx se incrementaron con la edad de los ratones (P<0,01). El aumento de ambas variables se correlacionó en forma positiva (r=0,47) y esta asociación fue estadísticamente significativa (P<0,05) a los 21 días (etapa prepúber) y 49 días (etapa pospúber).
Palabras clave: Testículo, testosterona, glutatión peroxidasa, ratón.
Association Between Seric Testosterone Concentration and the Glutathione Peroxidase Activity in Testicles of Mice of Different Ages.
ABSTRACT
Evidences exist that during the testosterone synthesis there is production of free radicals, which could increase the testicular antioxidant answer to avoid the cellular oxidative damage. The aim of this investigation was to determine if exists association between the seric concentration of free testosterone (Tl) and the testicular activity of the enzyme glutatión peroxidasa (GPx) in mice of different ages. 40 male mice of stock NMRI coming from the Central Bioterio of the Universidad Centroccidental Lisandro Alvarado selected themselves, and they were divided in 5 groups of 8 animals, according to the age in days (d). Group (1): 21d, (2): 28d, (3): 35d, (4): 42d and (5): 49d. Under light eterización they were sacrificed, the blood was collected and in the serum the concentration of Tl by electrochemiluminescence was determined. The testicles were dissected, weighed and they were placed to 4°C in in a solution buffer 50 mm Tris-HCl and 5 mm EDTA to pH 7.6 to obtain homogenate in which one the activity of the GPx and the protein concentration was determined. To the results expressed in mU/ml and mU/mg proteins, were applied to a test of multiple comparisons (DMS) and Pearsons correlation. The concentration of Tl as the catalytic activity and specific of the GPx they were increased with the age (P<0.01). The increase of both variables was correlated in positive form (r=0.47) and this association was statistically significant (P<0.05) to the 21 days (prepuber stage) and 49 days (postpuber stage).
Key words: Testicle, testosterone, glutathione peroxidase, mouse.
Recibido: 01 / 03 / 2006. Aceptado: 30 / 07 / 2007.
INTRODUCCIÓN
La testosterona es una hormona esteroidea sintetizada principalmente en los testículos y una de sus funciones es estimular la espermatogénesis [26]. Durante su síntesis interviene un grupo de enzimas, las citocromo P-450 monoxigenasas las cuales participan en diferentes reacciones de óxido-reducción que requieren Nicotinamida-Adenina Dinucleótido Fosfato-Oxidado (NADPH) y oxígeno para hidroxilar el colesterol y transformarlo en pregnenolona, paso en el cual se producen radicales libres (RL) [34].
Estos compuestos presentan estructuralmente un electrón desapareado y pueden interactuar con componentes celulares como ADN, lípidos; proteínas y carbohidratos, e inducir pérdida de la función celular. Su producción en grandes cantidades incrementa la lipoperoxidación (LPO) o deterioro oxidativo de los lípidos poli-insaturados de las membranas celulares, lo que podría constituir la base bioquímica de la disminución de la actividad testicular [7]. Los RL tienen un papel importante en la fisiología espermática normal, sin embargo, cuando se rompe el delicado equilibrio que debe existir entre la producción y degradación de éstos, se establece un estado de estrés oxidativo celular con consecuencias deletéreas para los espermatozoides [3], en este sentido, ha sido objeto de estudio la utilización de antioxidantes en la preservación del semen [28, 33].
Entre los RL que se originan en las células están las formas reactivas del oxígeno (ROS), entre las cuales se ubica el peróxido de hidrógeno (H2O2) que es la molécula más comunmente involucrada en el daño de los espermatozoides de equino [6]. En espermatozoides humanos ha sido indicado [1] que el H2O2 provoca una elevada fragmentación del ADN, además de disminuir su movilidad y capacidad de fusión con los ovocitos. Aunque el H2O2 no presenta electrones libres, es una molécula oxidante muy reactiva que puede generar radicales hidroxil (OH¯) en presencia de metales de transición [19]. Así mismo, el óxido nítrico (NO) induce la LPO de la membrana espermática en espermatozoides de ratón y de humanos [18], por acción del anión superóxido (O2¯ ) que al reaccionar con el óxido nítrico origina peroxinitrito, precursor de radicales OH¯, los cuales disparan la cadena de reacciones lipoperoxidativas.
Matheus y col. [24], en un estudio realizado en ratones mas musculus reportaron que la concentración de testosterona sanguínea aumentaba progresivamente con la etapa de desarrollo, y este aumento se correlacionó significativamente con el incremento de la LPO testicular, cuantificada por la concentración de dienos conjugados, producto inicial de la reacción lipoperoxidativa, y por la concentración de malondialdehído o MDA, producto final de ésta. Resultados similares han sido obtenidos en ratas Rattus norvegicus por Fisher y Aitken [11], quienes indican que en el macho, durante la diferenciación de las células germinales hay un aumento de su metabolismo, lo que induce a la generación de RL que participarían en la regulación redox gonadal.
Al respecto, Hipler y col. [20], señalan que la formación elevada de RL por las células de Sertoli puede provocar alteraciones morfológicas en las espermátidas, células que posteriormente se diferenciarán en espermatozoides; mientras que otros investigadores [10], reportan que las concentraciones bajas y controladas de RL juegan un papel importante en la hiperactivación y capacitación de los espermatozoides.
La dinámica de la membrana plasmática de la célula espermática cumple un papel importante en los procesos de maduración, capacitación y fecundación [38], sin embargo, el aumento de las ROS puede dañarla por peroxidación de los lípidos insaturados constituyentes de la membrana plasmática, proceso que modifica su fluidez y altera la permeabilidad, lo que eventualmente llevará a un proceso de muerte celular programada o apoptosis [5]. Las células espermáticas son protegidas de los agentes reactivos del O2, fundamentalmente por la acción de cinco enzimas [35]: glutatión peroxidasa (GPx), fosfolípido hidroperóxido glutatión peroxidasa (PHGPx), glutatión reductasa, superóxido dismutasa y catalasa. En el humano, las mitocondrias de los espermatozoides contienen grandes cantidades de PHGPx, una de las enzimas que actúa contra la peroxidación producida por el H2O2, la disminución de los niveles de esta enzima está asociada con la infertilidad del hombre [22].
Los cambios asociados con daño oxidativo, frecuentemente llevan a la activación o inactivación de genes que regulan la actividad de enzimas y de proteínas estructurales que permiten elevar la defensa antioxidante para reestablecer la homeostasis celular [13, 17]. Una de las enzimas que se pueden activar son las glutatión peroxidasas, selenoproteínas que se encuentran en diversos sitios del organismo, y presentan diferente especificidad de acuerdo al sistema antioxidante de cada tejido. Estas enzimas metabolizan el H2O2 y lipoperóxidos en diferentes compartimentos de la célula cumpliendo un papel antioxidante. La pérdida de la actividad de la GPx citosólica permitirá un incremento en las ROS, con el subsecuente daño a proteínas esenciales en toda la célula y a ácidos grasos insaturados de las membranas [2, 21].
El presente estudio tuvo como objetivo determinar si existe asociación entre el mecanismo antioxidante representado por la actividad de la enzima glutatión peroxidasa testicular con la concentración sérica de testosterona, en ratones de la cepa NMRI de diferentes edades.
Normalmente el equilibrio entre la producción de RL y los mecanismos antioxidantes impiden el daño oxidativo celular. El conocimiento de si existe o no, pérdida de este equilibrio de acuerdo con la edad del animal, permitirá establecer pautas de manejo en donde se tome en cuenta la administración o suministro de sustancias antioxidantes que garantice la fertilidad de los animales, sobretodo en aquellos con manejo reproductivo de estación de monta o apareamiento.
MATERIALES Y MÉTODOS
Población y Muestra
La población estuvo representada por ratones de la cepa NMRI (National Medicine Research Institute, EUA), procedentes del Bioterio Central de la Universidad Centroccidental Lisandro Alvarado (UCLA). Se seleccionaron al azar, a través de un muestreo aleatorio simple sin reposición, 40 animales en edad reproductiva (42 días), 20 machos y 20 hembras, los cuales se trasladaron hasta la Unidad de Investigación en Ciencias Funcionales Dr. Haity Moussatché (UNIHM), del Decanato de Ciencias Veterinarias de la UCLA, en donde se aparearon. Al momento del parto se anotó la fecha de éste, número de crías, peso de la camada. Cinco días después del nacimiento se sexaron las crías y se dejaron sólo los machos, que se destetaron a los 20 días de edad.
De las crías obtenidas, se utilizaron 40 machos, distribuidos en 5 grupos de 8 ratones cada uno, como se muestra:
Los animales bajo ligera eterización se sacrificaron, se recolectó la sangre en tubos Eppendorf y se centrifugó a 1000 x g / 20 minutos, se extrajo el suero con una pipeta Pasteur y se vertió en tubos Eppendorf, para posteriormente realizar la determinación de testosterona sérica. Los testículos se disecaron y en ellos se realizó la determinación de la actividad de la enzima glutatión peroxidasa.
Determinación de la Concentración Sérica de Testosterona Libre (Tl)
Se realizó por el método de electroquimioluminiscencia. En este inmunoensayo no competitivo el anticuerpo utilizado recubre unas micropartículas imantadas, que tras la formación del complejo antígeno-anticuerpo, se fijan a un electrodo por magnetismo. Dicho anticuerpo está conjugado con un marcador (derivado del rutenio) capaz de emitir fotones cuando se aplica una pequeña diferencia de potencial sobre el electrodo [25]. Este inmunoensayo validado para ratones, tiene la capacidad de detectar valores de testosterona libre menores a los 0,01 pg/ml. El coeficiente de variación intra-ensayo fue de 1,6% y el inter-ensayo de 8%.
Determinación de la Actividad Testicular de la Enzima Glutatión Peroxidasa
Los testículos disecados, se pesaron en una balanza analítica Sauter (Alemania) y se colocaron en un volumen de 6 ml / g de tejido, de una solución buffer 50 mM Tris-HCl y 5 mM EDTA a pH 7,6 a 4°C y en un homogenizador Potter de Bodine Elect. Comp. (Chicago, ILL, EUA) se obtuvo el homogenizado del tejido. Este se centrifugó a 4000 x g / 15 minutos a 4°C en una centrífuga Clay Adams modelo 21152 (Sparks, MD, EUA), se colectó el sobrenadante con pipeta Pasteur y se diluyó 1:10 con agua destilada.
La actividad de la enzima glutatión peroxidasa se determinó utilizando un Kit de Calbiochem Nº Catálogo 354104 (La Jolla, CA, EUA), para lo cual se prepararon 2 blancos y 8 muestras por duplicado, a los cuales se le agregó: 350 µl del buffer del ensayo, 350 µl del reactivo NADPH, 70 µl de agua destilada sólo al blanco y 70 µl de muestra diluida a los tubos identificados como muestras. Se vertió la solución en una cubeta de cuarzo y se le adicionó 350 µl de ter-Butil-hidroperóxido. Se realizó la lectura a una longitud de onda de 340 nm en un espectofotómetro Spectronic Genesys 5 (Rochester, NY, EUA), cada 30 seg. por 3 minutos.
Con los valores obtenidos se determinó la variación neta de la absorbancia a 340 nm / minuto. De esta manera, se obtuvo la actividad catalítica de la enzima que se expresó en mU / ml como también la actividad específica expresada en mU / mg de proteína.
Determinación de Proteínas
La concentración de proteínas en las muestras permitió calcular la actividad específica de la GPx expresada en mU / mg de proteínas. La determinación se realizó utilizando el Kit II Bio Rad Nº Catálogo 500-0002 (CA, EUA) basado en el método de Bradford [8], que utiliza una solución patrón de 1,41 mg / ml de albúmina sérica bovina.
Análisis Estadístico
Los datos fueron analizados estadísticamente a través del paquete estadístico SPSS versión 10,0 para Windows [32], a los mismos se les realizó un análisis descriptivo, prueba de comparaciones múltiples (DMS) y correlación de Pearson, para conocer si existían diferencias entre la concentración sérica de testosterona y la actividad de la enzima glutatión peroxidasa de acuerdo a la edad de los animales (P£0,05).
RESULTADOS Y DISCUSIÓN
El testículo es un órgano dinámico que sufre procesos complejos de proliferaciones y diferenciaciones desde el momento del nacimiento hasta la senectud. Estos cambios están asociados con la capacidad del testículo para sintetizar testosterona y formar espermatozoides [31]. En este estudio se determinó que, la media de la concentración sérica de testosterona libre aumentó de forma progresiva con la edad de los ratones (P<0,01), tal como se puede observar en la FIG. 1, con dos incrementos marcados a los 35 y 42 días de edad, período que coincide con la etapa de pubertad de esta especie [16].
Resultados similares a los obtenidos en este estudio fueron reportados en ratas por Trbovich y col. [36] y en ratones por Vergouwen y col. [37]. Estos autores han indicado que la baja concentración de testosterona durante la etapa prepúber se debe posiblemente a que los testículos se encuentran en un período de diferenciación y proliferación de las primeras líneas espermatogénicas y de las células de Sertoli, con aumento de la síntesis de receptores de LH, hormona responsable de estimular a las células de Leydig para sintetizar la testosterona. Durante este proceso, en el testículo hay producción de RL [30, 34] y la concentración sérica de la hormona se ha correlacionado significativamente con el grado de LPO testicular en ratones de la cepa NMRI, cuantificada por la concentración de dienos conjugados y malondialdehído [24].
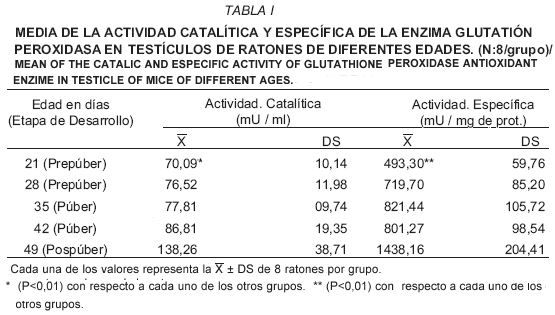
Se sabe que los cambios asociados con el daño oxidativo y con el reestablecimiento de la homeostasis celular, inducen la activación de enzimas de defensa antioxidante y proteínas estructurales [13, 17]. En el presente estudio se evidenció que la actividad de la GPx se incrementó con la etapa de desarrollo (TABLA I), con un valor máximo en la etapa pospúber, mientras que los animales prepúberes de 21 días presentaron la menor actividad catalítica (mU / ml) y específica (mU / mg de proteína) de la enzima (P<0,01).
Estos resultados concuerdan con los obtenidos por Peltola y col. [29], en tejidos de ratas, quienes indican que la enzima GPx alcanza su mayor actividad a los 5 meses de edad. Además, Giannattasio y col. [14], encontraron que en testículos de ratas la expresión de los patrones de GPx es baja en la etapa prepuberal y sobretodo, cuando éstas son sometidas a una hipofisectomía. Por su parte, Zini y Schlegel [39], en un estudio también realizado en testículo de ratas, encontraron que la glutatión peroxidasa presentaba la mayor actividad a los 40-90 días de edad, a pesar de que su transcripción se inicia a los 10 días del nacimiento.
En otras especies animales como el cerdo Sus serota y en diferentes tejidos se ha reportado [23], que tanto la expresión del mRNA de la GPx así como su actividad se incrementan con la edad. Giannattasio y col. [14], han descrito en humanos que los espermatozoides de éstos, son dependientes del sistema antioxidante glutatión peroxidasa/glutatión reductasa (GPx / GR) vía glutatión reducido (GSH) para inactivar las ROS, como el peróxido de hidrógeno y los hidroperóxidos orgánicos.
Por otra parte, el aumento en la concentración sérica de la testosterona libre estuvo correlacionado en forma positiva con el incremento de la actividad catalítica de la Gpx (r = 0,72), sin embargo, ésta sólo fue estadísticamente significativa a los 21 y 49 días de edad (P<0,05). A los 21 días los ratones están en etapa prepúber. La producción de ROS y el daño del ADN son mayores en espermatozoides inmaduros con retención citoplásmica y anormalidades morfológicas de la cabeza [27]. Los espermatozoides morfológicamente anormales generan una cantidad mayor de ROS que los de morfología normal [4], consecuentemente la actividad de la GPx, entre otros mecanismos antioxidantes, deberá compensar este aumento.
A los 49 días de edad los ratones han alcanzado la madurez sexual y hay plena producción de testosterona, hormona esencial para el cumplimiento de las funciones fisiológicas del macho, durante su síntesis el colesterol se transforma a pregnenolona por acción del sistema enzimático mitocondrial P-450 [34], momento en el cual se produce radical superóxido, con el consiguiente incremento de la actividad catalítica de la GPx testicular, observado en el presente estudio.
En el proceso de maduración sexual que tiene lugar entre los 21 y 49 días, es beneficiosa una LPO controlada porque ésta promueve la capacitación y activación del espermatozoide, actúa como interruptor de la tirosina cinasa, ocurre una hipermovilidad inducida por el anión O2– y un aumento en la afinidad por la zona pelúcida del ovocito [12].
Según Chainy y col. [9], quienes han explicado que la producción de ROS a nivel testicular puede verse afectada por algunos factores entre ellos la testosterona, la cual disminuiría la actividad de las enzimas relacionadas con el metabolismo del radical superóxido y peróxido de hidrógeno, con inducción de un aumento del nivel de peroxidación lipídica que conduciría a la pérdida de la función celular. Sin embargo, esto discrepa de los resultados de Ghosh y col. [15], quienes señalan que la testosterona es la clave de la correlación esteroidogénesis-espermatogénesis-estrés oxidativo, así como también, con los resultados del presente estudio que indicaron, que durante la etapa prepúber y pospúber el aumento de la actividad específica de la glutatión peroxidasa testicular, se correlacionó (r = 0,72) significativamente (P<0,05) con el aumento de la concentración sérica de testosterona libre, lo que hablaría a favor de que el tejido testicular trata de protegerse de la acción de los radicales libres y así preservar su buen funcionamiento, lo que aunado al aumento simultáneo de la testosterona estaría de acuerdo a que esta hormona es crucial para la relación indicada por Ghosh y col. [15], más aún cuando la actividad enzimática se eleva con la edad, es decir, hacia la obtención de la maduración sexual del macho, condición que requiere que el tejido testicular preserve su normal funcionamiento, de tal manera que la concentración de radicales libres no deberá sobrepasar los niveles normales, lo cual será posible gracias a la intervención de sistemas antioxidantes, entre ellos la actividad de la glutatión peroxidasa testicular.
CONCLUSIONES
A medida que avanzó el desarrollo de los ratones se incrementó paulatinamente la concentración sérica de testosterona libre y la actividad testicular de la glutatión peroxidasa.
El aumento de la actividad específica de la glutatión peroxidasa testicular se mostró asociada en forma significativa con el aumento de la concentración sérica de testosterona libre, a la edad de 21 y 49 días, lo que coincide con la pre-pubertad y post-pubertad respectivamente.
AGRADECIMIENTO
Los autores agradecen al Consejo de Desarrollo Científico, Humanístico y Tecnológico de la Universidad Centroccidental Lisandro Alvarado (CDCHT), por el financiamiento que hizo posible la realización de este proyecto.
REFERENCIAS BIBLIOGRÁFICAS
1. AITKEN, R.J.; GORDON, E.; HARKISS, D.; TWIGG J.P.; MILNE, P.; JENNINGS, Z.; IRVINE, D.S. Relative impact of oxidative stress on the functional competence and genomic integrity of human spermatozoa. Biol. Reprod. 59:1037-1046. 1998. [ Links ]
2. ANZOLA, H. Algunas Descripciones de la Actividad Biológica y Fisiológica del Selenio. Acovez 24(2):17-20. 1999. [ Links ]
3. BALL, B.A.; BAUMBER, J.; SABEUR, K. Role of reactive oxygen species on normal and abnormal function of equine spermatozoa. Theriogenol. 58:299-300. 2002. [ Links ]
4. BALL, B.A.; VO, A.T.; BAUMBER, J. Generation of reactive oxygen species by equine spermatozoa. Am. J. Vet. Res. 62:508-515. 2001. [ Links ]
5. BATELLIER, F; VIDAMENT, M.; FAUQUANT, J.; DUCHAMP, G.; ARNAUD, G.; YVON, J.M.; MAGISTRINI, M. Advances in cooled semen technology. Anim. Reprod. Sci. 68:181-190. 2001. [ Links ]
6. BAUMBER, J.; BALL, B.A.; GRAVANCE, C.G.; MEDINA, V.; DAVIES-MOREL, M.C. The effect of reactive oxygen species on equine sperm motility, viability, acrosomal integrity, mitochondrial membrane potential and membrane lipid peroxidation. J. Androl. 21:895-902. 2000. [ Links ]
7. BOVERIS, A. Biochemistry of free radicals: from electrons to tissues. Med. 58(4):350-356. 1998. [ Links ]
8. BRADFORD, M. A rapid and sensitive method for the quantities of microgram of protein utilizing the principle of protein-dye binding. Anal. Biochem. 72:248-254. 1976. [ Links ]
9. CHAINY, G.; SAMANTARAY, S.; SAMANTA, L. Testosterone induced changes in testicular antioxidant system. Androl. 29(6):343 -349. 1997. [ Links ]
10. DE LAMIRANDE, E.; JIANG, H.; ZINI, A.; KODAMA, H.; GAGNON, C. Reactive oxygen species and sperm physiology. Rev. Reprod. 2(1):48-54. 1997. [ Links ]
11. FISHER, H.; AITKEN, R. Comparative analysis of the ability of precursor germ cells and epididymal spematozoa to generate reactive oxygen metabolites. J. Exp. Zool. 1; 277 (5):390-400. 1997. [ Links ]
12. GADELLA, B.M.; RATHI, R.; BROUWERS, J.F.; STOUT, T.A.E.; COLENBRANDER, B. Capacitation and the acrosome reaction in equine sperm. Anim. Reprod. Sci. 68:249-265. 2001. [ Links ]
13. GAMALEY, I.; KLUYBIN, I. Roles of reactive oxygen species: signaling and regulation of cellular functions. Int. Rev Cytol. 188:203-255. 1999. [ Links ]
14. GIANNATTASIO, A.; GIROTTI, M.; WILLIAMS, K.; HALL, L.; BELLASTELLA, A. Puberty influences expression of phospholipid hydroperoxide glutathione peroxidase (GPX4) in rat testis: probable hypophysis regultion of the enzyme in male reproductive tract. J. Endocrinol. Invest. 20(8) 439-44. 1997. [ Links ]
15. GHOSH, D.; DAS, U.; GHOSH, S.; MALLICK, M.; DEBNATH, J. Testicular gametogenic and steroidogenic activities in cyclophosphamide treated rat: a correlative study with testicular oxidative stress. Drug Chem. Toxicol. 25(3):281-92. 2002. [ Links ]
16. FUENTES, M.; RODRÍGUEZ, C.; MENDOZA, C.; FERRARO, S. Biología de los Animales de Laboratorio. Proc. Curso Biología y Manejo de los Animales de Laboratorio. Universidad Centroccidental Lisandro Alvarado. Decanato de Ciencias Veterinarias. Bioterio Central. Barquisimeto, 19-21 de Julio. Venezuela. 16-18 pp. 2002. [ Links ]
17. HALLIWELL, B.; GUTTERIDGE, J. Free radicals in biology and medicine. 3ª Ed. Oxford Science Publications. Oxford. USA. 936 pp. 1998. [ Links ]
18. by indirect immunofluorescence of nitric oxide synthase in mouse and human spermatozoa. Reprod. Fertil. Dev. 8:931-934. 1996. [ Links ]
19. HICKS, J.J. Bioquímica Especial. Parte V. En: Bioquímica. 2da Ed. McGraw-Hill. México. 900 pp. 2001. [ Links ]
20. HIPLER, U.; GORNING, M.; HIPLER, B.; ROMER, W.; SCHEREIBER, G. Stimulation and scabestrogedn-inducent inhibition of reactive oxygen species generated by rat sertoli cells. Arch. Androl. 44 (2):147-54. 2000. [ Links ]
21. HOEKSTRA, W. Biochemical function of selenium and its relation to vitamin E. Feder. Procc. 34 (11):2083-9. 1975. [ Links ]
22. IMAI, H.; SUZUKI, K.; ISHIZAKA, K.; ICHINOSE, S.; OSHIMA, H.; OKAYASU, I.; EMOTO, K.; UMEDA, M.; NAKAGAWA, Y. Failure of the expression of phospholipid hydroperoxide glutathione peroxidase in the spermatozoa of human infertile males. Biol. Reprod. 64:674-683. 2001. [ Links ]
23. LEI, X.G.; ROSS, D.A.; PARKS, J.E.; COMBS, G.F. Effects of dietary selenium and vitamin E concentrations on phospholipid hydroperoxide glutathione peroxidase expression in reproductive tissues of pubertal maturing male rats. Biol. Trace Elem. Res. 59(1-3):195-206. 1997. [ Links ]
24. MATHEUS, N.; LÓPEZ-ORTEGA, A.; MENDOZA, C. Asociación entre la concentración sérica de testosterona y el grado de peroxidación lipídica en testículo de ratón. Memorias: VI Jornadas de Investigación Decanato de Ciencias Veterinarias. Universidad Centroccidental Lisandro Alvarado. Tarabana-Lara, 26-28 de Octubre Venezuela. 3 pp. 2003. [ Links ]
25. FUENTES, P. Fluoroinmunoanálisis y quimioluminoinmunoanálisis. In: Reverté (Ed). Bioquímica Clínica y Patología Molecular. 856-857 pp. 1997. [ Links ]
26. NIESCHALAG, E.; WEINBAUER, G.F.; GROMOLL, J.; SIMONI, M. Male Reproductive Physiology. In: Nieschalag (Ed.). Andrology. Springer Edition. 23-57 pp. 2004. [ Links ]
27. OLLERO, M.; GIL-GUZMÁN, E.; LÓPEZ, MC.; SHARMA, R.K.; AGARWAL, A.; LARSON, K.; EVENSON, D.; THOMAS, J.A.; ÁLVAREZ, C.J. Characterization of subsets of human spermatozoa at different stages of maturation: implications in the diagnosis and treatment of male infertility. Hum. Reprod. 16:1912-1921. 2001. [ Links ]
28. ORTEGA, A.; CÓRDOVA, A.; HICKS, J.J.; OLIVARES-CORICHI, I.M.; MARTÍNEZ, V.M.; VALENCIA, J. de J. Peroxidación lipídica y antioxidantes en la preservación de semen. Una revisión. INCI. 28(12):699-704. 2003. [ Links ]
29. PELTOLA, V.; HUHTANIEMI, I.; AHOTUPA, M. Antioxidant enzyme activity in the maturing rat testis. J Androl. 13(5):450-5. 1992. [ Links ]
30. PELTOLA, V.; HUHTANIEMI, I.; METSA-KETELA, T.; AHOTUPA, M. Induction of lipid peroxidation during steroidogenesis in the rat testis. Endocrinol. 137(1):105 - 12. 1996. [ Links ]
31. REY, R. Evaluación de la función testicular en el varón prepúber: Utilización del dosaje de hormona antimülleriana (AMH) sérica. Arch. Argent. Pediatr. 98(5):315. 2000. [ Links ]
32. SPSS Base 10.0 Applications Guide. Chicago: SPSS Inc. 2000. [ Links ]
33. STORNELLI, M.C.; TITTARELLI, C.M.; SAVIGNONE, C.A.; STORNELLI, M.A. Efecto de los procesos de criopreservación sobre la fertilidad seminal. Analecta Vet. 25(2):28-35. 2005. [ Links ]
34. STRYER, L.; BERG, J.M.; TYMOCZKO, L.L. Trasducción y almacenamiento de energía. In: Reverté (Ed.). Bioquímica. 620-650 pp. 2003. [ Links ]
35. TRAMER, F.; ROCCO, F.; MICALI, F.; SANDRI, G.; PANFILI, E. Antioxidant systems in rat epididymal spermatozoa. Biol. Reprod. 59:753-758. 1998. [ Links ]
36. TRBOVICH, A.; SLUSS, P.; LAURICH, V.; ONEILL, F.; MACLAUGHLIN, D.; DONAHOE, P.; TEIXEIRA, J. Mullerian inhibiting substance lowers testosterone in luteinizing hormone-stimulated rodents. Proc. Natl. Acad. Sci. 98(6):3393-7. 2001. [ Links ]
37. VERGOUWEN, R.; HUISKAMP, R.; BAS, R.; ROEPERS-GAJADIEN, H.; DAVIDS, J.; DE ROOIJ, D. Postnatal development of testicular cell populations in mice. J. Reprod. Fertil. 99(2):479-85. 1993. [ Links ]
38. WOLFE, C.A.; JAMES, P.S.; MACKIE, A.R.; LADHA, S.; JONES, R. Regionalized lipid diffusion in the plasma membrane of mammalian spermatozoa. Biol. Reprod. 59:1506-1514. 1998. [ Links ]
39. ZINI, A.; SCHLEGEL, P.N. Identification and characterization of antioxidant enzyme mRNAs in the rat epididymis. Internat J. Androl. 20:86. 1997. [ Links ]












 uBio
uBio