Revista Científica
versión impresa ISSN 0798-2259
Rev. Cient. (Maracaibo) v.20 n.1 Maracaibo feb. 2010
Detección y caracterización molecular de cepas variantes del virus de la enfermedad infecciosa de la bolsa en el Estado Zulia, Venezuela
Molecular detection and characterization of infectious bursal disease virus variant strains from Zulia State, Venezuela
Ana Oviedo 1, Elita García 2, Yaneth Mavarez 3, Marcelo Gil 3, Ana Arzalluz-Fischer 3 y Francisco Perozo 3
1 Servicio Autónomo de Sanidad Agropecuaria, Maracaibo, estado Zulia, Venezuela.
2 Biológicos y Laboratorio (BIOLABCA), Maracaibo, estado Zulia, Venezuela.
3 Facultad de Ciencias Veterinarias, Universidad del Zulia. Apartado 15252. Maracaibo 4005-A, estado Zulia, Venezuela. E-mail: frankperozo1@latinmail.com
RESUMEN
Las cepas clásicas del virus de la enfermedad infecciosa de la bolsa (por sus siglas en inglés IBDV) están presentes en la industria avícola venezolana desde el último tercio del siglo pasado, a pesar de la implementación de programas intensivos de vacunación. Recientemente, se ha reportado la presencia de cepas variantes del IBDV en varios países de Latinoamérica. El presente trabajo reporta la identificación, mediante técnicas moleculares, de cepas variantes en granjas avícolas venezolanas. En parvadas de pollos de engorde de cuatro semanas de edad se tomaron bolsas de Fabricio e improntas en la tarjeta Whatman Indicadora Clásica FTA® para evaluación histopatológica y detección molecular, respectivamente. Para la caracterización molecular se utilizó la prueba de reacción en cadena por la polimerasa-transcriptasa reversa (por sus siglas en inglés RT-PCR) acoplada a secuenciación directa de nucleótidos. El peso vivo del ave, el índice peso bolsa/peso corporal, así como el peso y diámetro de la bolsa se consideraron como indicadores de inmunocompetencia a la cuarta semana. Todas las aves muestreadas (n=113) resultaron positivas a IBDV. Los virus provenientes de 10 de las 13 granjas mostraron alta similitud con cepas variantes (A y E). En concordancia con los resultados de RT-PCR, los hallazgos histopatológicos mostraron lesiones relacionadas con IBDV. Los indicadores morfológicos de inmunocompetencia se afectaron significativamente en las granjas donde se detectaron cepas variantes. En Venezuela no se utiliza vacuna viva contra cepas variantes, lo que incrementa el riesgo de inmunosupresión, fallas en los programas de vacunación y la susceptibilidad a enfermedades endémicas.
Palabras clave: Virus de la enfermedad infecciosa de la bolsa, genotipificación, cepa variante, Venezuela.
ABSTRACT
Classical infectious bursa disease virus (IBDV) has been present in the Venezuelan poultry industry since the last quarter of the past century despite intensive vaccination programs applied to control the disease. Lately, the presence of variant strains has been reported in several Latin-American countries. This work reports the molecular identification of variant IBDV strains in poultry farms from Venezuela. Bursal imprints in Whatman classic indicator FTA® cards and bursa tissues for histopathological analysis were collected from 4-week old broiler flocks. Reverse transcriptase polymerase chain reaction (RT-PCR) and direct nucleotide sequence were used for the virus molecular characterization. The bird´s body weight, the bursal index, the bursa weight and diameter were used to assess the immune status at four weeks of age. All the birds sampled (n =113) were IBDV positive. Viruses from 10 out of 13 farms showed high similarity with the IBDV variant strains (variants A and E). Histopathological findings where consistent with the RT-PCR, results showing IBDV related bursa damage in the infected birds. The immune status indicators were significantly affected in the farms where variant strains were detected. No variant strain live vaccination is currently used in Venezuela, increasing the risk of immunossupression, vaccine failure and susceptibility to endemic diseases.
Key words: Infectious bursal disease virus, genotyping, variant strain, Venezuela.
Recibido: 25 / 11 / 2008. Aceptado: 27 / 02 / 2009.
INTRODUCCIÓN
El estudio de la sanidad animal en la avicultura es vital debido a la asociación entre la salud del ave y la calidad del producto final de la industria avícola. El sector avícola reconoce la inmunosupresión como un problema, que parece ir en aumento en la producción intensiva de aves [2]. Los virus que afectan el sistema inmune, incluyendo el virus de la enfermedad infecciosa de la bolsa (por sus siglas en inglés IBDV), son los agentes infecciosos primarios responsables de los problemas de inmunsupresión en la avicultura comercial [1, 32].
Los lotes inmunosuprimidos son más susceptibles a la infección con patógenos oportunistas y muestran respuestas subóptimas a la vacunación, lo que produce a menudo situaciones de enfermedades crónicas [1, 13]. Las manifestaciones clínicas dependen de la virulencia y la dosis del inóculo, de la edad y raza de las aves y de la presencia o ausencia de inmunidad pasiva [13, 30]. La terapia con antibióticos, utilizada frecuentemente como medio de control para las enfermedades secundarias a la inmunosupresión, son costosas e incrementan los costos de producción de la industria [1].
Debido a las mutaciones características de los virus ARN y la consecuente variabilidad genética, las cepas de IBDV presentes en el campo exhiben características antigénicas y patogénicas diversas [17, 18]. Como consecuencia de esta variabilidad antigénica y en patogenicidad, existen tres presentaciones de la enfermedad: la forma hipervirulenta, que cursa con alta mortalidad [2, 11, 13], la enfermedad clínica con anorexia, plumas erizadas, temblor, diarrea blanquecina o acuosa, postración que afecta las aves después de las tres semanas de edad (producida por cepas clásicas) y la forma subclínica causada por cepas variantes que afectan aves por debajo de las tres semanas de edad, la que sin signos clínicos induce bursitis que conlleva a atrofia bursal [3].
Las pruebas moleculares se basan en la reacción en cadena por la polimerasa-transcriptasa-reversa (por sus siglas en inglés RT-PCR), en las que se amplifica una porción específica del genoma del virus, de modo que pueda detectarse fácilmente, evitando así el proceso de la propagación del virus in vitro [4, 12, 15, 17, 18]. Posterior a la prueba de RT-PCR, se utiliza una variedad de análisis para clasificar los virus, la técnica más reciente para la caracterización molecular es la secuenciación directa de nucleótidos; los nucleótidos y las secuencias predichas de amino ácidos, constituyen los datos definitivos para el diagnóstico molecular de las cepas de IBDV. Dichas secuencias pueden utilizarse para predecir la antigenicidad, la ascendencia, el tropismo por cultivo celular y la atenuación de los virus [11, 19, 25, 34].
La protección conferida por la vacunación está relacionada con la conformación de la proteína viral 2 (por sus siglas en inglés VP2), que es el mayor determinante antigénico del virus [20]. La VP2 induce anticuerpos neutralizantes capaces de controlar la enfermedad y las características individuales de esta VP2 en las distintas cepas determina su fenotipo y su virulencia [17, 25, 34]. Es por esto que se hace necesario caracterizar las diferentes cepas de IBDV circulantes en un área geográfica para establecer medidas de control adecuadas.
El objetivo del presente trabajo fue detectar y caracterizar, por técnicas moleculares, cepas de IBDV provenientes de pollos de engorde en el estado Zulia, para que en base a la estrecha asociación entre las características genéticas y las antigénicas, se amplíe el conocimiento general de la biología de los virus de la enfermedad infecciosa de la bolsa presentes en la industria avícola zuliana.
MATERIALES Y MÉTODOS
Localización
Las aves muestreadas provenían de granjas de pollos de engorde pertenecientes a una integración avícola comercial, ubicadas en el municipio Mara, al Noroccidente del estado Zulia, en la Región Guajira, Venezuela. Esta es una zona agro-ecológica catalogada como bosque muy seco tropical en la parte oriental del Municipio y bosque seco tropical en la parte occidental, donde se concentra la mayor parte de la población avícola de la zona [8].
Toma de muestras
Se evaluaron aves provenientes de 13 granjas de pollos de engorde con lotes de cuatro semanas de edad sometidas a un programa de vacunación y de manejo según el estándar de la línea genética. Las aves fueron vacunadas contra el virus de la enfermedad de Gumboro utilizando sólo cepas clásicas. En cada granja se tomaron al azar 10 aves para ser trasladadas a las instalaciones de Biológicos y Laboratorio CA (Biolabca) donde se procesaron. Un total de 113 aves fueron pesadas y sacrificadas por dislocación cervical, 17 aves murieron durante el traslado. Una vez realizada la necropsia, para cada ave se determinó el peso y diámetro de la bolsa de Fabricio. Adicionalmente, se calculó la relación entre el peso de la bolsa y el peso corporal de cada ave (índice bursal) mediante la fórmula peso bolsa/peso corporal x 100. Las bolsas fueron seccionadas a la mitad, una sección fue sumergida en formalina buferada al 10%, durante por lo menos 24 horas y procesadas siguiendo los procedimientos rutinarios para la preparación de tejidos [26]. Con la otra mitad se realizaron las improntas en las tarjetas Whatman Indicadora Clásica FTA® [21].
Evaluación microscópica de la bolsa
La evaluación histológica proporcionó una gradación de las bolsas de Fabricio según la escala ordinal reportada por Henry y col. [14], el rango se describe a continuación: grado 0, bursa normal; grado 1: folículos aislados con necrosis leve; grado 2: depleción linfoide moderada y generalizada o folículos aislados con depleción linfoide severa; grado 3: depleción linfoide severa en más del 50% de los folículos; grado 4: folículos con escasos linfocitos y con quistes, aumento del tejido conectivo, epitelio engrosado y con pliegues; grado 5: pérdida de toda la estructura folicular y marcada fibroplasia.
Preservación de ácidos nucleicos del IBDV
Una vez seccionadas las bolsas de Fabricio se realizaron las improntas en las tarjetas Whatman Indicadora Clásica FTA®, aplicando directamente sobre el papel de filtro, frotando y presionando el epitelio interno de la bolsa de Fabricio en el área activa del filtro. Las tarjetas Whatman Indicadora Clásica FTA® fueron rotuladas y secadas a temperatura ambiente por 30 min. se empacaron y sellaron en pequeñas bolsas plásticas y mantenidas a temperatura ambiente hasta su procesamiento [21, 22, 23].
Extracción de ARN
Cinco discos de 2 mm fueron cortados con un sacabocados (Harris Micro-Punch, Ted Pella, Inc. EUA) de la tarjeta Whatman Indicadora Clásica FTA®, para ser resuspendidos en 200 µL del buffer de extracción (Whatman International, Ltd., Reino Unido) y colocados en hielo por 20 min., mezclando vigorosamente cada 5 min. [28]. La fase líquida obtenida fue sometida a un proceso de extracción de ARN empleando Trizol (Life Technologies Inc., Grand Island, NY, EUA), siguiendo las recomendaciones del fabricante. El precipitado final fue diluido en 50 µL de agua estéril y libre de ARNasas (Qiagen Sciences. Maryland, EUA).
Amplificación
La presencia de ácidos nucleicos de IBDV en las muestras fue detectada por la amplificación de una porción de 698-bp del gen VP2 que contiene la región hipervariable (entre los nucleótidos 567 y 1264) usando el siguiente par de iniciadores: 5-TCTGCAACAGCCAACATCAACG-3 y 5 TCAGGATTTGGGATCAGCTCGA-3. La prueba de RT-PCR se aplicó utilizando el kit SuperScript III (Invitrogen, Carlsbad, CA, EUA), siguiendo las recomendaciones del fabricante. La transcripción reversa se realizó a una temperatura de 55°C por 30 min. La reacción de PCR incluyó 40 ciclos: desnaturalización a 94°C por 30 seg., unión de iniciadores a 50°C por 30 seg. y extensión a 72°C por 1 min., seguido por una extensión final a 72°C por 7 min. [28]. Las muestras amplificadas fueron sometidas a electroforesis en un gel de 1,5% de agarosa y visualizadas en una cámara de luz ultravioleta (BioDoc-It, UVP Ltd, Upland, California, EUA) empleando bromuro de etidio a una concentración de 0,5 µg/mL [27].
Secuenciación
Los segmentos de ADN del tamaño esperado (698 pares de bases) fueron escindidos del gel y purificados empleando el paquete comercial QIAquick PCR Purification Kit (Qiagen Inc., Valencia, CA, EUA) siguiendo las instrucciones del fabricante. Los productos purificados fueron secuenciados empleando el paquete comercial de secuenciación BigDye Terminador v3, 1 y el secuenciador ABI PRISM 310 Genetic Analizer (Applied Biosystems, Foster City, CA, EUA). Las secuencias de nucleótidos y patrón de aminoácidos inferido del gen VP2 de IBDV fueron analizados con la ayuda del programa DNAStar (DNAStar, Inc., Madison, WI, EUA) [28].
Análisis estadístico
Los datos fueron registrados en una hoja de cálculo del programa Windows Excel. El análisis estadístico fue realizado con el paquete estadístico Statistical Analysis System [31]. Por no cumplir con el supuesto de normalidad, se realizó un análisis no paramétrico con el procedimiento Proc NPAR1WAY y la opción de la prueba de Wilxcon del SAS [31] para la comparación de medias. La significancia de los procedimientos estadísticos fue de P<0,05.
RESULTADOS Y DISCUSIÓN
Las técnicas moleculares para caracterización viral, ahora están disponibles a nivel mundial gracias al desarrollo de nuevas técnicas de toma y manejo de muestras, que permiten la genotipificación molecular de virus provenientes de países que carecen de los equipos y reactivos necesarios para aplicar la tecnología molecular [21, 28]. En el presente estudio, todas las aves muestreadas resultaron positivas para el virus de la enfermedad de Gumboro, sugiriendo que el virus es ubicuo en la zona. La implementación de vacunas vivas en las reproductoras y progenie en conjunción con la alta resistencia del virus a los detergentes y condiciones medioambientales pueden explicar esta ubicuidad [24].
La tipificación molecular de virus de Gumboro provenientes de distintas zonas geográficas permite realizar análisis epidemiológicos sobre el comportamiento y evolución de estos virus en la industria avícola mundial [7, 16-18]. En Latinoamérica, distintos estudios indican la presencia de todas las formas posibles del virus, desde las formas clásicas utilizadas ampliamente en los planes de vacunación, hasta las formas muy virulentas, pasando por las cepas variantes causantes de enfermedad subclínica [2, 3, 6, 15]. En Venezuela, el virus de Gumboro está presente al menos desde el año 1976, cuando Quiroz y col. [29], realizaron el primer aislamiento durante un brote de campo.
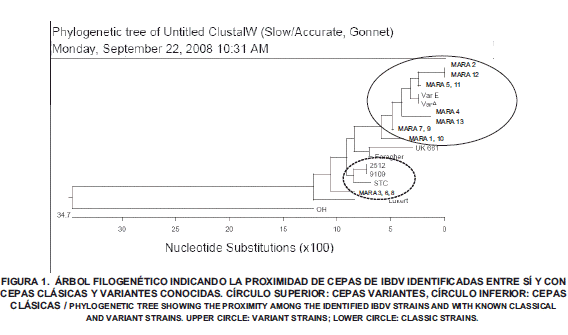
La tipificación molecular de cepas venezolanas ha sido reportada utilizando la técnica de análisis del polimorfismo de la longitud de los fragmentos de restricción (por sus siglas en ingles RFLP) [3] y mediante la secuenciación directa de nucleótidos [11]. Este es el primer trabajo de este tipo realizado en Venezuela. En este ensayo, se realizó la prueba de RT-PCR en improntas de bolsa de Fabricio obtenidas en tarjetas Whatman Indicadora Clásica FTA®, así como la secuenciación y análisis de los nucleótidos de la región hípervariable de la VP2, los resultados del análisis se muestran en un árbol filogenético donde se comparan los virus aislados entre si y con secuencias de cepas clásicas y variantes obtenidas de la base electrónica de datos GENBANK (FIG. 1). Virus provenientes de 10 de las 13 granjas muestreadas mostraron una similitud muy alta con las cepas variantes A y E, reconfirmando la presencia de este tipo de virus en la industria avícola nacional venezolana. Cacurrí [5] identificó por RFLP variante E tipo Delaware en el 50% de granjas muestreadas en la región central del país.
En la TABLA I se muestra el porcentaje de similitud y divergencia entre los virus detectados en el municipio Mara del estado Zulia. Los virus identificados se dividieron en dos grupos: los virus similares a las cepas clásicas utilizadas para comparación (94,4% similares a las cepas 9109 y 2512) y virus con alta similitud a las cepas variantes E y variante A (entre 94,4 y 98,6% similares). A partir de estos resultados se puede inferir si las vacunas usadas actualmente ayudan en el control de los virus de campo. Si la vacunación controlará el virus en campo, la mayoría de los resultados moleculares correspondiesen a las cepas vacunales clásicas.
Es importante señalar que, en Venezuela no se utilizan cepas variantes como vacuna viva en la inmunización de las aves, por lo que la aparición de las mismas probablemente obedece a mutaciones puntuales en aminoácidos claves como consecuencia de la presión de selección ejercida por el uso intensivo de cepas clásicas en la vacunación de las aves, un proceso similar al ocurrido en la industria avícola de Estados Unidos donde la mayor parte de los virus de Gumboro aislados actualmente corresponden a cepas variantes [3, 18, 33]. La aparición de variantes antigénicas, económicamente importantes como Delaware variante E y cepas de GLS en campo, ha provocado que en las áreas donde aparecen dichas cepas se incorporen cepas clásicas y variantes de IBDV en la vacunación para dar lugar a una protección de amplio espectro.
Los hallazgos histopatológicos fueron consistentes con los resultados de la prueba de RT-PCR mostrando lesiones de bolsa compatibles con IBDV en las aves infectadas. Los grupos en los que se detectó la presencia de cepas variantes mostraron un porcentaje de lesiones en bolsa significativamente mayor (P<0,0001) al mostrado en las aves en las que se detectaron virus similares a las cepas clásicas (TABLA II). Esta diferencia podria explicarse por la edad de las aves muestreadas (28 días en promedio) y la patogenia de las cepas variantes del virus de la enfermedad de Gumboro, que generan daño gradual de la arquitectura de la bolsa de Fabricio desde edad temprana (primeras tres semanas de vida) [24].
ANÁLISIS DE SIGNIFICANCIA DE LAS MEDICIONES REALIZADAS DURANTE LA NECROPSIA (AGRUPADOS SEGÚN EL TIPO DE VIRUS DETECTADO EN LAS AVES) /STATISTICAL ANALYSIS OF THE MEASUREMENTS OBTAINED DURING THE NECROPSY (GROUPED BY THE VIRUS DETECTED IN THE BIRDS).
|
| Virus | ||||||
| Clásica | Variante | Estadístico | |||||
| Variable | N | Media | Error Std | N | Media | Error Std | Z |
| Peso vivo | 26 | 1181,15 | 40,60 | 84 | 1038,33 | 18,63 | 3,3893*** |
| Diametro bolsa | 26 | 15,96 | 0,45 | 84 | 12,05 | 0,24 | 6,1319**** |
| Peso bolsa | 26 | 1,69 | 0,12 | 84 | 0,82 | 0,04 | 6,2828**** |
| Índice bursal | 26 | 0,14 | 0,01 | 84 | 0,08 | 0,00 | 5,8686**** |
| Lesión bolsa | 26 | 1,69 | 0,24 | 84 | 2,73 | 0,07 | -4,1237**** |
****= P < 0,0001 ***= P < 0,001.
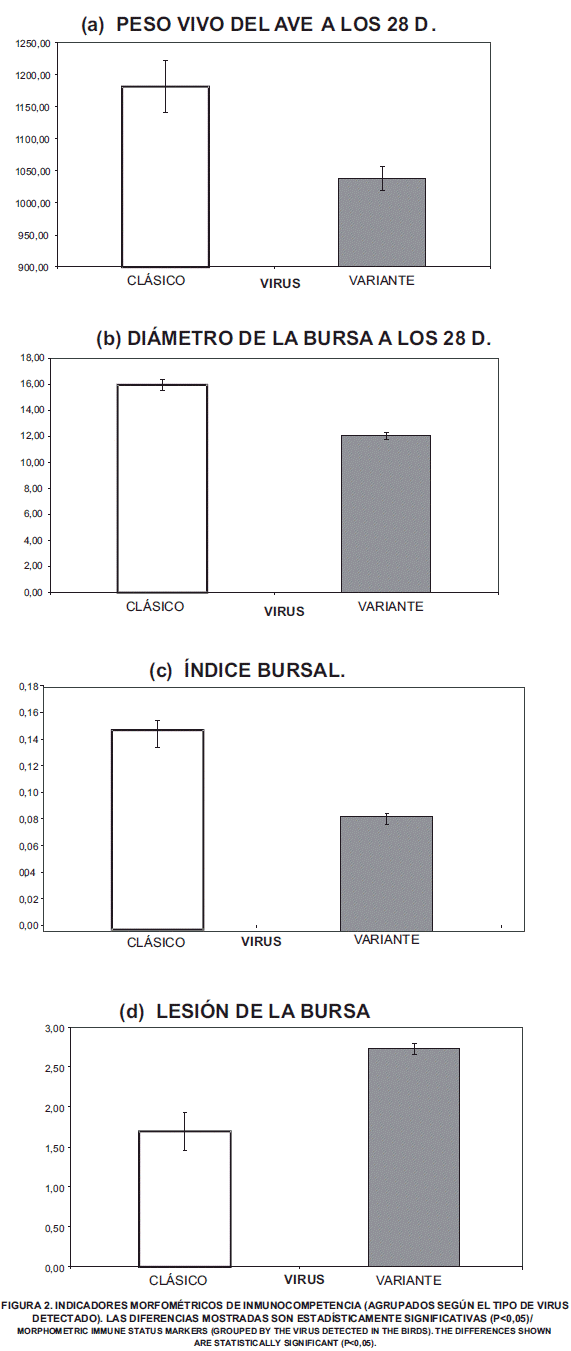
La TABLA II muestra los promedios y la significancia estadística de las diferencias entre el peso corporal de las aves, el índice bursal, así como el peso y el diámetro de la bolsa de las aves según el subtipo de virus detectado. En las aves que se detectaron cepas similares a las cepas clásicas, las bolsas fueron significativamente más grandes y pesadas que las bolsas de las aves en las que se detectaron cepas variantes. Esta diferencia se puede explicar debido a que las cepas que difieren antigénicamente (cepas variantes) de las cepas estándares producen una atrofia de la bolsa muy rápida asociada a una respuesta inflamatoria mínima [2]. Además, el peso y tamaño de la bolsa permite determinar la presencia y el tiempo de evolución de la enfermedad, en este trabajo las bolsas evaluadas presentaron un peso y tamaño compatibles con Gumboro de 5 a 8 días de evolución al coincidir con los cambios descritos por González y col. [10].
El índice bursal ha sido utilizado anteriormente como un indicador de inmunocompetencia en las aves [9]. En la presente investigación el índice peso bursa/peso vivo a los 28 días de edad, resultó significativamente menor en las aves en las que se detectó la presencia de cepas variantes, lo que demuestra el efecto detrimental de estos virus sobre el estatus inmunológico del ave. Es importante recalcar que el peso del ave esta ligado con el peso de los órganos linfoides, una variación significativa en el peso repercute en los índices morfométricos (peso bursa/peso corporal) por lo que es necesario establecer parámetros referenciales propios, para ser considerados en la toma de decisiones de la integración avícola [26].
Las aves en las que se detectaron cepas similares a las clásicas (probablemente cepas vacunales), el peso corporal fue significativamente mayor (FIG. 2a), la bolsa fue más grande y pesada (FIG. 2b) y en consecuencia, con un mejor índice bursal (FIG. 2c). Mientras en las aves en las que prevalecieron las cepas variantes, los indicadores evaluados resultaron afectados, sugiriendo un proceso activo de inmunosupresión.
El presente trabajo demuestra mediante técnicas moleculares de diagnóstico, la presencia de cepas variantes en una zona avícola del país. La información generada puede ser útil en la búsqueda de la solución a problemas sanitarios relacionados con la inmunosupresión que afecta a la industria avícola nacional. Los lotes inmunosuprimidos muestran mayor susceptibilidad a la infección con patógenos oportunistas y muestran respuestas subóptimas a la vacunación, si a esto se le agrega que el ave sufriendo la inmunosupresión no muestra signos clínicos, la solución del problema sólo es posible mediante la prevención. Una recomendación válida es la híperinmunización de las madres utilizando cepas variantes inactivadas, lo que genera una inmunidad pasiva que protege a la progenie durante las primeras semanas de vida.
CONCLUSIONES
Todas las aves muestreadas resultaron positivas para el virus de la enfermedad infecciosa de la bolsa, sugiriendo que el virus es ubicuo en la zona.
Virus provenientes de 10 de las 13 granjas muestreadas mostraron una muy alta similitud con las cepas variantes A y E, confirmando la presencia de este tipo de virus en la industria avícola nacional.
Los hallazgos histopatológicos fueron consistentes con los resultados de la prueba de RT-PCR mostrando lesiones de bolsa compatibles con IBDV en las aves infectadas.
El peso corporal de las aves, el índice bursal, así como el peso y el diámetro de la bolsa se afectaron significativamente en las granjas donde se detectó la presencia de cepas variantes en comparación con aquellas donde se detectaron las cepas vacunales.
AGRADECIMIENTO
A granjas AVIROSA y sus Médicos Veterinarios. Al Centro de Diagnóstico e Investigación Avícola (Poultry Diagnostic and Research Center) de la Universidad de Georgia, EUA. Al personal de Biológicos y Laboratorio (BIOLABCA) y al laboratorio de diagnóstico patológico Dr. Jorge Soto Bracho.
REFERENCIAS BIBLIOGRÁFICAS
1. BALAMURUGAN, V.; KATARIA, J.M. Economically important non-oncogenic immunosuppressive viral diseases of chickencurrent status. Vet. Res. Commun. 30(5):541-566. 2006. [ Links ]
2. BANDA, A.; VILLEGAS, P. Genetic characterization of very virulent infectious bursal disease viruses from Latin America. Avian Dis. 48(3):540-549. 2004. [ Links ]
3. BANDA, A.; VILLEGAS, P.; EL-ATTRACHE, J. Molecular characterization of infectious bursal disease virus from commercial poultry in the United States and Latin America. Avian Dis. 47(1):87-95. 2003. [ Links ]
4. BANDA, A.; VILLEGAS, P.; EL-ATTRACHE, J.; ESTEVEZ, C. Molecular characterization of seven field isolates of infectious bursal disease virus obtained from commercial broiler chickens. Avian Dis. 45(3):620-630. 2001. [ Links ]
5. CACURRI, G. Identificación y caracterización molecular del virus de la enfermedad infecciosa de la bolsa aislada en pollos de engorde en la región central de Venezuela. Biblioteca Dr. Piero Gallo Facultad de Ciencias Veterinarias UCV. Tesis de Grado. Pp. 90. 2005. [ Links ]
6. CARDOSO, T.C.; ROSA, A.C.; ASTOLPHI, R.D.; VINCENTE, R.M.; NOVAIS, J.B.; HIRATA, K.Y.; LUVIZOTTO, M.C. Direct detection of infectious bursal disease virus from clinical samples by in situ reverse transcriptase-linked polymerase chain reaction. Avian Pathol. 37(4):457-461. 2008. [ Links ]
7. DOLZ, R.; MAJO, N.; ORDONEZ, G.; PORTA, R. Viral genotyping of infectious bursal disease viruses isolated from the 2002 acute outbreak in Spain and comparison with previous isolates. Avian Dis. 49(3):332-339. 2005. [ Links ]
8. EWEL, J.; MADRIZ, A.; TOSI, Y. Areas geográficas. Zonas de Vida de Venezuela. 2a Ed. Caracas. Pp. 130. 1968. [ Links ]
9. GIAMBRONE, J. J.; CLAY, R. P. Evaluation of the immunogenicity, stability, pathogenicity, and immunodepressive potential of four commercial live infectious bursal disease vaccines. Poult. Sci. 65(7):1287-1290. 1986. [ Links ]
10. GONZÁLEZ, R; SILVEIRA, E.; OLAZÁBAL, E. Frecuencia y caracterización de lesiones anatomo-patológicas en la enfermedad de gumboro y enfermedades secundarias asociadas en nuestras condiciones ambientales. Estudio retrospectivo. REDVET. VI (10):1-8. 2005. [ Links ]
11. HAMOUD, M. M.; VILLEGAS, P. Identification of infectious bursal disease viruses from RNA extracted from paraffin-embedded tissue. Avian Dis. 50(4):476-482. 2006. [ Links ]
12. HAMOUD, M. M.; VILLEGAS, P.; WILLIAMS, S.M. Detection of infectious bursal disease virus from formalin-fixed paraffin-embedded tissue by immunohistochemistry and real-time reverse transcription-polymerase chain reaction. J. Vet. Diagn. Invest. 19(1):35-42. 2007. [ Links ]
13. HASSAN, M.K. Very virulent infectious bursal disease virus in Egypt: epidemiology, isolation and immunogenicity of classic vaccine. Vet. Res. Commun. 28(4):347-356. 2004. [ Links ]
14. HENRY, C.W.; BREWER, R.N.; EDGAR, S.A.; GRAY, B.W. Studies on infectious bursal disease in chickens. 2. Scoring microscopic lesions in the bursa of fabricius, thymus, spleen, and kidney in gnotobiotic and battery reared White Leghorns experimentally infected with infectious bursal disease virus. Poult. Sci. 59(5):1006-1017. 1980. [ Links ]
15. HERNÁNDEZ, M.; BANDA, A.; HERNÁNDEZ, D.; PANZERA, F.; PÉREZ, R. Detection of very virulent strains of infectious bursal disease virus (vvIBDV) in commercial broilers from Uruguay. Avian Dis. 50(4):624-631. 2006. [ Links ]
16. JACKWOOD, D.J.; COOKSON, K.C.; SOMMER-WAGNER, S.E.; LE GALLUDEC, H.; DE WIT, J.J. Molecular characteristics of infectious bursal disease viruses from asymptomatic broiler flocks in Europe. Avian Dis. 50(4):532-536. 2006. [ Links ]
17. JACKWOOD, D.J.; SOMMER-WAGNER, S. Genetic characteristics of infectious bursal disease viruses from four continents. Virol. 365(2):369-375. 2007. [ Links ]
18. JACKWOOD, D.J.; SOMMER-WAGNER, S.E. Molecular epidemiology of infectious bursal disease viruses: distribution and genetic analysis of newly emerging viruses in the United States. Avian Dis. 49(2):220-226. 2005. [ Links ]
19. JACKWOOD, D.J.; SREEDEVI, B.; LEFEVER, L.J.; SOMMER-WAGNER, S.E. Studies on naturally occurring infectious bursal disease viruses suggest that a single amino acid substitution at position 253 in VP2 increases pathogenicity. Virol. 377(1):110-116. 2008. [ Links ]
20. LETZEL, T.; COULIBALY, F.; REY, F. A.; DELMAS, B.; JAGT, E.; VAN LOON, A. A.; MUNDT, E. Molecular and structural bases for the antigenicity of VP2 of infectious bursal disease virus. J. Virol. 81(23):12827-12835. 2007. [ Links ]
21. MOSCOSO, H.; ALVARADO, I.; HOFACRE, C.L. Molecular analysis of infectious bursal disease virus from bursal tissues collected on FTA® filter paper. Avian Dis. 50(3):391-396. 2006. [ Links ]
22. MOSCOSO, H.; RAYBON, O.; HOFACRE, C.; KLEVEN, S. Molecular detection and serotyping of infectious bronchitis virus from FTA® filter paper. Avian Dis. 49(1): 24-29. 2005. [ Links ]
23. MOSCOSO, H.; THAYER, S.; HOFACRE, C.; KLEVEN, S. Inactivation, storage, and PCR detection of mycoplasma on FTA® filter paper. Avian Dis. 48(4): 841-850. 2004. [ Links ]
24. MULLER, H.; ISLAM, M. R.; RAUE, R. Research on infectious bursal diseasethe past, the present and the future. Vet. Microbiol. 97(1-2):153-165. 2003. [ Links ]
25. MUNDT, E. Tissue culture infectivity of different strains of infectious bursal disease virus is determined by distinct amino acids in VP2. J. Gen. Virol. 80 (8):2067-2076. 1999. [ Links ]
26. PEROZO M., F.; NAVA, J.; MAVAREZ, Y. Caracterización morfométrica de los órganos linfoides en pollos de engorde de la línea Ross criados bajo condiciones de campo en el estado Zulia, Venezuela. Rev. Científ. FCV-LUZ. XIV (3):217-225. 2004. [ Links ]
27. PEROZO, F.; VILLEGAS, P.; ESTEVEZ, C.; ALVARADO, I.; PURVIS, L. B. Use of FTA® filter paper for the molecular detection of Newcastle disease virus. Avian Pathol. 35(2):93-98. 2006. [ Links ]
28. PURVIS, L. B.; VILLEGAS, P.; PEROZO, F. Evaluation of FTA® paper and phenol for storage, extraction and molecular characterization of infectious bursal disease virus. J. Virol. Meth. 138(1-2):66-69. 2006. [ Links ]
29. QUIROZ, C; INFANTE, D. Primer aislamiento en Venezuela del virus de la enfermedad infecciosa de la bursa (Gumboro). Vet. Trop. (09): 39 - 46. 1984. [ Links ]
30. RAUW, F.; LAMBRECHT, B.; VAN DEN BERG, T. Pivotal role of ChIFNgamma in the pathogenesis and immunosuppression of infectious bursal disease. Avian Pathol. 36(5):367-374. 2007. [ Links ]
31. STATISTICAL ANALYSIS SYSTEM INSTITUTE (SAS). V.8,1. Institute, Cary, NC. 1998. [ Links ]
32. SELLERS, H.S.; VILLEGAS, P.N.; SEAL, B.S.; JACKWOOD, D.J. Antigenic and molecular characterization of three infectious bursal disease virus field isolates. Avian Dis. 43(2):198-206. 1999. [ Links ]
33. SREEDEVI, B.; LEFEVER, L. J.; SOMMER-WAGNER, S.E.; JACKWOOD, D. J. Characterization of infectious bursal disease viruses from four layer flocks in the United States. Avian Dis. 51(4):845-850. 2007. [ Links ]
34. VAN LOON, A. A.; DE HAAS, N.; ZEYDA, I.; MUNDT, E. Alteration of amino acids in VP2 of very virulent infectious bursal disease virus results in tissue culture adaptation and attenuation in chickens. J. Gen. Virol. 83 (Pt 1):121-129. 2002. [ Links ]












 uBio
uBio