Revista Científica
versión impresa ISSN 0798-2259
Rev. cient. (Maracaibo) v.20 n.3 Maracaibo jun. 2010
Perfil de la flora bacteriana vaginal. Un riesgo potencial para la reproducción de vacas criollo limonero
Profile of vaginal bacterial flora. A potential risk for reproduction in criollo limonero cows
Julio Boscán Ocando1*, Sunny Zambrano Nava2, Jexenia Nava3 y Germán Portillo Martínez1
1Unidad de Investigación en Reproducción Animal (UNIRA).
2Instituto Nacional de Investigaciones Agrícolas (INIA).
3Estudiante de Especialidad en Reproducción Animal, Facultad de Ciencias Veterinarias, Universidad del Zulia. Maracaibo, Venezuela. * julioboscan@cantv.net
RESUMEN
El objetivo del presente estudio fue determinar la población bacteriana vaginal de la vaca Criollo Limonero. Se tomaron muestras que consistieron en hisopados por duplicado a nivel del fornix de la vagina anterior, las cuales se sometieron a cultivos bacterianos en ambiente aerobio/anaerobio y pruebas bioquímicas convencionales para el aislamiento. De 102 hisopados se lograron 55 crecimientos (53,9%) y 47 sin crecimiento (46,1%). Los 55 crecimientos se distribuyeron de varias maneras: 23 (41,82%) aerobios y 32 (58,18%) anaerobios; 29 (52,72%) aislamientos puros y 26 (47,27%) aislamientos mixtos. Las bacterias Gram positivas predominaron (81,82 y 73,08%), con respecto a las Gram negativas (18,18 y 26,92%), tanto en aerobiosis como en anaerobiosis, respectivamente. Las bacterias más aisladas fueron Arcanobacterium pyogenes (22,92%), Staphilococcus aureus (15,63%), Staphylococcus coagulasa negativo (17,71%), Erysipelothrix rhusiopathiae (6,25%), Bacteroides spp. (13,54%) y Peptostreptococcus spp. (7,29%). En conclusión, se identificaron las bacterias que forman parte de la flora bacteriana vaginal de la vaca Criollo Limonero, su distribución en cuanto a especie, género, exigencia de oxígeno, tipo de aislamiento, tinción de Gram y potencial de patogenicidad son discutidos.
Palabras clave: Vacas, postparto, criollo limonero, flora vaginal, bacterias.
ABSTRACT
The objective of the current study was to determine the population of vaginal bacteria in Criollo Limonero cows. Two swabs from every cow were taken at the level of the fornix for bacterial isolation with biochemical test. From 102 swabs, 55 achieved bacterial growth (53.9%) and 47 did not get to any bacterial growth (46.1%). The 55 samples that achieved bacterial growth were distributed as follows: 23 (41.82%) aerobic bacteria and 32 (58.18%) anaerobic bacteria; 29 (52.72%) pure isolations and 26 (47.27%) mixed isolations. Gram positive bacteria were predominant (81.82 and 73.08%) compared to Gram negative bacteria (18.18 y 26.92%), both in aerobic and anaerobic media, respectively. Predominant bacteria were Arcanobacterium pyogenes (22.92%), Staphylococcus aureus (15.63%), Staphylococcus coagulase negative (17.71%), Erysipelothrix rhusiopathiae (6.25%), Bacteroides spp. (13.54%) and Peptostreptococcus spp. (7.29%). In conclusion, vaginal bacterial flora from Criollo Limonero cows were identified, in reference to the distribution of their specie, genus, oxygen requirements, type of isolation, Gram stain and potential pathogenic capacity were discussed.
Key words: Cows, postpartum, criollo limonero, vaginal flora, bacteria.
Recibido: 17 / 04 / 2009. Aceptado: 08 / 09 / 2009.
INTRODUCCIÓN
La vagina es un órgano que posee diversas funciones: es el conducto excretor del útero, órgano femenino del coito, y conducto del parto; su permeabilidad permite el paso de medicamentos, tiene capacidad inmunitaria y actúa como medio de depuración o defensa contra los microorganismos [2, 5, 13]. La vagina, al igual que la vulva y el cervix, presentan diferentes barreras de protección contra las bacterias que ascienden al tracto genital, siendo cada uno de estos órganos una barrera física. A su vez, el moco secretado actúa como barrera fisiológica; la invasión de polimorfonucleares describe una barrera inmune en respuesta a los desafíos bacterianos y los procesos inflamatorios como último freno para la defensa del genital ante la invasión microbiana [1, 5, 13, 15].
La vagina de varias especies de mamíferos, entre ellas, la vaca (Bos taurus-indicus), la oveja (Ovis aries), la cabra (Capra hircus), la perra (Canis familiaris) y la mujer (Homo sapiens), presentan una flora microbiana mixta, compuesta por microorganismos aerobios, anaerobios facultativos y anaerobios estrictos [2, 5, 6, 9, 12, 16, 18]. Esta mezcla de microorganismos incluyen a los saprofitos, patógenos potenciales y oportunistas, ellos están adaptados al modo de vida no invasivo, determinados por las limitaciones del ambiente, es decir, pueden proliferar y producir enfermedades si son introducidos en localizaciones extrañas [2, 16]. Bajo condiciones naturales, el ambiente de la vagina bovina, no permite la proliferación excesiva de microorganismos patógenos o saprofitos potencialmente patógenos [9], debido a que este ambiente sufre variaciones en cuanto a temperatura, humedad, pH, presencia de nutrientes, sustancias inhibitorias, entre otras [2, 4, 5].
La microbiología normal de la vagina está compuesta en su mayoría por bacterias y en una menor proporción por hongos, consiguiendo que las bacterias más comunes son las aerobias, entre ellas, las del grupo de los Staphylococcus, Streptococcus y Coliformes [1, 2, 4, 9, 11, 12, 16]. Asimismo, las anaerobias juegan un papel interesante en la microflora vaginal de la vaca. Entre las más señaladas se encuentran, las del género Lactobacillus, Fusobacterium y Peptostreptococcus; en un menor grado, se han aislado hongos del género Aspergillus y Penicillium [2, 6, 9, 11, 12, 18]. Otro microorganismo de carácter facultativo en cuanto a exigencias de oxígeno para su crecimiento es el Arcanobacterium pyogenes, reportado por varios autores [1, 2, 12].
Desde hace muchos años, se ha venido investigando sobre los microorganismos que residen temporal o permanentemente en el tracto genital de la hembra bovina, siempre con el interés de hacer lo más rentable posible la vida útil de la vaca, tanto productiva como reproductivamente [2, 10-12, 14, 15]. Por ser el útero el órgano donde se facilita la gestación, ha existido gran interés en conocer que tipo de microorganismos pueden ejercer alteraciones en la homeostasis uterina [1, 10, 13, 14]. Es así como surge la necesidad de identificar estos microorganismos y dar respuestas clínicas y terapéuticas en el momento que una vaca presente un proceso infeccioso que repercuta en su producción y reproducción. Por tanto, el objetivo de este estudio fue determinar el perfil de la población bacteriana de la vagina sana de la vaca Criollo Limonero.
MATERIALES Y MÉTODOS
Localización del experimento
El experimento se desarrolló durante el mes de agosto del año 2006 en la Estación Experimental Carrasquero (hacienda Laral), perteneciente al Instituto Nacional de Investigaciones Agrícolas (INIA) con ganaderías de Criollo Limonero ubicadas en el sector Playa Bonita, municipio Mara del estado Zulia, Venezuela. Esta es una zona agroecológica catalogada como de bosque seco tropical, con pluviosidad de 929 mm/año, una humedad relativa de 76% (67-91%) y una temperatura ambiental de 27,4°C (19,7-35,2°C). Los suelos son inundables de origen aluvial (Fuente MINAMB).
Unidades experimentales
Se utilizaron 51 vacas Criollo Limonero que conforman el rebaño de ordeño, seleccionadas al azar y tomando en cuenta aquellas vacas con más de 90 días postparto con una condición corporal de mínimo 2,75 en una escala del 1 al 5, para garantizar un óptimo estado nutricional postparto. Asimismo, las vacas debían cumplir satisfactoriamente un examen clínico general y específico de la vulva y vagina antes de ingresar al experimento, para descartar posibles patologías reproductivas. Estas vacas fueron manejadas bajo las mismas condiciones como un sólo rebaño. Las mismas fueron alimentadas en potreros de pasto Alemán (Echinochloa polystachya), donde se les suministraba agua, una mezcla de sal común (NaCl) y minerales ad libitum.
Todas las vacas del experimento estaban en ordeño, el cual se realizaba dos veces al día (mañana y tarde), manualmente y sin apoyo del becerro, por lo que se les suministraba 1 kg de alimento concentrado comercial para el apoyo o bajada de la leche.
Colección de la muestra a través del hisopado vaginal
Se utilizaron hisopos estériles de 45 cm de longitud diseñados comercialmente para la toma de muestras uterinas (Equivet®, Kruuse). La técnica empleada siguió los siguientes pasos: Previo a una limpieza y desinfección del área vulvar con agua y solución de yodo povidona al 7%, se procedió a abrir los labios vulvares con el fin de introducir el hisopo hacia el fornix anterior de la vagina, muy cerca del cervix realizando movimientos circulares. A cada vaca se le tomaron dos hisopados vaginales para ser transportados asépticamente y colocados en medios de transportes estériles repartidos en tubos de vidrio con tapa de baquelita. Uno de los hisopos fue insertado en un medio de transporte apropiado para preservar los microorganismos aerobios (medio Cary and Blair®, BBL, Becton Dickinson) y el otro hisopo fue insertado en un medio de transporte apropiado para preservar los microorganismos anaerobios (medio Thioglycollate®, HIMEDIA) [3, 8].
Una vez que los hisopos estaban colocados en el interior de los medios de transporte, se organizaron en gradillas para mantenerlas en una cava de anime a temperatura ambiente para llevarlos al laboratorio de investigación de la cátedra de Enfermedades Infecciosas de la Facultad de Ciencias Veterinarias de la Universidad del Zulia.
Procedimiento de laboratorio
Inoculación primaria de las muestras. El hisopo proveniente del medio Cary and Blair fue sembrado en dos placas de agar sangre (BBL, Becton Dickinson) y agar MacConkey (BBL, Becton Dickinson) e incubados en una estufa de cultivo (FANEM®, 002CB, Sao Paolo-Brasil) a 37°C en 48 horas, para el aislamiento de bacterias aerobias. El hisopo proveniente del medio Thioglycollate fue sembrado en agar chocolate y agar MacConkey. Estos agares fueron ubicados en jarras Gas Pack® (BBL, Becton Dickinson) para proporcionar un medio anaerobio durante la incubación a 37°C en 48 horas.
Protocolo de aislamiento de bacterias aerobias. El protocolo de aislamiento para bacterias aerobias se realizó bajo las recomendaciones de dos fuentes bibliográficas: Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica [3, 8]. Los hisopos se inocularon en placas de agar sangre y agar MacConkey y se incubaron a 37°C en 48 horas. Luego, se identificaron los microorganismos obtenidos de los cultivos siguiendo las especificaciones descritas [7].
A los cocos Gram positivos se les sometió a las siguientes pruebas bioquímicas: Catalasa, Oxidasa® (Sigma), Coagulasa, Rojo de Metilo® (BBL, Becton Dickinson), Voges Proskaüer® (BBL, Becton Dickinson), Prueba de CAMP, metabolismo de azucares (Manitol®, Trealosa®, Arabinosa®, Rhamnosa®, Glucosa®, Salicin®, Dulcitol®, Maltosa®, Esculina®; SIGMA) y aminoácido (Ornitina®, SIGMA), Triple Azúcar Hierro® (BBL, Becton Dickinson) e Indol® (BBL, Becton Dickinson).
A los cocobacilos y bacilos Gram positivos se les sometió a las siguientes pruebas bioquímicas: Catalasa, Oxidasa, Verde Malaquita® para tinción de espora (Merck), Coagulasa, Rojo de Metilo, Voges Proskauer, Prueba de CAMP, metabolismo de azucares (Manitol, Trealosa, Arabinosa, Rhamnosa, Glucosa, Salicin, Dulcitol, Maltosa, Esculina) y aminoácido (Ornitina), Triple Azúcar Hierro, Motilidad® (BBL, Becton Dickinson) e Indol.
Protocolo de aislamiento de bacterias anaerobias. Los hisopos se inocularon en placas de agar sangre y agar MacConkey y se colocaron en Jarras Gas Pack® con sobres de anaerobiosis para incubarlos a 37°C durante 48 horas. Luego, se identificaron los microorganismos obtenidos de los cultivos siguiendo las especificaciones descritas [3, 7].
A los cocobacilos y bacilos Gram negativos se les sometió a las siguientes pruebas bioquímicas: Catalasa, Oxidasa, Tinción de Espora, Coagulasa, Rojo de Metilo, Voges Proskauer, Prueba de CAMP, metabolismo de azucares (Manitol, Trealosa, Arabinosa, Rhamnosa, Glucosa, Salicin, Dulcitol, Maltosa, Esculina) y aminoácido (Ornitina), Triple Azucar Hierro (TSI), Motilidad e Indol.
Análisis estadístico
El diseño experimental correspondió a un análisis descriptivo, considerando como variable de estudio el crecimiento o aislamiento bacteriano. De igual forma se analizó la proporción de bacterias aisladas de tipo aerobia y anaerobia, de acuerdo a la tinción de Gram (Gram positivas o Gram negativa), además de recopilar los crecimientos puros o mixtos y su distribución de acuerdo a su patogenicidad. Se procedió a realizar la caracterización de la flora de todas las vacas del experimento y a la identificación y clasificación de cada uno de los microorganismos encontrados.
Todos los datos recopilados durante el ensayo fueron colectados y codificados electrónicamente, luego detallados como proporciones de ocurrencia y analizados mediante el programa informático Microsoft® Office Excel 2003 (Microsoft Corporation, EUA).
RESULTADOS Y DISCUSIONES
Aislamiento bacteriano
Se aislaron bacterias en 40 vaginas clínicamente sanas de un total de 51, correspondiéndose con un 78,43% de crecimiento bacteriano. En consecuencia, no se lograron aislamientos bacterianos en 11 vaginas clínicamente sanas, representando un 21,57%. La ocurrencia de aislamiento bacteriano está representada en la FIG. 1.
Aislamiento de bacterias aerobias
Se obtuvieron 44 aislamientos de tipo aerobios de un total de 96 aislamientos bacterianos. Estos aislamientos aerobios derivaron de 23 vaginas clínicamente sanas de un total de 40 que presentaron crecimiento bacteriano, correspondiéndose con un 45,83% de crecimiento aerobio. Las bacterias aerobias aisladas con mayor frecuencia fueron el Arcanobacterium pyogenes, Staphylococcus epidermidis, Erysipelothrix rhusiopathiae, Staphylococcus aureus y Escherichia coli. El total de especies de bacterias aerobias aisladas están representadas en la TABLA I.
TABLA I. ESPECIE DE BACTERIAS AEROBIAS AISLADAS DE VAGINAS CLÍNICAMENTE SANAS DE VACAS CRIOLLO LIMONERO / SPECIES OF AEROBIC BACTERIA ISOLATED FROM CLINICALLY HEALTHY VAGINAS OF CRIOLLO LIMONERO COWS
| Especies de bacterias aerobias aisladas | Número de aislamiento | Ocurrencia (%) |
| Arcanobacterium pyogenes | 12 | 27,27 |
| Staphylococcus epidermidis | 11 | 25,oo |
| Erysipelothrix rhusiopathiae | 6 | 13,64 |
| Staphylococcus aureus | 5 | 11,36 |
| Escherichia coli | 4 | 9,09 |
| Providencia stuartii | 2 | 4,54 |
| Staphylococcus saprophyticcus | 1 | 2,27 |
| Providencia spp. | 1 | 2,27 |
| Pseudomona aeruginosa | 1 | 2,27 |
| Total | 44 | 100 |
De estos 44 aislamientos bacterianos, los más frecuentes fueron: Arcanobacterium pyogenes (27,27%), Staphylococcus epidermidis (25%), Erysipelothrix rhusiopathiae (13,64%), Staphylococcus aureus (11,36%) y Escherichia coli (9,09%). Desde el punto de vista de la tinción de Gram, de los 44 aislamientos logrados en laboratorio, 36 bacterias (81,82%) se colorearon Gram positivo y 8 bacterias (18,18%) se colorearon Gram negativo (TABLA II). Cabe destacar que no se observaron cocos Gram negativos.
TABLA II. AISLAMIENTOS BACTERIANOS AGRUPADOS DE ACUERDO A LA TINCIÓN DE GRAM Y TIPO DE CRECIMIENTO EN VACAS CRIOLLO LIMONERO / BACTERIAL ISOLATIONS GROUPED ACCORDING TO GRAM STAIN AND TIPE OF GROWTH IN CRIOLLO LIMONERO COWS
| Aislamientos | Número aislamiento | Gram (%) | Número vaginas | Tipo de Crecimiento (%) | ||
| Positivas | Negativas | Puros | Mixtos | |||
| Aerobias | 44 | 81,82 | 18,18 | 23 | 39,13 | 60,87 |
| Anaerobias | 52 | 73,08 | 26,92 | 32 | 62,5 | 37,5 |
Aislamiento de bacterias anaerobias
Se obtuvieron 52 aislamientos anaerobios de un total de 96 aislamientos bacterianos. Estos aislamientos anaerobios derivaron de 32 vaginas clínicamente sanas de un total de 40, correspondiéndose con un 54,17%. Las bacterias anaerobias aisladas con mayor frecuencia fueron el Staphylococcus aureus, Staphylococcus intermedius, Arcanobacterium pyogenes, Peptostreptococcus spp. y Bacteroides spp. El total de especies de bacterias anaerobias aisladas del muestreo están representadas en las TABLA III.
TABLA III. ESPECIE DE BACTERIAS ANAEROBIAS AISLADAS DE VAGINAS CLÍNICAMENTE SANAS DE VACAS CRIOLLO LIMONERO / SPECIES OF ANAEROBIC BACTERIA ISOLATED FROM CLINICALLY HEALTHY VAGINAS OF CRIOLLO LIMONERO COWS
| Especies de bacterias anaerobias aisladas | Número de aislamiento | Ocurrencia (%) |
| Staphylococcus aureus | 10 | 19,23 |
| Arcanobacterium pyogenes | 10 | 19,23 |
| Peptostreptococcus spp. | 7 | 13,46 |
| Bacteroides spp. | 7 | 13,46 |
| Staphylococcus intermedius | 4 | 7,69 |
| Bacteroides melaninogénicus | 3 | 5,77 |
| Staphylococcus xilosa | 2 | 3,84 |
| Staphylococcus epidermidis | 2 | 3,85 |
| Staphylococcus hyicus | 2 | 3,84 |
| Bacteroides vulgatus | 2 | 3,84 |
| Bacteroides nodosus | 1 | 1,92 |
| Staphylococcus sacharolyticcus | 1 | 1,92 |
| Escherichia coli | 1 | 1,92 |
| Total | 52 | 100 |
De estos 52 aislamientos bacterianos, se encontró que Bacteroides spp. fue localizado en un 24,99% (sumatoria de todos los aislados del género Bacteroides), Staphylococcus aureus en un 19,23%, Arcanobacterium pyogenes se aisló en un 19,23%, Peptostreptococcus spp. se encontró en un 13,46% y Staphylococcus intermedius se identificó en un 7,69%. Desde el punto de vista de la tinción de Gram, de los 52 aislamientos logrados en laboratorio 38 bacterias (73,08%) se colorearon Gram positivo y 14 bacterias (26,92%) se colorearon Gram negativo (TABLA II).
Del total de vaginas con crecimiento bacteriano (aerobio, 23 y anaerobio, 32) durante el estudio, se organizaron en dos grupos: crecimientos puros y crecimientos mixtos (TABLA II). El primer grupo se definió como aquel donde se desarrolló un solo tipo de bacteria en el agar sangre, mientras el segundo grupo se definió como aquel donde se desarrollaron más de dos bacterias en el agar sangre. De esta manera se encontró que, de todos los crecimientos bacterianos reportados, 9 (39,13%) y 20 (62,5%) correspondieron a crecimientos puros en ambiente aerobio y anaerobio, respectivamente; mientras que 14 (60,87%) y 12 (37,5%) correspondieron a crecimientos mixtos en ambiente aerobio y anaerobio, respectivamente. En resumen, sobre un total de 102 hisopados vaginales, se encontraron 29 aislamientos puros (28,43%), 26 aislamientos mixtos (25,49%) y 47 hisopados sin lograr aislamientos (46,09%).
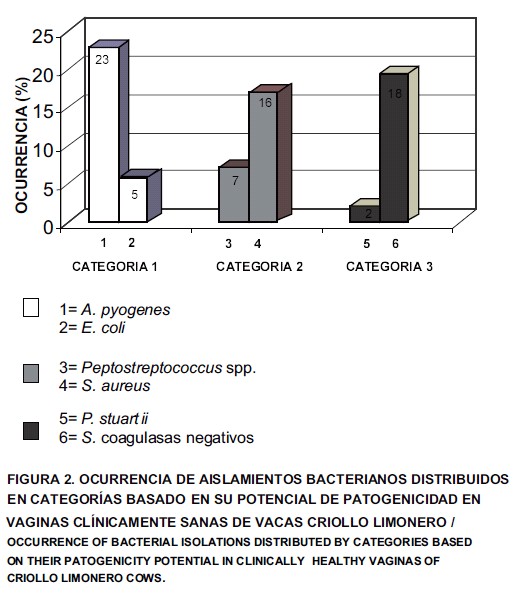
En base al potencial de patogenicidad, las bacterias que afectan al útero en el posparto temprano se han categorizado en tres grupos [14, 15]: bacterias que causas endometritis con frecuencia (categoría 1); bacterias que causan esporádicamente endometritis (categoría 2) y bacterias reconocidas como no patógenas (categoría 3). Con base en lo anteriormente citado, como se observa en la FIG. 2, se puede deducir que se aislaron bacterias de los tres grupos mencionados. Dentro del grupo de las bacterias que causan frecuentemente endometritis, se aislaron Arcanobacterium pyogenes (23%) y Escherichia coli (5%); dentro del grupo de las bacterias que causan esporádicamente endometritis, se aislaron Peptostreptococcus spp. (7%) y Staphylococcus aureus (16%) y dentro del grupo de las bacterias no patógenas uterinas, se aislaron Providencia stuartii (2%) y Staphylococcus coagulasa negativo (18%).
Analizando las bacterias aerobias y anaerobias que se aislaron en forma pura, se ilustró su implicación en desarrollar procesos de enfermedad [16]. En general, se encontraron ocurrencias bajas en los aislamientos puros, siendo A. pyogenes (12,5%) la bacteria que se aisló con mayor frecuencia de manera pura, seguido de S. aureus (5%), Bacteroides spp. (5%) y Peptostreptococcus spp. (5%); las demás bacterias estuvieron por debajo del 4% (FIG. 3).
Similares resultados han sido reportados. Estas bacterias se han aislado en estudios anteriores en vacas [2, 4, 9, 11, 12], en cabras [1], en perras [16] y en mujeres [18]. Por otro lado, en 11 vaginas clínicamente sanas (21,57%), no pudo ser posible el aislamiento bacteriano, reportado también por otros autores, donde trabajaron con 142 vacas para su experimento y sólo una de ellas produjo resultados negativos a crecimiento bacteriano (0,70%) [11]. En otro estudio, del 25% de las cabras en la primera semana postparto no se generaron crecimientos bacterianos [1], mientras otros investigadores encontraron un 9% de hisopados sin desarrollo bacteriano [16].
Dentro de las bacterias aerobias aisladas, Arcanobacterium pyogenes fue la bacteria con mayor frecuencia de aislamiento, tanto en el grupo de bacterias aerobias (27,27%) como de bacterias anaerobias (19,23%), concordando con otros hallazgos reportados; aislando con predominancia además de esta bacteria a S. aureus y E. coli [1]. Estos datos coinciden exactamente con este estudio, debido a que estas bacterias presentaron proporciones considerables de 11,36 y 9,09%, respectivamente. Arcanobacterium pyogenes representó el 16% de las bacterias aisladas, pero en vacas repetidoras (3 o más servicios) [11]. En un estudio más reciente, de un total de 55 hisopados a vaginas clínicamente sanas, se encontró en un 24% A. pyogenes [12].
La ocurrencia del S. aureus fue de 11,36 y 19,23%, tanto en el grupo de bacterias aerobias como de anaerobias, respectivamente. En otros estudios, esta bacteria se encontró en vacas clínicamente sanas en un 20% [12] y en un 15,4% [2]. En vagina y cervix de cabras, a los 4 días postparto se reportaron ocurrencias elevadas de 31,8% [1] y en perras clínicamente sanas se encontraron aislamientos como Staphylococcus spp. del 39% [16]. Otros autores no reportaron esta bacteria en vacas con buena fertilidad [11]. En el mismo sentido, en vacas clínicamente sanas en diferentes fases del ciclo estrual y vacas gestantes, se obtuvieron bajos porcentajes de ocurrencia de 2,5 y 1,7%, respectivamente, no encontrando aislamientos de esta bacteria en vacas en el postparto temprano [4].
Otro Staphylococcus encontrado frecuentemente en este estudio fue S. epidermidis con un 25% de ocurrencia, coincidiendo con los hallazgos encontrados por otros investigadores [11], los cuales reportaron un 19 y 17% en vacas con fertilidad normal y repetidoras de servicios, respectivamente. En otro experimento más reciente, se estudió la flora bacteriana vaginal de novillas sanas durante su crecimiento y desarrollo, encontrando un elevado contaje de S. epidermidis de 102 a 104 unidades formadoras de colonias (UFC) [9]. De igual manera, se reportó una ocurrencia del 20,5% para esta bacteria [2]. Sin embargo, otros estudios lograron aislar otros Staphylococcus (S. albus, S. citreus, S. aureus) [4]. El Erysipelothrix rhusiopathiae presentó una ocurrencia del 13,64%, coincidiendo solamente con otro experimento en vaginas clínicamente sanas, hallando una ocurrencia del 2% [12].
Dentro de las bacterias anaerobias aisladas, el Peptostreptococcus spp. presentó una frecuencia de aislamiento de un 13,46%, coincidiendo con los datos obtenidos por otros autores [18], quienes mediante la amplificación por reacción en cadena de la polimerasa (PCR) y un análisis filogenético a cinco vaginas humanas adultas, premenopáusicas y clínicamente sanas, han encontrado esta bacteria anaerobia con una baja frecuencia. En el mismo orden de ideas, se encontró una ocurrencia del 18% de este género de bacteria, predominando dos especies, P. tetrans (9%) y P. anaerobius (5%) [12].
Otro germen anaerobio encontrado con una alta frecuencia fue la bacteria del género Bacteroides spp. reportándose un 24,99% del total de crecimientos logrados. En otro estudio se obtuvo resultados contradictorios al no aislar esta bacteria en las vaginas clínicamente sanas de vacas [12]. Asimismo, se aislaron bacterias anaerobias pleomórficas sin llegar a una identificación clara con una ocurrencia del 2% [11]. En resumen, la mayoría de los autores citados no determinaron la presencia de bacterias anaerobias en la vagina y únicamente reportaron los crecimientos bacterianos aislados bajo ambiente aerobio.
Otro grupo de bacterias aisladas en este estudio fueron las enterobacterias, reflejando una ocurrencia del 9%. En otros hallazgos se aislaron un número mayor de enterobacterias (36%) en vacas con una buena fertilidad [11]. Autores trabajando con perras encontraron una frecuencia de aislamiento del 21% de enterobacterias [16]. Otro estudio reporta ocurrencias de hasta un 27% en vaginas clínicamente sanas de vacas [12]. Concordantemente, en otro reporte se logró una alta ocurrencia de enterobacterias de 41,5% en vaginas clínicamente sanas [2]. Estos resultados son confirmados en un estudio en cervix de vacas, donde se reporta un 47,1% de enterobacterias [4]. Al igual que los reportes anteriores, estudiando la flora bacteriana de la vagina de cabras postparto, se describe una elevadísima ocurrencia de enterobacterias del 86% [1]. Caso contrario, en hallazgos provenientes de vaginas clínicamente sanas de novillas, se encontraron niveles bajos de enterobacterias de 100 a102 UFC durante el período de estudio [9].
Sobre los aislamientos puros y mixtos reportados en este estudio, se correlacionan en gran parte con los datos encontrados por otros investigadores en vaginas clínicamente sanas de perras, donde existió predominancia marcada de los aislamientos puros (49%) con respecto a los aislamientos mixtos (24%) [16]. En otro estudio, se reportaron de un total de 16 hisopados recobrados de vaginas de cabras en el postparto temprano, 9 aislamientos fueron puros (56,25%) y 3 aislamientos fueron mixtos (18,75%) [1]. Resultados contrastantes se encontraron cuando se reflejó una predominancia marcada de los aislamientos mixtos (91,66%) sobre los aislamientos puros (6,9%) [11].
Los hallazgos microbiológicos obtenidos en este estudio sugieren que, las bacterias aisladas de los hisopados de vaginas clínicamente sanas de vacas Criollo Limonero, forman parte de la microflora normal, demostrado por otros estudios [1, 2, 4, 9, 11, 12, 16]. Esta microflora, a pesar de no producir enfermedad en el animal, está representada por bacterias saprofitas, patógenos potenciales y oportunistas [2, 4]. La flora vaginal se modifica al parto y postparto temprano alterándose el equilibrio biológico debido a la contaminación espontánea y/o provocada [4, 9, 15], ocurriendo en muchos casos el ascenso de bacterias al tracto uterino, contaminándolo y generando respuestas inflamatorias, resultando en una fertilidad disminuida [9, 12, 15, 17].
Con respecto al tipo de aislamiento, los datos confirman los resultados obtenidos por otros autores al mencionar que A. pyogenes es uno de los principales gérmenes bacterianos oportunistas de la vagina, que sólo espera condiciones favorables como la alteración de los mecanismos fisiológicos de defensa de la vagina y el útero, de esta manera debilitándose la resistencia local y sistémica de la vaca [2, 4, 12, 14, 15]. Bajo este ambiente, la virulencia aumenta y la proliferación de la bacteria es iniciada dejando su papel de oportunista para convertirse en patógeno.
En el presente estudio se aislaron bacterias que, a pesar de pertenecer a la flora normal de la vagina, algunas de ellas están descritas como patógenas oportunistas, es decir, en situaciones favorables causarán infecciones y otras descritas como saprofitas, es decir, raramente causarán infecciones. Estas afirmaciones, permiten tomar en cuenta la flora vaginal en momentos donde la vaca enfrente situaciones adversas durante y después del parto como distocia, retención placentaria, cervicitis, vaginitis, metritis, endometritis y piómetra; de esta manera reunir herramientas terapéuticas y de manejo para curar y prevenir estas patologías reproductivas y minimizar los efectos desfavorables sobre la eficiencia reproductiva y la producción de leche.
CONCLUSIONES
Los hallazgos permiten demostrar que en la vagina normal de la vaca Criollo Limonero residen microorganismos bacteriales con variada exigencias de oxígeno, tinción de Gram y potencial de patogenicidad que bajo condiciones de estudio conforman la flora normal del postparto temprano.
El aislamiento de Arcanobacterium pyogenes (27,27 y 19,23%, en ambiente aerobio y anaerobio, respectivamente) demuestra que en el ambiente vaginal residen bacterias con potencial de patogenicidad categoría 1, es decir, que causan frecuentemente endometritis. Los resultados de este estudio sientan las bases para futuras investigaciones sobre patógenos potenciales que causan procesos infecciosos uterinos en las vacas del trópico y profundizar en la pertinencia y correlación microbiológica, clínica y reproductiva.
AGRADECIMIENTO
Los autores expresan su agradecimiento al Consejo de Desarrollo Científico y Humanístico (CONDES) de LUZ, por el financiamiento económico otorgado al Proyecto Nº CC-354-06 y al INIA por el apoyo logístico y financiero para poder cumplir con los objetivos planteados.
REFERENCIAS BIBLIOGRÁFICAS
1. Ababneh, M.M.; Degefa, T. Bacteriological findings and hormonal profiles in the postpartum balady goats. Reprod. Dom. Anim. 41: 12-16. 2006. [ Links ]
2. Alba, L.O.; Silveira, E.A. La leucorrea vaginal bovina de carácter no inflamatorio y su significación clínica. Rev. Electr. de Vet. REDVET. VII(10). 2006. Octubre. En línea: http://www.veterinaria.org/revistas/redvet/n101006.html. 24 de abril de 2006. [ Links ]
3. Alcalá, L.; Betriu, C.; GarcÍa, J.E.; Reig, M. Bacterias Anaerobias. 2004. En: Procedimientos en Microbiología Clínica. Emilia Cercenado y Rafael Canton (Eds). Sociedad Española de Enfermedades infecciosas y Microbiología Clínica. Cap. 16: 1-40. En Línea: http://www.seimc.org/documentos/protocolos/microbiología/cap16.pdf. 24 de abril de 2006. [ Links ]
4. FERNÁNDEZ, A.; SILVEIRA, E.A.; LÓPEZ, O.F. Las infecciones uterinas en la hembra bovina. Rev. Electr. de Vet. REDVET. VII, (10). 2006. Octubre. En Línea: http://www.veterinaria.org/revistas/redvet/n101006.html. 24 de abril de 2006. [ Links ]
5. Hafez, E.S.E.; Hafez, B. Anatomía funcional de la reproducción: Reproducción e Inseminación Artificial en Animales. 7ma Ed, Mc Graw-Hill Interamericana Editores. 519 pp. 2002. [ Links ]
6. Hill, J.E.; Han G., S.; Money, D.M.; Doyle, M.; Li, A.; Crosby, W.L.; Links, M.; Leung, A.; Chan, D.; Hemmingsen, S.M. Characterization of vaginal microflora of healthy, nonpregnant women by chaperonin-60 sequence-based methods. Am J of Obstetr and Gynecol. 193: 682-692. 2005. [ Links ]
7. Mac Faddin, J.F. Identification schemas. Section III. In: Biochemical test for identification of medical bacterial. 3th Ed. Lippincott Williams and Wilkins (Publisher). USA. Pp 483-624. 2000. [ Links ]
8. Noakes, D.E.; Wallace, L.; Smith, G.R. Bacterial flora of the uterus of cows after calving on two hygienically contrasting farms. The Vet. Rec. 128: 440-442. 1991. [ Links ]
9. Otero, C.; Saavedra, L.; Silva de Ruiz, C.; Wilde, O.; Holgado, A.R.; Nader-Macías, M.E. Vaginal bacterial microflora modifications during the growth of healthy cows. Lett. in Appl. Microbiol. 31(3): 251-254. 2000. [ Links ]
10. Padula, A.M.; Macmillan, K.L. Effect of treatment with two intravaginal inserts on the uterine and vaginal microflora of early postpartum beef cows. Aust. Vet. J. 84(6): 204-208. (Abstr.). 2006. [ Links ]
11. Panangala, V.S.; Fish, N.A.; Barnum, D.A. Microflora of the cervico-vaginal mucus of repeat breeder cows. Can. Vet. J. 19: 83-89. 1978. [ Links ]
12. Ross H., J. Bacterial and fungal organisms in the vagina of normal cows and cows with vaginitis. 2003. Masters Thesis. Office of Graduate Studies of Texas A&M University. Veterinary Microbiology. December. On Line: https://txspace.tamu.edu/bitstream/1969.1/1310/1/etd-tamu-2003C-VTMI-Husted-1.pdf. 24 de abril de 2006.
13. Sheldon, I.M. The postpartum uterus. Vet. Clin. Food. Anim. 20: 569-591. 2004. [ Links ]
14. Sheldon, I.M.; Noakes, D.E.; Rycroft, A.N.; Pfeiffer, D.U.; Dobson, H. Influence of uterine bacterial contamination after parturition on ovarian dominant follicle selection and follicle growth and function in cattle. Reprod. 123: 837-845. 2002a. [ Links ]
15. Sheldon, I.M.; Noakes, D.E.; Rycroft, A.N.; Dobson, H. Effect of postpartum manual examination of the vagina on uterine bacterial contamination in cows. The Vet. Rec. 151: 531-534. 2002b. [ Links ]
16. Stornelli, M.A.; Cerdá, R.O.; Gobello, M.C.; Arauz, M.S.; Stanchi, N.O. Estudio de micoplasmas y bacterias aerobias en la vagina craneal de hembras caninas clínicamente sanas. Anal Vet. 20(1): 36 -38. 2000. [ Links ]
17. Williams, E.J.; Fischer, D.P.; Pfeiffer, D.U.; England G., C.W.; Noakes, D.E.; Dobson, H.; Sheldon, I.M. Clinical evaluation of postpartum vaginal mucus reflects uterine bacterial infection and the immune response in cattle. Theriogenol. 63: 102-117. 2005. [ Links ]
18. Zhou, Xia; Bent, S.J.; Schneider, M.G.; Davis, C.C.; Islam, M.R.; Forney, L.J. Characterization of vaginal microbial communities in adult healthy women using cultivation-independent methods. Microbiol. 150: 2565-2573. 2004. [ Links ]












 uBio
uBio