Revista Científica
versão impressa ISSN 0798-2259
Rev. cient. (Maracaibo) v.20 n.3 Maracaibo jun. 2010
Evidencia de residuos de cloranfenicol en muestras de riñón de cerdos de la región Central de Venezuela
Evidence of chloramphenicol residues in pigs kidney sample of the Central region of Venezuela
Elena del C. Briceño-Fereira1*, Elias R. Ascanio-Evanoff 1, José Gregorio Riera- Betancourt 2, Darwuin Arrieta-Mendoza1, Sergio A. Flores-Chona1 y Gema C. Maniglia-Mérida1
1Cátedra de Farmacología y
2Cátedra de Producción Animal. Facultad de Ciencias Veterinarias, Universidad Central de Venezuela. Maracay, Venezuela. * edelcbf@hotmail.com
RESUMEN
El cloranfenicol ha sido prohibido en animales para consumo humano; sin embargo, recientemente varios laboratorios de control en países desarrollados han detectado residuos de dicho antibiótico en alimentos de origen animal procedentes de Sur América. En Venezuela, la prohibición data desde 1988, pero recientemente se han detectado residuos de este fármaco en hígado y riñón de bovinos, y en leche de larga duración para consumo humano, por lo que se sospecha que se está comercializando en forma ilegal; así se planteó como objetivo, evidenciar la presencia de residuos de cloranfenicol en riñones de cerdos. Se tomaron en forma aleatoria muestras de riñón de cerdos de tres plantas beneficiadoras (n: 150 muestras), en el período agosto a diciembre del 2004, y que fueron posteriormente llevadas al laboratorio para su procesamiento y análisis según el método ELISA-RIDASCREEN® con un límite de detección: 12,5 ng/kg, para evidenciar su presencia y cuantificar niveles de cloranfenicol. Los resultados evidenciaron residuos de cloranfenicol en el 17% de las muestras de cerdos con niveles que oscilan entre 13,6-42,9 ng/kg. Tales resultados evidencian así una violación en las normas internacionales y nacionales de prohibición en el uso de este antibiótico, lo cual podría determinar graves problemas en salud pública, dadas las reacciones adversas que este agente ocasiona en humanos.
Palabras clave: Cloranfenicol, residuos, cerdos, muestras de riñón.
ABSTRACT
Chloramphenicol has been banned for animal consumption but recently several control laboratories in developed countries have identified residues in food of animal origin from South America. In Venezuela, the ban dates back to 1988, but have recently been detected drug residues in bovine liver and kidney, and long-life milk for human consumption, it is suspected that is being marketed illegally in the antibiotic thus arises as an objective, evidence the presence of residues of chloramphenicol in pig kidneys for human consumption. Samples of pig kidney benefiting from three floors (n: 150 samples) were taken in random, from August to December 2004 and taken to the laboratory for processing and analysis using the method RIDASCREEN®-ELISA (detection limit 12.5ng/kg), to demonstrate the presence and quantify levels of chloramphenicol. The results showed residues of chloramphenicol in 17% of samples from pigs (13.6-42.9ng/kg).These results show a violation of national and international laws banning the use of this antibiotic, which could lead to serious problems in public health because of the adverse reactions this agent causes in humans.
Key words: Chloramphenicol, residues, pigs, kidney samples.
Recibido: 26 / 03 / 2009. Aceptado: 29 / 09 / 2009.
INTRODUCCIÓN
En ciertas regiones de Venezuela, la producción de cerdos (Sus scrofa domestica) es considerada una de las bases sociales más sólidas, logrando así una fuente de trabajo e ingreso estable para un gran número de familias, a la vez representando una de las principales fuentes de proteína animal con que cuenta la población venezolana [5]. Ante los retos propios de los sistemas de producción, los antibióticos se han utilizado frecuentemente con fines terapéuticos, profilácticos y/o promotores del crecimiento [1]. El cloranfenicol es un antibiótico de amplio espectro de actividad contra bacterias Gram-positivas y Gram-negativas. Fue aislado por Ehrlich y col. en 1947 a partir de cultivos del Streptomyces venezuelae [11].
En el pasado, fue ampliamente usado de forma terapéutica y profiláctica para tratar animales productores de alimentos, especialmente para el tratamiento de mastitis en vacas (Bos taurus-indicus) [15]. Hay evidencias de que el cloranfenicol puede producir serios efectos sobre la salud humana [7]. Debido a que estos efectos tóxicos no son dosis-dependiente, ningún nivel sin efecto adverso pudiera ser identificado, y se estableció un nivel de cero tolerancia para este compuesto en los alimentos [19].
Los residuos de cloranfenicol en carne y leche, constituyen un problema de salud pública porque pueden causar anemia aplásica y síndrome gris en recién nacidos; además, el uso del cloranfenicol en vacas lecheras ha sido relacionado en humanos con infecciones por Salmonella resistentes al cloranfenicol [25].
El uso del cloranfenicol en medicina veterinaria ha sido prohibido en animales para consumo humano [7] y el Comité JECFA (FAO/OMS) sugirió tolerancias cero para los residuos [21].
El cloranfenicol nunca fue aprobado para usarlo en animales de consumo en los Estados Unidos y desde 1994, el empleo de este antibiótico ha sido prohibido en la Unión Europea; sin embargo, este fármaco todavía es utilizado en países asiáticos, lo cual puede tener relación con la incidencia de anemia aplásica en esta población. La incidencia de anemia aplásica en Europa es de 0,2 casos por 100.000 habitantes; por el contrario, en países del sur asiático, la anemia aplásica es mucho más frecuente; en China es de alrededor de 2 casos por 100.000 y en Tailandia 3,7 casos por 100.000 habitantes [14].
Actualmente, el grado de vigilancia y control de residuos de cloranfenicol en animales y sus productos derivados se ha incrementado y es considerado de gran importancia en la Unión Europea y otros países como Estados Unidos y Canadá [3]. Recientemente se ha reportado la detección de cloranfenicol en diferentes alimentos, principalmente miel y productos del mar [20, 23]. En el año 2000, se realizaron análisis de mieles importadas por Estados Unidos procedentes de China ante la sospecha de la existencia de residuos de cloranfenicol, algunos de los cuales resultaron positivos [23].
En agosto del 2001, la autoridad de salud alemana detectó residuos de cloranfenicol en un cargamento de camarón (Palaemon serratus) procedente de China. Posteriormente, se confirmó la presencia de residuos de este antibiótico en cargamentos de camarón procedentes de Vietnam e Indonesia [20].
En el 2002, la Organización de las Naciones Unidas para la Agricultura y la Alimentación (FAO) mediante un comunicado de prensa, desestimula el uso del cloranfenicol en la producción animal, ya que en un descubrimiento habían encontrado este tipo de antibiótico en el pasto [27]. En marzo del 2002, durante ensayos de rutina para detectar residuos de fármacos en miel, la Agencia de Inspección de Alimentos de Canadá (CFIA) descubrió la presencia de cloranfenicol en un envío de miel desde China. En ese mismo año, se detectaron residuos de cloranfenicol en gambas y camarones del Brasil y la CFIA informó que en 5 lotes de miel, marcadas como Producto de Canadá, se descubrió que contenían residuos de cloranfenicol [12].
Entre los años 2002-2003, varios laboratorios de control en países miembros de la Unión Europea, detectaron cantidades de residuos de medicamentos veterinarios prohibidos, principalmente cloranfenicol en alimentos de origen animal importados desde América del Sur. En agosto de 2003, los laboratorios de control de importaciones de Estados Unidos detectaron residuos de nitrofuranos y cloranfenicol en miel procedente de Argentina [12].
En Venezuela, la prohibición del uso del cloranfenicol data desde 1988, siguiendo la regulación del Ministerio de Agricultura y Cría (MAC). Resolución 34.100 [18], pero en el laboratorio se han detectado residuos de este fármaco en hígado y riñón de bovinos [4], y en leche de larga duración para consumo humano [2], lo que hace sospechar que en Venezuela se está comercializando en forma ilegal este producto, estableciéndose como objetivo del presente trabajo, evidenciar la presencia de residuos de cloranfenicol en riñones de cerdos, a través ELISA, considerada una metodología de scrrening.
MATERIALES Y MÉTODOS
Todas las muestras se recolectaron durante los meses de agosto a diciembre del 2004.
Muestras de riñones de cerdos
Las muestras de riñones de cerdos fueron tomadas de las tres principales plantas beneficiadoras de cerdos que funcionan en el estado Aragua, Venezuela, identificadas con las letras A, B y C, las cuales reciben animales procedentes de toda la zona central del país, de las granjas ubicadas en los estados Aragua y Carabobo, debido a que en dichos estados se concentra la mayor población porcina nacional [22].
En forma aleatoria, se tomaron 5 riñones de las canales que provenían de una misma granja hasta completar 30 grupos (30 granjas muestreadas), para un total de 150 riñones; éstos se colocaron en bolsas plásticas identificadas y se llevaron al laboratorio en una cava refrigerada.
En el laboratorio se disecó la medula renal donde se reporta la mayor concentración de cloranfenicol [8]. Las muestras se almacenaron y analizaron en pool de 5 muestras cada uno, en un congelador (Revco Scientific, Inc., ULT1386-3-A14, EUA), a –20°C para posterior procesamiento y análisis.
Procesamiento de las muestras
Las muestras se procesaron y se analizaron en pool de cinco riñones cada una, según el método de screening oficial de la Association of Official Agricultural Chemists (AOAC) de ELISA-RIDASCREEN® (límite de detección de 12,5 ng/kg), que se basa en reacciones antígeno-anticuerpos y permite la determinación cuantitativa de cloranfenicol mediante enzimoinmunoensayo competitivo en microplaca [20], y fueron leídas en un espectofotómetro de placa (Neogen® Corporation, LOG/ LOGIT versión 1,06, EUA).
Análisis estadístico de los datos
La investigación realizada fue del tipo no experimental transeccional descriptivo, ya que los datos fueron recolectados en un solo momento y se realizan descripciones comparativas entre grupos [13]. El análisis estadístico fue de tipo descriptivo, con caracterización de las variables, tales como promedios y porcentajes, los cuales fueron representados en histogramas y gráficos de tortas [10].
RESULTADOS Y DISCUSIÓN
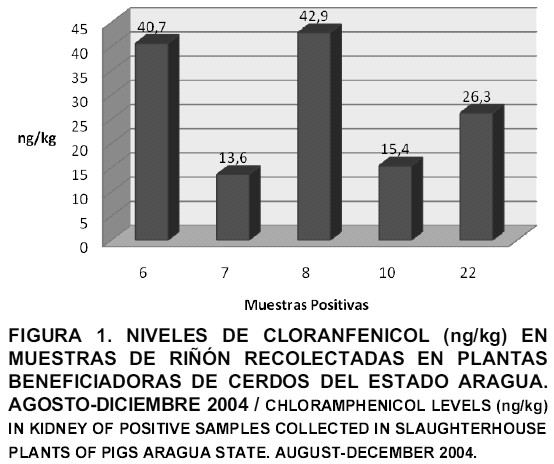
En la FIG. 1 se evidencian los resultados obtenidos en las canales de cerdos y se observa que, de 30 pools de riñón procesadas, cinco fueron positivas a la presencia de niveles de cloranfenicol (17%), los cuales van desde 13,6 ng/kg a 42,9 ng/kg. Cuando se compararon los niveles de residuos de cloranfenicol detectados en las muestras de riñón de las diferentes plantas beneficiadoras del estado Aragua (FIG. 2), se observó que en las plantas A y B se registraron muestras positivas a dicho antibiótico con un nivel medio de 27,46 ng/kg y 28,25 ng/kg, respectivamente, no existiendo diferencia entre estos niveles, mientras que en las muestras provenientes de la planta C, no se detectaron niveles de cloranfenicol (0 ng/kg), lo cual pudiera deberse a que en esta planta sólo se muestrearon dos granjas, ya que al revisar el cronograma de beneficios se observó que muchas de las granjas que beneficiaban sus animales ahí ya habían sido muestreadas en las otras dos plantas.
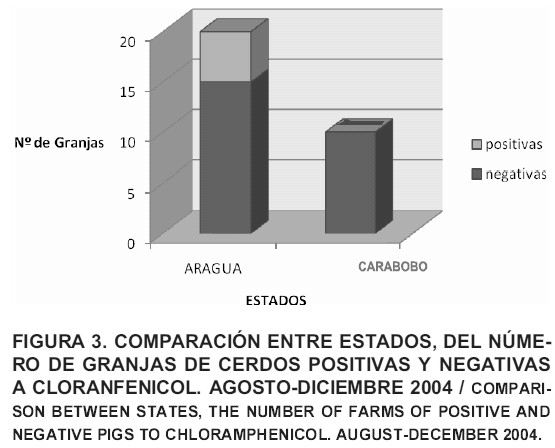
En la FIG. 3, se comparó el número de granjas por estado que arrojaron resultados positivos y negativos en los niveles de cloranfenicol en muestras de riñones de cerdos. Se evidenció que dentro de las 20 granjas muestreadas en el estado Aragua, 5 mostraron resultados positivos al cloranfenicol, mientras que en las granjas del estado Carabobo, no se obtuvieron niveles detectables del antibiótico.
El cloranfenicol se elimina principalmente a través del riñón [15-17] y su vida media biológica (t1/2) en cerdos es 1,3 horas [26], pero en un estudio realizado por Mercer y col. [17], observaron que cuando el antibiótico se administra por vía oral, los niveles obtenidos son significativamente mayores que cuando se administra por vía intramuscular y pueden detectarse niveles hasta 6 horas postratamiento. Por otro lado, en los animales enfermos, los residuos de cloranfenicol pueden persistir 2 a 3 veces más que en los sanos [15]. Esto permite especular que, bien sea que el antibiótico se esté administrando en estas granjas como tratamiento preventivo en el alimento o en el agua, o que se esté usando como tratamiento terapéutico en animales enfermos que fueron llevados al beneficio y que no se están cumpliendo los tiempos de espera o de retirada cuando se usa este antibiótico, lo que conlleva a un problema de salud pública, ya que estos residuos se encuentran todavía en la canal destinada al consumo humano.
La detección de granjas positivas a la presencia del cloranfenicol confirma la sospecha de que en Venezuela, se está utilizando el cloranfenicol en forma ilegal, ya que este antibiótico fue prohibido desde 1988 [18], no estableciéndose ningún Límite Máximo de Residuos (LMR), siendo cero su nivel de tolerancia; por esta razón, no importa si los niveles encontrados son bajos o no, puesto que es imperativo que esté ausente.
Existen pocas evidencias del uso ilegal del cloranfenicol en otros países desarrollados; sólo en Canadá en 1984, de 279 muestras de tejidos de cerdos enfermos que posiblemente habían recibido antibióticos y llevados al beneficio, sólo en 31 se detectaron niveles de este antibiótico [24]. Desde que la prohibición del uso del cloranfenicol fue introducida en la Unión Europea en 1994, el grado de control y vigilancia de estos residuos ha aumentado; así se tiene que en el Reino Unido, de 800 muestras analizadas, en ninguna se detectó [8].
El cloranfenicol fue prohibido hace más de 30 años en medicina veterinaria, debido a que las bacterias que afectan a los animales pueden adquirir resistencia a este producto y posteriormente transferirla a las causantes de tifus exantemático y fiebre tifoidea del humano que tienen en el cloranfenicol la única alternativa terapéutica. Por esto, la Organización Mundial de la Salud (OMS), reserva algunos antibióticos para ser usados únicamente en los hospitales, para tratar tipos específicos de microorganismos [9]. A pesar de esto, según la Directora General de la OMS, en 1992, dos tercios de los casos notificados de fiebre tifoidea en la India eran resistentes al cloranfenicol [6].
A pesar de que el uso del cloranfenicol está prohibido en Venezuela [18], los resultados obtenidos en esta investigación sugieren que actualmente se está utilizando en forma indiscriminada en las explotaciones de cerdos. Sin embargo, se requiere analizar las muestras positivas mediante el uso de otros métodos confirmatorios como el método de cromatografía liquida de alta resolución (HPLC).
CONCLUSIONES
Se determinó la presencia de residuos de cloranfenicol en riñones de cerdos en el 17% de las muestras procesadas. Tales resultados evidencian la violación de las normas internacionales y nacionales de prohibición en el uso de este antibiótico, lo que podría determinar graves problemas en salud pública dadas la reacciones adversas que este antibiótico ocasiona en humanos.
RECOMENDACIONES
Analizar las muestras positivas mediante el uso de otros métodos confirmatorios como el HPLC.
Crear programas de vigilancia para la detección de la presencia de residuos de antibiótico y, principalmente, del cloranfenicol en productos de origen animal destinados al consumo humano.
Crear programas de control del uso de medicamentos para uso veterinario de forma adecuada, especialmente en cuanto a regímenes de dosificación y tiempo de espera o retirada de los fármacos.
Vigilar el cumplimiento de la Resolución 34.100 del Ministerio de Agricultura y Cría sobre la prohibición del uso del cloranfenicol en animales para consumo humano.
REFERENCIAS BIBLIOGRÁFICAS
1. ANADÓN, A.; BRINGAS, P.; MARTÍNEZ-LARRAÑAGA, M.R.; DIAZ, M.J. Bioavailability pharmacokinetics and residues of chloramphenicol in the chicken. J. Vet. Pharmacol. Therp. 17: 52-58. 1994. [ Links ]
2. ASCANIO, E.; SOGBE, E.; MELÉNDEZ, B.; BRICEÑO, E.; DIAZ, C.T.; ASCANIO, D.E.; ASCANIO, D.C. Chloramphenicol residues in commercial milk produced for human consumption in Venezuela. J. Vet. Pharmacol. Ther. 29 (Supl.1):173-174. 2006. [ Links ]
3. BAYO, J.; MORENO, M.A.; PRIETA, J.; DÍAZ, S.; SUÁREZ, G.; DOMÍNGUEZ, L. Chloramphenicol extraction from milk by using the diphasic dialisis method followed by liquid chromatographic determination. J. AOAC. Int. 77(4): 854-856. 1994. [ Links ]
4. BRICEÑO, E.; ASCANIO, E.; ARRIETA, D.; FLORES, S.; MANIGLIA, G.; ROJAS, J. Determination of cloramphenicol residues in liver and kidney samples used for human consumption in the Bolivarian Republic of Venezuela. J. Vet. Pharmacol. Therp. 32 (Supl.1): 208-209. 2009. [ Links ]
5. BRICEÑO, E.; ASCANIO, E.; RIERA, J. Residuos de cloranfenicol en riñones de cerdos procedentes de la región central de Venezuela. LVII CONVENCIÓN ANUAL de ASOVAC. San Cristóbal, 18-23 de noviembre. Venezuela. 241 pp. 2007. [ Links ]
6. BRUNDTLAND, G.H. Mensaje de la Directora General de la Organización Mundial de la Salud. 2000. En Línea: http://www.who.int/infectious-disease-report/2000/otherversions/IDR2000Spanish.pdf. 05-10-05. [ Links ]
7. CERKVENIK, V. Analysis and monitoring of chloramphenicol residues in food of animal origin in Slovenia from 1991 to 2000. Food Add. Contam. 19(4): 357-367. 2002. [ Links ]
8. COOPER, A.D.; TARBIN, J.A.; FARRINGTON, W.H.H.; SHEARER, G. Aspects of extraction, spiking and distribution in the determination of incurred residues of chloramphenicol in animal tissues. Food Add. Contam. 15(6): 637-644. 1998. [ Links ]
9. COTRINO, V.; GAVIRIA, B.C.; ESPINDOLA, E. Los antibióticos: recurso no renovable. 2003. Laboratorio Médico Veterinario LMV Ltda. Colombia. En Línea: http://lmvltda.com/index.php?section=26. 05-10-05. [ Links ]
10. DE LA HORRA, J. Estadística descriptiva de una variable. Cap. 1. En: Estadística Aplicada. 3º Ed. Ediciones Diaz de Santos. Madrid. España. Pp. 1-10. 2003. [ Links ]
11. EHRLICH, J.; BARTZ, Q.R.; SMITH, R.M.; JOSLYN, D.A. Chloromycetin a new antibiotic from soil actinomycete. Science 106: 417. 1947. [ Links ]
12. FERNÁNDEZ, A. International trade of animal food products from South American countries: Cases of detection of residues of banned veterinary drugs. 2004. FAO. On Line: http://www.fao.org/docrep/008/y5723eOjhtm. 15-03-05. [ Links ]
13. HERNÁNDEZ, R.; FERNÁNDEZ, C.; BAPTISTA, P. Diseños no experimentales de investigación. En: Metodología de la Investigación. 2º Ed. Editorial Interamericana McGraw- Hill. México. Pp 183-201. 1998. [ Links ]
14. ISSARAGICIL, S.; KAUFMANN, D.W.; ANDERSON, T.; CHANSUNG, K. Low drug attributality of aplastic anemia in Thailand. Blood. 89(11):4034-4039. 1997. [ Links ]
15. KNIGHT, A.P. Chloramphenicol therapy in large animals. J. Am. Vet. Med. Assoc. 178(3): 309-310. 1981. [ Links ]
16. LEMOS, M.L. Antimicrobianos que inhiben la síntesis de proteínas. En: BOTANA, L.M.; LANDONI, F.; MARTÍN-JIMÉNEZ, T. (Eds). Farmacología y Terapéutica Veterinarias. McGraw-Hill Interamericana. Madrid. España. Pp. 475-477. 2002. [ Links ]
17. MERCER, H.D. The comparative pharmacology of chloramphenicol. JAVMA 176(9): 923-924. 1980. [ Links ]
18. MINISTERIO DE AGRICULTURA Y CRÍA VENEZUELA. Prohibición del uso del cloranfenicol y demás sustancias que lo contengan en animales cuyos productos estén destinados al consumo humano; bovinos de carne y leche, ovinos, caprinos, cerdos, aves, conejos, peces. Resolución 34.100 del 24/11/88. Caracas. 1pp. 1988. [ Links ]
19. MONTOYA, N. Análisis de residuos de cloranfenicol y nitrofuranos. Cenaim informa Boletín informativo Nº 70. 2002b. Centro Nacional de Acuicultura e Investigaciones Marinas Edgar Arellano M. Ecuador. En Línea: http://www.cenaim.espol.edu.ec/publicaciones/quincenal/bquinc70.pdf. 19-02-2004. [ Links ]
20. MONTOYA, N. Residuos de antibióticos en camarones: Límites residuales y detección de fenicoles. Cenaim informa Boletín informativo. Nº 54. 2002a. Centro Nacional de Acuicultura e Investigaciones Marinas Edgar Arellano M.. Ecuador. En Línea: http://www.cenaim.espol.edu.ec/publicaciones/quincenal/bquinc54. 19-02-04. [ Links ]
21. ORGANIZACIÓN DE LAS NACIONES UNIDAS PARA LA AGRICULTURA Y LA ALIMENTACIÓN (FAO): El estado mundial de la pesca y la acuicultura. 2002. En Línea: http://www.fao.org/documents. 19-02-04. [ Links ]
22. PINEDA, Y.; DE LÓPEZ, A.; DE APONTE, F.; DE PARRA, C.; SANTANDER, J. Serotipos de Actinobacillus pleuropneumoniae aislados de cerdos en Venezuela y su susceptibilidad a los agentes antimicrobianos. Vet. Trop. 21: 35-47. 1996. [ Links ]
23. RODRÍGUEZ, J.J. La presencia de cloranfenicol en productos apícolas. 2005. Revista Consumer Eroski. Fundación Eroski. En Línea: http://www.consumer.es/seguridad-alimentaria/ciencia-y-tecnologia/2005/12/14/21562.php 30-06-06. [ Links ]
24. SALISBURY, C.D.C.; PATTERSON, J.R.; MACNEIL, J.D.; FELTMATE, T.F.; TITTIGER, F. ASSELIN, J.; BLACK, W.D. Survey of chloramphenicol residues in diseased swine. Can. J. Vet. Res. 52:15-17. 1988. [ Links ]
25. SPIKA, J.S.; WATERMAN, S.H.; HOO, G.W.; ST LOUIS, M.E.; PACER, R.E.; JAMES, S.M.; BISSETT, M.L; MAYER, L.W.; CHIU, J.Y; HALL, B. Chloramphenicol-resistant salmonella Newport traced through hamburger to dairy farms: A major persisting source of human salmonellosis in California. N. Engl. J. Med. 316:565-70. 1987. [ Links ]
26. TROLLDENIER, H. Cloranfenicol. En: Antibióticos en Medicina Veterinaria. Editorial Acribia. España Pp.181-205. 1980. [ Links ]
27. YEVES, E. La FAO invita a interrumpir el empleo de cloranfenicol en la producción animal. Comunicados de prensa de la FAO. Organización de las Naciones Unidas para la Agricultura y la Alimentación. 02/03. 2002. En Línea: http://www.fao.org/waicent/ois/press_ne/spanish/2002/index.html. 15-03-05. [ Links ]












 uBio
uBio