Revista Científica
versão impressa ISSN 0798-2259
Rev. cient. (Maracaibo) v.20 n.4 Maracaibo jul. 2010
EFECTO DEL AZUL DE METILENO EN LA HIPOTENSIÓN
Y BRADICARDIA ASOCIADAS A LA ADMINISTRACIÓN DE UNA DOSIS LETAL DEL VENENO TOTAL DE CASCABEL VENEZOLANA
(Crotalus durissus cumanensis) EN RATAS
Elena del C. Briceño-Fereira 1*, Héctor A. Zerpa-Gónzalez 2, Elías R. Ascanio-Evanoff 1, Sergio A. Flores-Chona 1,
Gema C. Maniglia-Mérida 1 y Simón G. Comerma-Steffensen 2
1 Cátedra de Farmacología. 2 Cátedra de Fisiología. Universidad Central de Venezuela. Facultad de Ciencias Veterinarias, Maracay, Venezuela. * edelcbf@hotmail.com
RESUMEN
Se investigaron los efectos hemodinámicos del azul de metileno (AM) antes de administrar una dosis única (1,5 mg/kg, IV) de veneno total (VT) de Crotalus durissus cumanensis. Doce ratas machos adultas fueron subdivididas en dos grupos: grupo I, 6 ratas tratadas con VT y grupo II, 6 ratas tratadas con solución AM al 2% (dosis única: 2 mg/kg, IV), 40 min después, se administró VT, como en el grupo I. Previamente, cada rata fue anestesiada con una mezcla de azaperona:ketamina. Se canuló la arteria y vena femoral para el registro de presión arterial directa y administración de soluciones, respectivamente. La frecuencia cardiaca (FC) se estimó usando registros electrocardiográficos. Se midió presión arterial media (PAM) y FC antes y después de administrar las soluciones (5; 10; 20 y 30 minutos post-administración). El efecto del VT y del VT+AM sobre las variables, se analizó por ANOVA para muestras seriadas en el tiempo. Los resultados demuestran caída de PAM (87,0 ± 8,4 a 31,8 ± 3,6 mmHg) y FC (260,0 ± 12,7 a 170,0 ± 10,0 lat/min) en grupo I, a 5 min de la administración del VT. Los valores descendieron durante 10 min, hasta la muerte de los animales. El grupo II no mostró cambios significativos (P>0,05) en PAM y FC post-AM durante 40 min. Seguidamente se inyectó VT y la PAM cayó de 73,0 ± 6,6 a 27,0 ± 2,8 mmHg y FC de 360,0 ± 9,9 a 180,0 ± 9,0 l/min, similar (P>0,05) al grupo I. Transcurridos 10 min, hubo recuperación de variables, alcanzando a los 30 min valores de 72,6 ± 7,9 mmHg y 360 ± 11 lat/min, respectivamente, con sobrevivencia del 100% a las 24h. Considerando que AM inhibe la guanilato ciclasa soluble, el blanco celular del oxido nítrico (ON), VT pudiera activar al ON, siendo éste parcialmente responsable de los cambios hemodinámicos observados. Azul de metileno podría representar una potencial herramienta terapéutica útil en el shock circulatorio inducido por una dosis letal de VT.
Palabras clave: Azul de metileno, presión arterial media, frecuencia cardíaca, ratas, Crotalus, cascabel venezolana.
Effect of Methylene Blue on the Hypotension and Bradycardia Associated With the Administration of a Lethal Dose of Total Venom of the Venezuelan Rattlesnake (Crotalus durissus cumanensis) in Rats
ABSTRACT
The effects of pre treatment with methylene blue (MB) on the cardiovascular effect caused by the administration of total venom (TV) of Crotalus durissus cumanensis was studied in adult rats, allocated into two groups: group I, six rats treated with TV (single dose: 1.5 mg/kg, IV) and group II, six rats treated with a 2% solution of methylene blue (single dose: 2 mg/kg, IV) and forty min later, TV was injected as in group I. Before the onset of the experiments, each rat was anesthetized with azaperone:ketamine. The femoral artery and vein were cannulated to record blood pressure (mean arterial pressure: MAP) and to infuse solutions, respectively. Heart rate (HR) was estimated by electrocardiography. MAP and HR were measured before and after the treatments (5, 10, 20 and 30 min). Differences between treatments were estimated by repeated measures ANOVA. A sudden (5min) reduction in MAP (from 87.0 ± 8.4 to 31.8 ± 3.6mmHg) and HR (from 260.0 ± 12.7 to 170.0 ± 10.0 lat/min) was observed in group I. This reduction was steadily during the first 10 min, followed by death in all treated rats. Rats in group II did not exhibit significant (P>0.05) changes in MAP and HR after the administration of methylene blue. Forty min later, TV was injected causing a reduction in MAP (73.0 ± 6.6 to 27.0 ± 2.8mmHg) and HR (360.0 ± 9.9 to 180.0 ± 9.0 l/min). After 10 min, the MAP and HR returned to baseline levels, reaching 72.6 ± 7.9 mmHg and 360.0 ± 11.0 lat/min, respectively, with a 100% survival at 24h. Methylene blue inhibits soluble guanylate cyclase, the cellular target of nitric oxide (NO). Therefore, the possibility exists that this venom might activate the production and release of NO, contributing to the observed hypotension and bradycardia. Since MB restored these haemodynamic variables and avoided the venom-evoked death at 24 hours, it might be a potential useful therapeutic tool to control the shock caused by this total venom.
Key words: Methylene blue, mean arterial pressure, heart rate, rats, crotalus, Venezuelan rattlesnake.
Recibido: 26 / 03 / 2009. Aceptado: 18 / 01 / 2010.
INTRODUCCIÓN
Los accidentes ofídicos por serpientes del género Crotalus, representan un problema de salud en las zonas tropicales y subtropicales del mundo [19], el cual puede afectar, tanto a seres humanos como animales domésticos. El agente crotálico puede ser responsable de acciones simultáneas sobre los sistemas cardiovascular, respiratorio y nervioso, así como en sangre y otros tejidos [17].
El veneno de las serpientes del género Crotalus posee agentes capaces de producir efectos cardiotóxicos y neurotóxicos [3]. Las alteraciones agudas en presión arterial, así como de la respiración (apnea), no dependen de la crotamina, sino de algún otro componente del veneno crotálico, con propiedades farmacológicas vinculadas al desarrollo del shock y trastornos respiratorios [25]. La crotoxina es la principal proteína del veneno de Crotalus durissus terrificus, la cual está compuesta por una fosfolipasa básica y una subunidad acídica con actividad intrínseca de fosfolipasa A2 [21].
El veneno crotálico produce shock comparable al observado en el curso del shock anafiláctico e histamínico [4, 21]. El oxido nítrico (ON) es un mediador central de los cambios hemodinámicos asociados a diferentes tipos de shock, incluyendo: séptico, anafiláctico y endotóxico. Estos últimos se caracterizan por presentar hipotensión prolongada, mala distribución de la sangre y muerte [15]. Así, la excesiva producción de ON puede causar shock circulatorio, daño microvascular y falla en múltiples órganos [7]. Parte de la hipotensión asociada a la producción excesiva de ON durante el shock, se vincula con una vasodilatación acentuada debido a la activación de la guanilato ciclasa soluble (GCs) citoplasmática, resultando en la producción de guanosil monofosfato cíclico (GMPc), relajación del músculo liso vascular y caída en la resistencia periférica y la presión arterial [2].
El ON se sintetiza por la enzima óxido nítrico sintetasa (ONS). Se han descrito al menos dos subtipos generales de ONS: 1) la enzima constitutiva (ONSc), la cual está constantemente activa y se expresa, tanto en neuronas como en el endotelio; y 2) la enzima inducible (ONSi), la cual es activada bajo la influencia de endotoxinas y citoquinas durante procesos inflamatorios. La activación de la ONSi en el endotelio y musculo liso vascular, resulta en un incremento en la síntesis de ON y el subsecuentemente incremento en la concentración de GMPc, conduciendo a vasodilatación, depresión miocárdica, e incremento en la permeabilidad vascular [10]. Al mismo tiempo, la producción de ON vía ONSi en los leucocitos, también contribuye al desarrollo de shock durante la respuesta inflamatoria sistémica [2, 16].
La inhibición de la producción excesiva de ON podría prevenir la vasodilatación sistémica y reducir la injuria microvascular [7]. Los análogos de la L-arginina pueden revertir los efectos hemodinámicos asociados al ON, sin embargo, no escapan de efectos colaterales adversos [15]. El azul de metileno (AM) (C16H18ClN3S) es un inhibidor no selectivo combinado de la GCs y la ONSi en células musculares lisas [8, 13], el cual ha sido estudiado en animales con endotoxemia y pacientes humanos con shock séptico. Estudios en diferentes modelos de sepsis experimental en animales indican los beneficios hemodinámicos de la infusión de AM durante el shock endotóxico, donde se reporta un aumento de la presión arterial media y la resistencia vascular periférica, con un efecto menor sobre el gasto cardíaco [18]. El AM puede disminuir los niveles plasmáticos de los metabolitos estables de ON, nitritos y nitratos, así como GMPc. Consecutivamente, la administración de AM restaura transitoriamente la presión arterial media a través del incremento en la resistencia vascular sistémica y mejorando la función miocárdica durante el shock séptico en humanos [9, 20]. El AM es una droga segura y ha sido ampliamente usada en clínica en diferentes tipos de shock [7, 9, 10]. Considerando que el envenenamiento por Crotalus puede producir shock con hipotensión, comparable al observado en el curso del shock anafiláctico e histamínico, el objetivo de este trabajo fue determinar si la administración de AM modula los efectos hemodinámicos (presión arterial media y frecuencia cardiaca) provocados por la administración intravenosa de una dosis letal de veneno total de Crotalus durissus cumanensis.
MATERIALES Y MÉTODOS
Origen del veneno
Se usó veneno total liofilizado de Crotalus durissus cumanensis proveniente de la Escuela de Ciencias Veterinarias de La Universidad Centro Occidental Lisandro Alvarado, y se conservó protegido de la luz y mantenido en un refrigerador (Sankey, RF-1015, México), hasta el momento de su uso.
Animales de experimentación y registro de variables hemodinámicas
Se utilizaron ratas (Rattus norvegicus) Sprague Dawley, machos, adultas (350-450g), las cuales fueron anestesiadas con una mezcla de azaperona: ketamina (50:87 mg/kg) administrada vía intraperitoneal. Una vez obtenido un plano de anestesia quirúrgica se canuló la vena femoral para administrar los fármacos y se introdujo un catéter vía arteria femoral hasta la aorta abdominal para registrar la presión arterial. Este catéter se acopló a un transductor de presión Linear-Core P-1000ª (Narco bio-system®, EUA). La presión arterial media (PAM) fue calculada del trazado de presión arterial directa a partir de la siguiente ecuación: PAM=PD+1/3PP, donde PP representa la presión de pulso, la cual se estima como la diferencia entre presión sistólica (PS) y presión diastólica (PD) [22]. La frecuencia cardíaca (FC) se midió a partir de los intervalos R-R del registro electrocardiográfico, tomado en derivación II. Los electrodos exploradores (agujas hipodérmicas) se colocaron en el tejido subcutáneo [14] y los registros, tanto del electrocardiograma como de la presión arterial (FIG. 1), se obtuvieron en un polígrafo modelo DMP-4B (Narco bio-system®, EUA).
Protocolo experimental
Las ratas se dividieron en dos grupos de 6 individuos. Al grupo I, se le administró 1,5 mg/kg de VT (dosis letal 100) vía IV diluido en solución salina isoosmolar al plasma sanguíneo (0,9% NaCl) y se tomaron registros 40 min antes e inmediatamente después; al grupo II, se le administró 2,0 mg/kg de una solución del azul de metileno al 2% vía IV, tal como lo reportan Levin y col. y Sánchez y col. [11, 23] y pasados 40 min se le inyectó una dosis del VT similar a la del grupo I. Se tomaron registros 5; 10; 20 y 30 min después de las administraciones.
Análisis estadístico
Se analizaron las diferencias entre tratamientos a través de análisis de variancia (GraphPad Prism 5.0, EUA) para muestras seriadas a un nivel de probabilidad de P£0,05.
RESULTADOS Y DISCUSIÓN
La administración de AM previo a la exposición con una dosis letal del VT de Crotalus durissus cumanensis en ratas, previno la reducción mantenida de la FC y PAM, lográndose sobrevivencia a las 24 horas en todos los animales evaluados.
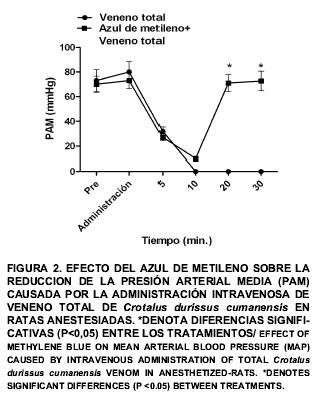
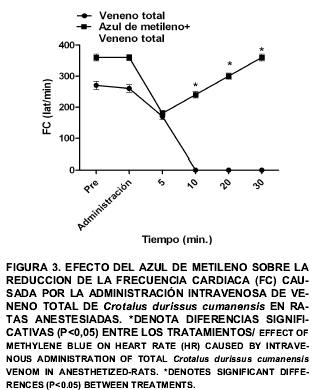
En los animales del grupo I, después de administrar el veneno se observó una caída acentuada de la PAM (87,0 ± 8,4 mmHg a 31,8 ± 3,6 mmHg) y FC (260,0 ± 12,7 l/min a 170,0 ± 10,0 l/min) a los 5 min de administrar el VT, lo cual representa aproximadamente un 63 y 35% de reducción, respectivamente. Estos valores continuaron descendiendo durante los siguientes 5 min hasta producirse la muerte de todos los animales (FIGS. 2 y 3). El comportamiento hemodinámico y el desarrollo de muerte asociado a la administración intravenosa de veneno crotálico total en ratas, coincide con lo reportado en caninos (canis lupus familiaris) usando una dosis letal del veneno crotálico [1]. Otros autores señalan que, los cambios hemodinámicos pueden ser atribuidos a la acción directa del veneno sobre la musculatura lisa vascular, a la liberación de sustancias autacoides y/o como respuesta a mecanismos neurogénicos [24].

El grupo de ratas tratadas con AM (grupo II), no presentaron cambios significativos en PAM y FC luego de su administración pasados 40 min de registro (FIG. 4). Estos resultados coinciden con los reportados por Menardi y col. [15], donde después de una infusión IV de AM en cerdos (Sus scrofa ferus), no se observaron cambios hemodinámicos significativos. La ausencia de efecto del AM sobre la PAM en el grupo II antes de administrar el VT, fue un resultado inesperado, ya que al ser un inhibidor de la GCs, el AM podría reducir el efecto vasodilatador basal provocado por la liberación de ON de origen endotelial y como consecuencia, incrementar la PAM. De hecho, se ha reportado que la inhibición de la síntesis de ON con L-NAME en condiciones basales, causa incremento en la presión arterial al eliminar el efecto vasodilatador del ON y liberar el efecto tónico de los eferentes autonómicos simpáticos sobre el músculo liso vascular [5, 12].
Después de transcurridos 40 min en el grupo II, se observó que la administración del VT causó una caída en PAM a los 5 min (73,0 ± 6,6 mmHg a 27,0 ± 2,8 mmHg) y FC (360,0 ± 9,9 l/min a 180,0 ± 9,0 l/min) siendo similar (P>0,05) a la observada en el grupo I. Después de 10 min, se observó una recuperación de las variables fisiológicas medidas y a los 30 min, éstas alcanzaron valores de 72,6 ± 7,9 mmHg y 360,0 ± 11,0 l/min para PAM y FC, respectivamente, los cuales fueron significativamente (P<0,05) superiores a los del grupo 1 (FIGS. 2 y 3). Se observó una sobrevivencia del 100% de las ratas a las 24 horas post-tratamiento.
Los resultados obtenidos al tratar las ratas con AM, coinciden con el efecto hipertensor dosis dependiente del AM, sobre la hipotensión en modelos de shock séptico y shock endotóxico [9, 18]. De forma similar, otros autores reportan el incremento de la PAM y FC después de administrar AM en pacientes con shock séptico [6, 9, 10, 20] y shock endotóxico [26]. La recuperación de las variables hemodinámicas luego del tratamiento con AM, en conjunto con la sobrevivencia de todas las ratas expuestas al VT crotálico sugieren que, el AM es capaz de modular la respuesta sistémica ante el veneno crotálico previniendo el desarrollo de shock y muerte. Considerando que el AM puede inhibir la actividad de la GCs y la ONSi [8, 13] se sugiere que la inyección del veneno IV podría activar la vía del ON, promoviendo su síntesis y liberación, contribuyendo parcialmente a los cambios hemodinámicos observados al administrar la dosis letal del veneno. Es posible que el efecto del AM observado al administrar el veneno crotálico, no dependa completamente de la inhibición de la GCs, ya que en las ratas controles en condiciones basales, la administración de AM no modificó la PAM. Se requieren de más experimentos para demostrar el mecanismo de acción del AM en esta preparación.
Los hallazgos observados en el modelo experimental empleado sugieren al AM como un potencial agente modulador del shock experimental asociado a la administración IV de una dosis letal de veneno crotálico. Sin embargo, se requieren de trabajos adicionales para evaluar el efecto de este tratamiento en otros modelos experimentales o durante los accidentes ofídicos ocurridos en forma natural.
CONCLUSIONES
La inyección IV de una dosis letal de VT de Crotalus durissus cumanensis en ratas, causó una reducción aguda de la PAM y FC, provocando la muerte de los individuos. La administración del azul de metileno al 2% (2 mg/kg) no modificó las variables hemodinámicas por sí solo, sin embargo, restituyó los cambios producidos por la administración de VT, promoviendo la sobrevida a las 24 horas de todos los individuos.
AGRADECIMIENTO
Los autores agradecen a la Cátedra de Toxicología de la Escuela de Ciencias Veterinarias de la Universidad Centro Occidental Lisandro Alvarado (Barquisimeto, Edo. Lara), por facilitar el veneno total de Crotalus durissus cumanensis.
REFERENCIAS BIBLIOGRÁFICAS
1. ASCANIO, E.; VEGA, F.; SOGBE, E.; YUFA, B.; MARTÍNEZ, A.; DÍAZ, C.; ASCANIO, M. Hemodynamic Evaluation in dogs under action lethal dose of rattlesnake (Crotalus durissus cumanensis) total venom. J. Vet. Pharmacol. Therap. 23 (supl 1):91. 2000. [ Links ]
2. BENAVIDES, M.C.; PINZÓN, A. Oxido nítrico: implicaciones fisiopatológicas. Rev. Col. Anest. 36:45-52. 2008. [ Links ]
3. BIEBER, A. Studies of an acidic cardiotoxin isolated from the venom of Mojave rattlesnake (Crotalus sculatus sculatus). Bioch. Biophys. Acta. 400:178-188. 1975. [ Links ]
4. BOQUET, P. Venins de serpent (1ére partie) physiopathologíe de lenvenimation et proprieties biologiques des venins. Toxicon. 2:5-41. 1964. [ Links ]
5. CLAXTON, CH. R.; BRANDS, M.W.; FITZGERALD, SH. M.; CAMERON, J.A. Inhibition of Nitric Oxide Synthesis Potentiates Hypertension During Chronic Glucose Infusion in Rats. Hypertens. 35:451-456. 2000. [ Links ]
6. DAEMEN-GUBBELS, C.R.; GROENEVELD, P.H.; GROENEVELD, A.B.; VAN KAMP, G.J.; BRONSVELD, W.; THIJS, L.G. Methylene blue increases myocardial function in septic shock. Crit. Care. Med. 23:1363-70. 1995. [ Links ]
7. EVGENOV, O.V.; SAGER, G.; BJERTNAES, L.J. Methylene blue reduces lung fluid filtration during the early phase of endotoxemia in awake sheep. Crit. Care. Med. 29:374-379. 2001. [ Links ]
8. GRUETTER, C.A.; GRUETTER, D.Y.; LYON, J.E. Relationship between cyclic guanosine 3:5-monophosphate formation and relaxation of coronary arterial smooth muscle by glyceryl trinitrate, nitroprusside, nitrite and nitric oxide: Effects of methylene blue and methemoglobin. J. Pharmacol. Exp. Ther. 219:181–186. 1981. [ Links ]
9. KEANEY, J.F.J.; PUYANA, J.C.; FRANCIS, S. Methylene blue reverses endotoxin-induced hypotension. Circ. Res. 74:1121–1125. 1994. [ Links ]
10. KWOK, E.S.H.; HOWES, D. Use of methylene blue in sepsis: A systematic Review. J. Intensive. Care. Med. 21:359-363. 2006. [ Links ]
11. LEVIN, R.L.; DEGRANGE, M.A.; BRUNO, G.F.; DEL MAZO, C.D.; TABORDA, D.J.; GRIOTTI, J.J.; BOULLON, F.J. Methylene blue reduces mortality and morbidity in vasoplegic patients after cardiac surgery. Ann Thorac. Surg. 77:496-499.2004.
12. LU, Y.C.; LIU, S.; GONG, Q.Z.; HAMM, R.J.; LYETH, B.G. Inhibition of nitric oxide synthase potentiates hypertension and increases mortality in traumatically brain-injured rats. Mol. Chem. Neuropathol. 30:125-37. 1997. [ Links ]
13. MAYER, B.; BRUNNER, F.; SCHMIDT, K. Inhibition of nitric oxide synthesis by methylene blue. Biochem. Pharmacol. 45:367–374. 1993. [ Links ]
14. MAYO, P.R.; JAMALI, F. Methoxyflurane Anesthesia Augments The Chronotropic And Dromotropic Effects of Verapamil. J. Pharm. Pharmaceut. Sci. 2:30-35, 1999. [ Links ]
15. MENARDI, A.C.; VIARO, F.; DE ANDRADE, W.V.; RODRIGUES, A.J.; BARBOSA, P.R. Hemodynamic and vascular endothelium function studies in healthy pigs after intravenous bolus infusion of methylene blue. Arq. Bras. Cardiol. 87:477-483. 2006. [ Links ]
16. MIKI, S.; TAKEYAMA, N.; TANAKA, T.; NAKATANI, T. Immune dysfunction in endotoxicosis: Role of nitric oxide produced by inducible nitric oxide synthase. Crit. Care. Med. 33:716-720. 2005. [ Links ]
17. MIRANDA, A. Resistencia de Crotalus durissus terrificus y Bothrops nuwied a la neurotoxicidad de cantidades masivas de veneno crotálico. Acta Fisiol. Latinoam. 32:103-115. 1982. [ Links ]
18. PAYA, D.; GRAY, G.A.; STOCLET, J.C. Effects of methylene blue on blood pressure and reactivity to norepinephrine in endotoxemic rats. J. Cardiovasc. Pharmacol. 21:926-930. 1993. [ Links ]
19. PIRELA DE LAS SALAS, R.; LÓPEZ-JONSTHON, J.; HERNÁNDEZ R. J. Caracterización toxinológica del veneno total de la serpiente de cascabel crotalus durissus cumanensis (viperidae), presente en la localidad de porshoure, Guajira venezolana. Rev. Científ. FCV-LUZ. XVI (3): 232 – 238. 2006. [ Links ]
20. PREISER, J.C.; LEJEUNE, P.; ROMAN, A. Methylene blue administration in septic shock: A clinical trial. Crit. Care. Med. 23:259–264. 1995. [ Links ]
21. RADVANJI, F.; BON, C. Investigations on the mechanism of action of crotoxin. J. Physiol. 79:327-333. 1984. [ Links ]
22. ROSA, F.; CEDEÑO, J.; LEON, L.; ESTRADA, O.; ROMERO-VECCHIONE, E.; VÁSQUEZ, J.; ANTEQUERA, R. Cardiovascular excitatory effect on rats of a fraction isolated from the eyestalk of shrimp: Peneaus vanameii. Invest. Clín. 47:133-141. 2006. [ Links ]
23. SÁNCHEZ, K.H.; SALAZAR, C.; DOBLES. C. Experiencia preliminar en el tratamiento de la vasoplejia post-circulación extracorpórea con azul de metileno. Rev. Costarric. Cardiol. 5:15-18. 2003. [ Links ]
24. SCHAEFFER, R.; CARLSON, R.; ROUSSELL, F. Cardiovascular response to rattlesnake (Crotalus viridis helleri) venom in dog. Fed. Proc. 32:865. 1973. [ Links ]
25. VITAL B., O.; FRANCESCHI, J.; WAISBICH, E. Pharmacology of crystalline crotoxin and neuromuscular blocking action. Mem. Inst. Butantán. 33: 981-992. 1966. [ Links ]
26. ZHANG, H.; ROGIERS, P.; PREISER, J.C.; SPAPEN, H.; MANIKIS, P.; METZ, G.; VINCENT, J.L. Effects of methylene blue on oxygen availability and regional blood flow during endotoxic shock. Crit. Care. Med. 23: 1711–1721. 1995. [ Links ]












 uBio
uBio 
