Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista de la Facultad de Ingeniería Universidad Central de Venezuela
Print version ISSN 0798-4065
Rev. Fac. Ing. UCV vol.22 no.3 Caracas 2007
Deshidrogenación oxidativa de n-pentano sobre catalizadores a base de óxidos de vanadio y magnesio modificados con á-Al2O3
*+PAPA, JOSÉ; + ARMAS, NORKA; BRITO, JOAQUÍN L., +MARZUKA, SAMIR; + DE RISI, LUISA; +ROSILLO, CRISTÓBAL Y +GUARÁN, NURY
+ Universidad Central de Venezuela, Facultad de Ingeniería, Escuela de Ingeniería Química. Venezuela.
Instituto Venezolano de Investigaciones Científicas, IVIC. Venezuela.
*E-mail: jpapa@reacciun.ve
RESUMEN
En este trabajo se presenta un estudio sobre la Deshidrogenación Oxidativa (DHOX) de n-pentano sobre dos catalizadores preparados a base de óxidos de vanadio y magnesio soportados sobre un 30% en peso de -Al2O3, uno con una relación atómica Mg/V=4 (Alfa 30) y el otro con dicha relación igual a12 (Alfa-31). Se encontró que en la superficie del catalizador la fase principal que se forma es Mg3V2O8 y que la relación Mg/V afecta a la cinética de las reacciones que tienen lugar, pero que lo hace con todas en la misma proporción ya que las selectividades evolucionan con la conversión siguiendo líneas de tendencias coincidentes. Los pentenos evolucionan como productos primarios de reacción, encontrándose entre ellos que el 1-penteno es significativamente más estable. Los pentadienos en cambio presentaron características mixtas de ser productos de reacción primarios y secundarios a la vez. La mayor reactividad de los productos intermedios de reacción asociada al aumento en el número de carbonos de la cadena, conduce a selectividades que decrecen con la conversión con una pendiente mayor a la observada para la DHOX de n-butano.
Palabras clave: Deshidrogenación Oxidativa, n-pentano, Catalizadores, Actividad, Selectividad.
Oxidative dehydrogenation of n-pentane over -Al2O3 modified catalysts based on mixtures of vanadium and magnesium oxides
ABSTRACT
In this work, a study is presented on the behaviour of two catalysts based on vanadium and magnesium oxides, Alfa- 30(Mg/V=4) y Alfa-31 (Mg/V=12), and supported on a 30% by weight of -Al2O3. It was found that on the catalyst surface the main phase formed is Mg3V2O8 and that the atomic ratio Mg/V modifies the kinetics of all the reactions in the same proportion because the selectivity of all formed compounds follow the same tendency lines, no matter what that ratio is. Pentenes behave like primary reaction products and it was found that the 1-pentene is significantly more stable than its isomers. Pentadienes proved to be products with mixed characteristics of primary and secondary reaction products, whose selectivity goes through a maximum and showing a low relative stability. It was also found that the selectivity toward olefins decreases with conversion as was expected.
Keywords: Oxidative Dehydrogenation, n-pentane, Catalysts, Activity, Selectivity.
Recibido: noviembre de 2006 Revisado: julio de 2007
INTRODUCCIÓN
Algunos procesos de la industria de la refinación, como son los de hidrocraqueo para la producción de combustibles (por ejemplo, la nafta), producen cantidades importantes de hidrocarburos de cinco átomos de carbono que al no tenerun mercado específico para su venta se usan como aditivos de la gasolina. Sin embargo, legislaciones recientes que tratan de limitar la contaminación ambiental en una cantidad significativa de países, imponen restricciones sobre la presión Reid de las gasolinas, lo cual se traduce en una disminución sustancial en el contenido de hidrocarburos C5. Esto origina la necesidad de encontrar procesos que permitan transformarlos en productos de mayor valor agregado o que permitan su reincorporación a las naftas. La importancia económica de esta fracción sirve como incentivopara el desarrollo de investigaciones tanto aplicadas como de innovación que permitan el desarrollo de tales procesos.
El panorama de posibilidades es bastante amplio y en la mayoría de los casos implica el uso de catalizadores. La más inmediata está relacionada con la hidroconversión, isomerización y alquilación, con el objetivo primario de lograr la reincorporación de los C5 a la gasolina como productos de mayor peso molecular y menor presión de vapor (Kandari et al. 2005). También se están explorando las vías que implican procesos de oxidación parcial o controlada. Éstas enfrentan a los investigadores con la dificultad de cómo maximizar la producción de los compuestos de mayor valor agregado, que son intermedios y termodinámicamente inestables bajo las condiciones de reacción (Dejoz, 1995). Una de las alternativas propuestas es la deshidrogenación y craqueosimultáneo bajo condiciones oxidativas, utilizando por ejemplo catalizadores a base de ZSM-5 modificados con el agregado de alguno o varios metales como Co, Mo, K, Ca, Mg, etc., (Ling-Xiang et al. 1994) o catalizadores a base de Pt y/o Rh soportados sobre alúmina en reactores estructurados (Dietz et al. 1996), etc. Otra de las víaspropuestas y que ha alcanzado importancia industrial es la de oxidación parcial con inserción de oxígeno para la producción de anhídrido maléico y ftálico (Umit et al. 1997; Zazhigalov et al. 2001; Michalakos et al. 1993; Mamedov et al. 1995).
En años recientes también se ha estudiado la Deshidrogenación Oxidativa (DHOX) de etano, propano yprincipalmente n-butano, con el objetivo de producirhidrocarburos no saturados y sin inserción de oxígeno en la cadena carbonada. Sin embargo, en lo que al n-pentano serefiere, la información disponible es muy escasa (Armas,2004; Korili et al. 1996). Estos procesos conducen a laproducción de CO y CO2 que son termodinámicamente más estables. Para controlar la selectividad hacia loshidrocarburos intermedios no saturados, hay que recurrir a catalizadores modificados que permitan controlar las cinéticas de las reacciones de la forma más conveniente.
Las ventajas de la DHOX son que no existen limitaciones de equilibrio, lo cual permite bajar la temperatura de reacción, y que las reacciones de oxidación total son altamente exotérmicas y aprovechables para ayudar a mantener la temperatura en el nivel apropiado.
La DHOX de hidrocarburos ligeros ha sido objeto de numerosos estudios durante las últimas dos décadasconduciendo a la preparación de varios catalizadorespromisorios para futuros desarrollos. Para el caso de laDHOX de n-butano, en años recientes se han estudiado al menos dos (Armas, 2004; De Risi y Rosillo, 2003; Korili et al. 1996; Michalakos et al. 1993). Uno de ellos consiste deuna fase activa compuesta por una mezcla de óxidos de magnesio y de vanadio modificada con á-Al2O3 (30% en peso) (Armas, 2004; De Risi y Rosillo, 2003).
El comportamiento catalítico del óxido de vanadio en la oxidación de hidrocarburos, varía dependiendo de si está puro o modificado por el agregado de fósforo o de ciertos óxidos (particularmente si son alcalinos), del método empleado para la preparación, de la acidez superficial, etc.,además de las relaciones Hidrocarburo:O2 alimentadas alreactor (Armas, 2004). Así, si se utiliza óxido de vanadio puro o mejor, mezclado con fósforo (VPO), el n-butano y el n-pentano en presencia de O2 son oxidados principalmente a anhídrido maléico, anhídrido ftálico CO y CO2 (Umit et al. 1997; Michalakos et al. 1993; Mamedov et al. 1995; Zazhigalov et al. 2001). Si en cambio se lo modifica o soporta sobre óxidos como SiO2, á-Al2O3, ã-Al2O3, MgO, TiO2, etc., se puede evitar la inserción de oxígeno a la cadena carbonada aumentando la actividad, y en mayor medida la selectividad, hacia productos de DHOX (Michalakos et al. 1993; Mamedov et al.; Armas, 2004; Papa et al. 2007).
De la gran cantidad de catalizadores que se han estudiado para la DHOX de n-butano, los basados en mezclas de óxidos de vanadio y oxido de magnesio se perfilan como los más activos y selectivos. Estos catalizadores operan de acuerdocon el mecanismo redox de Mars-van Krevelen, y se ha encontrado que separando el ciclo de reducción de oxidacióndel catalizador, la selectividad aumenta considerablemente(Soler et al. 1998; Soler et al. 1999, Hernández y Vásquez,2006). La separación de dichos ciclos requiere del uso dereactores especiales como los de lecho fluidizado, de lechomóvil, de arrastre o de caída libre, para los cuales los catalizadores deben tener, además, una resistencia a laatrición apropiada. Para ello, se los modifica agregándole la cantidad apropiada de un óxido que se caracteriza por su resistencia al desgaste, como es el caso de la á-Al2O3 (Armas, 2004; Papa et al. 2007). Además la selectividad de los catalizadores a base de óxidos de vanadio dependen del valor de la relación Mg/V (Mamedov et al. 1995) y para el caso de la DHOX de n-butano se encontró que debía situarse en el rango 4-12 (Blanco y Reynoso, 2002; De Risi y Rosillo, 2003).
Los trabajos publicados sobre el proceso de DHOX de npentano utilizando catalizadores basados en mezclas de V2O5 y MgO son escasos (Korili et al. 1996; Armas, 2004). El propósito de este trabajo fue el de estudiar las posibilidadesde extender el proceso de DHOX al n-pentano, utilizando para ello el catalizador MgVO/ á-Al2O3 que se caracterizópor su buen comportamiento en la DHOX de n-butano (Papa et al. 2007). Dada la mayor longitud de cadena carbonada del n-pentano respecto al n-butano, también se estudió el efecto del aumento de la distancia promedio entre centros activos, modificando la relación atómica Mg/V.
TÉCNICAS EXPERIMENTALES
Este trabajo se basó en el uso de dos catalizadores modificados mediante el agregado de 30% en peso de á-Al2O3 y el propósito fue el estudio de la deshidrogenación oxidativa de n-pentano. Dichos catalizadores se diferencianentre si por la relación atómica Mg/V utilizada. El nombreAlfa-30 se refiere al catalizador cuya relación Mg/V es igual a 4, y el de Alfa-31 al catalizador cuya relación Mg/V es de 12.
Preparación de los catalizadores
Según la cantidad en peso de catalizador que se desea preparar, primero se pesan las cantidades necesarias de Metavanadato Amónico [NH4VO3] (MVA), Acetato de Magnesio [Mg(C2H4O2)2.4H2O] (AM), Ácido Oxálico [(COOH)2.2H2O] (AO), y á-Al2O3 de modo de obtener la relación atómica Mg/V deseada, manteniendo una relación AO/MVA=3.2. Primero se prepara una disolución acuosa deoxalato de vanadilo. Para ello se disuelve el ácido oxálico enuna cantidad de agua desionizada a 70ºC de modo que la relación en peso H2O/AO sea aproximadamente igual a 10 y luego, a esta disolución, se le añade poco a poco y manteniendo agitación continua el metavanadato de amonio. La agitación se mantiene hasta la disolución total delmetavanadato, y finalmente se deja reposar a temperaturaambiente. Se obtiene una disolución de color azul-verdosoque indica la formación del oxalato de vanadilo. Por separado se prepara también una disolución acuosa de acetato demagnesio en una cantidad de agua que haga que la relación en peso H2O/AM sea aproximadamente igual a 1.2. Una vez preparadas las dos soluciones, la segunda se agrega a la primera a temperatura ambiente, se mezclan y la solución resultante se agrega a la cantidad apropiada de á-Al2O3. La mezcla resultante se calienta en baño de silicona a 80º C, agitando vigorosamente hasta llegar a sequedad. El sólido que se obtiene se seca en estufa a 110º C durante 24 horas. Posteriormente se tritura hasta alcanzar tamaños de partícula inferiores a 0.25mm y se calcina en aire a 600º C durante 16 horas.
La α-Al2O3 Pechiney utilizada como modificador tiene un área superficial de 4 m2/g (tamaño de partícula utilizado de 0.25-0.45 mm). El difractograma de rayos X que se le realizó muestra la presencia de α -Al2O3, como única fase cristalina.
Caracterización
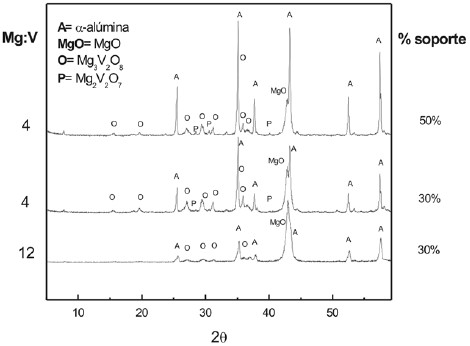
Los catalizadores fueron caracterizados mediante análisis químico por absorción atómica en un equipo Varian AA-10plus y la superficie específica fue determinada por BETmediante la adsorción de nitrógeno a la temperatura de nitrógeno líquido, en un equipo ASAP 200 Micromeritics.La difracción de rayos X se realizó con un equipo PhillipsX´Pert-PW-3719. Los resultados se muestran en la figura 1 superpuestos a un difractograma realizado a un catalizador soportado sobre 50% en peso de α -Al2O3.y relación Mg/ V=4.
Figura 1. Difractogramas de rayos-X de catalizadores V-Mg-O soportados sobre -alúmina: a) relación Mg/V= 12 y 30% en peso de soporte; b) relación Mg/V= 4 y 30% en peso de soporte; c) relación Mg/V= 4 y 50% en peso de soporte.
Se observan los picos correspondientes a la fase Mg3V2O8 (ortovanadato de magnesio), MgO y á-Al2O3. Debido a la baja intensidad de los picos no puede asegurarse la presenciade la fase Mg2V2O7 (pirovanadato de magnesio) ya que seconfunden con el ruido de la línea base. Tampoco puededescartarse la presencia de fases como AlV2O4 y AlVO4 queaportan señales aproximadamente dentro del mismointervalo. La espectroscopia de infrarrojo en el intervalo400-1200 cm-1 realizada con un equipo NICOLET 710 FTIR, muestra las bandas características de los enlaces V-O y Mg- V a 856, 830 y 691 cm-1 y dos de menor intensidad a 970 y 912 cm-1. La espectroscopia de reflectancia difusa en el rango RD-UV-vis realizada con un equipo Cary 5 equipado con una cámara de tratamiento presenta un pico centrado en 274 nm que confirma también la presencia mayoritaria de la faseortovanadato. Las experiencias de reducción a temperaturaprogramada con hidrógeno (TPR-H2) se realizaron con un equipo 2910 Micromeritics y muestran picos de reducción entre 608 y 625ºC. Los resultados de caracterización que reflejan la presencia de la especie activa se resumen en la tabla 1.
Tabla 1. Características de los Catalizadores Empleados, V-Mg-O modificados con á-Al2O3 humedad y remover posibles trazas de contaminantes.

Equipo experimental
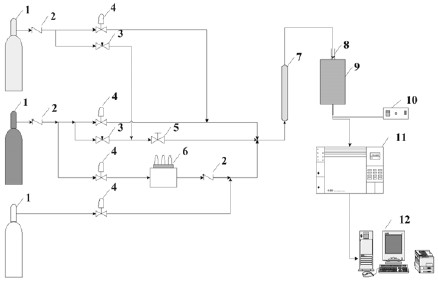
El equipo experimental utilizado para las pruebas catalíticas se muestra en la figura 2 y básicamente consta de un baño térmico, cilindros de gases, controladores de flujo, reactor y cromatógrafo.Además, integraron el sistema de reacción losdispositivos necesarios para el control de la temperatura de reacción. El sistema está dispuesto de manera de poder trabajar en la deshidrogenación oxidativa de n-butano o de n-pentano. La alimentación está constituida por cuatro líneasde gases: 1) aire, 2) nitrógeno, 3) n-butano y 4) nitrógeno de arrastre para alimentar n-pentano cuyos flujos másicos fueron dosificados con controladores de flujo AALBORG AFC2600D. Luego de los controladores y de la unidad de saturación con n-pentano, los gases se mezclan y se hacen pasar a través de un lecho de zeolita para absorber la a) -Al2O3 (SBET= 4 m2g-1); b) O= ortovanadato magnésico; P= pirovanadato magnésico; Mg= MgO; = -Al2O3;c) Temperatura de los máximos observados durante los TPR-de H2; d) (V5+O4) = Tetraedros VO4 aislados con el vanadio en estado de oxidación 5+. El baño termostático fue diseñado para mantener la temperatura del n-pentano contenido en tres (3) saturadores, de los cuales sale una corriente de nitrógeno saturada con dicho reactante. La presión dentro del sistema de saturación fue medida mediante un manómetro en U con mercurio comolíquido manométrico. Los flujos que salen del lecho de zeolitason introducidos a un reactor tubular de lecho fijo que opera en régimen de flujo tipo pistón. El reactor es de cuarzo y consta de dos secciones de diferentes diámetros, una de 12mm de diámetro externo, 10 mm de diámetro interno y 27 cmde longitud y otra de 9 mm de diámetro externo, 7 mm de diámetro interno y 21 cm de longitud. El reactor se encuentra en el interior de un horno cuya temperatura es medida con un termopar tipo K y controlada mediante un controlador PID. En el interior del reactor se encuentra otro termopar tipo K mediante el cual se mide la temperatura del lecho catalítico. Los gases que salen del reactor se analizaron con un cromatógrafo modelo HP4890D, equipado con dos detectores: uno catarométrico (TCD) y otro de llama (FID). Además, el cromatógrafo posee dos columnas para el análisis simultáneo de los gases orgánicos e inorgánicos.
1: Cilindros a presión de aire, nitrógeno y n-butano. 2: Válvulas anti-retorno. 3: Válvulas reguladoras de flujo de aire y nitrógeno. 4: Válvulas de control de flujo de aire, nitrógeno y n-butano. 5: Válvula paso rápido. 6: Baño termostático de n-pentano. 7: Purificador de lecho de zeolita y sílica. 8: Reactor tubular de lecho fijo. 9: Horno. 10: Controlador PID e indicador de temperatura. 11: Computador con impresora. 12: Cromatógrafo de gas HP-4890D.
Figura 2. Diagrama del equipo
La columna encargada de separar y analizar los compuestos orgánicos es una HP-PLOT/Al2O3 de 50m x 0.53mm x 15.0 ìm Film Thickness HP part Nº 19095P-S25, y la otra columna que realiza el análisis de los compuestos inorgánicos es de zeolita 13X 100/120 mesh Supelco 1-0212 y pueden operar hasta una temperatura de 300ºC. El método de control que se utilizó fue optimizado para una adecuada separación de los picos.
Para el empaque del reactor, se respetaron los parámetrossugeridos en la literatura respecto a la relación de diámetro de reactor a diámetro de partícula, al grado de dilución dellecho catalítico y a las alturas mínimas de los lechos en números de partículas (Bleek et al. 1969).
Los catalizadores estudiados poseen un tamaño muy fino de partícula, que no se corresponden con las del carburo de silicio (material conductor inerte) disponible en el laboratorio(425 μm), el cual satisface la relación de diámetro del reactor/ diámetro de partícula sugerida por la bibliografía: mayor a 8. Para lograr un mezclado uniforme, es necesario adecuar el tamaño de partícula del catalizador al del carburo de silicio aglomerándolo primero, por compresión en forma de pastilla en un molde, para luego molerlo y tamizarlo. El catalizadorcon tamaño promedio de partícula del orden de 425 μm es llevado a una estufa durante 24 horas, para así eliminar la humedad. Una vez seco, se procede a pesar 0.4 g y luego se mezcla con carburo de silicio en una proporción volumétrica de una de catalizador por tres de carburo. Al hacerlo debe procederse muy cuidadosamente hasta obtener una mezcla homogénea para evitar así la generación de zonas de alta temperatura.
Montaje del lecho catalítico en el reactor
Una vez preparado el catalizador se procede a introducirloen un reactor de lecho fijo en el cual se realiza la reacción. Primero se desliza en su interior una rejilla circular de aceroinoxidable del mismo diámetro del reactor, con unaperforación en su centro, de forma tal, que ayude a ajustar ya centrar el termopar. Luego se introducen al reactor 2.455 gde carburo de silicio cuyo diámetro promedio de partícula es de 425 μm. A continuación, se procede a colocar los 0.4 del catalizador diluido con la cantidad arriba indicada de carburo de silicio. Finalmente, se adicionan 10.55 g de carburo.
Cada lecho se encuentra separado por una rejilla de acero inoxidable del mismo diámetro del reactor que permite aislarlas zonas inertes de la zona de reacción. La finalidad decolocar capas de carburo de silicio antes y después del lecho catalítico es la de obtener un mejor perfil de temperatura dentro del reactor y de distribuir en forma homogénea el flujo de gas alimentado, aproximando de esta manera, el efecto deseado de flujo pistón. Todo lecho ubicado por debajo y por arriba de la zona catalítica debe tener, almenos, una altura equivalente a 50 partículas. En nuestrocaso, para un diámetro de 425 ìm, se debe disponer de una altura mínima de 2.2 cm, la cual es superada por cada uno de los lechos dispuestos.
Una vez preparado el lecho catalítico, se debe garantizar que el catalizador se encuentre en el máximo estado de oxidación (V5+). Para ello se introduce el reactor en el interior del horno, realizando las conexiones de los termopares y de las líneas de flujos de entrada y salida. Con un flujo constantede aire de 70 cc/min, se programa el controlador de manerade aumentar la temperatura a razón de 2º C/min, desde latemperatura ambiente hasta 70º C la cual se mantiene poruna hora. El calentamiento es suave para evitar la acumulación de presión dentro de las partículas delcatalizador que pudiera demolerlas. Se vuelve a incrementar la temperatura a la misma velocidad (2° C/min.) hasta alcanzar 120 ° C, temperatura que se mantiene por un período de una hora. El calentamiento continúa suavemente, para evitar dilataciones rápidas que pudieran debilitar la estructura de las partículas. Finalmente se incrementa nuevamente la temperatura hasta 550º C a razón de 1º C/min. y se mantiene a esta temperatura por tres horas. A continuación se disminuye la temperatura hasta 120º C y el flujo de aire a 20 cc/min para mantener el catalizador oxidado mientras no esté en operación.
Con el objeto de verificar la reproducibilidad del lecho catalítico, con algunos de los catalizadores se procedió a armar el reactor varias veces con catalizador fresco. Las experiencias realizadas luego de cada empaque, mostraron diferencias promedio en los resultados del orden del 4%, lo cual confirma la importancia de respetar las normas sugeridas por Bleek et al. (1969).
Las experiencias se realizaron en el rango de temperatura de 475 a 550ºC, primero en escala descendente, y luego en forma ascendente para verificar la reproducibilidad de los datos. Al concluir el programa de experiencias se repitieron las quese realizaron de primeras y para todo el rango detemperaturas, con la finalidad de verificar que el catalizador no había sufrido cambios de actividad.
RESULTADOS Y DISCUSIÓN
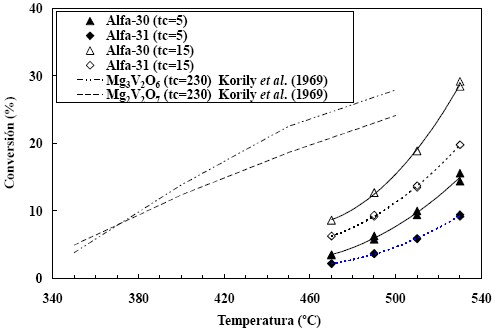
Se realizaron experiencias usando tres tiempos de contacto: 5, 10 y 15 [gcat h/molpentano] y a cuatro temperaturas de reacción: 470, 490, 510 y 530ºC. La composición de la alimentación se mantuvo constante en una relación molar C5:O2:N2 de 4:8:88. Los resultados obtenidos con ambos catalizadores se muestran en términos de conversión en función de la temperatura de reacción en la figura 3. Por razones declaridad no se incluyeron los datos correspondientes al tiempo de contacto 10, los cuales presentan valores intermedios.
Figura 3. Conversión en función de la temperatura de reacción.
Korili et al. (1969) publicaron datos de la DHOX de npentano sobre dos fases de vanadato de magnesio: ortovanadato de magnesio (Mg3V2O6) y piro-vanadato demagnesio (Mg2V2O7), utilizando un tiempo de contacto aproximado de 230 [gcat h/molpentano] y una relación molar C5:O2:He de 3.5:3.5:93. Las líneas de tendencia de sus resultados se presentan superpuestas a nuestros datos en la figura 3. La comparación resulta difícil por la disparidaden los tiempos de contacto utilizados, por diferencias en el rango de temperaturas explorado, por el valor de la relación C5/O2 (igual a 0.5 en este trabajo e igual 1.0 para Korili et al. (1996) y por la diferencia en la relación atómica Mg/V (4 para el catalizador Alfa-30, 12 para Alfa-31, 1.5 para Mg3V2O6 y 1.0 para Mg2V2O7).
Como puede observarse, para el mismo tiempo de contacto la conversión obtenida sobre el catalizador Alfa-30 es mayor que la obtenida con el Alfa-31. Este comportamiento puede justificarse, al menos parcialmente, considerando que para la misma masa de catalizador, el Alfa-31 tiene un contenido de vanadio igual a la tercera parte del que contiene el Alfa- 30. Sin embargo, mientras que la relación del contenido de vanadio Alfa-30/Alfa-31 es igual a 3, la conversiónnormalizada por átomo de vanadio favorece al catalizadorAlfa-31 por un factor aproximado de 2. Dar una explicacióna este fenómeno no parece simple y pudiera ser el resultadode la combinación de varios factores, como el grado de accesibilidad a los centros activos, que el MgO en excesodesempeñe alguna función como la de aportar los reactivosa los centros activos, etc. Al compararlos con los datos de Korili et al. (1996), se observa que las curvas de conversióncon la temperatura tienen formas diferentes, lo cual se debeen primera instancia a la marcada diferencia en los tiempos de contacto y en segunda instancia a que hay agotamiento de oxígeno a las temperaturas de reacción más elevadas: 500ºC sobre Mg3V2O6 y 450 y 500ºC sobre Mg2V2O7. A esto hay que añadir que la relación O2/C5 utilizada por dichos autores es la mitad de la utilizada en nuestro caso.
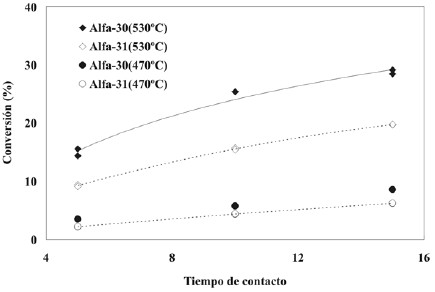
La conversión en función del tiempo de contacto, para dos niveles de temperatura de reacción, se muestra en la figura 4. Nuevamente se omiten las temperaturas intermedias paraevitar confusiones, lo cual no impide que puedan derivarselas conclusiones pertinentes. Como puede observarse las pendientes de las curvas disminuyen con la conversión locual es una consecuencia de la disminución en la concentración de reactivos.
Figura 4. Conversión en función del tiempo de contacto.
Los catalizadores utilizados son a base de óxidos de magnesio y vanadio, pero difieren considerablemente encuanto a la relación Mg/V y a la presencia de un sólido modificador como la α-Al2O3. Además, en este trabajo se tuvo especial cuidado de que el oxígeno nunca se agotara,a diferencia del trabajo de Korili donde a las temperaturas de reacción más elevadas se reconoce su agotamiento. En consecuencia es virtualmente imposible hacer una comparación más allá de lo cualitativo.
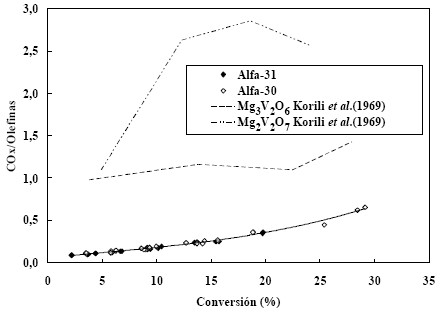
La relación entre las selectividades a óxidos de carbono y la selectividad a olefinas sin discriminar [COx/Olefinas] nos da en cierto modo una idea de cómo varía la selectividadcon la conversión. En la figura 5 se presentan estos datospara ambos catalizadores (Alfa-30 y Alfa-31), para todos lostiempos de contacto y todas las temperaturas, en funciónde la conversión. Como puede observarse los datos caenprácticamente sobre la misma curva de tendencia. Esto quiere decir que la relación atómica Mg/V no tiene incidencia sobre el mecanismo de reacción y que afecta la cinética detodas las reacciones involucradas en el mecanismo de reacción en la misma proporción. Superpuestas a los datos de este trabajo, se presentan las líneas de tendenciacorrespondientes al trabajo de Korili. Las diferencias sonnotables pero pueden explicarse como una suma de variosefectos. Es sabido que uno de los factores que afectan laselectividad es el valor de la relación Mg/V. A medida que esta relación crece, aumenta la basicidad de la superficie, y disminuye su afinidad con los hidrocarburos no saturados, cuya basicidad relativa es mayor que la de los hidrocarburossaturados. Esto favorece la adsorción de las parafinas sobre las olefinas, lo cual se traduce en velocidades de oxidación menores para éstas respecto de las primeras, y por lo tanto en un aumento de la selectividad. Sin embargo, valores muyaltos de la relación Mg/V inducen a la formación de centros Mg2+ que en alguna medida contribuyen a las reacciones de combustión total y disminuyen la selectividad. Al efecto ácido-base mencionado se superpone otro efecto que es el aumento de la distancia entre centros activos a medida quela relación Mg/V aumenta. Esto favorecería la formación dela fase orto-Mg3V2O8 con una mayor proporción de especiesaisladas V5+ (con coordinación tetraédrica) que favorecenla selectividad. Simultáneamente, si la relación Mg/V es pequeña (contenidos en peso de óxido de vanadio mayores al 20-30%) la disponibilidad de oxígeno reticular y laprobabilidad de que una molécula de C4 o C5 se adsorbasimultáneamente sobre dos centros activos aumenta y enconsecuencia la selectividad disminuye. El valor de larelación Mg/V para los catalizadores utilizados en estetrabajo y los utilizados por Korili sigue la secuencia Alfa- 31>Alfa-30> Mg3V2O6> Mg2V2O7 (12>4>1.5>1). El punto de máxima selectividad se ubica en el entorno del valor Mg/ V=4, que explica lo que se observa en la figura 5 (Mamedov et al. 1995; Corma, 1993a, Corma 1993b, Corma 1994; López Nieto et al. 1995; Blanco y Reinoso, 2000; Armas, 2004). Los espectros de RX para los catalizadores utilizados en este trabajo muestran que la especie superficial dominante es la de Mg3V2O6, especie a la cual se atribuye la mejor selectividad hacia hidrocarburos no saturados.
Figura 5. Relación [COx/Olefinas] en función de la conversión para los catalizadores Alfa-30 y Alfa-31
Adicionalmente en la figura 5 se observa una diferencia notable de comportamiento entre las especies Mg3V2O6 y Mg2V2O7. Son fases puras y las diferencias en la relaciónMg/V es muy pequeña y no explica la magnitud de dicha diferencia. En la primera fase el vanadio está en coordinación tetraédrica con el magnesio enlazando a tres oxígenos como elemento puente, mientras que en la segunda fase los dostetraedros están enlazados por un O2-. Este oxígeno es muchomás móvil y contribuye a aumentar las velocidades de las reacciones de oxidación total, perjudicando la selectividad (Mamedov et al. 1995). Como se observa en la figura 3 la curva de conversión en función de la temperatura para lafase Mg3V2O6 supera a la correspondiente de la fase Mg2V2O7. Como en ambos casos, para T= 500ºC, se ha agotado el oxígeno, el ordenamiento observado es unaconsecuencia lógica de la mayor selectividad de la primerafase, ya que a igual cantidad de oxígeno en la alimentaciónse transformarán más moléculas de n-pentano cuanto mayorsea la selectividad. Este comportamiento y el hecho de queen los catalizadores Alfa-30 y alfa-31 la fase dominante es la de Mg3V2O6, soportan la opinión generalizada de que esta fase es la responsable de la selectividad.
En la figura 5 puede observarse también una característica común de la DHOX de hidrocarburos livianos, la cual esque dicha relación tiende a un valor superior a cero paraconversión cero, lo cual significa que los óxidos de carbonoson simultáneamente productos primarios y secundarios dereacción. Además, como los productos de oxidación totalson termodinámicamente más estables bajo las condiciones de reacción, su tendencia es a aumentar a medida que aumenta la conversión y en forma acelerada debido a que a todos los tiempos de contacto y todas las temperaturas de reacción. los hidrocarburos no saturados que se producen son más inestables que el n-pentano.
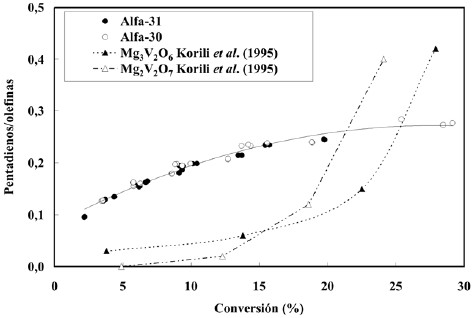
En la figura 6 puede observarse el comportamiento de la relación [Pentadienos/olefinas] en función de la conversión. Muestra el comportamiento clásico de productos secundarios meta-estables de reacción, es decir que aumenta con la conversión sin sobrepasar el valor unitario. Nuevamente una extrapolación a conversión cero indica que la relación no cae a cero, lo cual significa que los pentadienos tienen también características de productos primarios. Si el oxígeno se agotara los catalizadores se volverían algo más selectivos hacia los dienos (Hernández y Velásquez, 2006) y la curva debería mostrar un rápido incremento sin superar el valor unidad.
Figura 6. Relación [Pentadienos/Olefinas] en función de la conversión para los catalizadores Alfa-30 y Alfa-31 a todos los tiempos de contacto y todas las temperaturas de reacción.
En la figura 6 se superponen los valores correspondientes a los datos de Korili que muestran el cambio de pendiente, a menor conversión para la fase Mg2V2O7, que para la Mg3V2O6, lo cual concuerda con el hecho de que el oxígenose agota a conversiones menores para el primero. La diferencia con los datos de este trabajo, se justifican por el hecho de que los catalizadores Alfa-30 y Alfa 31, con relaciones Mg/V iguales a 4 y 12, respectivamente, retardan considerablemente las reacciones de oxidación total, y aque en nuestro caso no se llegó nunca al agotamiento total del oxígeno.
Otro fenómeno que se observa en las figuras 5 y 6, es que graficando los valores de ambas relaciones en función de la conversión, los datos caen sobre una curva común. Estopudiera explicarse por el hecho comprobado de que laselectividad sólo depende marginalmente de la relación Mg/V, si ésta se encuentra por encima del valor 4 (Blanco y Reinoso, 2002; Armas, 2004).
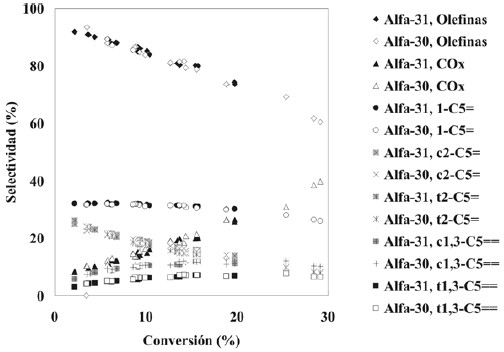
En la figura 7 se condensa toda la información. Como puede observarse las selectividades a pentenos muestran unatendencia decreciente con el aumento de conversión, comportamiento característico de productos primarios. También puede observarse que el 1-penteno es más estable que los isómeros de posición de doble ligadura. En cuanto a los pentadienos es ya observable la tendencia a pasar porun máximo lo cual nos dice que son más inestables que el butadieno en el caso de la DHOX de n-butano. Resulta también claro que los resultados obtenidos sobre ambos catalizadores siguen una tendencia común para todos losproductos de reacción, lo cual confirma que la relación Mg/V no tiene mayor influencia sobre el mecanismo de lareacción, dentro del rango explorado. En cuanto a la selectividad a olefinas, sin discriminar, se observa undecaimiento con el aumento de la conversión llegando avalores próximos al 60% para conversiones del orden del30%. Este decaimiento es mayor al observado con n-butano, lo cual sugiere que debería analizarse la posibilidad de modificar los catalizadores de modo de disminuir la afinidad a adsorberse de los productos de deshidrogenación.
Figura 7. Selectividades de los diferentes productos de reacción en función de la conversión para todos los tiempos de contacto y todas las temperaturas utilizadas.
CONCLUSIONES
Se ha estudiado el comportamiento de los catalizadores Alfa 30 y Alfa 31 en la DHOX de n-pentano, y los resultados se comparan con los escasos datos publicados. Se observa que la relación Mg/V afecta la cinética de reacción en lamisma proporción para todas las reacciones que describenal mecanismo de reacción, sin afectar al mecanismo mismo,ya que los datos de ambos catalizadores se ajustan a líneasde tendencia comunes. La importancia de la relación Mg/V y del nivel de alcalinidad del catalizador se resalta por comparación con los datos publicados por otro investigador. Además se observa que el 1-penteno es más estable quesus isómeros de posición de la doble ligadura, y que lospentadienos se producen en menor cantidad y son menos estables que los productos primarios de reacción. La caída de la selectividad a olefinas es relativamente pronunciada por lo que para fomentar el uso de estos catalizadores en la DHOX de n-pentano sería conveniente intentar su optimización.
AGRADECIMIENTOS
Los autores agradecen el apoyo de la Universidad Central de Venezuela, FONACIT e IVIC y los oportunos consejos del Profesor José Manuel López Nieto del ITQ, Universidad Politécnica de Valencia, España.
REFERENCIAS
1. ARMAS, M. N. (2004). «Deshidrogenación Oxidativa de Alcanos Ligeros», Tesis de Doctorado, Universidad Politécnica de Cataluña, España. [ Links ]
2. BLANCO, C. Y REINOSO, N. (2000). «Deshidrogenación oxidativa de n-butano sobre un catalizador VMgO/SiO2», Trabajo Especial de Grado, Universidad Central de Venezuela, Caracas, Venezuela. [ Links ]
3. CORMA, A., LÓPEZ NIETO, J.M. AND PAREDES N. (1993a). «Preparations of V-Mg-O Catalysts: Nature of Active Species Precursors». Appl. Catal. A: General, 104, 161- 174. [ Links ]
4. CORMA A., LÓPEZ NIETO J.M. AND PAREDES, N. (1993b). «Oxidative Dehydrogenation of Propane on Vanadium Supported on Magnesium Silicates». Appl. Catal. A: General, 97, 159-175. [ Links ]
5. CORMA A., LÓPEZ NIETO, J.M., PAREDES, N., DEJOZ, A. AND VÁZQUEZ, I. (1994). «Oxidative Dehydrogenation of Propane and n-Butane on V-Mg Based Catalysts». New Development in Selective Oxidation II, 113-123. [ Links ]
6. DEJOZ, A. (1995). «Deshidrogenación Oxidativa de n-Butano sobre Catalizadores de óxido de vanadio soportado», Tesis de Doctorado, Universidad de Valencia, España. [ Links ]
7. DE RISI, L. Y ROSILLO, C. (2003). «Deshidrogenación Oxidativa de n-Butano y n-Pentano sobre Catalizadores VMgO Soportados y Promovidos». Trabajo Especial de Grado. UCV. [ Links ]
8. DIETZ, III A. G., CALSSON, A. F. AND SCHMIDT, L. D. (1996). «Partial oxidation of C5 and C6 alkanes over monolith catalysts at short contact time», Journal of Catalysis, 176, 459. [ Links ]
9. H. AL KANDARI, AL-KHARAFI, F., AL-AWADI, N., EL-DUSOUQUI, O.M., ALI, S. A. AND KATRIB, A. (2005). «The catalytic active sites in partially reduced MoO3 for the hydroisomerization of 1-pentene and n-pentane», Applied Catálisis A: General, 295, 1. [ Links ]
10. HERNÁNDEZ, Y. C. Y VÁSQUEZ, M. C. C. (2006). «Deshidrogenación oxitativa del n-butano y su relación con el estado de oxidación del catalizador». Trabajo Especial de Grado. UCV. [ Links ]
11. KORILI, S. A., RUIZ, P. AND DELMON, B. (1996). «Oxidative dehydrogenation of n-pentane on magnesium vanadato catalysts», Catalysis Today, 32, 229. [ Links ]
12. LÓPEZ NIETO, J.M., DEJOZ, A., VÁSQUEZ, M.I. (1995). «Preparation, Characterization and Catalytic Properties of Vanadium Oxides Supported on Calcined Mg/Al- Hydrotalcite». Appl. Catal. A, 132, 41-59. [ Links ]
13. MAMEDOV, E. A. AND CORTÉS-CORBERÁN, V. (1995). «Oxidative Dehydrogenation of Lower Alkanes on Vanadium Oxidebased Catalysts. The Present State of the Art and Outlooks», Appl. Catal. A: General, 127, 1. [ Links ]
14. MICHALAKOS, P.M., KUNG, M-C., JAHAN, I. AND KUNG, H.H. (1993). «Selectivity patterns in alkane oxidation over Mg3(VO4)2-MgO, Mg2V2O7 and (VO)2P2O7», Journal of Catalysis, 140, 226. [ Links ]
15. PAPA, J., BRITO, J. L., MARZUKA, S., DÁVILA, K.D., OJEDA, D.A. & GUARÁN, N. (2007). «Preparation and evaluation of non supported and supported catalysts base don mixtures of vanadium and magnesium oxides for the ODH of nbutane », Rev. de Ingeniería, 22, in Press. [ Links ]
16. SOLER, J., LÓPEZ NIETO, J. M., HERGUIDO, J., MENÉNDEZ, M. AND SANTAMARÍA, J. (1998). «Oxidative Dehydrogenation of n-Butane on V/MgO Catalysts. Influence of the Type of Contactor», Catal. Lett. 50, 25. [ Links ]
17. SOLER, J., LÓPEZ NIETO, HERGUIDO, J. M., MENÉNDEZ, J., M. AND SANTAMARÍA, J. (1999). «Oxidative Dehydrogenation of n-Butane in a Two-Zone Fluidized-Bed Reactor», Ind. Eng. Chem. Res., 38, 90. [ Links ]
18. TAO LING-XIANG, WANG LIN-SHENG, XIE MAO-SANG, XU GUI FEN AND WANG SUE-LIN. (1994). «New method for olefin production from Light alckanes» React. Kinet. Catal. Letter, 1994, 53(1), 205. [ Links ]
19. UMIT S. OZKAN, HARRIS, TODD A. AND SCHILF, BRIAN T. (1997). «The partial oxidation of C5 hydrocarbons over vanadium-based catalysts», Catalysis Today, 33, 57. [ Links ]
20. VAN DEN BLEEK, K., VAN DER WIELE, P. J. AND VAN DEN BERG. (1969). «The Effect of Dilution on the Degree of Conversión in Fixed Bed Catalytic Reactors», Chem. Eng. Sci., 24, 681. [ Links ]
21. ZAZHIGALOV, V. A., HABER, J., STOCH, J. AND CHEBURAKOVA, E.U. (2001). The mechanism of n-pentane partial oxidation on VPO and VPBiO catalysts», Catalysis Communications, 2, 375. [ Links ]