Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Facultad de Ingeniería Universidad Central de Venezuela
versión impresa ISSN 0798-4065
Rev. Fac. Ing. UCV v.23 n.1 Caracas mar. 2008
Relacion entre el estado de oxidacion, la actividad y la selectividad de catalizadores a base de VMgO en la dhox de n-butano
José Papa 1,2, Joaquín Brito 2, Leidy López 1, Gonzalo Correa 1
1 Universidad Central de Venezuela, Facultad de Ingenieria, Escuela de Ingenieria Quimica.
2 Instituto Venezolano de Investigaciones Cientificas, IVIC. e-mail: jpapa@reacciun.ve
RESUMEN
Se estudio la Deshidrogenacion Oxidativa (DHOX) de n-butano en forma aerobica y anaerobica sobre cuatro catalizadores a base de una mezcla de Oxido de Vanadio y Magnesio (VMgO) con una relacion Mg/V=4. Los resultados experimentales obtenidos soportados con las tecnicas de caracterizacion utilizadas (DRX, XPS, BET, ATG y Absorcion atomica), permitieron verificar la reproducibilidad en la preparacion de los catalizadores, que la actividad y la selectividad dependen del estado de oxidacion de los mismos, que durante el proceso de reaccion se producen cambios superficiales de cristalinidad, y que la actividad se puede recuperar en su totalidad al re-oxidarlos. La fase activa dominante, formada sobre todos por los catalizadores preparados, fue el orto-vanadato de magnesio y se encontro que en los catalizadores sin usar el unico estado de oxidacion presente para el vanadio fue V+5. Operando bajo condiciones anaerobicas se detecto la presencia del estado de oxidacion V+4 con una relacion V+4/V+5 que aumenta con el grado de reduccion alcanzado, el cual en este trabajo nunca llego al nivel de producir V+3. Ademas, operando en presencia de oxigeno molecular solo se observaron especies de V+5. La presencia de un segundo soporte (silica o a-alumina) no tuvo influencia sobre las especies de vanadio presentes, pero se comprobo que promueven la estabilidad de los productos de quimisorcion de CO2, que aumentan la dispersion de las especies y que reducen la selectividad hacia los productos deseados.
Palabras Clave: Deshidrogenacion oxidativa, n-Butano, Vanadio, Magnesio, Alumina, Silice, XPS.
Relationship between the state of oxidation, the activity and selectivity of catalysts based on VMgO for the odh of n-butane
ABSTRACT
The Oxidative Dehydrogenation (ODH) of n-butane was studied under aerobic and anaerobic conditions on four catalysts based on a mixture of Vanadium and Magnesium Oxides (VMgO) with an atomic ratio Mg/V=4. The experimental results supported by the characterization techniques used (DRX, XPS, BET, TGA and Atomic Adsorption) made it possible to verify the reproducibility of the catalysts preparation method and to determine that activity and selectivity is a function of the catalysts oxidation state, that during the reaction process surface crystallinity changes are taking place, and that activity can be fully recovered by the catalyst re-oxidation. The main active phase formed on all the prepared catalysts was magnesium ortho-vanadate and it was found that the unique oxidation state of vanadium present in fresh catalysts was V+5. Working under anaerobic conditions it was detected the formation of the V+4 oxidation state and it was found that the ratio V+4/V+5 is a function of the catalyst reduction degree, which in our case never reached the level of producing V+3 . In the presence of molecular oxygen only V+5 was observed. The presence of a second support (silica or a-alumina) had no effect on the vanadium species formed, but it was found that it promotes the stability of products formed by chemisorption of CO2, that it increases the dispersion of species formed and that it decreases the selectivity toward desired products.
Keywords: Oxidative dehydrogenation, n-Butane, Vanadium, Magnesium, Alumina, Silica, XPS.
Recibido: noviembre de 2006 Revisado: marzo de 2008
INTRODUCCION
Durante los ultimos anos se han publicado una serie de trabajos con el proposito de hacer posible el desarrollo de nuevas tecnologias y con el objetivo de aumentar el valor agregado de productos como el propano, n-butano y npentano. Venezuela cuenta con grandes reservas probadas de gas natural con un contenido economicamente importante de dicho hidrocarburo, lo que permite predecir expansiones en el area de produccion, las cuales son un incentivo para el desarrollo de nuevas tecnologias.
La Deshidrogenacion Oxidativa (DHOX) de parafinas para producir olefinas es una de las alternativas para incrementar el valor agregado de n-butano. Este proceso permite superar algunos de los problemas encontrados en los procesos actualmente en uso como: a) las limitaciones impuestas por equilibrio termodinamico, b) la considerable cantidad de energia termica requerida (reaccion endotermica) a un nivel alto de temperatura, y c) la apreciable cantidad de subproductos producidos por las reacciones de craqueo. En cambio las reacciones de DHOX no presentan limitaciones termodinamicas y por lo tanto pueden conducirse a temperaturas mas bajas. Ademas, las condiciones de reaccion son tales que evitan la formacion de una cantidad apreciable de coque. Sin embargo, los productos de oxidacion profunda son termodinamicamente mas estables, con lo que aparece un problema dificil de resolver que es el de la selectividad. Este problema solo puede resolverse con el desarrollo de catalizadores selectivos y el uso de reactores apropiados.
La DHOX ha sido estudiada para diferentes hidrocarburos, desde el etano hasta el pentano, y los resultados fueron descritos en varias publicaciones (Kung, 1994; Mamedov y Cortes, 1995; Vedrine et al. 1997; Cavani y Trifiro, 1995; Blasco et al. 1997 y Papa et al. 2007). Los hidrocarburos que han recibido la mayor atencion son el propano y n-butano, mientras que para el n-pentano los estudios realizados son escasos. Como agentes oxidantes los mas indicados son el oxigeno molecular, los oxidos nitrosos, los halogenos, el azufre elemental o cualquiera de sus compuestos. De ellos el que resulta mas atractivo y mas viable a nivel industrial es el oxigeno, tanto por el bajo costo como por tener menos impacto ambiental.
La DHOX de n-butano es un proceso de interes para Venezuela, pero para que tenga posibilidades de imponerse, deben desarrollarse catalizadores activos, selectivos, resistentes a la atricion, estables, faciles de re-oxidar y ademas con tecnicas de preparacion que garanticen la reproducibilidad. De los catalizadores estudiados hasta ahora hay al menos dos que se perfilan con buenas posibilidades de uso. La fase activa de ambos esta constituida por una mezcla de oxidos de vanadio y magnesio con una relacion atomica Mg/V entre 4 y 12 y se diferencian por el tercer oxido utilizado para tratar de conferirle la necesaria resistencia mecanica. Estos oxidos, sin embargo, interaccionan de alguna forma con la fase activa modificando sus caracteristicas, encontrandose que un buen balance que mantiene bajos los cambios en actividad y selectividad, es usarlos con una proporcion en peso del 30%. Sin embargo, todavia no se han resuelto todos los items arriba indicados.
Este trabajo se desarrolla con el proposito de ayudar a resolver el problema de la reproducibilidad de preparacion de los catalizadores, de mejorar la estabilidad durante el tiempo en uso, y de observar las posibles relaciones entre el estado de oxidacion y los cambios superficiales con la actividad y la selectividad.
TECNICA EXPERIMENTAL
Para tratar de entender el comportamiento de estos catalizadores se dispuso de dos sistemas de reaccion, uno anaerobico y el otro aerobico, y del auxilio de varias tecnicas de caracterizacion como son la Difraccion de Rayos X (DRX), la Espectroscopia Fotoelectronica de rayos X (XPS), la Determinacion de Superficie Especifica (BET con nitrogeno), la Reduccion a Temperatura Programada (RTP) usando la tecnica de Analisis Termico Gravimetrico (ATG), y la absorcion atomica. Las tecnicas de caracterizacion mencionadas suministraran informacion para intentar la deteccion de cambios estructurales de los catalizadores en funcion del metodo de preparacion, la temperatura de calcinacion, la temperatura y condiciones de estabilizacion y la historia de uso, tanto en condiciones aerobicas como anaerobicas. Ademas permitirian relacionar la actividad y la selectividad observadas sobre los catalizadores utilizados para la DHOX de n-butano, bajo condiciones anaerobicas y aerobicas, con el estado de oxidacion del catalizador.
Catalizadores empleados
Se utilizaron cuatro catalizadores, dos masicos (que solo poseian oxidos de vanadio y magnesio), uno calcinado a 600 (B16) y el otro a 700ºC (B17), un tercer catalizador fue soportado en 30% de a-Al2O3 y calcinado a 600ºC (A16) y el cuarto soportado en 30% de SiO2 y calcinado a 600ºC.(S16). La preparacion de los catalizadores base se repitio cuatro veces y cuando corresponda se identificara como una secuencia de preparaciones.
Tanto los catalizadores soportados como los masicos, se prepararon a base de oxidos de vanadio y magnesio, manteniendo una relacion atomica magnesio-vanadio igual a 4. Para la preparacion de los catalizadores denominados como base, se mezclaron soluciones acuosas de oxalato de vanadilo y de acetato magnesico; la solucion resultante se seco a 100ºC con agitacion a velocidad constante, y el producto solido se coloco en la estufa a 100º C durante 24 horas. Finalmente el catalizador fue triturado, uniformado y luego calcinado. Para la preparacion de los catalizadores soportados se siguio la misma metodologia con la diferencia de que a la mezcla de las soluciones de oxalato de vanadilo y de acetato magnesico se le agrego la cantidad apropiada de a-Al2O3 o de SiO2 de modo que despues de la calcinacion constituyeran el 30% en peso del catalizador.
Pruebas Cataliticas Realizadas
- Condiciones aerobicas
El equipo experimental utilizado y su modo de operarlo ya ha sido descrito por De Risi y Rosillo (2003). Se cargo el catalizador base calcinado a 600ºC previamente diluido con carburo de silicio al reactor, y en ambiente de nitrogeno se llevo a 400ºC. Luego se establecieron las condiciones de reaccion: tiempo de contacto de 6 (min gcat/moltot) y composicion de la alimentacion C4H10/O2/N2 = 8/12/80% (base molar), y a los 40 minutos, se realizo un analisis cromatografico de los efluentes del reactor (este analisis sirvio de referencia). Posteriormente, se calento por etapas de la forma estandar a: 480, 500, 520 y 540ºC. A cada una de estas temperaturas, luego de un periodo de estabilizacion de 40 minutos se realizo un analisis cromatografico y se determino la conversion y selectividades logradas. A 540ºC se realizaron analisis cada 40 minutos hasta que no se observaron cambios en la conversion con el tiempo en operacion. Luego se enfrio el reactor en ambiente de nitrogeno y se retiro el catalizador. A continuacion se cargo nuevamente el reactor y se repitieron las experiencias anteriormente descritas pero a los siguientes niveles de temperatura 400, 485, 505, 525, 550ºC. La ultima de estas temperaturas se mantuvo tambien durante el tiempo necesario para lograr la estabilidad haciendo para ello un analisis de efluentes cada 40 minutos. A partir de ese momento se realizaron experiencias en la escala descendente de temperaturas (550, 525, 505 y 485) para luego repetirlas en la escala ascendente. Las experiencias en la escala descendente y ascendente se repitieron para tiempos de tiempos de contacto de 25 y 50 (min gcat/moltot). La secuencia completa de pruebas se realizo tambien para los catalizadores B16, A16 y S16, mientras que para el B17 las experiencias se limitaron a la estabilizacion. En todos los casos los catalizadores usados fueron convenientemente resguardados luego de la reaccion para someterlos a pruebas de DRX y XPS.
- Condiciones anaerobicas
En la tabla 1 se presenta un resumen de las experiencias realizadas. Una vez montado el lecho catalitico, se fijo el flujo de nitrogeno al valor correspondiente para un tiempo de contacto de 50 (min gcat/moltot) y se establecieron las condiciones de operacion de manera que en 45 minutos se alcanzara la temperatura deseada (550ºC). Una vez alcanzada la temperatura de reaccion se procedio a inyectar pulsos de 1 cc de n-butano con el espaciado de tiempo necesario para realizar el analisis cromatografico de efluentes del reactor. Para cada pulso se determino la conversion y las selectividades hacia butenos, 1,3-butadieno, COx y productos de craqueo. En un caso aislado que se detalla en la tabla 1 la temperatura de reaccion se fijo en 540ºC en lugar de 550ºC. La presion de trabajo se fijo en 8 psia., la cual garantizaba el desvio de una fraccion del flujo de salida hacia el cromatografo. Al final de cada ensayo, o secuencias de ensayos, el catalizador fue conservado para realizar las medidas de caracterizacion que fuesen posibles dado el pequeno tamano de la muestra.
Tabla 1. Pruebas cataliticas realizadas.
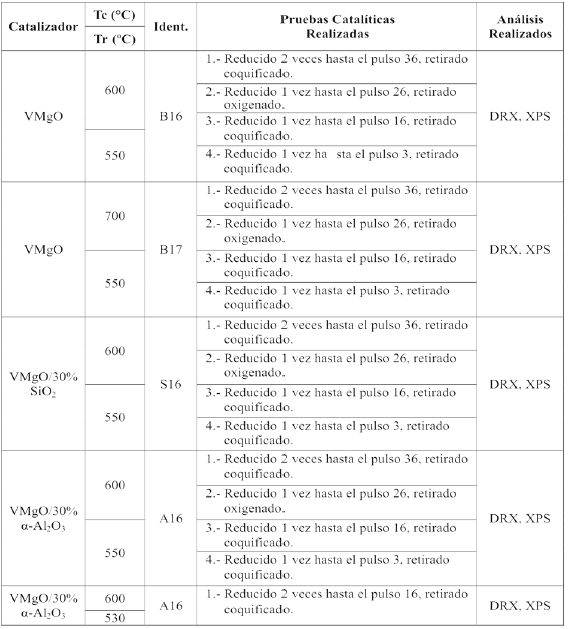
Tc: Temperatura de calcinacion Tr: Temperatura de reaccion
Tecnicas de Caracterizacion
Los espectros de XPS se obtuvieron en un sistema VG ESCALAB 220i-XL, equipado con una fuente no monocromatica de doble anodo (Mg/Al), operada a 400W. Todos los experimentos se hicieron bajo vacio ultra-alto, a una presion inferior a 10-9 Torr. El tratamiento de la data experimental para realizar la deconvolucion de los espectros se realizo con los programas XPSSPEAK 4.1 y XPS GRAPH. Dado que las muestras son no conductoras, la escala de energias de enlace de los espectros se ajusto utilizando la senal del C 1s (aleatorio) a 284,6 eV como estandar interno.
La DRX se realizo en un Siemens D-5005 en el que se introdujo una cantidad de catalizador previamente pulverizado, el cual se irradio con radiacion X al mismo tiempo que se rotaba. Se genero un grafico representativo de las fases desarrolladas sobre la superficie del catalizador. Para la identificacion de los picos se emplearon las cartas del Centro Internacional de Difraccion de Rayos X y los patrones de difraccion de las especies puras orto, meta y para vanadato, y de los soportes.
Los experimentos de TPR se hicieron mediante un sistema para Analisis Termo-Gravimetrico (ATG) Mettler Toledo TGA/SDTA851 empleando un flujo de 100 ml/min de mezcla 10% H2 en N2 y una velocidad de calentamiento de 10ºC/ min entre 25 y 900ºC. La superficie especifica se determino por el metodo de adsorcion de nitrogeno a la temperatura de nitrogeno liquido (BET) y el analisis quimico por absorcion atomica.
DISCUSION Y RESULTADOS
Caracterizacion por DRX, Absorcion Atomica, BET y ATG
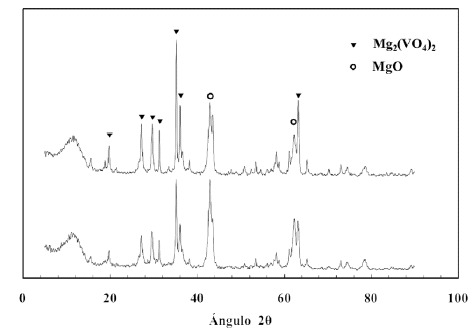
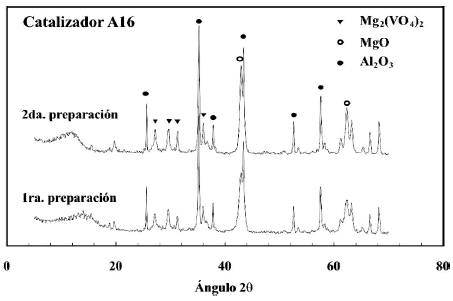
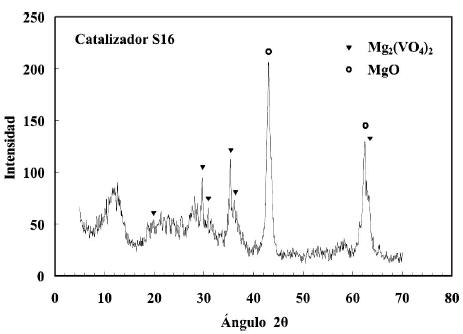
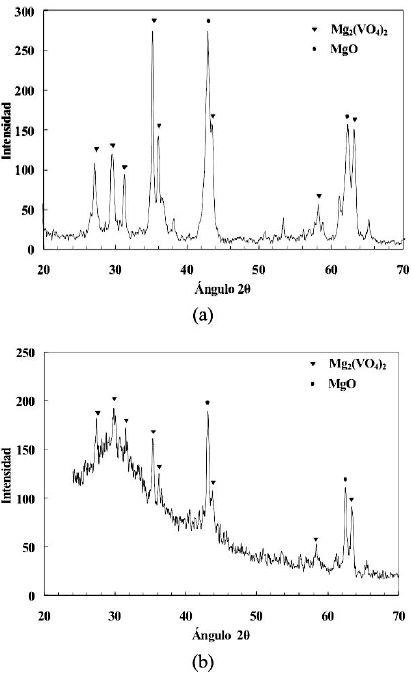
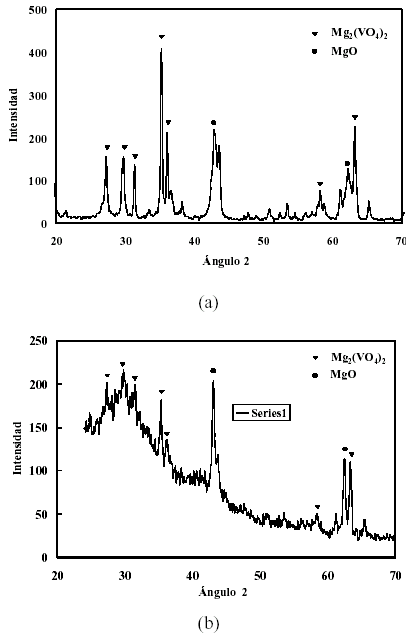
En las figuras 1, 2 y 3 se presentan los difractogramas obtenidos para los catalizadores sin usar. Como se observa las principales fases que se forman en todos los catalizadores son la de orto-vanadato de magnesio y la de oxido de magnesio. En la figura 2 se observan los DRX para dos preparaciones independientes, ademas los picos caracteristicos de la fase a-Al2O3 presente como tercer componente oxidico, mientras que en la figura 3 la linea base se observa muy afectada por el nivel de ruido generado por el SiO2 amorfo. Cada catalizador presenta diferencias en la intensidad de los picos correspondientes a las fases que se forman, pero lo fundamental es que la fase que predomina es la de orto-vanadato (Mg3(VO4)2), fase a la que se le atribuye la selectividad (Armas, 2004). El oxido de magnesio, al igual que el ortovanadato, produce picos de considerable intensidad. Esto es importante ya que el primero es responsable de la basicidad superficial que facilita la desorcion de las olefinas mejorando de esta forma la selectividad del catalizador, y el segundo proporciona los centros activos y selectivos para la reaccion (Vidal-Michel et al. 2003).
Figura 1. Patrones de difraccion de los catalizadores masicos calcinados a 600ºC (B16, difractograma superior) y a 700ºC (B17, difractograma inferior).
Figura 2. Patrones de difraccion para dos preparaciones del catalizador soportado en a-Al2O3 (A16) calcinado a 600ºC.
Figura 3. Patron de difraccion del catalizador soportado en SiO2 (S16) calcinado a 600ºC.
Los difractogramas de cuatro preparaciones independientes del catalizador base se muestran en la figura 4. Como puede observarse tanto la ubicacion de los picos como las intensidades relativas son similares. Las pequenas diferencias que se notan pueden ser atribuidas a ruidos experimentales durante la aplicacion de la tecnica de Difraccion de Rayos X de polvo o a los tratamientos a los cuales fueron sometidos los patrones para la eliminacion del ruido (FFT filtering). Esto indica que las fases cristalinas que se formaron en cada uno de los catalizadores son las mismas y que ademas se encuentran en proporciones similares.
Figura 4. Patrones de difraccion de diferentes catalizadores masicos elaborados con el mismo metodo de preparacion y calcinados a 600ºC.
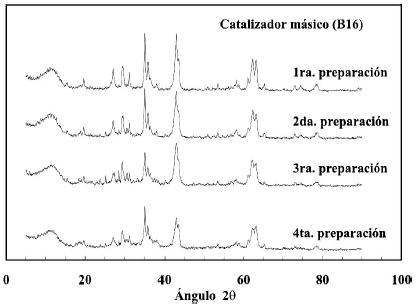
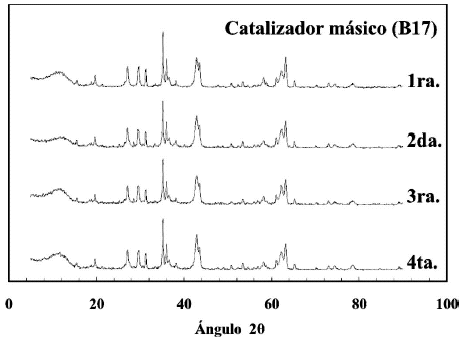
En la figura 5 se presentan los patrones de difraccion de cuatro preparaciones independientes del catalizador base calcinado a 700oC y al igual que en el caso anterior no se encontraron mayores diferencias entre ellos. La reproducibilidad en la preparacion de catalizadores es un punto esencial para el desarrollo de un proceso catalitico, y los resultados mostrados sugieren que se ha conseguido.
Figura 5. Patrones de difraccion de diferentes catalizadores masicos elaborados con el mismo metodo de preparacion y calcinados a 700ºC (con 1ra., 2da.,3ra. y 4ta. se identifica la preparacion).
Los resultados obtenidos por absorcion atomica ratifican lo dicho con anterioridad y se presentan en la tabla 2. Las relaciones atomicas para los catalizadores masicos son algo mayores a la relacion atomica Mg/V=4 deseada, pero la diferencia es pequena. Estas diferencias entre las relaciones atomicas no traen mayores consecuencias a la hora de comparar actividades y selectividades (Blanco y Reynoso, 2000).
Tabla 2. Valores de superficie especifica y de la relacion Mg/V para los catalizadores preparados.
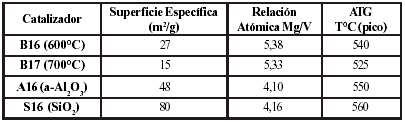
Los catalizadores masicos se calcinaron a dos temperaturas diferentes (600 y 700ºC) con la finalidad de observar el efecto de esta variable de preparacion sobre el comportamiento del catalizador. Los catalizadores masicos calcinados a 700ºC presentan patrones de difraccion con mejor definicion de los picos y un nivel de ruido a angulos bajos menor, cuando se los compara con los catalizadores masicos calcinados a 600ºC, lo cual sugiere que en los primeros se ha logrado un mejor grado de cristalinidad (figura 1). Por otro lado, la superficie especifica del catalizador calcinado a 700ºC es considerablemente menor (tabla 2), lo que prueba que el nivel de sinterizacion alcanzado es mayor. Este resultado, asociado a los observados por DRX, indica una disminucion en el contenido de fase amorfa, lo cual, de acuerdo con los estudios realizados por Vidal-Michel et al. (2003), que encontraron que el area especifica de los catalizadores disminuye a medida que el tamano del cristal aumenta, pudiera sugerir que tambien se produce un leve aumento en el tamano de los cristales. Por otro lado Vidal-Michel et al. (2003) sostienen que para conversiones similares de nbutano, la selectividad hacia buteno es mayor en un catalizador con cristales grandes que en uno con cristales pequenos.
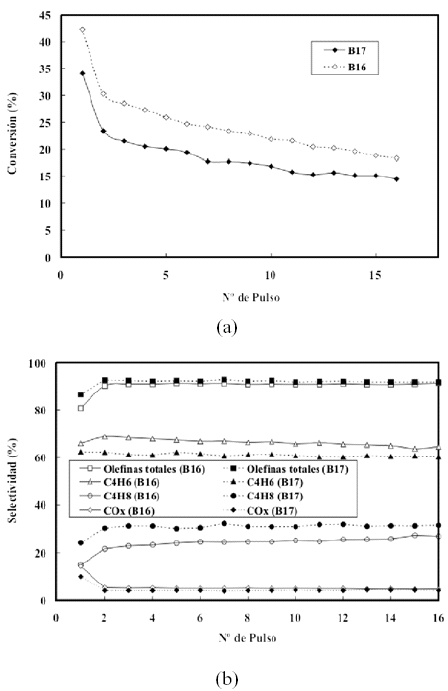
En la figura 6 se muestran los resultados obtenidos operando bajo condiciones anaerobicas con los catalizadores B16 (calcinado a 600º) y B17 (calcinado a 700º). En ella se observa efectivamente que la conversion de n-butano es mayor sobre el calcinado a 600ºC (de mayor superficie especifica) y que la selectividad hacia butenos es mayor sobre el calcinado a 700ºC. La inyeccion del primer pulso de n-butano reduce considerablemente la disponibilidad de oxigeno en la superficie, lo cual afecta en mayor medida a las reacciones de oxidacion total por ser de mayor orden en oxigeno (Armas et al. 2003; Armas, 2004; Briceno, 2002). Ello se refleja en los resultados mostrados en la figura 6-b donde, a partir del segundo pulso, se observa un aumento considerable en la selectividad hacia olefinas totales, y una disminucion en los productos de oxidacion total. La comparacion del comportamiento de ambos catalizadores operando bajo condiciones aerobicas no fue posible por la inestabilidad operacional observada al usar el catalizador B17. En este caso se sospecha la formacion de algunos centros muy activos (puntos calientes) capaces de iniciar una reaccion homogenea en cadena, que invariablemente determino la perdida de control de la temperatura y la desactivacion casi total del catalizador.
Figura 6. Conversion de n-butano (a) y selectividades (b) de catalizadores masicos calcinados a 600ºC (B16) y a 700ºC. (B17).
La desactivacion bajo condiciones aerobicas del catalizador B17 demostro ademas ser irreversible, ya que al someterlo al proceso de reoxidacion no pudo recuperarse la actividad original, marcando asi una diferencia notable con el catalizador B16 calcinado a 600¡ÆC cuya actividad se recupera totalmente (Davila y Ojeda, 2006). Estudios previos resenan que la DHOX tambien puede lograrse por la via de un mecanismo por radicales libres, y que la probabilidad de que este ultimo se active aumenta considerablemente con el aumento del tamano de los cristales (Vidal-Michel et al. 2003).
Para que los resultados experimentales obtenidos, operando bajo condiciones aerobicas, sean comparables, un factor importante es que la conversion y la selectividad sean estables con el tiempo en uso. Debido a ello, se considero importante realizar experimentos que permitieran confirmar el logro de la estabilidad (Davila y Ojeda, 2006; Papa et al. 2007). Los resultados de caracterizacion por DRX obtenidos con los catalizadores no estabilizados y estabilizados se muestran en las figuras 7 para los calcinados a 600¡ÆC y en la figura 8 para el unico caso en que fue posible realizar la estabilizacion con el catalizador calcinado a 700ºC (B17). La diferencia mas notable que muestran los catalizadores antes y despues del proceso de estabilizacion, es la disminucion relativa de la intensidad de los picos correspondientes al orto-vanadato cuando se los compara con los de oxido de magnesio. Adicionalmente, las intensidades de los picos correspondientes a la fase orto-vanadato que se observan en las figuras 7-b y 8-b son menores a los correspondientes de las figuras 7-a y 8-a, respectivamente, indicando una posible disminucion en la cristalinidad de la fase activa o la formacion de cristales mas pequenos (Creaser et al. 1998). En cambio, el deterioro de la linea base que se observa con los catalizadores estabilizados, se debe en parte al tamano muy reducido de la muestra, menor de los 200 mg, que se cargaron al reactor debido a las perdidas inevitables de masa al separarla de las particulas de carburo de silicio. Sin embargo, la contribucion mas importante la hace la tecnica especial que hubo que emplear para realizar la DRX. Los resultados obtenidos con catalizadores masicos y soportados sometidos a diferentes tiempos de contacto y diferentes tiempos en operacion no difieren sensiblemente de los mostrados en las figuras 7-b y 8-b, razon por la que no se muestran.
Figura 7. Difractogramas del catalizador masico calcinado a 600ºC (B16): (a) antes de estabilizarlo y (b) despues de estabilizarlo.
Figura 8. Difractogramas del catalizador masico calcinado a 700ºC (B16): (a) antes de estabilizarlo y (b) despues de estabilizarlo.
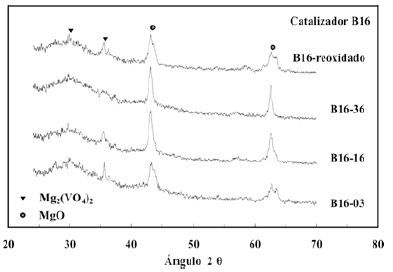
En la figura 9 se presentan las variaciones en los patrones de difraccion del catalizador masico calcinado a 600ºC con diferentes historias de uso bajo condiciones de operacion anaerobicas. A pesar del elevado nivel de ruido de la linea base, cuyo origen se explico con anterioridad, se nota la disminucion de las intensidades de los picos correspondientes a la fase de orto-vanadato con el aumento del numero de pulsos de n-butano inyectados. Despues del tercer pulso, las intensidades relativas de los picos de la fase ortovanadato son equivalentes a las intensidades de los picos de la fase de oxido de magnesio, aunque ya se nota una perdida de intensidad con respecto a los catalizadores sin utilizar (figura 1). Luego del pulso 16, la intensidad de los picos de la fase orto-vanadato es menor que la intensidad de los picos en el pulso 3, y para el pulso 36 las intensidades de los mismos casi se confunden con el ruido del patron de difraccion. Esto confirma la perdida del grado de cristalinidad de la fase activa (orto-vanadato) a medida que el catalizador se reduce. Se observa tambien que el grado de cristalinidad de la fase se recupera en gran medida con el proceso de re-oxidacion del catalizador. Nuestros resultados indican que el catalizador puede re-oxidarse con exito
Figura 9. Patrones de difraccion a diferentes niveles de reaccion de catalizadores masicos calcinados a 600ºC: reducido una vez retirado en el pulso 3 (B16-03), reducido una vez retirado en el pulso 16 (B16-16), reducido una vez retirado en el pulso 36 (B16-36), reducido una vez y retirado oxigenado (B16-reoxidado).
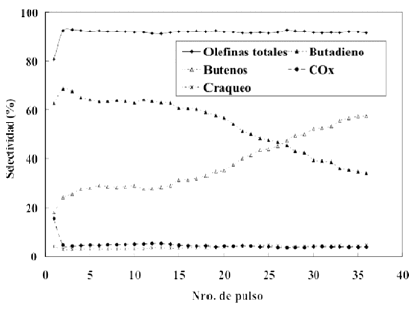
Comparando las variaciones en los patrones de DRX a medida que varia el historial de uso del catalizador (figura 9), con los resultados mostrados en figura 10 donde se grafica la variacion de las selectividades con el numero de pulsos, se observa un cierto paralelismo entre la perdida de intensidad de los picos de orto-vanadato y el aumento de la selectividad hacia butenos. Por lo tanto, se puede deducir que un aumento del grado de reduccion de la fase activa esta relacionado con el aumento de la selectividad hacia butenos. Este comportamiento puede explicarse teniendo en cuenta que la produccion de butadieno se debe mayoritariamente a la reaccion de oxidacion de los butenos (Armas et al. 2003; Armas, 2004; Briceno, 2002). Dado que operando bajo condiciones anaerobicas la concentracion de oxigeno superficial disminuye considerablemente con el aumento del numero de pulsos inyectados, la probabilidad de que las moleculas de los butenos sufran un segundo proceso de oxidacion a butadieno disminuye tambien. El paralelismo observado entre la selectividad y el estado de oxidacion del catalizador coincide con los resultados obtenidos por otros autores (Lopez et al. 1998).
Figura 10. Variacion de las selectividades del catalizador masico calcinado a 600¨¬C (B16) con el numero de pulsos inyectados.
La influencia de la historia de uso tambien se nota al comparar la superficie especifica de los catalizadores usados y retirados despues del pulso 36, con la correspondiente al catalizador fresco (tabla 3).
Tabla 3. Variaciones de la superficie especifica del catalizador B16 con el historial de uso.
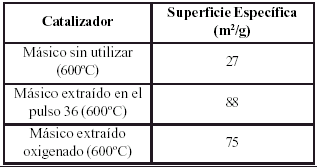
Se observa un aumento considerable del area especifica que, aun teniendo en cuenta que los errores experimentales son considerablemente mayores debido a la poca cantidad de muestra, todavia es significativa. Este aumento puede deberse en parte al incremento en la cantidad de carbono en la superficie (Lopez et al. 1998), e incluso al carbono que no fue completamente eliminado durante el proceso de reoxidacion. Por otro lado experimentalmente se observo que el catalizador usado sin reoxidar presenta un color gris oscuro y que el que fue reoxidado presenta un color algo mas palido que el catalizador sin uso, lo cual indica un cambio en la estructura de la fase activa. La disminucion de la superficie especifica de 88 m2/g antes de reoxidar a 75 m2/g despues de reoxidar refleja el efecto del cambio en el contenido de carbono, pero la diferencia con el valor original sigue siendo elevada. Los cambios de estructura superficial que las evidencias indican, mostraron no tener una influencia remarcable sobre la actividad y selectividad de los catalizadores (Hernandez y Vasquez, 2006), pero pudieran explicar el cambio de superficie especifica.
Las variaciones de las propiedades con el historial de uso, observadas para el catalizador B16, se repiten cualitativamente para los catalizadores B17, S16 y A16, lo que explica su comportamiento experimental (Hernandez y Vasquez, 2006; Davila y Ojeda, 2006), y es la razon por la cual no se analizan en este trabajo.
Por otro lado, en la tabla 2 se observa que la superficie especifica de los catalizadores sin uso es mayor para los soportados que para los masicos, fenomeno que esta relacionado con la superficie del tercer oxido sobre la que se deposita la fase activa. Las experiencias anaerobicas en las cuales el catalizador fue reducido, re-oxidado, vuelto a reducir y re-oxidado revelaron solo diferencias significativas, y positivas en lo que respecta a selectividad solo para las dos primeras inyecciones de n-butano, lo cual significa que el catalizador una vez reducido no recupera exactamente el estado original de oxidacion de los atomos superficiales. Este comportamiento es consistente con los resultados de la DRX y XPS, y concuerda con lo observado por Creaser et al. (1998).
Caracterizacion por Espectroscopia Fotoelectronica de rayos X (XPS)
En la mayoria de los casos que se estudiaron se obtuvo un solapamiento de senales asociadas a distintos estados de oxidacion de un mismo elemento. Para obtener la contribucion individual de cada uno de esos estados se realizo la deconvolucion de la senal compuesta, empleando el software del equipo y usando como referencia la senal del carbono C1s de energia de enlace 284,6 eV y corrigiendo por este valor cualquier desplazamiento obtenido en los picos de magnesio, vanadio y oxigeno. En la figura 11 se presentan los resultados de la deconvolucion correspondiente a las senales obtenidas con los catalizadores calcinados a 600 (B16) y a 700ºC (B17) sin uso.
Figura 11. Espectros de XPS en las regiones C 1s y V 2p. (a) Deconvolucion de la senal C1s para los catalizadores base calcinados a 600 (B16) y 700ºC (B17). (b) Deconvolucion de la senal V2p para los catalizadores base calcinados a 600 (B16) y 700ºC (B17).
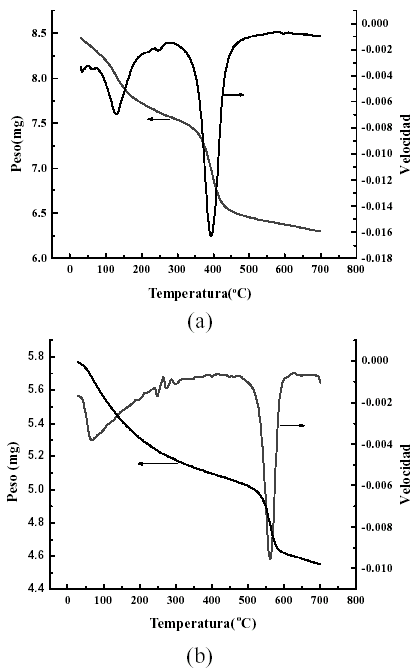
Como puede observarse las diferencias no son significativas. La deconvolucion del carbono para las dos temperaturas de calcinacion, revela tres picos que corresponden a especies con diferentes estados quimicos. Se observa un pico de mayor intensidad ubicado a una energia de enlace de 284,6 eV (carbono aleatorio de referencia) y dos de menor intensidad. El de 289,2 eV se asocia a la presencia de una especie del tipo del carbonato de magnesio, y el restante a algun tipo de carbono de menor energia de enlace. Este resultado de XPS se corrobora con lo obtenido por analisis termogravimetrico (ATG) en atmosfera inerte que se muestra en la figura 12-a, donde aparecen dos senales: una a baja temperatura (125ºC) que se asocia con agua adsorbida y otro a una temperatura mas elevada (395ºC), proxima pero menor a la de descomposicion del carbonato de magnesio puro, que corresponde al desprendimiento del CO2 atmosferico adsorbido quimicamente sobre la superficie del catalizador, presumiblemente sobre atomos de magnesio expuestos de la superficie. Estos compuestos superficiales normalmente presentan ligaduras distorsionadas, y por lo tanto se descomponen a temperaturas menores que la correspondiente a sal pura. En la literatura especializada estos compuestos reciben con alguna frecuencia el nombre de la sal con el calificativo de bidimensional, y seria carbonato de magnesio bidimensional en nuestro caso. En la figura 12-b se muestra el resultado de ATG en atmosfera de hidrogeno realizado a la misma muestra luego del analisis en atmosfera inerte. En ella aparece un pico a 560ºC, asociado a la perdida de peso por reduccion del vanadio presente en el catalizador (Armas, 2004).
Figura 12. ATG del catalizador B16 y su derivada con el aumento de la temperatura: (a) Calentamiento en atmosfera de nitrogeno (inerte). (b) Calentamiento en atmosfera de hidrogeno.
Volviendo a la figura 11-b se observan los resultados de la deconvolucion del pico de vanadio obtenido por XPS de los catalizadores B16 y B17 sin usar. Se observa una senal de mayor intensidad a 517,5 eV, y a menor energia de enlace que las demas presentes, que corresponde al V+5. Ademas, esta es la unica especie de vanadio detectable presente, lo cual confirma que el catalizador se encuentra en su estado de oxidacion maximo. El pico que aparece a 524 eV tambien pertenece a V+5 pero con un numero cuantico spin diferente. Ello no marca diferencia entre las especies desde el punto de vista de especies activas. La senal que se encuentra a 522 eV de energia de ligadura esta asociada a una senal satelite de oxigeno que normalmente aparece entre las dos senales de vanadio mencionadas. Debido a la ausencia de diferencias significativas en los resultados obtenidos para las dos temperaturas de calcinacion, se puede asegurar que esta no tiene influencia sobre los estados de oxidacion de las especies en los catalizadores sin uso.
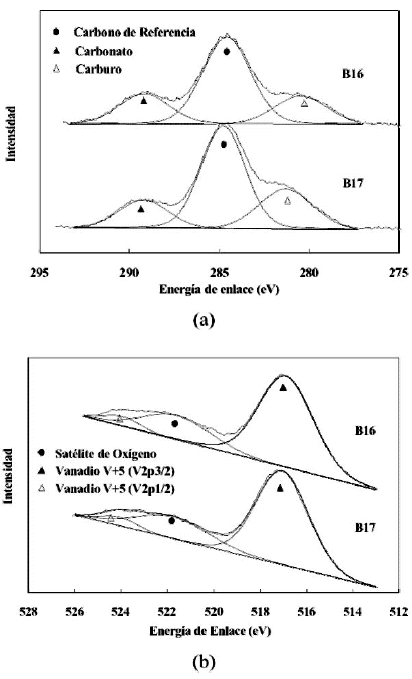
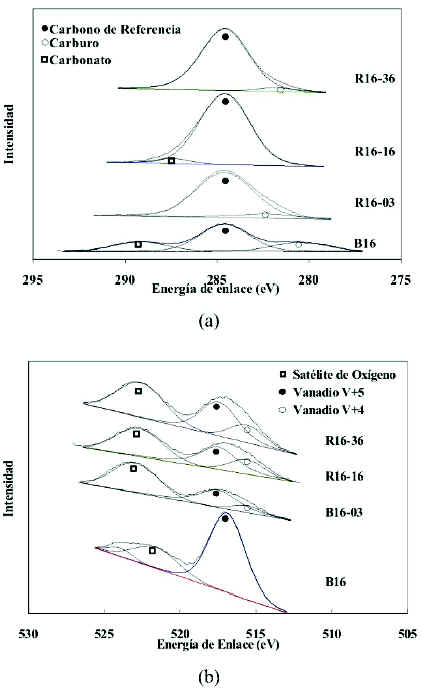
Los resultados XPS del catalizador masico calcinado a 600ºC y utilizado en experiencias anaerobicas se muestran en la figura 13, para cuatro niveles diferentes de reduccion, y asi como las diferencias cualitativas y cuantitativas significativas. Se observa la presencia de diferentes especies de carbono, donde el pico de mayor intensidad ubicado a 284,6 eV corresponde al carbono de referencia. Esta senal aumenta en intensidad a medida que avanza la reaccion y se debe a un incremento en la cantidad de carbono depositado en la superficie del catalizador. Por otra parte, para los catalizadores retirados en el pulso 3(R16-03) y en el pulso 36 (R16-36), se puede observar la aparicion de senales asociadas a carburo de silicio que aparecen a menor energia de enlace. La presencia de dicho carburo se debe a que en el reactor el catalizador se coloca entre dos lechos de carburo de silicio y, aunque son lechos separados del catalizador, siempre es posible que alguna particula termine mezclandose con el lecho catalitico. En cuanto al catalizador sin utilizar (B16) dicho pico se asocia en cambio a una especie de carbono de baja energia. Con el curso de la reaccion, incluso a la tercera inyeccion de n-butano, el pico asociado con la especie denominada como carbonato de magnesio bidimensional que aparece en la deconvolucion del catalizador masico sin utilizar, primero desaparece para luego volver a aparecer a una energia de ligadura diferente cuando ya se han procesado unos 16 pulsos de n-butano. Como se explico en la metodologia, el catalizador es sometido a un tratamiento previo antes de cargarlo al reactor, el cual consiste en someterlo a un tratamiento termico en ambiente de aire a 600¡ÆC. En el transcurso de este tratamiento la especie de carbonato distorsionado se descompone (figura 12-a) y por lo tanto no aparece en las deconvoluciones realizadas a las senales XPS correspondientes a los catalizadores usados y reoxidados. En algunas de las deconvoluciones correspondientes al catalizador usado se vuelve a observar el pico a menor energia; y en este caso pudiera deberse a algunas de las especies carbonadas presentes en la muestra o a un error de manipulacion. En la figura 13-b se pueden observar los cambios en el pico correspondiente al vanadio. Sobre el catalizador fresco solo se observa el vanadio en su estado de oxidacion mas elevado V+5 a una energia de ligadura de 517,5 eV.
Figura 13. Espectros de XPS en las regiones C 1sy V 2p de los catalizadores B16 (masico); R16-03 (extraido en el pulso 3); R16-16 (extraido en el pulso 16); y R16-36 (extraido en el pulso 36). (a) Deconvoluciones de la senal C1s. (b) Deconvoluciones de la senal V2p.
A medida que disminuye el estado de oxidacion, relacionado con el numero de pulsos de n-butano inyectados, el area de este pico disminuye y se advierte la aparicion de un pico cuya posicion corresponde a una energia de enlace de 515,6 eV, el cual esta asociado con la especie vanadio V+4. De un punto de vista cualitativo, al comparar las relaciones de areas (V+5/V+4) de los tres graficos, se observa que esta disminuye con la reduccion del estado de oxidacion, precisamente lo que ocurre en el lecho catalitico.
Por otro lado, es sabido que las especies presentes en la superficie del catalizador tienen una influencia significativa en la actividad y selectividad del mismo. Asi, en la figura 10 se observa que a partir del tercer pulso inyectado de nbutano, se comienza a estabilizar la selectividad del catalizador hacia olefinas totales, mientras que las correspondientes al butadieno disminuye y a los butenos aumenta, al principio suavemente, para luego acentuarse a partir de aproximadamente la inyeccion del pulso dieciseis con una clara tendencia a cruzarse para estados de reduccion mayores. Comparando los resultados mostrados en la figura 13-b con los que aparecen en la figura 10, se observa que la actividad catalitica esta relacionada con el tipo y cantidad de especie de vanadio presente en el catalizador lo cual coincide con lo observado por Blasco et al. (1995). Este comportamiento se ajusta tambien a lo que se observa en la figura 6 y con lo descrito por Craser et al. (1998) quienes, en su estudio cinetico en estado transiente, afirman que inicialmente, cuando el catalizador se encuentra altamente oxidado, la velocidad de reaccion es alta, y que disminuye a medida que el catalizador se reduce. Igualmente, a medida que disminuye la disponibilidad del oxigeno movil de la red la selectividad hacia butenos se ve favorecida a expensas de la selectividad hacia butadieno, ya que la selectividad total permanece practicamente invariable.
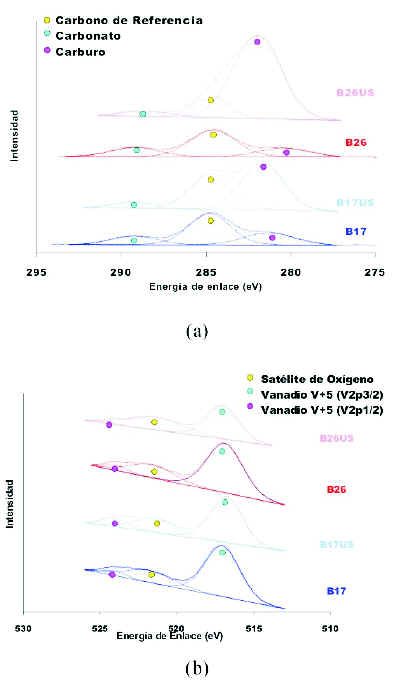
Los resultados de un estudio similar, pero realizado en condiciones aerobicas se muestran en la figura 14. Se puede distinguir un cambio significativo en las senales para el carbono C1s. Ademas del pico a energia de enlace 284,6 eV, que corresponde al carbono de referencia, en la figura 14-a se observa un pico a menor energia de enlace que el carbono de referencia, el cual crece una vez que el catalizador es utilizado, y se asocia a la formacion de especies carbonadas asociadas al magnesio, probablemente relacionadas con productos adsorbidos. Por su parte, la deconvolucion obtenida para el vanadio V2p sugiere que no experimenta cambios en su estado de oxidacion. El oxigeno molecular presente en el medio reaccionante vuelve a oxidar los centros cationicos parcialmente reducidos que intervienen en la reaccion; reaccion que segun Armas (2003) esta controlada por el equilibrio termodinamico, el cual a su vez esta casi totalmente desplazado hacia los estados de oxidacion mas elevados.
Figura 14. Espectros de XPS en las regiones C 1s y V 2p de catalizadores masicos nuevo (B26=B16 y B17) y utilizado (B26US y B17US) operados en condiciones aerobicas y a un tiempo de contacto de 6 min gcat/moltotal. (a) Deconvoluciones de la senal C1s. (b) Deconvoluciones de la senal V2p.
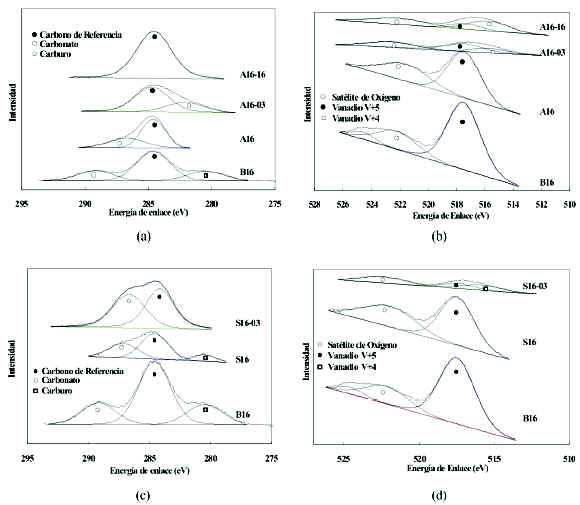
Si bien con los catalizadores masicos se obtienen selectividades, actividades y conversiones aceptables, no tienen posibilidades de uso por su baja resistencia mecanica, por lo que se desarrollaron los catalizadores soportados A16 y S16. Los resultados de XPS para los catalizadores masicos y soportados sin utilizar se muestran en la figura 15. Se nota que predominan las especies de vanadio con estado de oxidacion V+5 y no se notan diferencias sensibles que pudieran atribuirse al soporte utilizado. Los resultados del ATG se resumen en la tabla 2. Se observan pequenas variaciones de la temperatura en que aparecen los picos, las cuales se atribuyen a diferencias de estructura de la fase activa y a su interaccion con la superficie del tercer soporte.
Figura 15. Espectros de XPS en las regiones C 1s y V 2p de catalizadores masicos (B16), soportado en alumina (A16) y soportado en Silice (S16). Todos sin usar. (a) Deconvoluciones de la senal C1s. (b) Deconvoluciones de la senal V2p.
En la figura 15-b se puede notar que la relacion entre el pico satelite del oxigeno y el de vanadio aumenta con la presencia del soporte. Esto podria ser un indicativo de que al distribuirse la fase activa sobre una superficie lo hace en capas mas finas, lo que reduce la longitud del camino de migracion para el oxigeno movil, que se traduce en una mayor concentracion en la cercania de la superficie. La presencia de una mayor cantidad de oxigeno en la superficie hace que toda la familia de senales del oxigeno aumente. Las deconvoluciones de la senal de carbono que se presentan en la figura 15-a, muestran ademas de la senal de referencia, la presencia de compuestos carbonatados superficiales de energia intermedia entre la senal de referencia y la correspondiente al carbonato distorsionado, cuya formacion se ve favorecida por la presencia del soporte. Otra diferencia que se observo fue que el ATG del catalizador soportado sobre silice presenta una menor definicion que el soportado sobre a-Al2O3 y el masico, atribuible al caracter amorfo de dicho soporte y a su caracter acido que hace que la concentracion de oxido de magnesio libre se vea reducida.
Una vez que se comprobo, mediante la caracterizacion, que no se detectan cambios en los estados de oxidacion, los catalizadores fueron sometidos a reaccion, analizando al igual que para el catalizador base, la estructura a distintos niveles (3, 16, 26 y en algunos casos 36 pulsos). Algunos resultados se muestran en la parte superior de la figura 16. Puede notarse que al igual que para el catalizador base, el pico correspondiente a los carbonatos bidimensionales no aparece sobre el catalizador usado y reoxidado que ha sido soportado en alumina. En cambio, para el catalizador usado y reoxidado soportado en silice estas especies carbonatadas aparecen. Aparentemente la silice los estabiliza retardando su descomposicion total. Mas aun, a medida que la reaccion evoluciona la proporcion de carbonatos bidimensionales crece con respecto al carbono de referencia, dando la impresion de que este soporte, gracias a su alta porosidad, promueve la retencion del CO2 formado por la reaccion de DHOX y le brinda suficiente tiempo para que este reaccione con moleculas de oxido de magnesio, formando nuevamente el carbonato.
Figura 16. Espectros de XPS en las regiones C 1s y V 2p (a) Deconvoluciones de la senal C1s para el catalizador soportado en alumina. (b) Deconvolucion de la senal V2p para el catalizador soportado en alumina. (c) Deconvoluciones de C1s para el catalizador soportado en silice. (d) Deconvolucion de V2p para el catalizador soportado en silice. Catalizador B16 fresco; catalizador A16 fresco; catalizador A16-03 retirado a los tres pulsos; catalizador A16-16 retirado a los 16 pulsos; catalizador S16 fresco; catalizador A16-03 retirado luego del tercer pulso.
Nuevamente se observa que bajo las condiciones de reaccion anaerobicas utilizadas, el vanadio solo se reduce parcialmente hasta V+4. Esto se debe a que la cantidad de pulsos inyectados no es suficiente para consumir todo el oxigeno movil. Tambien se observo un crecimiento de la fase de vanadio con estado de oxidacion V+4 a medida que se inyecta un mayor numero de pulsos. Si se realiza un analisis comparativo de la relacion entre las senales de V+4 y V+5 correspondientes a los catalizadores A16 y S16; cuando se han procesado 16 pulsos de n-butano, se puede notar que sobre el alfa alumina (A16) la relacion entre las areas de los picos V+4/V+5 es mayor que sobre el silice por lo que se puede inferir que la alumina permite una mayor reducibilidad del vanadio.
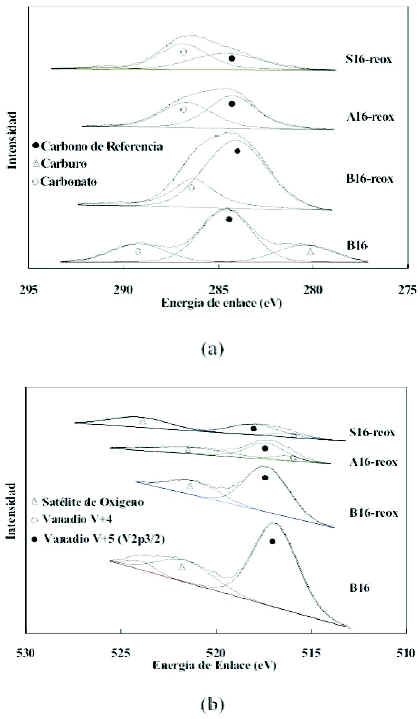
Otro factor importante es la capacidad de re-oxidacion de los catalizadores, ya que es necesario conocer el grado de reversibilidad de los cambios que ocurren durante el proceso de reaccion en el que intervienen. Al re-oxidar el catalizador base (figura 17), las especies de V+4 desaparecen, recuperandose el estado de oxidacion del vanadio a V+5 (Davila y Ojeda, 2006; Hernandez y Vasquez, 2006). Por otra parte observando los resultados de las deconvoluciones para los catalizadores soportados se puede apreciar que la presencia del soporte ejerce un efecto sobre la capacidad de re-oxidacion ya que no permite que esta sea completa, tal como lo encontraron Creaser et al. 1998. Sin embargo, la cantidad que queda de V+4 sin re-oxidar es muy pequena y no parecieran tener efectos acumulativos por lo que potencialmente los catalizadores pueden utilizarse por un numero mas elevado de ciclos de reduccion-oxidacion.
Figura 17. Espectros de XPS en las regiones C 1s y V 2p. (a) Deconvoluciones de la senal C1s para el catalizador base (B16), base reoxidado (B16-reox), soportado en alumina reoxidado (A16-reox) y soportado en silice re-oxidado (S16-reox). (b) Deconvoluciones de la senal V2p para los mismos catalizadores.
Los resultados de actividad y selectividad, como lo demostraron Davila y Ojeda (2006); y Hernandez y Vasquez (2006), no varian significativamente con la presencia del soporte, lo cual concuerda con los resultados que se muestran en este trabajo.
CONCLUSIONES
Con las modificaciones introducidas al metodo de preparacion de los catalizadores se ha logrado su reproducibilidad. Ademas se encontro que la principal fase involucrada en el proceso catalitico estudiado es el ortovanadato de magnesio y que la especie predominante en la superficie del catalizador fresco, sea masico o soportado, es el V+5. Se comprobo que la temperatura de calcinacion tiene influencia sobre la cristalinidad de las fases presentes, pero no en los estados de oxidacion de las especies observadas en la superficie. Tambien se observo que el tamano de cristal tiene influencia en la deshidrogenacion oxidativa (a mayor tamano la selectividad hacia los butenos aumenta), y que la presencia de cantidades crecientes de la especie V+4 tiene influencia negativa creciente sobre la selectividad hacia butadieno. El catalizador masico calcinado a 600ºC presenta una mayor estabilidad, actividad y una mejor combinacion orto-vanadato-oxido de magnesio que los catalizadores calcinados a 700ºC. Se encontro que la superficie especifica de los catalizadores cambia a medida que cambia el tamano del cristal y los niveles de reaccion, y tambien con el tipo del tercer oxido. Igualmente se encontro que al re-oxidarlos, los catalizadores recuperan totalmente la actividad. Ademas, se observo que en presencia de oxigeno molecular solo se detecta la presencia de las especies de V+5 y que bajo condiciones anaerobicas no se observa la generacion de especies V+3 o inferiores dentro del rango explorado de extension de la reaccion. La presencia de soporte no mostro tener influencia sobre las especie de vanadio existentes, pero se comprobo que promueve la formacion de carbonatos, que aumenta la dispersion de las especies y que reduce la selectividad hacia los productos deseados. Las fases activas de los solidos disminuyen su grado de cristalinidad luego de la DHOX, pero siempre estan presentes al culminar las pruebas cataliticas realizadas. Durante la DHOX la presencia de alfa alumina confiere al catalizador una mayor reducibilidad de las especies de vanadio, e inhibe la formacion de carbonatos.
AGRADECIMIENTOS
Los autores agradecen el apoyo de la Universidad Central de Venezuela (UCV), del Fondo Nacional de Ciencia, Tecnologia e Innovacion (FONACIT) y del Instituto Venezolano de Investigaciones Cientificas (IVIC) y los oportunos consejos del Profesor Jose Manuel Lopez Nieto del ITQ de la Universidad Politecnica de Valencia, Espana.
REFERENCIAS
1. ARMAS, N., LOPEZ NIETO, J.M., PAPA J., SOLSONA, B. Y BRICENO A. (2003). <<Cinetica y Mecanismo de la Deshidrogenacion Oxidativa de n-Butano sobre un Catalizador VMgO soportado en SiO2>>, Revista Tecnica de la Facultad de Ingenieria, LUZ, Vol 26(2), 117. [ Links ]
2. ARMAS M. (2004). Deshidrogenacion Oxidativa de Alcanos Ligeros, Tesis de Doctorado, Universidad Politecnica de Cataluna. [ Links ]
3. BLANCO, C. Y REINOSO, N. (2000). Deshidrogenacion Oxidativa de n-Butano sobre catalizadores V-Mg/SiO2. Trabajo Especial de Grado. UCV. [ Links ]
4. BLASCO, T., GALLI, A., LOPEZ NIETO, J.M. AND TRIFIRO, F. (1997). Oxidative Dehydrogention of Ethane and n-Butane on VOx/Al2O3 Catalyst, J. Catal., 169, 203. [ Links ]
5. BRICENO B., A. (2001). Mecanismo y cinetica de la deshidrogenacion oxidativa de n-butano sobre un catalizador V-Mg/SiO2, Trabajo Especial de Grado. UCV. [ Links ]
6. CAVANI, F. AND TRIFIRO, F. (1995). The Oxidative Dehydrogenation of Ethane and Propane as an Alternative Way for the Production of Light Olefins, Catal. Today, 24, 307. [ Links ]
7. CREASER, D., ANDERSSON, B., HUDGINS, R.R., SILVERSTON, P.L. (1998). Transient Kinetic Analysis of the Oxidative Dehydrogenation of Propane, J. Catal., 182, 264. [ Links ]
8. DAVILA, K. Y OJEDA, D. (2006). Deshidrogenacion Oxidativa de n-Butano sobre Catalizadores Masicos y Soportados de Oxidos de Vanadio y Magnesio. Preparacion, Comprobacion y Comparacion de su Comportamiento, Trabajo Especial de Grado. UCV. [ Links ]
9. DE RISI, L. Y ROSILLO, C. (2003). Deshidrogenacion Oxidativa de n-Butano y n-Pentano sobre Catalizadores VMgO Soportados y Promovidos, Trabajo Especial de Grado. UCV. [ Links ]
10. HERNANDEZ, Y. C. Y VASQUEZ, M. C. C. (2006). Deshidrogenacion oxidativa del n-butano y su relacion con el estado de oxidacion del catalizador¡í. Trabajo Especial de Grado. UCV. [ Links ]
11. KUNG, H. H. (1994). <<Oxidative Dehydrogenation of Light (C2 to C4) Alkanes>>, Adv. Catal. 40, 1. [ Links ]
12. LOPEZ NIETO, J. M., DEJOZ, A., VASQUEZ, M. I., OLEARY, W. CUNNINGHAM, J. (1998). Oxidative Dehydrogenation of n-Butane on MgO Supported Vanadium Oxide Catalysts, Catal. Today, 40, 215. [ Links ]
13. MAMEDOV, E. A. AND CORTES-CORBERAN, V. (1995). Oxidative Dehydrogenation of Lower Alkanes on Vanadium Oxidebased Catalysts. The Present State of the Art and Outlooks, Appl. Catal. A: General, 127, 1.` [ Links ]
14. PAPA J., BRITO J.M., MARZUKA S., DAVILA K. D., OJEDA D. A. Y GUARAN N. (2007). Preparacion y evaluacion de catalizadores masicos y soportados a base de oxidos de vanadio y magnesio. DHOX de n-butano, Revista de Ingenieria, Vol. 22(1),p. 79. [ Links ]
15. VEDRINE, J.C., COUDURIER, G. AND MILLET, J-M. M. (1997). Molecular Design of Active Sites in Partial Oxidation Reactions on Metallic Oxides, Catal. Today 33, 3. [ Links ]
16. VIDAL-MICHEL, R. AND HOHN, K. L. (2004). Effect of crystal size on the oxidative dehydrogenation of butane on V/ MgO catalysts¡í. J. Catal., 221,127. [ Links ]