Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Facultad de Ingeniería Universidad Central de Venezuela
versión impresa ISSN 0798-4065
Rev. Fac. Ing. UCV v.23 n.4 Caracas dic. 2008
Síntesis y caracterización de óxidos de hierro nanoparticulados soportados en pvp y sílice
Yurgenis Henríquez1, Lourdes Rivas1, Olgioly Domínguez-Quintero2, Susana Martínez1, Lindora Dornelas1, Heinz Krentzien1, Fernando González-Jiménez3, Lissetta Donofrio3, Caribay Urnina4, Marie-JO Casanove5
1 Universidad Central de Venezuela, Facultad de Ciencias, Escuela de Química, Caracas-Venezuela.
2 Universidad Central de Venezuela, Facultad de Ingeniería. Caracas-Venezuela. dominguchi@gmail.com
3 Universidad Central de Venezuela, Facultad de Ciencias, Escuela de Física, Laboratorio de Magnetismo Caracas-Venezuela.
4 Universidad Central de Venezuela, Facultad de Ciencias, Escuela de Biología, Centro de Microscopia Caracas-Venezuela.
5 CEMES-CNRS, 31055 Toulouse-Cedex, Francia
RESUMEN
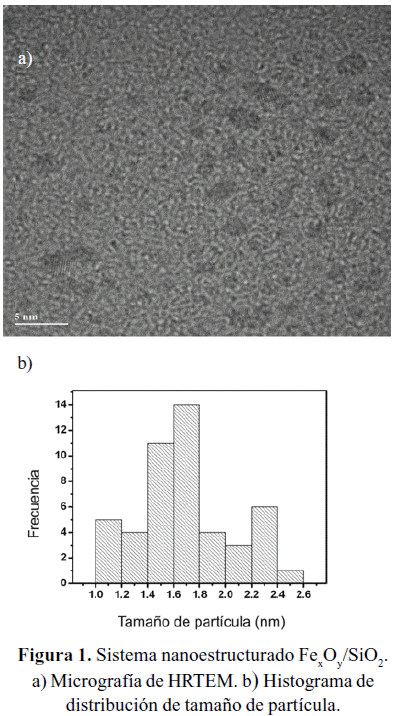
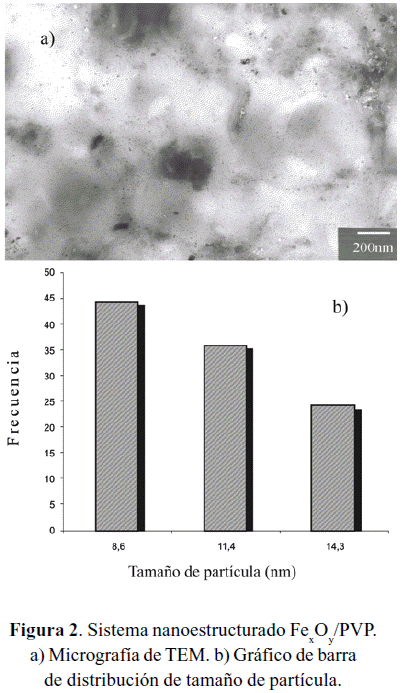
En este trabajo se reporta la síntesis de nanopartículas de óxido de hierro (Ferrihidrita) estabilizadas en sílice y polivinilpirrolidona (PVP), [FexOy/SiO2] y [FexOy/PVP], obtenidos a partir de la hidrólisis de FeCl3.6H2O con NH4OH. Ambos sistemas fueron caracterizados mediante ICP-OES, HRTEM, MET, espectroscopia de Mössbauer y XPS. El tamaño promedio de las nanopartículas fue de 1,7 nm para el [FexOy/SiO2] y entre 2 y 3nm para [FexOy/PVP], mostrando además una distribución estrecha de tamaños.
Palabras clave: Óxidos de hierro nanoestructurado, Nanopartículas, Óxidos de hierro, PVP.
Synthesis and characterization of iron oxide nanoparticles supported on pvp and silica
ABSTRACT
In this work we report the syntheses of iron oxide nanoparticles (ferrihydrite) stabilized on silica and polyvinylpyrrolidone (PVP), [FexOy/SiO2] and [FexOy/PVP], from the hydrolysis of FeCl3.6H2O with NH4OH. Both systems were characterized by ICP-OES, HRTEM, MET, Mössbauer and XPS. The mean particle size for the [FexOy/SiO2] system was 1,7nm whereas for the [FexOy/PVP] it was between 2 and 3nm showing narrow size distribution.
Keywords: Nanostructured iron oxides, Iron oxides nanoparticles, Iron oxides, PVP.
Recibido: octubre de 2007 Recibido en forma final revisado: julio de 2008
INTRODUCCIÓN
Debido principalmente a las aplicaciones nanotecnológicas, en lo referente al almacenamiento de datos y a su posible capacidad catalítica a nivel nanoestructurado, entre otras aplicaciones, el hierro ha recibido mucha atención en los últimos 15 años en el área de nanomateriales. Esto se traduce en una gran variedad de métodos de síntesis de nanopartículas de este metal, entre las cuales cabe mencionar los siguientes: a) Reducción de FeCl3 con N(octyl)4[BEt3H], bajo condiciones suaves de reacción, obteniendo partículas de 3 nm(Bönnemann et al. 1994; Bönnemann et al. 1996); b) Sonoquímicamente a partir de Fe(CO)5 (5-6 nm) y a partir de Fe(acac)2 (10nm) (Dantsin et al. 2000; Kesavan et al. 2002); c) Termo descomposición del Fe(CO)5 y Ni(COD)2 en presencia de hexadecilamina como estabilizante y a temperatura de ebullición del anisol, reportando nanopartículas bimetálicas de NiFe entre 2,7 y 3,3nm (Dumestre et al. 2004). d) La obtención de redes de nanocubos de Fe(0) mediante la reducción del complejo Fe[N(SiMe3)2]2 con H2 (Dumestre et al. 2004). e) Mediante la hidrólisis de Fe(acac)3 en dodecilsulfato de sodio (20nm) (Ocaña et al. 2006). También se han obtenido coloides de óxido de hierro a partir de: a) Coloides de Fe(0) estabilizados con N(octyl)4Br, los cuales son oxidados lentamente mediante exposición al aire de las soluciones en THF, aquí se reportan partículas de 3 nm (Bönnemann et al. 1994; Bönnemann et al. 1996). Más recientemente se han reportado la síntesis de nanomateriales de Fe(0) soportado sobre PV3A obteniéndose nanopartículas dispersas en el soporte entre 7,9 y 15 nm (Sun et al. 2007). b) Por hidrólisis de una mezcla acuosa de FeCl2 y FeCl3, en NaOH concentrado, estabilizados con PVA con tamaños entre 2,7-10nm (Tronc et al. 1995) y por hidrólisis de FeCl2 en una mezcla de CH3OH, H2O y NaOH, estabilizadas por ácido algénico, con tamaños entre 4 y 15 nm (Kroll et al. 1996). d) Por reducción de FeCl3 con polvo de magnesio obteniéndose nanopartículas de γ- Fe2O de 9 a 54 nm (Saurav et al. 2001).
Estos nanomateriales tienen aplicaciones potenciales en catálisis, en registros y almacenamiento de datos en memorias magnéticas y más recientemente se ha determinado su potencial en aplicaciones médicas tales como en sistemas de descarga de drogas, (DDS); sensores magnéticos en imagenología de resonancia magnética y en terapia contra el cáncer (Neuberger et al. 2005; Portet et al. 2001; Ito et al. 2005; Iida et al. 2007).
Por lo antes mencionado, en el trabajo aquí descrito se planteó la generación de un método de síntesis, sencillo y económico, que asegurara la producción de nanopartículas de óxidos de hierro, así como estudiar el efecto que el soporte pueda tener sobre las propiedades del nanomaterial de hierro sintetizado.
TÉCNICAS EXPERIMENTALES
Generales
El polímero polivinilpirrolidona (PVP), utilizado como agente estabilizante, tiene un peso molecular promedio de 55.000 y fue producido por Aldrich. Previo a su uso, la PVP fue pretratada a 70°C bajo vacío, durante dos horas. La sílice (Gomasil G-200) contiene 98,8 % de SiO2, 0,69 % de Na2SO4 y presenta un tamaño de grano promedio de 0,5μm. La sílice, donada por Rhodia Sílices de Venezuela C.A, fue activada a 300 °C bajo vacío durante 72 horas previo a su uso. Después de la activación, la SiO2 presentó un área específica BET de 169 m2/g.
Síntesis de las nanopartículas de óxido de hierro estabilizadas en sílice y PVP Como ejemplo se describe la síntesis de las nanopartículas de óxido de hierro estabilizadas en sílice. Se disuelven 5g (18,5mmoles) de FeCl3.6H2O en 50mL de agua y se vierte sobre una suspensión de sílice en 400mL de agua, tal que el porcentaje de metal sea un 10% p/p en relación con la sílice. Esta suspensión se deja bajo agitación durante 24 horas, luego se gotea un exceso de solución de NH4OH diluido y se agita durante 24 horas más. Cuando el soporte es sílice se precipita y se decanta el sobrenadante y el sólido obtenido es lavado con agua fría a fin de eliminar todo el exceso de NH4OH y hierro no adsorbido; finalmente se seca al vacío con calentamiento suave.
Para el sistema soportado sobre PVP, ésta no decanta, por lo cual se seca bajo vacío a 60°C; una vez obtenido el sólido seco, éste se lava varias veces con agua fría a fin de eliminar el exceso de hierro no adsorbido. En este procedimiento, debido a la alta solubilidad del PVP en agua, parte de ésta se pierde en los lavados, lo que trae como consecuencia que se obtenga un altísimo porcentaje de hierro en el sistema soportado en PVP.
A partir de estas síntesis se obtiene un sólido color pardo opaco [FexOy/SiO2], cuyo análisis elemental arrojó un porcentaje de hierro de 6.5±0.2 % p:p. y un sólido negrusco brillante, [FexOy/PVP] con 26,0± 0,2 % p:p de metal.
Caracterización de los sistemas nanoestructurados
Los análisis elementales (% p/p de metal), se determinaron por espectroscopía de emisión atómica inductivamente acoplada a plasma (ICP-OES), en un equipo de la casa Thermo Jarrel ASH, modelo IRTFIS H12.
Los análisis por microscopía electrónica de transmisión (MET), se realizaron en un microscopio JEOL JEM 1220 operando a un voltaje de aceleración de 120kV. Los análisis de microscopía electrónica de alta resolución (HRTEM), se realizaron en un microscopio Philips CM30 de resolución 0.19nm, en el Centro de Elaboración de Materiales y de Estudios Estructurales de la Universidad Paul Sabatier en Toulouse, Francia.
Para estos análisis se colocó una gota de la suspensión del sólido en tetrahidrofurano, sobre una rejilla de cobre de 150 ó 200 mesh, cubierta con colodión/grafito o sólo grafito.
Los análisis de espectroscopía fotoelectrónica de rayos X (XPS) fueron hechos en un equipo marca Escalab 220i-XL, con fuente de MgKα (1253,6eV), empleando una potencia de 400 vatios. Las señales fueron deconvolucionadas con el programa XPS Peak Fitting versión 4.1. Todos los espectros fueron calibrados con la señal de energía de enlace de los electrones 1s del carbón (284,6eV).
Los espectros de 57Fe Mössbauer fueron registrados en un espectrómetro Wissel-Electronik de aceleración constante con una señal de velocidad simétrica triangular y una unidad de movimiento marca Wissel. La unidad de variación de temperatura consta de un circuito cerrado de helio marca Cryo Industries of America, Inc. La fuente radioactiva de 57Co está incluida en una matriz de rodio. El desplazamiento isomérico se reporta con referencia a á-Fe. Para la adquisición del espectro, el sólido molido (200-300mg) se colocó en un porta muestras de aluminio y se mezcló con resina epóxica.
Las medidas de susceptibilidad magnética fueron realizadas en un equipo comercial SQUID en un campo de 100 Gauss en «zerofield cooling» ZFC y «field cooling» FC desde 4,2K hasta temperatura ambiente.
Los sistemas nanoestructurados de óxido de hierro estabilizados sobre sílice y polivinilpirrolidona (PVP), [FexOy/SiO2] y [FexOy/PVP], fueron obtenidos a partir de la hidrólisis de FeCl3.6H2O con NH4OH, de acuerdo con la ecuación (1).
FeCl3.6H2O+NH4OHdil. Estabilizante [FexOy/Estb] (1)
(Estabilizante= SiO2, PVP)
Estos materiales fueron caracterizados mediante ICP-OES, HRTEM, MET, Mössbauer y XPS. En el caso del óxido estabilizado con sílice, también fue posible medir la susceptibilidad magnética en un magnetómetro SQUID.
El análisis elemental para el material [FexOy/SiO2] dio como resultado 6,5±0,2 % de Fe (p/p: Fe/sílice). Para el material [FexOy/PVP] se obtuvo un 26,0 % de Fe (p/p: Fe/PVP). El porcentaje en peso obtenido para cada uno de los sistemas se debe esencialmente a las diferencias en las propiedades de solubilidad de cada soporte (ver parte experimental).
Mediante el análisis de microscopia electrónica de alta resolución (HRTEM) para el sistema [FexOy/SiO2] (figura 1-a), se pudo apreciar nanopartículas muy bien dispersas en la sílice, de tamaño promedio 1,7 nm y con una distribución relativamente estrecha de tamaño (1,0-2,5nm) (figura 1-b).
Mediante el análisis TEM se pudo determinar que el material [FexOy/PVP] está compuesto por nanopartículas (figura 2-a) que se encuentran bien dispersas en el polímero, con un tamaño promedio de 11nm, aun cuando existen áreas donde se observa una mayor aglomeración. Cabe destacar que este resultado fue determinado mediante microscopía electrónica de baja resolución. Ambos materiales presentan una gran estabilidad al aire.
En la figura 3, se muestra el análisis de XPS para el sistema [FexOy/SiO2]. En la región Fe 2p, se observan dos señales, a energías de enlace de 712eV(2p3/2) y 725.7eV(2p1/2) (figura 3-a). La energía de enlace a 712eV, se puede asignar a especies de Fe+3, tales como Fe2O3, óxido mixto Fe3O4 (Fe(II)-Fe(III) o a la especie FeO (Wagner et al. 1997; Brion 1980). En la región O1s (figura. 3-b), se observan dos señales; a 532,8eV, asignable al oxígeno del SiO2 y a 530,3eV, asignable al oxígeno de óxidos de Fe+3 (Fe2O3, Fe3O4, FeOOH) (Wagner et al. 1997; Clayton et al. 1986). En la figura 3-c se muestran los espectros XPS correspondientes al estado de energía 2p del Si en el sistema [FexOy/SiO2].
El valor de energía de enlace a 103.4 (figura. 3-c) se atribuye al óxido de silicio, SiO2. Los valores de energías de enlace son reportados en referencia al valor de la señal Si2p3/2 (102,6 eV) de la sílice (Wagner et al. 1997; Brion 1980).
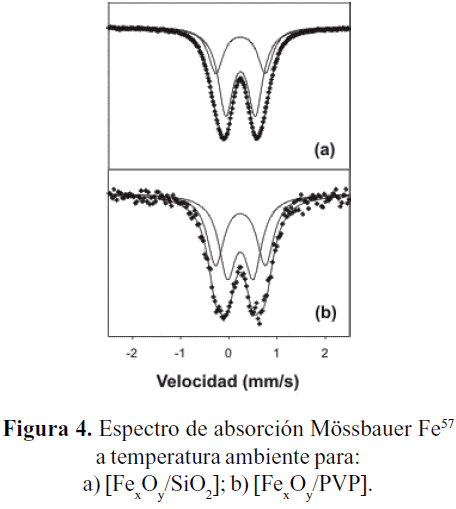
En la figura 4 se agrupan los espectros Mössbauer a temperatura ambiente para los dos sólidos [FexOy/SiO2] y [FexOy/PVP] y en la tabla 1 se muestran los parámetros Mössbauer obtenidos del ajuste de los espectros. Las muestras presentan distribuciones anchas descritas por dos dobletes con valores de QS ~ 1mm/s y 0,5-0,6mm/s, con relaciones de intensidad 68/32 y 52/48 las cuales podrían corresponder a la ferrihidrita (Fh) en fases donde una se encuentra mejor cristalizada que la otra, respectivamente (Tronc et al. 1995; Briggs et al. 1993; Rao et al. 2000; Vandenberghe et al. 1990). Estos resultados son corroborados con aquellos encontrados a baja temperatura, donde se observa un régimen de relajación magnética lenta; los dobletes observados a temperatura ambiente corresponden, en efecto, a pequeñas partículas magnéticas en un régimen superparamagnético (relajación magnética rápida).
Los resultados que se describen a continuación siguen el mismo orden de aquellos de la tabla 1.
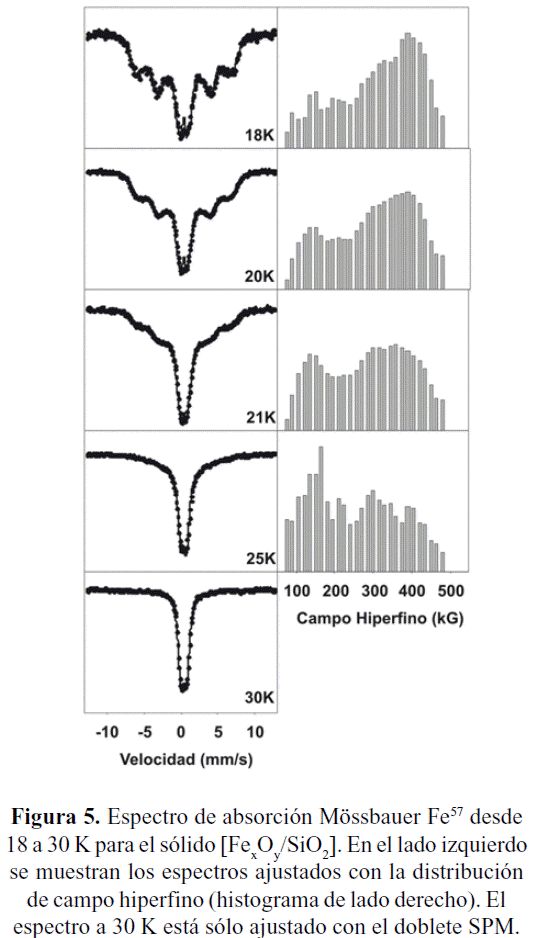
En el lado izquierdo de la figura 5 son reportados los espectros Mössbauer entre 30 K y 18 K para la muestra [FexOy/SiO2], ajustados con un doblete superparamagnético (SPM) y una distribución de campos hiperfinos (HPFD); mientras que los histogramas de las contribuciones magnéticas se presentan del lado derecho de la figura (los límites del campo magnético son 80 a 490kG). La rapidez de la evolución térmica entre 18K y 30K, indica que: primero, por ser ferrihidrita (Fh, donde K= 105 J/m3) se corrobora que las nanopartículas son muy pequeñas (menores a 2 nm) ya que las contribuciones magnéticas colapsan prácticamente a 30K y segundo, una distribución relativamente amplia en tamaños, lo cual conduce a una distribución apreciable en el histograma de los campos magnéticos (claramente visible en el espectro a 18K) (Rao et al. 2000; Vandenberghe et al. 1990; DOnofrio et al. (a ser publicado)).
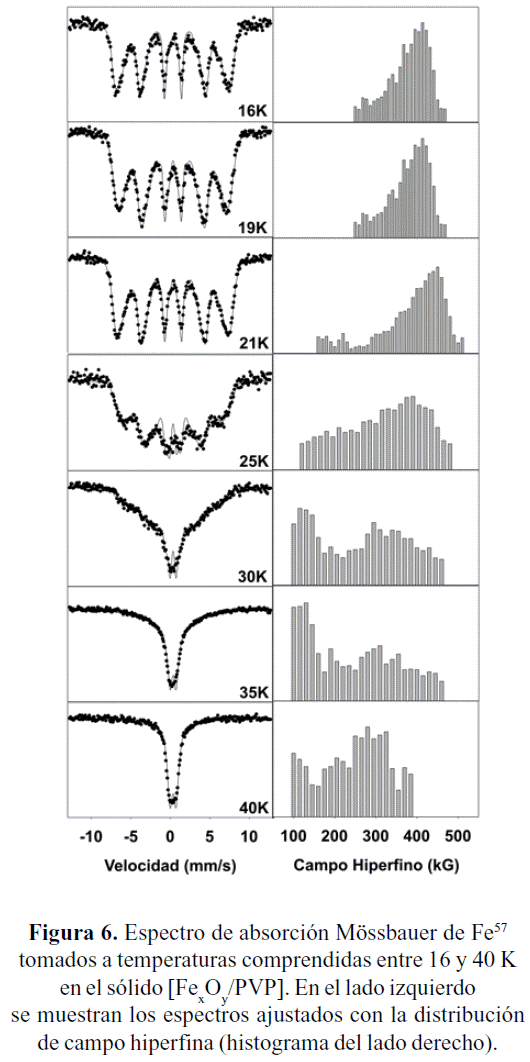
Al igual que en la figura 5, en la figura 6 son presentados los espectros Mössbauer y los histogramas HPFD para la muestra [FexOy/PVP]. Considerando las nanopartículas de Fh, se observa claramente que son más grandes que las estabilizadas en sílice, como lo demuestra la evolución térmica del espectro Mössbauer, muy bien resuelto, sin doblete superparamagnético, y un estrecho HPFD a 16K; en este caso se observa el colapso a un doblete SPM por encima de los 40K. El tamaño promedio puede ser estimado entre 2 y 3 nm (DOnofrio et al. (a ser publicado)).
En la figura 7 se gráfica el campo hiperfino promedio en función de la temperatura, calculados para diferentes valores del diámetro promedio de partícula. En el mismo gráfico se incluyen los valores experimentales correspondientes a [FexOy/SiO2] y a [FexOy/PVP]. Se observa una dependencia lineal con la temperatura (pendiente negativa) que corresponde a la evolución térmica esperada del campo hiperfino debido a las fluctuaciones cuánticas del motivo antiferromagnético. Se debe destacar que si este comportamiento es extrapolado hacia bajas temperaturas el campo promedio se encontrará en 490kG, lo cual está dentro de los valores esperados para la ferrihidrita.
En la figura 8 se presentan las curvas ZFC y FC obtenidas para las medidas de susceptibilidad magnética. La curva ZFC indica un máximo relativo a temperatura Tp ~ 12K y la temperatura de irreversibilidad Tirr~20K. El uso de la relación entre Tp y KV0 conduce a un tamaño promedio de partícula de 2,2nm. La estrecha vecindad entre las curvas ZFC y FC a una Tirr más bien baja indica una buena dispersión y, en consecuencia, una muy pequeña interacción entre las nanopartículas. El incremento en la susceptibilidad ZFC por debajo de 5K indica la presencia de una impureza en muy baja proporción.
CONCLUSIONES
La hidrólisis de FeCl3.6H2O en medio básico de NH4OH, conduce a la formación de nanopartículas de óxido de hierro (ferrihidrita) estabilizados en sílice y polivinilpirrolidona. Cabe destacar que la forma de ferrihidrita depende del método de síntesis utilizado. Los sistemas obtenidos, [FexOy/SiO2] y [FexOy/PVP], fueron caracterizados mediante las técnicas ICP-OES, HRTEM, MET, Mössbauer y XPS. El tamaño promedio de las nanopartículas fue de 1,7 nm para el sólido [FexOy/SiO2] y entre 2 y 3nm para [FexOy/PVP], mostrando además una distribución relativamente estrecha de tamaños sobre ambos soportes. El tamaño de partícula más pequeño fue encontrado para el material soportado sobre sílice lo cual lo hace un material potencial para aplicaciones en catálisis.
AGRADECIMIENTOS
Desean agradecer al CDCH-UCV (bajo el proyecto PI 03-12- 5062-2005); a FONACIT (bajo el proyecto CONICITCONIPET Nº 97003711), así como al BID-FONACIT (proyecto QF10) por el financiamiento; y al Laboratorio Nacional de Análisis Químico por los análisis de XPS.
REFERENCIAS
1. BONNEMANN, H., BRIJOUX, W., BRINKEMANN, R., FRETZEN, R., JOUSSEN, T., KOPPLER, B., KORALL NEITELER, P., RITCHER, J. (1994). Preparation, characterization and application of fine metal particles and metal colloids using hydrotriorganoborates. J Mol Cat, 86: 129. [ Links ]
2. BONNENMANN, H., BRAUN, G., BRIJOUX, W., BRINKENMANN, R., SCHULTZE, A., SEEVOGEL, K., SIEPEN, K. (1996). J of Organometall Chem, 520:143. [ Links ]
3. BRIGGS, D. & SEAK, M.P. (1993). Practical Surface Analysis. John Willey & Sons, Vol.1, second edition. [ Links ]
4. BRION, D. Etude par spectroscopie de Photoelectrones de la degradacition superficialle de FeS, CuFeS, ZnS et PBS aLAir et dans LEau.(1980). App. of Surface Science; 5: p 133. [ Links ]
5. CLAYTON, C.R. & LU, Y.C. (1986). A bipolar Model of the passivity of stainless steel: The role of Mo addition. J Electrochem Soc, 133(12): 2465-2473. [ Links ]
6. DONOFRIO, L., GONZALEZ-JIMENEZ, F., BONVILLE, P., GONZALEZ, G., SNOECK, E., LECANTE, P., URBANI, F. To be published. [ Links ]
7. DANTSIN, G., & SUSLICK, K. J. (2000). Sonochemical preparation of a nanostructured bifunctional catalyst. J Am Soc, 122: 5214-5215. [ Links ]
8. DUMESTRE, F., CHAUDRET, B., AMIENS, C., RENAUD, P., FEJES, P. (2004). Superlattices of iron nanocubes synthezised from Fe(N(SiMe3)2)2. Science, 303: 821. [ Links ]
9. DUMESTRE, F., MARTINEZ, S., ZITOUN, D., FROMEN, M-C., CASANOVE, M-J., LECANTE, P., RESPAUD, M., SERRES, A., BENFIELD, R. E., AMIENS, C., CHAUDRET, B. (2004). Magnetic nanoparticles through organometallic synthesis: evolution of the magnetic properties from isolated nanoparticles to organised nanostructures. Faraday Discuss, 125: 265–278. [ Links ]
10. KROLL, E., WINNIK, F. M., ZIOLO, R.F. (1996). In situ preparation of nanocristalline ã –Fe2O3 in iron (II) crossliked alginate gels tube. Chem Mater, 8: 1594. [ Links ]
11. IIDA, H., TAKAYANAGI, K., NAKANISHI, T., OSAKA, T. (2007). Synthesis of Fe3O4 nanoparticles with various sizes and magnetic properties by controlled hydrolysis. Journal of Colloid and Interface Science doi: 10.1016/j. jcis.2007.05.047. [ Links ]
12. ITO, A., SHINKAI, M., HONDA, H., KABAYASHI, T. (2005). Medical application of functionalized magnetic nanoparticles. J Biosci Bioeng, 100(1): 1-11. [ Links ]
13. KESAVAN, V., DHAR, D., KOLTYPIN, Y., PERKAS, N., PALCHIK, O., GEDANKEN, A., CHANDRASENKARAN, S. (2002). Studies of catalytic aerobic oxidation with nanostructured amorphous metals, alloys and metal oxides. J of Indian Inst Sci, 82:113-120. [ Links ]
14. OCAÑA, M., ANDRÉS-VERGÉS, M., SERNA, C. (2006). Spherical iron/silica nanocomposites from core-shell particles. J Coll and Inter Sci, 294: 355-36. [ Links ]
15. PORTET, D., DENIZOT, B., RUMP, E., LEJEUNE, J. J., JALLET, P. (2001). Nonpolymeric coating of iron oxides colloids for biological use as Magnetic Resonance Imaging Contrast agents. J. Colloid Interface Sci, 238: 37. [ Links ]
16. RAO, R., GIRIDHAR, C.N., KULKARNI, U., THOMAS; J.P., EDWARDS, PP. (2000). Metal nanoparticles and their assemblies. Chem Soc Rev, 29: 27-35. [ Links ]
17. SAURAV, G., SANJUKTA, G., MANORANJAN, V. (2001). Surface oxidation of iron nanoparticles. Applied Surface Science, 182: 345. [ Links ]
18. SUN, Y.-P., LI, X.-Q., ZHANG, W.-X., WANG, H.P. (2007). Method for the Preparation of Stable Dispersion of Zero-valent Iron Nanoparticles. A Colloids and Surfaces A: Physicochemical and Engineering Aspects doi:10.1016/ j.colsurfa.2007.05.029. [ Links ]
19. NEUBERGER, T., SCHÖPF, B., HOFMANN, H., HOFMANN, H., VON RECHENBERG, B. (2005). Superparamagnetic nanoparticles for biomedical applications: Possibilities and limitations of a new drug delivery system. J Magn and Magn Mater, 293: 483. [ Links ]
20. T
RONC, E., PRENE, P., JOLIVET, J.P., ORAZIO, F., LUCARI, F., FIORANI, M., GODINHO, R., CHERKAOUNI, M., NOGUES, R., DAVMANN, J.L. (1995). Magnetic behaviour of ã-Fe2O3 nanoparticles by Mössbauer spectroscopy and magnetic measurements. Hyperfine Interactions, 95: 129-148. [ Links ]21. VANDENBERGHE, R.E., DE GRAVE, E., LANDUYDT, C., BOWEN, L.H. (1990). Some aspects corncerning the characterization of iron oxides and hydroxides in solis and clays. Hyperfine Int, 53: 175. [ Links ]
22. WAGNER, C.D, MOULDER, J.F., DAVIS, L.E., RIGGS, W.M. (1997). Handbook of X-ray photoelectron spectroscopy; Perkin- Elmer Corporation Physical Electronics Division. [ Links ]