Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Facultad de Ingeniería Universidad Central de Venezuela
versión impresa ISSN 0798-4065
Rev. Fac. Ing. UCV v.24 n.2 Caracas jun. 2009
Efectos del estiércol equino y del humus líquido en el proceso de biodegradación de un suelo contaminado con petróleo
Celeste Fernández 1*, Henry Labrador 2*, María Llobregat 1, Leonardo Méndez 1, Henry Bastidas 1, Bonnie Sien 1
1 Universidad de Carabobo, Centro de Investigaciones Ambientales, (CIAUC).
2 Universidad de Carabobo, Facultad Experimental de Ciencias y Tecnología, Departamento de Química, Laboratorio de Investigación, Valencia, Edo. Carabobo, Venezuela
*e-mail: cfernand@uc.edu.ve, hjlabrad@uc.edu.ve
RESUMEN
Se evaluó el proceso de degradación de un suelo contaminado con petróleo pesado, empleando estiércol equino y humus líquido como agentes bioestimulantes, con el fin de remover los contaminantes presentes en el mismo. Se realizó el seguimiento de hidrocarburos totales de petróleo, caracterización de saturados, aromáticos, resinas y asfaltenos (SARA), porcentaje de humedad, potencial de acidez, conteo de aerobios mesófilos totales, cromatografía de gases saturados y espectros de resonancia magnética de protones a las resinas y asfaltenos. Además se realizó el análisis de varianza para un diseño en bloques completos al azar, estableciendo las comparaciones de medias mediante las pruebas de Tukey HSD y Dunnett. Se obtuvieron diferencias significativas (p < 0,05) en la disminución de los HTP para el tratamiento con estiércol equino, producto de la degradación microbiana de un 37,72 ± 0,02 % quedando demostrado la efectividad de éste como agente bioestimulante en la remoción de los HTP; a diferencia del humus líquido para el cual no se registraron diferencias significativas (p > 0,05) en la prueba de Dunnett, con un porcentaje de degradación del 16,36 ± 0,02 % de HTP. El tratamiento con estiércol equino presentó un alto porcentaje de remoción de hidrocarburos saturados. Sin embargo, en los 22 días que duró el tratamiento no se lograron los niveles de limpieza establecidos en la normativa ambiental vigente.
Palabras clave: Biorremediación, Estiércol equino, Humus líquido, Petróleo, Agente bioestimulante.
Effects of horse dung and liquid humus on the biodegradation process of oil contaminated soil
ABSTRACT
The degradation process of heavy oil on a soil using horse dung and liquid humus like biostimulants agents was evaluated to reduce its pollution level. Total petroleum hydrocarbon, characterization saturated, aromatics, resins and asphalt fractions (SARA), humidity rate, acidity potential, totals aerobics mesophylic count, gas chromatic to saturated fraction and resonance magnetic de protons spectra to resins and asphalt fractions were determined. In addition was realized the analysis of variance for randomized complete block and the multiple comparisons like all pairwise Tukey HSD and with a control of Dunnetts test. Shows significant differences (p < 0,05) in the reduction of TPH concentrations with horse dung treatment by the microbial degradation enhance to 37,72 ± 0,02 %, which demonstrates the effectiveness the horse dung like biostimulants agent in the removal of the HTP, unlike the liquid humus for which significant differences in Dunnetts test were not registered (p > 0,05) with 16,36 ± 0,02 % of TPH removal. The horse dung treatment showed a high percentage of saturated hydrocarbon removal. But in the time of treatment (22 days) the levels of cleaning were not obtained established by the environmental norm.
Keywords: Bioremediation, Horse dung, Liquid humus, Petroleum, Agent biostimulant.
Recibido: abril de 2008 Recibido en forma final revisado: abril de 2009
INTRODUCCIÓN
La biodegradación se refiere al uso de procesos biológicos mediante el cual los microorganismos transforman componentes degradables en compuestos como el dióxido de carbono, agua y biomasa bacteriana, entre otros, favoreciendo así la detoxificación de un suelo impactado por un desecho orgánico contaminante (Infante, 2001).
La biorremediación es el proceso utilizado por el hombre para detoxificar variados contaminantes en los diferentes ambientes –mares, estuarios, lagos, ríos y suelos– usando de forma estratégica microorganismos, plantas o enzimas. Esta técnica es utilizada para disminuir la contaminación por los hidrocarburos de petróleo y sus derivados, metales pesados e insecticidas; además se usa para el tratamiento de aguas domésticas e industriales, aguas procesadas y de consumo humano, aire y gases de desecho (Gallego et al. 2005).
La bioestimulación como su nombre lo indica, consiste en estimular los microorganismos nativos del suelo adicionando nutrientes como nitrógeno y fósforo. (Gallego et al. 2005). Estos nutrientes se añaden como agentes bioestimulantes y pueden ser fertilizantes, vermicompostes, estiércoles o aditivos orgánicos (Durán & Henríquez, 2007).
El tratamiento biológico de componentes recalcitrantes presenta uno de los más grandes retos a las técnicas de bioremediación modernas, los cuales están basados en la bioestabilización (mineralización) de resinas y asfaltenos que son los componentes del crudo más difíciles de degradar por la acción microbiana. No obstante, estos componentes pueden ser tratados y oxidados a través de métodos de bioremediación que empleen organismos autóctonos en cultivos adecuados para su desarrollo (Talley, 2005).
De acuerdo a experiencias llevadas a cabo por Sánchez et al. (2004), los suelos contaminados con petróleo crudo pueden limpiarse por la acción de bacterias autóctonas presentes en agentes bioestimulantes de interés agronómico. Esto coincide con los resultados de Infante (2001), quien señala que la bioestimulación con microorganismos autóctonos es más efectiva y más aplicada a nivel de campo.
En Venezuela la industria petrolera genera una gran cantidad de desechos con altos contenidos de hidrocarburos, los cuales requieren una adecuada disposición. En el suelo, el petróleo crudo representa un riesgo para el aire, las aguas subterráneas, la calidad del suelo, la flora y la fauna (Schaefer & Filser, 2007). La biorremediación o biotratamiento permite la recuperación de suelos contaminados, mediante el empleo de microorganismos autóctonos, los cuales llevan a cabo la degradación del hidrocarburo, empleándolo como fuente de energía en procesos oxidativos y reductivos bajo ciertas condiciones especiales (Álvarez & Guevara, 2003)
Kirchmann & Ewnetu (1998), utilizaron estiércol equino como bioestimulante para degradar desechos de petróleo logrando una remoción de hidrocarburos de 78 a 93 % en un período de 4,5 meses. Por otro lado Schaefer & Filser (2007) emplearon a la lombriz roja californiana Eisenia foetida como agente bioestimulador en la degradación de crudo obteniendo excelentes resultados a partir de su humus. Así mismo Ogbo & Okhuoya (2008) emplearon estiércol animal y otros acondicionadores como co-sustratos, para disminuir las fracciones tóxicas en un suelo contaminado con crudo.
Algunos estudios han revelado que los asfaltenos pueden ser alterados por microorganismos. Connan (1984) observó que algunos microorganismos pueden sobrevivir en un medio de cultivo en el cual los asfaltenos son la única fuente de carbono. Magot et al. (2000) probaron que los microorganismos pueden crecer en un crudo sin cambios en la fracción de n-alcanos y aromáticos. Experimentos de biodegradación llevados a cabo por Jenisch-Anton et al. (2000) indicaron que las geomacromoleculas (asfaltenos) son degradables durante la biodegradación aerobia, y nuevas funcionalidades pueden ser introducidas a éstas por la oxidación de sus cadenas laterales.
El presente trabajo tiene como objetivo evaluar la descontaminación de un suelo impactado con petróleo pesado mediante biorremediación con sustratos orgánicos, ya que para realizar la biorremediación de un suelo es necesario adicionar agentes estructurantes o acondicionadores orgánicos. Dentro de estos agentes algunos actúan como fuente de microorganismos y fertilizantes, tal es el caso del estiércol equino y del humus líquido.
METODOLOGÍA
Para desarrollar la investigación se llevó a cabo el montaje de microcosmos correspondientes a la aplicación ex situ de dos tratamientos, empleando como agentes bioestimulantes estiércol equino y humus líquido en un suelo contaminado con petróleo pesado de 15.70º API conocido como Merey, proveniente de la faja petrolífera del Orinoco en el campo Carabobo. Se hizo necesario la preparación del suelo (encalado), la caracterización del crudo y el seguimiento de las variables determinadas a lo largo de los tiempos muestrales establecidos en la experimentación para cada tratamiento.
Obtención y caracterización de las muestras de suelo
Se trabajó con un suelo proveniente de Morichal, estado Monagas, en el rodal del módulo MPE – 3 de SINOVENSA (filial de PDVSA). Primeramente se limpió el terreno superficial sobre los puntos de muestreo y se procedió a introducir un barreno recto para tomar una muestra cilíndrica no perturbada, con una capacidad de aproximadamente 20 kg de suelo. El muestreo se realizó en forma de zig-zag mediante ploteos, los puntos de muestreo fueron (Morichal punto 1 y Morichal punto 2) donde el punto 1, se ubica geográficamente entre las coordenadas 50° 97 62,00" E y 96° 49 19,00" N, con una pendiente de aproximadamente 1,3 %, la vegetación presente compuesta por pinos (Pinus caribea). El punto 2, se ubica entre las coordenadas 51° 02 97,00" E y 96° 49 39,00" N, con una pendiente de 1 % y la vegetación en esa área es de chaparros y gramíneas del genero Trachypogon. En cada punto seleccionado se consideraron dos horizontes a diferentes profundidades, el A profundidad (0 – 15) cm y B profundidad (30 – 45) cm. Las muestras seleccionadas fueron debidamente identificadas para su posterior caracterización y traslado, los parámetros a determinar fueron:
Variables físicas: porcentaje de arcillas (% A), porcentaje de limo (% L) y porcentaje de arena (% a) (Agronomy, 1986).
Variables químicas: capacidad de intercambio catiónico (CIC), porcentaje saturación con bases (% SB), relación de absorción de sodio (RAS) (Blake & Hartge, 1986), potencial de acidez (pH) SW 846 9045 C, 1996, calcio (Ca) 3500-Ca, 1998; fósforo total (P) 4500 - P E, 1983; nitrógeno total (N) SM 4500-Norg B, 1996; potasio (K) 3500-K B, 1998; sodio (Na) 3500-Na B, 1998; magnesio (Mg) 3500-Mg, 1998; conductividad eléctrica (Ce) SW 846 9050 A, 1996; porcentaje de materia orgánica (% MO) Walkley Black 9045C, 1995; aluminio intercambiable (% Al3+INT) (Agronomy, 1986).
Encalado del suelo
El potencial de acidez fue de aproximadamente 4,87, factor limitante para aplicar técnicas de biorremediación, según lo expresa el artículo 53 del decreto 2.635. Como enmienda del suelo se seleccionó el carbonato de calcio sólido (CaCO3), el cual permite la corrección de la acidez por el intercambio de los cationes aluminio en la matriz suelo. Para la realización del encalado, es necesario definir la cantidad de enmienda a utilizar. Esto se realizó según la metodología planteada por Casanova (2005), en donde la cantidad de enmienda a añadir es función del aluminio intercambiable presente en el suelo, la densidad del mismo y la profundidad promedio a la cual fue tomada la muestra de suelo. Una vez determinada la cantidad de enmienda a suministrar, la misma debe añadirse disuelta en aproximadamente a un 60% de la capacidad de saturación del suelo. Ésta se determinó pesando aproximadamente 200 g de suelo virgen a los cuales se les adicionó gradualmente un volumen de 1 mL de agua destilada hasta observar una ligera capa sobrenadante de agua en la superficie del suelo (ASTM- D2216), lo que corresponde al punto de saturación. Una vez encalado el suelo se dejó en reposo realizando monitoreos de pH hasta obtener su estabilización en valores cercanos a la neutralidad.
Caracterización de los agentes bioestimulantes
Se trabajó con dos tipos de sustratos que fueron el estiércol equino y el humus líquido, los cuales han sido usados ampliamente por Kirchmann & Ewnetu (1998), Schaefer & Filser (2007) y por Ogbo & Okhuoya (2008), como agentes bioestimulantes en la biodegradación de suelos contaminados con crudo. Estos sustratos orgánicos fueron caracterizados para conocer el contenido de C, N, P y el porcentaje de materia orgánica presente en ellos, con el fin de calcular las relaciones C/N y C/P y su posterior evaluación dentro del rango de valores óptimos propuesto por Levin & Gealt (1997), ya que estos parámetros garantizan el desarrollo de los microorganismos presentes en el suelo.
Aplicación de técnicas de biorremediación
A 15 kg de suelo encalado se le adicionaron aproximadamente una cantidad de 850 g de crudo Merey, obteniendo una concentración de hidrocarburos totales de petróleo inicial de 5,58 ± 0,02 %.
Para el montaje de los microcosmos se utilizaron recipientes rectangulares de plástico de polietileno de alta densidad ([PE-HD] 20×15×10 cm) cada uno con 1,5000 ± 0,0001 kg de suelo contaminado dispuestos de la siguiente manera: uno con suelo contaminado (control), 3 replicas con suelo contaminado y 0,3500 ± 0,0001 kg de estiércol equino; 3 replicas con suelo contaminado y 0,1900 ± 0,0001 kg humus líquido. Las bandejas se colocaron en el laboratorio a temperatura ambiente y sin exposición directa de la luz solar. Se realizó el proceso de aireación por 5 minutos mediante una espátula y se ajustó el valor de humedad al 5 % cada dos días. Posteriormente se tomaron las muestras de suelo para cada análisis realizando un monitoreo a los 0, 5, 9, 14 y 22 días.
Determinación de los hidrocarburos totales de petróleo (HTP) y de fracciones, saturados, aromáticos, resinas y asfaltenos (SARA)
Los HTP fueron determinados siguiendo el método gravimétrico 3540c Soxhlet extraction (1996) propuesta por la Agencia de Protección Ambiental (EPA), empleando tetrahidrofurano como solvente en un equipo de extracción Soxhlet. Se siguió el procedimiento por determinación gravimétrica de SARA, según la norma propuesta por EPA, 8020/8100 EPA (1986) empleando como solventes n-hexano, tolueno, metanol y mezclas de estos en una columna cromatográfica de silica gel 60 de Merck 63-200μm (70-230 mesh ASTM).
Determinación de la tasa de biodegradación
De acuerdo a las concentraciones de cada uno de los componentes del petróleo (SARA) y de los hidrocarburos totales del mismo, en cada tiempo muestral, se calculó la tasa de biodegradación de la fracción o de los HTP según la siguiente expresión:
![]()
donde:
i = (0 ...22) .
%Di : porcentaje de degradación de la fracción o del HTP en el día i de muestreo con respecto al porcentaje inicial (%).
%PTFi : porcentaje de la fracción o del HTP en el día i de muestreo (%).
%PTF0 : porcentaje de la fracción o del HTP en el día de inicio (%).
Análisis del potencial de acidez
Para la determinación del potencial de acidez se utilizó un pH-metro marca Oaklon modelo 510, equipado con un electrodo de referencia de calomel saturado y un indicador de membrana de vidrio sensible con referencia interna de Ag/AgCl. Una vez calibrado, se pesaron aproximadamente 5 g de suelo contaminado en un vaso de precipitado, se le adicionaron 25 mL de agua destilada (relación 1:5) según TMECC (2001), se agitó por espacio de 15 minutos, se filtró y al líquido sobrenadante se le determinó el pH.
Análisis gravimétrico de humedad
Se utilizó el método de ensayo estándar para la determinación del contenido de humedad de suelo por masa (ASTMD2216, 1998). Se determinó la masa de una cápsula de Petri con tapa, sobre la cual se agregaron 20 g de suelo y se colocó en la estufa a 120 ºC por 12 horas, por gravimetría se determinó el porcentaje de humedad.
Análisis cromatográfico de la fracción saturada del crudo
Una vez obtenida la fracción saturada del crudo, se procedió a realizar un análisis cromatográfico empleando un cromatógrafo de gases modelo VARIAN 3800 empleando helio como gas de arrastre, en el cual se inyectaron 2 μL de la fracción obtenida previamente rota evaporada, en una columna de sílica fundida-100 % dimetil polysiloxano, BP1 no polar (30m× 0,22mm Di×0,33mmDe), con un detector de ionización de flama (FID) a 300ºC, y 270 ºC en el inyector, realizándose la corrida de 100 a 290 ºC con un gradiente de 4 ºC/min, par un tiempo total de 49,50 min.
Análisis de espectros de RMN-1H
Las fracciones de resinas y asfaltenos fueron analizadas en un espectrómetro BRUKER-AC-200. Los valores de desplazamientos químicos se obtuvieron en ppm, utilizando tetrametilsilano (TMS), como referencia interna y las muestras fueron disueltas en cloroformo.
Análisis microbiológico
El crecimiento de los microorganismos heterótrofos totales de las muestras de suelos contaminadas con hidrocarburos, se efectuó según el método de dilución seriada y vertido en placa de Agar Plate Coutn, incubado a 37 ºC por 24 horas; para cada día de muestreo se realizó el contaje bacteriano (aerobios mesófilos) (Norma COVENIN 902-1987).
Análisis estadístico
Para realizar la estimación de las principales variables estadísticas de interés se empleó el software analítico STATISTIX 8.0 para Windows. El diseño experimental fue en bloques completos al azar, donde se aplicaron 3 réplicas por tratamiento. Con los resultados obtenidos se realizó un análisis de varianza (ANOVA TWO WAY). Los resultados fueron tratados mediante las pruebas de significancia cuyo valor se situó en 0,05 (Gutiérrez & De la Vara, 2004). Se aplicaron las pruebas de estimación de supuestos, como la de Shapiro – Willk, así como también se realizó la prueba de homogeneidad de las varianzas mediante el gráfico de los residuos por valores fijos. Para lograr una comparación efectiva de los tratamientos en conjunto se realizó la prueba de Tukey HSD, además para realizar la comparación de las unidades experimentales en función del tratamiento control se empleó la prueba de Dunnett.
RESULTADOS Y DISCUSIÓN
De acuerdo con el triángulo textural, el suelo usado en este estudio es franco arenoso, el cual favorece al proceso de biorremediación según lo establecido en el decreto 2.635. En la tabla 1 se muestran los resultados de la textura del suelo.
Tabla 1. Análisis textural del suelo virgen.
| Parámetro | Horizontes Morichal | ||||
| Punto 01 | Punto 02 | ||||
| A | B | A | B | ||
| Arena (Ar ± 0,1)% | 63,0 | 65,0 | 66,0 | 67,0 | |
| Arcilla Ac ± 0,1)% | 20,8 | 24,8 | 20,8 | 20,8 | |
| Limo (L ± 0,1)% | 16,2 | 10,2 | 13,2 | 12,2 | |
Otras de las caracterizaciones relevantes son el fósforo total (P) en ambos horizontes para cada punto muestreado (tabla 2), los valores son menores a 10 mg/kg indicando que puede haber fijación de este elemento ya que el suelo es muy ácido (Casanova, 2005).
Tabla 2. Análisis de los macroelementos y materia orgánica presente en el suelo virgen empleando el proceso de biorremediación.
| Parámetro | Horizontes Morichal | ||||
| Punto 01 | Punto 02 | ||||
| A | B | A | B | ||
| Calcio total (Ca ± 0,01) mg/kg | <40,00 | <40,00 | <40,00 | <40,00 | |
| Potasio total (K ± 0,01) mg/kg | 270,70 | 148,89 | 87,21 | 152,41 | |
| Sodio total (Na ± 0,01) mg/kg | <40,00 | <40,00 | <40,00 | 115,75 | |
| Magnesio total (Mg ± 0,01) mg/kg | <40,00 | <40,00 | 20,8 | <40,00 | |
| Fósforo total (P ± 0,01) mg/kg | 3,10 | 2,05 | <2,00 | <2,00 | |
| Nitrógeno total (N ± 0,001) % | 0,022 | 0,022 | 0,022 | 0,022 | |
| Materia orgánica (Mo ± 0,01) % | 1,36 | 0,54 | 1,51 | 0,00 | |
También los elementos como el calcio (Ca), sodio (Na) y Magnesio (Mg), en ambos perfiles de cada punto, están por debajo de 40 mg/kg, lo que significa que existe deficiencia de estos elementos que son propicios para el desarrollo de plantas en los suelos (Sandoval, 2002). Con respecto al potasio, Sardi & Debreczeni (1992) y Buhman (1993), resaltan que los minerales arcillosos son la fuente principal de potasio en el suelo.
El suelo captado a pesar de ser arenoso, tiene un porcentaje de arcillas cercano al 20%, es por ello que los valores de potasio se encuentran elevados por encima de 150 mg/kg siendo satisfactorio en la fertilización según Casanova (2005). En cambio el nitrógeno total es bajo, lo que limita el crecimiento de los consorcios bacterianos en el estudio (Canals, 2005). Otra de las variables importantes es la capacidad de intercambio catiónico (tabla 3) para cada punto muestreado, los valores son muy bajos, propio de suelos arenosos CIC<10 meq/100 g de suelo (Casanova, 2005), esto trae como consecuencia que las partículas coloidales del suelo (principalmente arcillas) e intersitios arenosos, se encuentran saturadas por cationes aluminio (Al3+) y protones (H+), en lugar de cationes intercambiables como calcio, magnesio, sodio y potasio. Este tipo de suelo no tiene la habilidad de retener nutrientes Na, Mg y Ca ya que son susceptibles al lavado del perfil; esto ocasiona que el porcentaje de saturación con bases sea bajo (< 65%) (Casanova, 2005), aunque el decreto 2635 establece un nivel mayor a 80%. El valor de conductividad eléctrica promedio es de 18,40 mmhos/cm, lo que indica que el suelo tiene un abundante contenido de sales minerales, catalogado por potencialmente salino (Rodríguez et al. 2006), ya que el decreto 2.635 establece un máximo permitido de 3,5 mmhos/cm, lo que puede inhibir el normal desarrollo de los cultivos.
Tabla 3. Variables físico-químicas de interés para la determinación de las condiciones del suelo virgen
| Parámetro | Horizontes Morichal | ||||
| Punto 01
| Punto 02 | ||||
| A | B | A | B | ||
| Potencial de acidez (pH ± 0,01)adim | 4,55 | 4,47 | 5,28 | 5,18 | |
| Conductividad eléctrica (Ce ±0,01)mS/cm | 31,40 | 14,77 | 17,68 | 9,76 | |
| Saturación con bases (Sb ± 0,01)% | 0,12 | 0,06 | 0,08 | 0,08 | |
| Aluminio intercambiable(A ± 0,001) meq/100 g de suelo | 7,710 | 7,710 | 7,710 | 7,710 | |
| Relación de absorción de sodio (RAS± 0,001) adim | 0,128 | 0,125 | 0,050 | 0,428 | |
| Capacidad de intercambio catiónico (CIC ± 0,01) meq/100 g de suelo | 0,73 | 0,50 | 0,60 | 0,65 | |
El potencial de acidez en los horizontes evaluados (pH < 5,00) refleja acidez en el suelo. Esto es debido a la presencia de gran cantidad de iones aluminio (Al3+) e iones hidronios, por lo que se procedió a realizar la enmienda o encalado del suelo, ya que los protones liberados en el proceso de mineralización de la materia orgánica pueden reaccionar con las estructuras cristalinas de las arcillas, liberando aluminio y ácido salicílico a la disolución del suelo. El ión aluminio pasa a los sitios de intercambio de las arcillas y puede sufrir un proceso de hidrólisis produciendo una mayor cantidad de iones hidronios que disminuyen el pH, finalmente el aluminio precipita como hidróxido de aluminio [Al(OH)3(s)] (Casanova, 2005).
En la caracterización del petróleo se tiene que la fracción de hidrocarburos aromáticos es de 32,8 ± 0,8 %, la fracción saturada es de 29,8 ± 0,8 %, las resinas de un 32,9 ± 0,8 %, y los asfaltenos de 4,3 ± 0,8 %. Por otro lado en la caracterización de los agentes bioestimulantes que muestra la tabla 4, el estiércol equino empleado como agente bioestimulante, es rico en materia orgánica, fósforo y nitrógeno total, no obstante, algunos autores como Sandoval (2002) sugieren que los estiércoles se deben utilizar como acondicionadores y mejoradores del suelo y no como fertilizantes, debido a la baja cantidad de nutrientes que aportan con respecto a la excesiva demanda que requieren los suelos.
Tabla 4. Caracterización del estiércol equino y de los humus líquidos empleados como bioestimulantes en el proceso de biorremediación.
| Parámetro | Estiércol equino | Humus líquido |
| Materia orgánica(Mo ±0,02 )% | 1,81 | 0,34 |
| Carbono total (CT ± 0,02 ) % | 1,05 | 0,19 |
| Nitrógeno total (NT ± 0,02 ) % | 0,14 | 0,16 |
| Fósforo total (PT ± 0,2) mg/kg | 290,2 | 100,0 |
El humus líquido es una gran fuente de nitrógeno, carbono y fósforo de excelencia sobre los estiércoles ya que éste contiene ácidos húmicos y fúlvicos, compuestos orgánicos muy usados como complemento de los fertilizantes que contienen un pool de bacterias degradadoras de materia orgánica Sandoval (2002). No obstante, en la caracterización del mismo (tabla 4) la cantidad de macro elementos presentes (C, N, P) son muy bajos, esto se debe a que el humus utilizado en este estudio proviene de una solución del lavado de la pila de compostaje, lo que origina que el residuo esté muy diluido (Durán & Henríquez, 2007).
De acuerdo con Levin & Gealt (1997), para que el proceso de biorremediación sea exitoso, es imprescindible mantener una relación de nutrientes adecuada (tabla 5). Con la caracterización inicial del suelo virgen, del crudo, del humus líquido y del estiércol equino, se pueden estimar, en función de las cantidades de bioestimulante adicionadas, las relaciones de nutrimentos iniciales en los microcosmos.
Tabla 5. Relación de nutrientes presentes en los diversos tratamientos al inicio de la experimentación.
| Tipo de Tratamiento | Relación de nutrientes (R ± 0,04) adim | ||
| (C/N) | (C/P) | ||
| Control | 197,84 | 14040,00 | |
| Estiércol equino | 93,25 | 679,83 | |
| Humus líquido | 102,36 | 3473,20 | |
Para el tratamiento control (atenuación natural), las relaciones de nutrientes indican que existe un déficit de nitrógeno y de fósforo ya que las relaciones son mayores al rango óptimo. Lo que sugiere que los microorganismos autóctonos del suelo no podrán degradar en mayor porcentaje el carbono presente en el suelo. Para los tratamientos con estiércol equino, las relaciones arrojan resultados favorables dentro del rango propuesto por Levin & Gealt (1997), no obstante, en el tratamiento con humus líquido se pone de manifiesto una deficiencia de fósforo por encima de la deficiencia de nitrógeno como agentes propiciadores del buen desarrollo bacteriano (tabla 5).
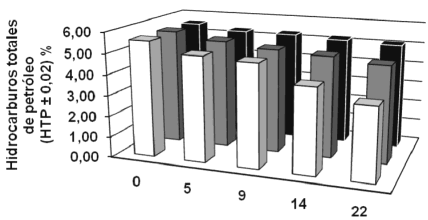
Por otro lado, en la determinación de los HTP se empleó tetrahidrofurano p.a (C4H8O) como solvente extractor, ya que es un compuesto heterocíclico moderadamente polar, el cual permite solubilizar a todos los diferentes tipos de compuestos presentes en el crudo SARA, (Vívas et al. 2002). Los resultados se representan en la figura 1 y revelan una disminución de los hidrocarburos totales de petróleo en función del tiempo para todos los tratamientos, esto se debe principalmente al establecimiento de comunidades bacterianas autóctonas que logran degradar parte de los compuestos que están presentes en el crudo, debido a que se mantienen ciertas condiciones que propician su desarrollo (Canals, 2005).
Figura 1. Disminución de los hidrocarburos totales de petróleo en cada uno de los tratamientos aplicados.
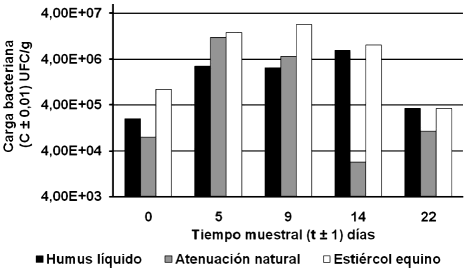
Según La Grega et al. (2002) las bacterias, hongos y levaduras son las responsables de las reacciones de biodegradación. Estos acotan también que aunque dichas reacciones forman parte normal del metabolismo de una célula bacteriana, el objetivo de estos microorganismos no es la eliminación de los contaminantes ambientales; sino crecer y mantenerse, es por ello que existe un incremento de la carga bacteriana como consecuencia de la degradación de los HTP; en la figura 2 se evidencia el crecimiento de la carga bacteriana mesófila en el tiempo.
Figura 2. Evolución de la carga bacteriana mesófila para cada uno de los tratamientos aplicados.
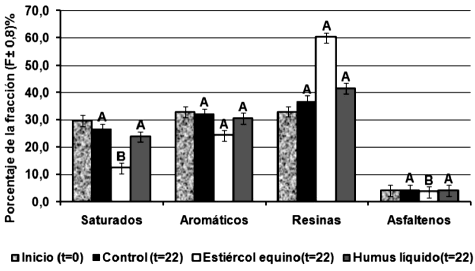
El porcentaje de degradación de hidrocarburos totales de petróleo del suelo control representó un 8,50 ± 0,02 % al final del tratamiento, con el estiércol equino hubo un porcentaje de degradación de 37,72 ± 0,02 %, mientras que para el humus líquido el porcentaje de degradación es de 16,36 ± 0,02 %. No se registraron diferencias significativas (p>0,05) en el tratamiento con humus líquido en la prueba de Tukey HSD ni en la prueba de Dunnett con respecto al tratamiento control (figura 3). Estos resultados revelan que el humus líquido no fue efectivo en la remoción de los HTP a diferencia del tratamiento con estiércol equino.
Figura 3. Porcentaje en peso de las diversas fracciones de crudo al inicio y al final del tratamiento. Tratamientos con la misma letra no difieren significativamente (Tukey p> 0,05).
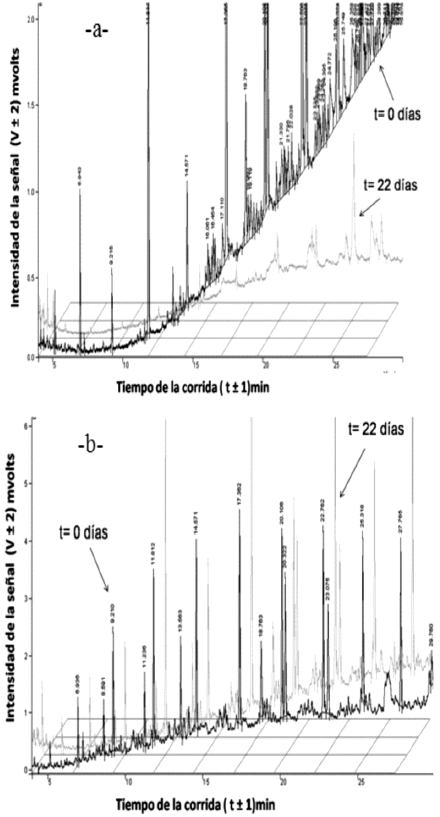
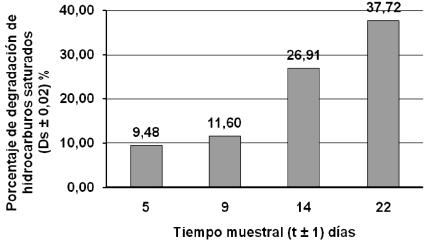
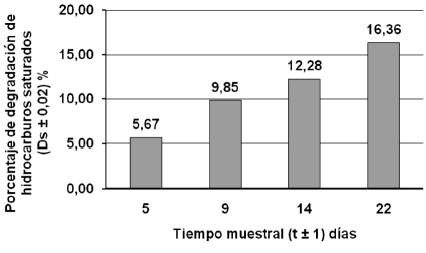
Con respecto a la fracción saturada en los tratamientos con estiércol equino y humus liquido al inicio y al final del mismo (figura 4) y la tasa de degradación en las figuras 5 y 6, respectivamente, se observa reducción de las áreas en los picos del cromatograma y se contrasta con la tasa de degradación, resultando que la tasa de degradación es más elevada con el tratamiento estiércol equino.
Figura 4. Cromatograma de la fracción saturada. a) Tratamiento con estiércol equino; b) Tratamiento con humus líquido. Al inicio del tratamiento (t = 0) y al final del mismo (t = 22).
Figura 5. Porcentaje de degradación de la fracción de saturados aplicando estiércol equino.
Figura 6. Porcentaje de degradación de la fracción de saturados aplicando humus líquido.
Se puede establecer que las fracciones de hidrocarburos saturados presentes en el crudo son fácilmente biodegradables, esta degradación se debe a la acción de las bacterias autóctonas del suelo, del estiércol y del contaminante, que a través de la humedad, aireación y nutrientes aceleran la biodegradación, ya que son capaces de crecer y desarrollarse en el medio, usando la materia orgánica como sustrato y fuente de energía.
Otra de las causas es que los compuestos saturados del petróleo, como los n-alcanos, son considerablemente más biodegradables que los alcanos ramificados y los alquilaromáticos (Infante, 2001). También las fracciones de menor peso molecular son más biodegradables, solubles en agua, y más volátiles que los componentes de mayor peso molecular y por lo tanto son removidos de la mezcla más rápidamente.
La fracción de hidrocarburos aromáticos aunque no sufrió diferencias significativas en la prueba de Tukey (p>0,05), presentó una disminución progresiva para el tratamiento con estiércol equino con respecto a la del humus líquido. Al último día de tratamiento había un 24,10± 0,02 % y 30,60± 0,02 % de hidrocarburos aromáticos en los microcosmos con estiércol y humus, respectivamente. Esta disminución se debe principalmente a que las comunidades bacterianas son capaces de degradar hidrocarburos aromáticos por medio de reacciones metabólicas para la obtención de energía (Infante, 2001).
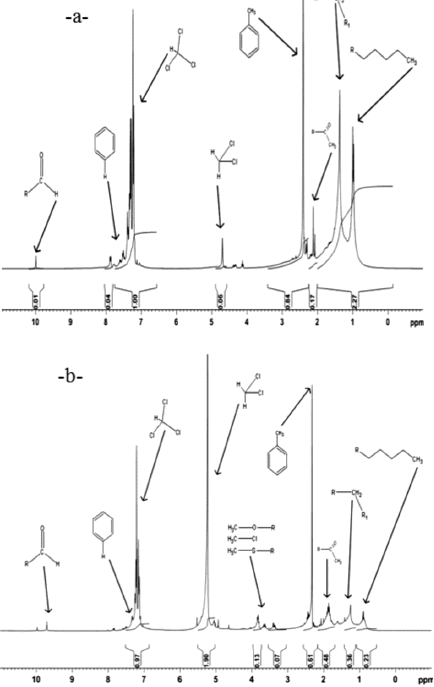
Los espectros de resinas reflejan algunas cambios, como la disminución de las señales de protones alifáticos en la estructura de las resinas, así como la inclusión de heteroátomos al final del tratamiento (figura 7), lo que indica que hubo una posible degradación de las mismas mediante la acción oxidativa de algunos microorganismos que se encuentran presentes en el suelo (Álvarez & Guevara, 2004). Estos resultados concuerdan con los obtenidos por Araujo et al. (2006), quien encontró diferencias significativas en la degradación de resinas por medio de consorcios microbianos. También se evidencia la presencia de tres sustancias contaminantes (cloroformo, dicloro-metano y tolueno) que se encontraron en las muestras durante la realización de los espectros debido a su pretratamiento.
Figura 7. Espectros de resonancia magnética nuclear para las resinas extraídas del suelo usando el tratamiento con estiércol equino: a) Al inicio del tratamiento, b) Al último día de la experimentación.
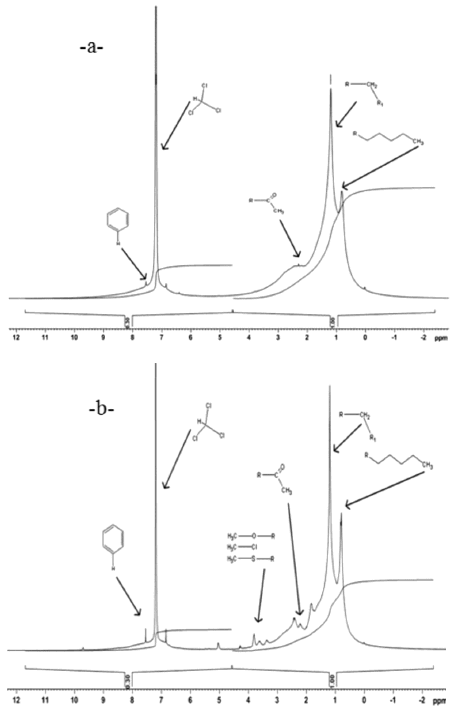
Los espectros de asfaltenos (figura 8), muestran también formación de heteroátomos que son producto de una degradación oxidativa por medio del oxígeno y nitrógeno que se incorporan al microcosmos. Estos resultados también fueron obtenidos por Ward (2003), el cual logró la remoción de asfaltenos a partir de cepas bacterianas. En este trabajo hubo remoción de asfaltenos, los cuales fueron trasformados en otras fracciones incrementando la fracción resinas (figura 3). Lo que coincide con los resultados obtenidos por Walter & Colwell (1976), quienes reportaron la degradación de asfaltenos pero con un incremento en la fracción de resinas. Esto se debe, como se mencionó anteriormente, a que el estiércol es un agregado del suelo que aumenta su porosidad, lo que impide que se creen zonas anóxicas y por ende degradaciones reductivas. (Gómez et al. 2006), biodegradaron asfaltenos empleando humus de lombrices rojas californianas y vermicompostes. Pineda et al. (2001, 2002 y 2004) evidenciaron la degradación de asfaltenos a través de consorcios microbianos de crudo extrapesado por medio de mecanismos de alteración macromoleculares. Por otro lado, Rontani et al. (1985) mostraron la degradación parcial de asfaltenos por medio de una mezcla de bacterias marinas con hidrocarburos saturados como co-sustratos. Estudios más recientes, como los llevados a cabo por Liao et al. (2009), sugieren que la biodegradación puede alterar la composición y estructura de resinas y asfaltenos produciendo ácidos carboxílicos, fenoles y alcoholes, entre otros, a través de mecanismos de oxidación. Y Silva et al. (2008) proponen que aunque los asfaltenos son fracciones difíciles de degradar los mismos poseen grupos alifáticos que son susceptibles a biodegradación por medio de consorcios microbianos, originando estructuras más simples.
Figura 8. Espectros de resonancia magnética nuclear para los asfaltenos extraídos del suelo usando el tratamiento con estiércol equino: a) Al inicio del tratamiento b) Al último día de la experimentación.
Otros de los parámetros fisicoquímicos estudiados fueron el pH y la humedad del suelo. El pH no varió de forma significativa, esto se debe a que cuando se realizó la enmienda con carbonato de calcio éste adquirió una capacidad reguladora que es capaz de resistir los cambios bruscos de potencial de acidez (figura 9) manteniéndose en un valor cercano a la neutralidad, favoreciendo el crecimiento bacteriano (Canals, 2005). Con respecto a la humedad ésta se controló durante el proceso de degradación del crudo, la cual se mantuvo en aproximadamente 5 %, lo que equivale a decir un valor del 60% de la capacidad de campo (Infante, 2001), para que exista el adecuado trasporte de nutrientes a través de las células de los microorganismos que ejercen la función degradadora.
Figura 9. Cambios del potencial de acidez para cada tratamiento.
CONCLUSIONES
El suelo virgen empleado presentó textura franco-arenosa y problemas de baja cantidad de nutrientes y un alto contenido de acidez, verificándose que la aplicación de carbonato de calcio al suelo permite reducir los contenidos de aluminio intercambiable y neutralizar su acidez, otorgándole una capacidad reguladora de pH.
La caracterización del crudo indica que corresponde a un crudo pesado con un 29,8 ± 0,8% de saturados, 32,8 ± 0,8 % de aromáticos, 32,9 ± 0,8 % de resinas y 4,3 ± 0,8% de asfáltenos.
La caracterización del estiércol equino indica que posee un buen contenido de macronutrientes; no obstante el humus líquido presentaba un déficit de los mismos, por lo tanto las relaciones de nutrientes en los microcosmos con estiércol equino al inicio del tratamiento son favorables, a diferencia de los microcosmos con humus líquido.
Los HTP disminuyeron en 8,50 ± 0,02 % al final del tratamiento para el control, un 37,72 ± 0,02 % para el estiércol equino y 16,36 ± 0,02 % para el humus líquido, desarrollándose una máxima carga bacteriana mesófila en el tratamiento control de (1,20 ± 0,01) ×107 UFC/g, (2,30 ± 0,01) ×107 UFC/g para el estiércol equino y (6,30 ± 0,01) ×106 UFC/g para el humus líquido.
El porcentaje de degradación de la fracción de hidrocarburos saturados, utilizando estiércol equino, tuvo mayor degradación que el tratamiento con humus líquido.
Los cromatogramas de las fracciones de saturados al inicio y al final del tratamiento señalan un decrecimiento de las áreas.
El potencial de acidez y el porcentaje de humedad en los microcosmos durante el tratamiento, no sufrieron cambios significativos, según la prueba de Tukey (p >0,05). Mientras que se obtuvieron resultados significativamente diferentes según la prueba de Tukey (p < 0,05) en la fracción saturada y de asfaltenos del crudo presente en el suelo para los microcosmos con el tratamiento de estiércol equino a diferencia de la fracción aromática y de resinas. No obstante se verificó la inclusión de heteroátomos dentro de la estructura de los asfaltenos y resinas al final del tratamiento. En la prueba de Dunnett no se encontró diferencia significativa (p > 0,05) entre los tratamientos con humus líquido y el control.
AGRADECIMIENTOS
Los autores agradecen a los Laboratorios del Centro de Investigaciones Químicas de la Facultad de Ingeniería, al Laboratorio de Investigación de la Facultad Experimental de Ciencia y Tecnología de la Universidad de Carabobo, la Unidad de Lombricultura de la Facultad de Agronomía de la Universidad Central de Venezuela, núcleo Maracay; así como al Consejo de Desarrollo Científico y Humanístico de la Universidad de Carabobo por el financiamiento Nro. 00113-07.
REFERENCIAS
1. Álvarez, P. & Guevara, E. (2003). Biorremediación y atenuación natural de acuíferos contaminados por sustancias químicas peligrosas. Consejo de Desarrollo Científico y Humanístico de la Universidad de Carabobo (CDCH-UC), Venezuela. [ Links ]
2. Araujo, I., Montilla, M., Cárdenas, C., Herrera, L., Angulo, N., Morillo, G. (2006). Lodos estabilizados y cepas bacterianas en la biorremediación de suelos contaminados con hidrocarburos. Interciencia, 31 (004): 268-275. [ Links ]
3. AstmD2216 (1998). Determinación del contenido de humedad. Consulta, 2007, Agosto 10. [ Links ]
4. Blake, G. & Hartge, K. (1986). Bulk Density. En Klute A (Ed.) Methods of soil analysis. American Society of Agronomy. Madison, Wisconsin, EEUU. pp. 363-375. [ Links ]
5. Buhman, C. (1993). K fixing phyllosilicates in soils, the role of in herieted components. J.Soil Sci. 44: 347 360. [ Links ]
6. Canals, M. (2005). Biorremediación de suelos contaminados por hidrocarburos: caracterización microbiológica, química y ecotoxicológica. Tesis Doctoral publicada. Universidad de Barcelona. Facultad de Biología. Departamento de microbiología. Barcelona. España. (en línea) http://www.tdx.cesca.es/TDX-0920105-085623/. Acceso: 30 Agosto (2008). [ Links ]
7. Casanova, E. (2005). Introducción a la ciencia del suelo. Consejo de Desarrollo Científico y Humanístico de la Universidad Central de Venezuela (CDCH-UCV). Venezuela. [ Links ]
8. Connan, J. (1984). Biodegradation of crude oils in reservorirs. In: Brooks. J Welte, D.H (Eds.), Advances in petroleum Geochemistry I. Academic Press, London UK. 298-335. [ Links ]
9. Covenin 902 (1987). Comisión Venezolana de normas industriales. Método para recuento de colonias de bacterias aerobias en placas de Petri. 2da revisión. [ Links ]
10. Decreto 2635 (1998). Reforma parcial del decreto contentivo de las normas para el Control de la Recuperación de Materiales Peligrosos y el manejo de desechos peligrosos. Gaceta Oficial de la República de Venezuela Nº 5.245. Extraordinaria. Caracas. [ Links ]
11. Durán, L. & Henríquez, C. (2007). Caracterización química, física y microbiológica de vermicompostes producidos a partir de cinco sustratos orgánicos. Revista Agronomía Castrense. 31, 001, 41-51 (en línea) http://redalyc.uaemex.mx/redalyc/pdf/436/43631105.pdf. Consulta: 31 Agosto (2008). [ Links ]
12. Gallego, P., Cuéllar., R., Dussán, J. (2005). Biorremediación de residuos de petróleo. Documento en línea. Disponible en: http://www.mindefensa.gov.co/derecho/mea01gua.html. Consulta: 2008, Enero 16. [ Links ]
13. Gómez, E., Correa, A., Hernández, S., Martín, J., Sánchez, M., González, J., Hurtado, J., Ramos, M. (2006). Biodegradación de asfaltenos del Prestige mediante la aplicación de técnicas de compostaje-vermicompostaje. Revista Residuos, 16 ( 92): 56-63. [ Links ]
14. Gutiérrez, H. & De La Vara, R. (2004). Análisis y diseño de experimentos. Primera edición. México. Mc Graw-Hill. [ Links ]
15. Infante, C. (2001). Biorrestauración de áreas impactadas por crudo por medio de intebios® y biorize®. Interciencia, 26(010): 504-507.
16. Jenisch-Anton, A., Adam, P., Michaelis, W. Connan, J., Herrmann, D., Rohmer, M., Albercht, P. (2000). Molecular evidence for biodegradation of geomacromolecules Geochimica et Cosmochimica. Acta, 64: 3525-3537.
17. Kirchmann, H. & Ewnetu, W. (1998). Biodegradation of petroleum-based oil wastes through composting. Biodegradation, 9: 151-156.
18. Magot, M. (2000). Microbiology of petroleum reservoirs. Antonie Van Leeuwenhoek, 77:103-106.
19. Método 3500-CA(1998). Standard Methods for the examination of water and wastewater. 20TH edition. [ Links ]
20. Método 3500-KB(1998). Standard Methods for the examination of water and wastewater. 20TH edition. [ Links ]
21. Método 3500-NAB(1998). Standard Methods for the examination of water and wastewater. 20TH edition. [ Links ]
22. Método 3500-MG(1998). Standard Methods for the examination of water and wastewater. 20TH edition. [ Links ]
23. Método 4500 – P. E. (1983). Colorimétrico estándar. Fósforo total por espectrofotometría UV-VIS, (método del ácido ascórbico).UNE. Unión Nacional Europea. 77047. [ Links ]
24. La Grega, M., Buckingham, P., Evans, J. (2002). Gestión de residuos tóxicos. Tratamiento, eliminación y recuperación de suelos. Volumen II. Editorial Mc.Graw Hill, Madrid. [ Links ]
25. Levin, M. & Gealt, M. (1997). Biotratamiento de residuos tóxicos y peligrosos. 1ª Edición. Editorial Mc.Graw Hill, Madrid. [ Links ]
26. Liao, Y., Geng, A., Huang, H. (2009). The influence of biodegradation on resins and asphaltenes in the Liaohe Basin. Organic geochemestrym, 40: 312- 320.
26. Ogbo, J. & Okhuoya, E. (2008). Biodegradation of aliphatic, aromatic, resinic and asphaltic fractions of crude oil contaminated soils by Pleurotus tuber-regium Fr. Singer - a white rot fungus. African Journal of Biotechnology. 7(23): 4291-4297.
27. Pineda, G. & Mesta, A. (2001). Petroleum asphaltenes: generated problematic and possible biodegradation mechanisms. Revista Latinoamericana de microbiología. 43(3): 143-150.
28. Pineda, G., Boll, G., Mesta, A. (2002). Biodegradación de asfálteno por un consorcio microbiano aislado de petróleo crudo MAYA. Revista Internacional de Contaminación Ambiental. 18(2): 67-73.
29. Pineda, G., Boll, G., Galeana, C., Mesta, A. (2004). A microbial consortium isolated from a crude oil sample that uses asphaltenes as a carbon and energy source. Biodegradation, 15: 145-151.
30. Rodríguez, R., Moreno, J., Larreal, M. (2006). Comportamiento de la conductividad eléctrica en dos series de suelo del sector Caño San Miguel, municipio Mara, estado Zulia durante un período de dos años. Universidad del Zulia. Revista Facultad de Agronomía. 23(4): 395-406.
31. Rontani, J., Joulak-Bousser, F., Rambeloarisoa, E. Bertrabd, J., Giusti, G., Faure, F. (1985). Analytical study of astahr crude oil asphaltenes biodegradation. Chemosphere, 14: 1413-1422.
33. Sandoval, J. (2002). Acondicionadores y mejoradores de suelo. Instituto colombiano agropecuario. Medellín. Colombia. [ Links ]
34. Sardi, K. & Debreczeni, K. (1992). Comparison of methods evaluating the plant available potassium content in soils of different types and potassium levels. Comm. Soil Sci. Plant Anal. 23; 26: 13 2632. [ Links ]
35. Schaefer, M. & Filser, J. (2007). Efectos de la Lumbricus terrestris, Allolobophora chlorotica y Eisenia foétida sobre las comunidades dinámicas microbianas en los suelos contaminados por petróleo. Applied Soil Ecology. 36: 53-62.
36. Silva, T., Azevedo, D., Rangel, M., Fontes, R., Aquino, F. (2008). Effect of biodegradation on biomarkers released from asphaltenes. Organic geochemistry, 39: 1249-1257.
37. Statistix 8.0 for Windows (2003). Analytical Software. Tallahassee, FL. [ Links ]
38. Talley, W. (2005). Bioremediation of recalcitrant compounds. Taylor & Francis Group. Boca Ratón, FL. 2-3. [ Links ]
39. Tmecc(2001). Test Methods for the Examination of Composting and Compost. U.S. The Composting Council Research and Education Foundation. [ Links ]
40. USEpa Method 3540-C (1996). Soxhlet Extraction. Determinación de HTP. Agencia de protección ambiental (EPA). [ Links ]
41. USEpa (8020/8100) (1998). Agencia de protección ambiental (EPA) – Caracterización de crudos en fracciones SARA. [ Links ]
42. USEpa Method SW 846 9050 A (1996). Método conductimétrico. Determinación de conductividad. Agencia de protección ambiental (EPA). [ Links ]
43. USEpa Method SW 846 9045 C (1996). Método electrométrico. Determinación de potencial de acidez. Agencia de protección ambiental (EPA). [ Links ]
44. USEpa Method Walkley Black 9045C (1995). Determinación de materia orgánica. Agencia de protección ambiental (EPA). [ Links ]
45. USEpa Method SM 4500-Norg B(1996). Método Kjeldahl. Determinación de nitrógeno total. Agencia de protección ambiental (EPA). [ Links ]
46. Vivas, E., Bravo, B., Chávez, G. (2002). Estudio de las fracciones ácidas y básicas extraídas de asfaltenos de un crudo pesado. Revista Ciencia. 10(4): 419-428.
47. Walter, J. & Colwell, R. (1976). Enumeration of petroleum-degrading microorganisms. Microbial Biotechnology, 10: 284.