Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista de la Facultad de Ingeniería Universidad Central de Venezuela
Print version ISSN 0798-4065
Rev. Fac. Ing. UCV vol.25 no.2 Caracas June 2010
Degradación de películas plastificadas de quitosano obtenidas a partir de conchas de camarón (L.vannamei)
Ángel López 1, Johan Rivas 1, Mariielys Loaiza 1,2, Marcos Sabino 2*
1 Universidad Nacional Experimental Francisco de Miranda. Área de Tecnología. Estado Falcón. Venezuela
2 Universidad Simón Bolívar, Departamento de Química, Grupo B5IDA, Apdo. 89000, Caracas 1080-A. *e-mail: msabino@usb.ve
RESUMEN
El presente trabajo desarrolla una propuesta para la elaboración de películas poliméricas biodegradables en base a quitosano plastificado, el cual fue sintetizado a partir de quitina extraída a través de diversos métodos químicos, con rendimientos entre 79 % y 94 %, de conchas de camarón de la especie L. vannamei proveniente de la Península de Paraguaná-Venezuela. Posteriormente, mediante desacetilación termoalcalina de la quitina y a 120 °C, se obtuvo el quitosano, con grados de desacetilación entre 94 % y 97 % y pesos moleculares viscosimétricos (Mv) en un rango de 3 x 105 y 4 x 105 g/mol. Con el quitosano sintetizado se prepararon soluciones bases de quitosano en acido acético diluido para preparar películas de quitosano puro y plastificadas con 0,2 % de glicerina, mediante evaporación del solvente, a una temperatura alrededor de 50 ºC. Luego, se determinaron las propiedades mecánicas de las películas, encontrándose un buen efecto plastificante por parte de la glicerina. El estudio de degradación de ambos tipos de películas (plastificadas y no plastificadas), se llevó a cabo en sistemas de compostaje en distintas zonas del país (zona árida Punto Fijo-Falcón y zona húmeda Los Teques- Miranda) y luego fue caracterizado a través de la pérdida porcentual de peso y por la morfología superficial de las películas usando microscopia electrónica de barrido (MEB). Las películas degradadas en Falcón presentaron una disminución en la velocidad de degradación con respecto a las degradas en Los Teques de acuerdo al sistema evaluado.
Palabras clave: Camarón (L.vannamei), Quitina, Quitosano, Película biodegradable, Plastificación, Sistemas de compostaje.
DEGRADATION OF PLASTICIZER CHITOSAN FILM OBTAINED FROM SHRIMP SHELLS (L. vannamei)
ABSTRACT
This research attempts to develop a proposal for the development of biodegradable polymer film based on Chitosan, synthesized from chitin extracted from shells of shrimp species L. vannamei that can be found on the Peninsula of Paraguaná- Venezuela. Chitin was isolated from the shrimp shells selected through various chemical methods giving yields between 79 % and 94 %. Then, through thermal alkaline desacetilation, at 120 °C, chitosan was obtained, reaching levels of between 94 % and 97 %, and viscosimetric molecular weights between 3 x 105 y 4 x 105 g/mol. With the obtained chitosan, solutions were prepared using the solvent casting technique (at a temperature around 50 ºC) to prepare pure chitosan film and plastifiant chitosan adding 0.2 % of glycerin using dilute acetic acid as solvent. The mechanical properties of samples were determined, finding a good plasticizer effect through the presence of the glycerin. The study of degradation of the plastic film and the pure chitosan film was carried out in compost systems in different parts of the country (arid zone in Punto Fijo city and a wet zone in the city of Los Teques ). The degradation was measured by weight loss (%) and the superficial morphology of the films using scanning electron microscopy (SEM). The degraded films in the arid zone showed a decrease in the degradation rate compared to the degraded films in wetlands, as expected, due to the conditions given to the process of enzymatic hydrolysis that can occur in wetlands.
Keywords: Shrimp (L. vannamei), Chitin, Chitosan, Biodegradable films, Plasticization, Compost systems.
Recibido: octubre de 2008 Recibido en forma final revisado: julio de 2009
INTRODUCCIÓN
Los materiales poliméricos son de gran importancia en la vida del hombre, ya que tienen una gran utilidad en las actividades que desarrolla, sin embargo, su uso genera un gran impacto ambiental, debido a que la mayoría de ellos no son biodegradables.
Con la presente investigación se pretende aportar un estudio en el área de la producción de productos poliméricos biodegradables de origen natural, de manera tal de obtener nuevos materiales susceptibles a la degradación por la exposición de estos a los distintos factores degradadores del medio ambiente, que pueden ser tanto de naturaleza aeróbica, como anaeróbica.
La quitina no posee una amplia gama de usos en la industria química debido a su insolubilidad en agua, disolventes orgánicos y ácidos diluidos. El uso más importante de la quitina es su modificación química a quitosanos, la cual consiste en eliminar en un grado entre 70% y 90% los grupos acetilos unidos a los grupos aminos de la molécula, mediante un procedimiento denominado desacetilación (Márquez et al. 2006; Khor & Lima, 2003).
El quitosano es un biopolímero con muchos usos en la industria de la agricultura, biomedicina, alimentos, en tratamientos de aguas residuales y potabilización, en cosméticos, entre otros. Esto debido a que posee grupos aminos libres que le infieren mejores propiedades químicas y físicas (Márquez et al. 2006; Lárez, 2003.
En Venezuela se han desarrollado estudios sobre el quitosano, como materia prima principal, para la elaboración de distintos productos químicos de gran importancia en la vida del hombre, sin embargo son pocos los estudios desarrollados para su uso como materia prima en la producción de productos plásticos biodegradables (Nayak, 1999; Correlo et al. 2005; Cárdenas et al. 2002; Martínez et al. 2008).
No obstante, Falcón es un estado con amplias costas, y se encuentra entre los principales productores de camarón del país (entre los que se encuentra la especie L.vannamei), y aún no existen proyectos para la explotación de estos pasivos ambientales, ni de tecnologías que incentiven su uso como material plástico. Es por esto que se hace necesaria la elaboración de una investigación donde se proponga el uso de este polímero natural en el sector industrial, en el que tiene amplias posibilidades de uso.
PARTE EXPERIMENTAL
Extracción de la quitina (QA) de las conchas de camarón L. vannamei
Preparación de materia prima. Consistió en la selección, lavado, secado y molido de las conchas de camarón.
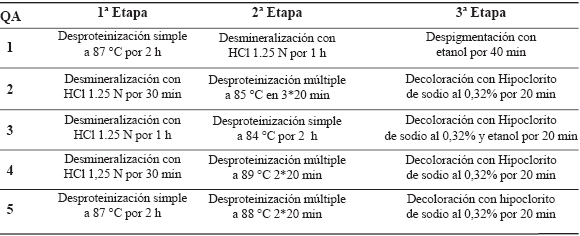
Desmineralización. La desmineralización de las conchas de camarón se llevó a cabo con el uso de ácido clorhídrico (HCl, Riedel-de Haën, 37% de pureza) al 1,25N y 2N, durante períodos comprendidos entre 0,5 y 1 h, con una relación sólido-líquido de 1:5 p/v, a temperatura ambiente; luego se lavaron con agua destilada hasta llegar a pH neutro.
Desproteinización. Para la desproteinización se utilizó hidróxido de sodio (NaOH, Eka Nobel, 98% de pureza) al 0,5% y 3%, y consistió en un método de extracción múltiple y uno de extracción simple. En la extracción múltiple, se desproteinizó en tres (3) ocasiones con hidróxido, cada una por 20 min a temperaturas altas entre 80 °C y 90 °C y con una relación sólido-líquido de 1:5 p/v. La extracción simple se realizó durante 2 h a temperaturas similares a las utilizadas en la extracción múltiple y con una relación sólido-líquido de 1:7 p/v. Todos los procedimientos fueron antecedidos por una desproteinización con hidróxido de sodio al 0,5% durante 30 min, a una temperatura de 90 °C y una relación de 1:5 p/v. Luego se lavaron hasta neutralidad con agua destilada.
Despigmentación. El proceso de despigmentación se desarrolló usando varios disolventes, como etanol absoluto (CH3CH2OH, Riedel-de Haën, 99% de pureza), etanol/ agua/hipoclorito de sodio (NaClO, Eka Nobel, 99% de pureza) y agua/hipoclorito de sodio, y consistió en remojar las muestras en esta solución entre 20 y 40 min a temperatura ambiente, dependiendo del sistema usado, luego se lavaron hasta neutralidad y se secaron en estufa a 70 °C durante 6 h.
Caracterización de la quitina extraída de las conchas de camarón. Se usó espectroscopia infrarroja para determinar los grupos funcionales de las muestras. Se llevó a cabo mediante la preparación de pastillas con 180 mg de bromuro de potasio (KBr, Eka Nobel, 99,9% de pureza) y 20 mg de quitina. Para ello, se utilizó un equipo marca Nicolet, modelo magna 750, usando una resolución de 4 cm-1. A través de este proceso se pudieron identificar los grupos funcionales característicos de la quitina.
Obtención de quitosano (QN) a partir de la desacetilación termoalcalina de la quitina extraída de las conchas de camarón L.vannamei
Desacetilación termoalcalina de la quitina. Se realizó mediante hidrólisis en medio altamente alcalino en fase heterogénea. Primeramente se colocaron en calentamiento las muestras de quitinas obtenidas, en soluciones de NaOH al 50% a 120 °C, durante 1 h según el método descrito por Peniche (2006). El producto resultante fue lavado hasta neutralidad y secado por 6 h a 80 °C, el mismo no se solubilizó en acido acético (CH3COOH, Fisher Scientific, 99% de pureza) por lo cual se sometió la quitina no desacetilada a un proceso de pulverización, con la ayuda de un molino en condiciones criogénicas. El polvo obtenido fue sometido a una segunda desacetilación con una solución de NaOH al 30% a 120 °C, por un período de 90 min. Cada uno de los quitosanos obtenidos, fueron sometidos a un proceso de purificación, mediante el uso de una membrana de diálisis, durante 72 h a una temperatura de 22 ºC; realizando el intercambio de agua cada 24 h.
Determinación del grado de desacetilación del QN por FTIR. Para la determinación del grado de desacetilación del quitosano, se prepararon películas de quitosano al 1% en peso en una solución de acido acético al 2% v/v, las cuales se dejaron secar durante toda la noche a una temperatura de 60 °C, luego se lavaron con agua destilada y se secaron nuevamente por 5 h. Después de estar bien secas, se guardaron en bolsas plásticas herméticas hasta su caracterización. El grado de desacetilación fue establecido mediante Espectroscopia Infrarroja y se cuantificó a partir de la curva de calibración reportada por Brugnerotto et al. (2001), cuya ecuación (1) de recta es:
A1320/A1420 = 0.3822 + 0,03133*DA (1)
donde:
A1320 y A1420 son las absorbancias a 1320 cm-1 y a 1420 cm-1, y DA representa el grado de acetilación, el cual es restado al 100% de desacetilación, para de esta forma calcular el grado de desacetilación del quitosano (DD).
Determinación de la masa molecular viscosimétrica del QN. Luego de su purificación en la membrana de diálisis y habiéndose secado, para determinar la masa molecular viscosimétrica (Mv), el quitosano fue disuelto en solución madre de ácido acético al 5%, a distintas concentraciones del polímero. Usando un viscosímetro capilar Ubbelhode, se midieron los distintos tiempos de caída entre dos puntos del viscosímetro de las soluciones preparadas con el fin de determinar la viscosidad intrínseca (ŋint), la cual viene dada por la intersección entre la viscosidad inherente (ŋinh) y la viscosidad reducida (ŋr). Para el cálculo de la masa molecular, se efectuaron cinco (5) medidas de tiempo para cada concentración de quitosano utilizada (2 x 10-4 g/mL, 4 x 10-4 g/mL, 6 x 10-4 g/mL y 8 x 10-4 g/mL). La MV se calculó utilizando la ecuación (2) de Mark-Houwink:
hn = KMaV (2)
donde: a y K son constante que dependen del sistema polímerosolvente a una temperatura determinada.
Para el sistema QN-Acido acético los valores de las constantes son K = 0,069 y a = 0,77.
Como control comparativo en relación a los pesos moleculares obtenidos a partir de la experiencia en el laboratorio, se utilizó un quitosano comercial (Aldrich, 75 - 85% de grado de desacetilación).
Obtención de películas poliméricas en base a QN
Preparación de solución base de quitosano. Para la elaboración de las películas se prepararon soluciones de quitosano al 2% p/v en una solución al 5% v/v de ácido acético.
Preparación de la solución de quitosano plastificada. Partiendo de la solución base de quitosano se prepararon soluciones para elaborar películas de quitosano con un aditivo, que pudiese mejorar sus propiedades mecánicas tales como flexibilidad y ductilidad. El aditivo elegido como agente plastificante para alcanzar tal fin fue la glicerina (C3H8O3, Fisher, 99,5% de pureza), debido a que es un producto natural con excelentes propiedades plastificantes y de precio moderado.
Formación de películas. Para la formación de películas, fueron usadas cápsulas petri de 10 cm de diámetro, las cuales fueron lavadas con abundante agua y desengrasadas con acetona. A cada recipiente se le agregó 25 mL de la solución base de quitosano con glicerina al 0,2%; luego se dejaron en la estufa entre 50-60 °C y por evaporación del solvente se formaron las películas.
Evaluación de la biodegradabilidad en compost de las películas poliméricas de quitosano
El estudio de la biodegradabilidad de las películas poliméricas, se realizó bajo condiciones de simulación de un proceso de compostaje (tierra abonada) aeróbico, para lo que se prepararon lechos de compost con materia orgánica de dos zonas diferentes del país, siendo las mismas Los Teques (estado Miranda) y Punto Fijo (estado Falcón), y cuyos sistemas de degradación se identificaron usando las siglas LT y PF, respectivamente. Además las películas (dimensiones, espesor) compuestas de Quitosano-glicerina se identificaron con la letra G con la finalidad de ver como influye el clima y demás factores ambientales a la degradación de las películas. En el lecho, a una profundidad de 5 cm, se enterraron las películas de quitosano (dos de cada tipo para cada sistema), y las compuestas con glicerina. Se le hizo un seguimiento a la degradación de las mismas mediante la medición de las siguientes variables:
Variación o pérdida de peso. La medida de la variación de peso, se realizó para determinar si las películas que fueron colocadas en degradación en un sistema de compostaje sufrían pérdida de masa. Esto se determinó mediante la pesada en una balanza (modelo Adventure Pro AV264, marca Ohaus Corporation, 0,0001 g de apreciación), de las películas antes y después de la degradación, y de esta forma, crear un registro en una hoja de cálculo que permitiera procesar los resultados obtenidos y determinar el porcentaje de pérdida de peso.
Estudios morfológicos. La inspección morfológica de la superficie degradada, en medio de compost, se realizó a través de MEB, para lo cual se empleó un microscopio electrónico de barrido marca Phillips, modelo S-500. Todas las muestras fueron recubiertas con oro, para crear una densidad electrónica en el material, ya que los polímeros carecen de la misma, y se utilizó un voltaje de 10 KV para evitar dañar las muestras durante su observación. Esto sirvió para observar a nivel microscópico la superficie de las películas degradadas tanto en el compost de Punto Fijo, como en el de Los Teques, y así poder apreciar cualitativamente diferencias en la degradación de ambos medios.
RESULTADOS Y DISCUSIÓN
Extracción de quitina (QA) de las conchas de camarón L.vannamei
Características y rendimiento de las quitinas extraídas. La extracción de la quitina de las conchas de camarón se efectuó siguiendo las metodologías descritas (Peniche, 2006; Li et al. 1997; Muzzarelli, 1973), donde las principales variables en estudio fueron el tiempo del proceso y las relaciones sólido/líquido. El protocolo de extracción se muestra en la tabla 1.
Tabla 1. Procedimientos empleados para la extracción de la quitina.
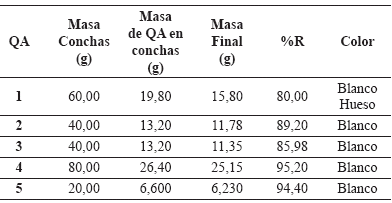
A su vez los resultados obtenidos se presentan en la tabla 2.
Tabla 2. Resultados de la extracción de quitina (QA) de conchas de camarón L.vannamei. de Los Teques, y así poder apreciar cualitativamente diferencias en la degradación de ambos medios.
El porcentaje de rendimiento de la extracción de quitina de las conchas de camarón, se calculó suponiendo que el contenido de quitina en las conchas de camarón era de 33%, debido a que poseen un valor teórico que varia entre 14% y 33% (Márquez et al. 2006; Li et al. 1997), dando como resultado que los porcentajes de rendimiento se encuentran entre 80 y 95,2%.
Sin embargo, se puede apreciar que los rendimientos obtenidos para QA1 y QA3 son los más bajos, esto se debe a que fueron sometidos a procesos de desproteinización y desmineralización más severos que los otros (tabla 2). También se aprecia que QA1 es menos blanco que el resto, debido a que la despigmentación se realizó usando sólo etanol como agente de extracción de los pigmentos (Axtasantina, β-Carotenos, etc.), a diferencia de las otras muestras, las cuales se blanquearon con hipoclorito de sodio o mezclas de hipoclorito de sodio/etanol.
La acción del hipoclorito como agente blanqueador ayuda a mejorar el proceso de decoloración, sin embargo, se debe tener cuidado con su uso, ya que se ha reportado que puede ocasionar modificaciones en la morfología de la quitina (Peniche, 2006).
Caracterización de la quitina QA. Mediante los espectros FTIR obtenidos, se lograron ver las bandas características de los grupos funcionales de la QA.
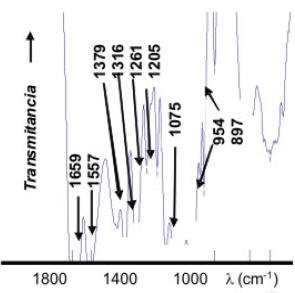
Si bien se obtuvieron espectros para cada una de las quitinas extraídas, en la figura 1 se presenta un espectro característico que corresponde a la muestra QA1, en la zona de huella dactilar.
Figura 1. Espectro IR de la muestra de QA1.
Se puede apreciar en dicha figura, la formación de las señales características del modo Amida I entre 1654 cm-1 y 1659 cm-1, mientras que para el modo Amida II se obtuvieron valores entre 1557 cm-1 y 1562 cm-1, los cuales coinciden con los valores reportados por Castillo et al. (2003), garantizando así la efectividad en el proceso de extracción aplicado para la quitina.
El origen de la banda a 3270 cm-1, aunque corresponde al enlace –NH, no se logró identificar plenamente, debido a que en esta zona prevalecen las señales del grupo –OH. Sin embargo, las señales de los otros grupos funcionales si permiten caracterizar la estructura molecular esperada para una película de quitina.
Obtención y caracterización del quitosano (QN) mediante desacetilación termoalcalina de la quitina extraída de las conchas de camarón
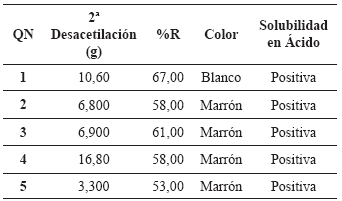
Síntesis del quitosano. En la tabla 3 se presentan los resultados y observaciones obtenidos en el proceso de desacetilación de la quitina.
Tabla 3. Resultados y observaciones de la desacetilación de quitina.
Como se observa en dicha tabla, el rendimiento de la desacetilación de la QA, para sintetizar el QN, está entre el 53 y el 67%.
Los rendimientos obtenidos están cercanos a los reportados por Peniche (2006), quien registra valores alrededor de 70%. Además, se observó en el proceso de desacetilación, un cambio de la coloración en todas las muestras (desde QN2 a QN5), las cuales se tornaron de amarillento-marrón, a diferencia de QN1 que permaneció con su coloración blanca. Esto se debió a un posible proceso de oxidación que pudo ser ocasionado por la presencia de restos de pigmentos que reaccionaron con el hidróxido de sodio concentrado.
En la tabla 2 se puede apreciar que la QA1 obtuvo el menor rendimiento, lo que indica que a diferencia de las otras muestras se logró una mayor remoción de los otros componentes relacionados con la quitina nativa en las conchas de camarón (proteínas, minerales, lípidos y pigmentos).
Caracterización del quitosano sintetizado
Determinación del peso molecular viscosimétrico Mv. En la tabla 4 se presentan los resultados obtenidos del peso molecular viscosimétrico de los quitosanos sintetizados, una vez que se aplicó la ecuación de Mark-Houwins para su determinación (Márquez et al. 2006; Castillo et al. 2003).
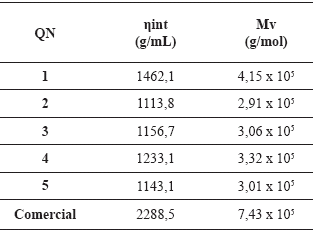
Tabla 4. Pesos moleculares viscosimétricos de los QN sintetizados y comercial.
En esta tabla se presentan los valores obtenidos de la viscosidad intrínseca y los pesos moleculares de cada polímero, los cuales se encuentran entre 2,91 x 105 y 4,15 x 105 g/mol para los QN sintetizados y de 7,43 x 105 g/mol para el QN comercial. Estos valores están en el rango del peso molecular teórico del quitosano, ya que se han reportado valores que varían entre 1 x 105 y 1,2 x 106 g/mol (Márquez, 2006; Khor & Lim, 2003; Peniche, 2006).
A partir de los Mv obtenidos los quitosanos se pueden clasificar en quitosanos de masa molecular baja, media y alta (Muzzarelli, 1973). Los pesos moleculares de QN2 hasta QN5 son considerados bajos, a diferencia de QN1 que presenta una masa molecular que puede ser considerada como mediana, en comparación con el QN comercial, el cual presenta una alta masa molecular.
La diferencia entre las masas moleculares obtenidas, se produjo por despolimerización parcial de los quitosanos, la cual pudo ser ocasionada porque los tratamientos químicos a los cuales fueron sometidas las conchas de camarón para extraerle la quitina, se llevaron a cabo en atmósferas con presencia de oxigeno; esto puede propiciar la despolimerización de la quitina y por consiguiente se obtienen quitosanos con menores pesos moleculares (Muzzarelli, 1973).
Sin embargo, estas diferencias son interesantes desde el punto de vista tecnológico ya que son compuestos con masas moleculares muy altas, y dependiendo de su aplicación se puede variar las mismas, por ejemplo, como un polielectrolito para tratamiento de agua, o como emulsificante en la industria de alimentos mejoran sus funciones de forma proporcional con el aumento de sus masas moleculares, por otro lado en la formación de películas, masas moleculares bajas mejoran la calidad de las mismas.
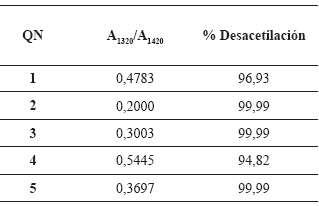
Determinación del grado de desacetilación. El grado de desacetilación de los QN sintetizados, se calculó usando los espectros infrarrojos de cada muestra, a partir de las absorbancias medidas a 1320 cm-1 y a 1420 cm-1; con esto valores se utilizó la curva de calibración dada por Brugnerotto et al. (2001). La importancia de usar esta curva de calibración recae en el hecho de que la misma fue construida a partir de diversas técnicas analíticas cualitativas y usando varios tipos de quitosano, lo cual le imparte cierta confiabilidad al momento de considerarla para estimar los grados de desacetilación alcanzados (Castillo et al. (2003). Los valores obtenidos se muestran en la tabla 5.
Tabla 5. Grado de desacetilación de los QN sintetizados.
Como se aprecia en la tabla 5, aunque los porcentajes alcanzados con una desacetilación en una sola etapa están entre 75 y 85 %, se sabe que cuando se lleva a cabo en dos o más etapas la desacetilación termoalcalina podría aumentar (Peniche, 2006; Brugnerotto et al. (2001).
Obtención de películas en base a quitosano QN. En la figura 2 se presenta la apariencia de las películas de QN plastificado y sin plastificar. Las diferencias en el aspecto de la película de QN1 con respecto al resto, se puede atribuir a una consecuencia en el proceso de desacetilación, ya que en todas las quitinas desacetiladas se llevó a cabo un proceso de oxidación ocasionado por el hidróxido de sodio concentrado. En el caso de la quitina 1 (QA1), este proceso de oxidación podría estar relacionado con la presencia de pigmentos que no fueron extraídos en el proceso de decoloración de la quitina, o a la presencia de rastros de hipoclorito de sodio, como se explicó anteriormente, tornándose así una coloración oscura (marrón) al momento de desacetilar, lo cual pudo afectar la apariencia del producto obtenido. Por otro lado, la textura rugosa de las películas obtenidas con el QN1, se generó por la baja solubilidad del quitosano en la solución de ácido acético diluido, por lo que el empaquetamiento de las cadenas al momento de la evaporación del solvente posiblemente no se dio de forma homogénea, por lo que presenta este aspecto rugoso y de separación de fase. La baja solubilidad de QN1 en solución de ácido acético, se debe a que el f mismo presentó un grado de desacetilación menor (tabla 5), en comparación de los otros QN, por lo que el grado de desacetilación del quitosano afecta su solubilidad en los buenos solventes que se puedan encontrar para este polisacárido (Karlsson & Albertsson, 1998).
Figura 2. Comparación entre películas: (a) Película de QN1; (b) Película de QN5.
Como el QN comercial presentó características similares en disolución que QN1, y ambos presentan altos pesos moleculares en comparación con las otras muestras, se cree que a medida que aumenta el peso molecular del quitosano, la solubilización se disminuye (Aslan et al. 2000), debido a que se produce un mayor enredo molecular lo que puede disminuir el efecto del solvente para solvatar el soluto (QN), sin embargo si el peso molecular es muy bajo (oligómeros), la formación de películas también se vería afectada.
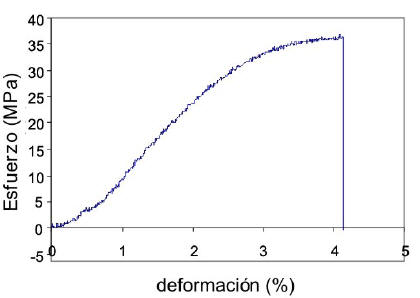
Caracterización mecánica de las películas de quitosano. La caracterización mecánica de todas las películas de QN y QN plastificado con glicerina, se realizó en una máquina de ensayos mecánicos con una celda de 100 N a una velocidad de ensayo de 5 mm/min. Los resultados obtenidos demuestran que el Quitosano forma películas de alta rigidez, debido a que los gráficos obtenidos de esfuerzo vs. deformación, muestran una alta resistencia a la deformación, al aplicarse grandes esfuerzos a la probeta (Martínez et al. 2008). Esto puede apreciarse de mejor manera en la figura 3, donde se presenta el grafico obtenido para el ensayo tensil de QN3.
Figura 3. Curva esfuerzo vs deformación de películas de QN3 (puro).
En dicha figura, se aprecia como para un esfuerzo a la ruptura (σruptura) de 36 Mpa se produce solo un porcentaje de deformación del 4% y un Módulo de Young de 210 Mpa. Esto indica que su comportamiento mecánico corresponde a un material rígido y frágil.
No obstante, los materiales hechos a base de quitosano, pueden experimentar mejoras con respecto a su rigidez, al combinarse con otros polímeros (Correlo et al. 2005; Cárdenas et al. 2002; Martínez et al. 2008; Castillo et al. 2003; Karlsson & Albertsson, 1998 o con plastificantes (Márquez et al. 2006; Martínez et al. 2008; Shu et al. 2001), que le otorguen unas mejores propiedades mecánicas, respecto a su rigidez y su consecuente fragilidad.ç
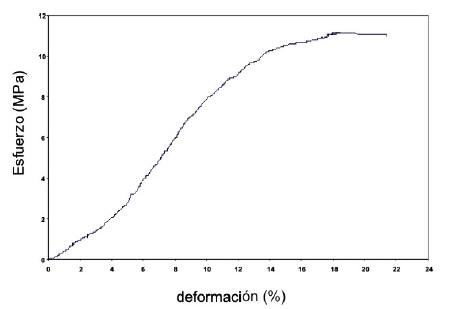
En la figura 4 se muestra la curva esfuerzo vs. deformación, para una película de QN3 mezclada con glicerina.
Figura 4. Curva esfuerzo vs deformación de películas de QN3 plastificado.
En dicha figura, se observa como el esfuerzo a la ruptura (σruptura), disminuyó considerablemente desde 36 Mpa hasta 13.5 Mpa, mientras que el porcentaje de deformación aumentó desde 4% para una película de QN puro hasta un 27% para la película de quitosano plastificada. También presenta una disminución del 50% en el módulo de Young o módulo elástico (hasta 110 Mpa). Todo ello indica que el material al estar plastificado reduce su rigidez, tal y como lo demuestra el comportamiento mecánico obtenido, sin embargo se mantiene el comportamiento rígido al no generarse el punto de fluencia característico de un material dúctil.
Por otro lado, el aumento en la elasticidad de las películas de quitosano plastificadas en relación con aquellas elaboradas solo con quitosano, le otorgan una mayor funcionalidad a estas películas en sus posibles aplicaciones como membranas, films, etc. (Márquez et al. 2006; Li et al. 1997; Aslan et al. 2000; Cervera et al. 1996).
Evaluación de la biodegradabilidad en compost de las películas poliméricas obtenidas
Para el seguimiento de la degradación se siguió la variación de varios parámetros, entre los que se encuentra la pérdida de masa y la morfología.
La figura 5 muestra la apariencia de las películas de quitosano puro degradadas en el compost de Los Teques, donde se puede apreciar que la degradación es bastante agresiva para un tiempo de tan solo 8 días (192 h), sin embargo, fue necesario analizar la influencia del tipo de película y compost en la velocidad de degradación.
Figura 5. Apariencia de películas degradadas en compost de Los Teques.
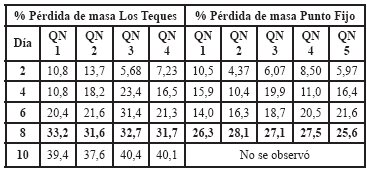
Pérdida porcentual de masa. Una vez que las muestras fueron desenterradas, se limpiaron cuidadosamente para no dañar su estructura, luego se lavaron cuidadosamente y se envolvieron en papel filtro para que se secaran, y finalmente fueron pesadas hasta obtener el peso constante. Los resultados se resumen en la tabla 6.
Tabla 6. Pérdida porcentual de masa de películas de quitosano puro degradadas en compost.
Como se observa en dicha tabla, la degradación medida cuantitativamente (disminución de la masa) de las películas de quitosano puro degradadas en compost, se alcanzó con mayor rapidez en las películas que se degradaron en Los Teques ya que si se observan los porcentajes al octavo (8º) día de degradación, en Los Teques son superiores a los obtenidos en Punto Fijo en el mismo período.
Esta diferencia en la velocidad de degradación de las películas en los diferentes compost se debe a la diferencia de humedad, temperatura, presencia de diversas poblaciones de microorganismos y tipo de tierra, por lo que es factible que en un ambiente como el de Los Teques con una alta humedad y bajas temperaturas, la proliferación de colonias de microorganismos en el compost se vio favorecida (Martínez et al. 2008). Todo lo contrario ocurrió en Punto Fijo.
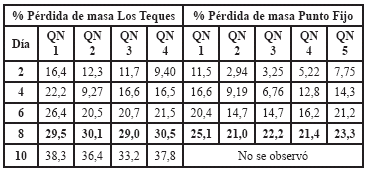
Como se aprecia en la tabla 7, en la degradación de las películas de quitosano compuestas con glicerina se mantiene la diferencia en las velocidades de degradación con respecto al tipo de compost y su ubicación.
Tabla 7. Pérdida porcentual de masa de películas de QN con glicerina degradadas en compost.
Por otro lado se puede ver que la velocidad de degradación se ve ligeramente disminuida por la presencia del aditivo (glicerina), pues podría considerarse que la glicerina solvata las moléculas de éste, dándole mayor estabilidad a las redes poliméricas que forman las películas y a su vez las protege en cierta medida al ataque de microorganismos y otros elementos que generen la degradación de las películas, lo cual implica que está actuando como un aditivo antifúngico.
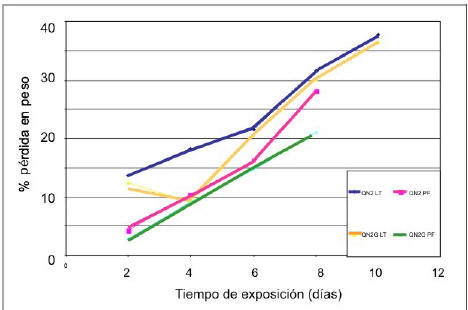
Con el fin de establecer una comparación de los distintos sistemas trabajados (tipo de película-compost). En la figura 6 se muestran los resultados sólo para la muestra QN2, debido a que las otras muestras presentaron tendencias similares. En ella se puede apreciar la diferencia en la degradación, así la curva que alcanza un mayor porcentaje en la pérdida de masa pertenece a la degradación de la película de QN2 puro en el compost de Los Teques (QN2 LT), y aquella que tiene menor pérdida porcentual de peso viene dada por las películas compuestas de quitosano 2 más glicerina, degradadas en el compost en la zona de Punto Fijo (sistema QN2G PF).
Figura 6. Pérdida porcentual de masa de las películas de QN2 degradadas en los distintos sistemas descritos (QN LT, QNG LT, QN PF y QNG PF).
Caracterización morfológica. La figura 7 ayuda a comprender con mayor amplitud las características morfológicas de las películas de quitosano obtenidas a tiempo cero (t0). Si se observa la morfología de QN1, se nota la diferencia en la textura de ésta en comparación con las superficies de las otras películas, ya que la misma presenta una textura altamente rugosa, y las demás poseen superficies lisas. Patrón característico que ya se observó a nivel macro y cuyas posibles razones fueron explicadas anteriormente. Para el estudio de la morfología de las películas degradadas, se muestran las imágenes obtenidas a través del microscopio electrónico para cada sistema de degradación.
Figura 7. Morfología de las muestras de las películas de QN a tiempo cero (t0): (a) QN1; (b) QN2; (c) QN3; (d) QN4; (e) QN5.
Las micrografías presentadas en la figura 8, muestran las superficies degradadas de las películas de QN1, tanto en el compost de Punto Fijo, como en el de Los Teques. Se puede apreciar la diferencia en la agresividad de la degradación en las degradadas en el compost de Los Teques en comparación de la superficie de aquellas películas degradadas en Falcón.
Figura 8. Morfología de las películas de QN1 degradadas en compost durante 10 días en diferentes medios: (a) Punto Fijo; (b) Los Teques.
Como se observa en la figura 8, las películas degradadas en el compost de Falcón tienen una superficie muy parecida a la de tiempo cero (figura 7), lo que indica que la degradación no se dio o fue ligera, no obstante, se sabe que hubo pérdida de masa por el seguimiento que se le hizo a esta variable en pruebas anteriores. En el detalle de esta imagen con una magnificación, se apreció una especie de gránulo, esto no es más que material no solubilizado al momento de preparar la película, este efecto es el que impide una superficie más uniforme de las películas preparadas con QN1.
Con respecto a las películas degradadas en el compost de Los Teques, éstas presentaron un grado de degradación superior a las degradadas en Punto Fijo, presentando formación de microgrietas y/o microcavidades (Martínez et al. 2008), las cuales se originan por efecto de la actividad fúngica de microorganismos (Márquez et al. 2006; Martínez et al. 2008). Las divergencias en las velocidades de degradación se generan por las diferencia del medio ambiente (temperatura, humedad, pH del suelo, etc.), al cual pertenece el compost, debido a que en Los Teques existe una mayor humedad y menores temperaturas, originando la proliferación de colonias de microorganismos f más acelerada, por lo que la velocidad de degradación es mayor en este ambiente. No obstante, a mayor temperatura, como es el caso de Punto Fijo, se debe propiciar una degradación de carácter térmico, solo que la misma es más lenta, y la ausencia de humedad en el suelo, podría limitar el crecimiento de los microorganismos y producir una actividad biológica lenta. A continuación, en la figura 9 se presenta la morfología de las películas de quitosano degradadas en los dos compost para un tiempo máximo de exposición a los mismos.
Figura 9. Morfología de películas de quitosano degradadas en compost de Los Teques: (a) QN1; (b) QN2; (c) QN3; (d) QN4; y Falcón: (e) QN1; (f) QN2; (g) QN3; (h) QN4; (i) QN5; durante 10 días con una magnificación de 326X.
En la figura 9 se observa claramente como las películas degradadas en el compost de Falcón poseen una superficie bastante lisa parecidas a las de tiempo cero (t0), caso contrario sufren las películas degradadas en compost de Los Teques. Especialmente, las películas de QN3 y QN4 presentaron una superficie rugosa y erosionada con presencia de microgrietas y microporos. Sin embargo, las películas de quitosano degradadas en Falcón no presentaron evidencias de degradación superficial. No obstante, cabe destacar que todas estas películas eran muy sensibles al haz de electrones del microscopio en comparación con la muestra control (muestra sin degradar), por lo que se tuvo que reducir el voltaje usado para su observación. Las muestras degradadas en la zona árida (Punto Fijo), al momento de su observación al MEB, presentaron la formación de burbujas o ligeros hinchamientos de las muestras. Todo ello es indicativo de que las películas se podrían encontrar en una etapa inicial dentro del proceso degradativo y debido a eso, las muestras eran fácilmente afectadas por el haz de electrones, comparado con el quitosano original a tiempo cero (t0).
CONCLUSIONES
Se logró extraer quitina de conchas de camarón, por método químico vía húmeda, cuyos rendimientos de extracción estuvieron entre el 80 y 95,2%, la cual luego fue desacetilada en dos etapas, para obtener quitosano, alcanzándose porcentajes de desacetilación de alrededor de 94 y 97% y con porcentajes de rendimiento entre 53 y 67%. La etapa inicial de desacetilación ocurrió de manera heterogénea, debido a que no se logró una alta modificación, por lo que en la segunda etapa se complementó dicha desacetilación, lográndose finalmente un proceso homogéneo que justifica los altos porcentajes reportados.
Adicionalmente, se logró determinar el peso molecular viscosimétrico (Mv) de los quitosanos, reportándose entre 2,91 x 105 y 4,15 x 105 (en comparación con el de un quitosano comercial ~ 7,43 x 105 ), así como también se prepararon películas en base a quitosano con buena apariencia física cuyas superficies eran lisas y con buenas texturas, a excepción de las elaboradas con el QN1 que formaron películas porosas y frágiles. Por otro lado, las películas compuestas de quitosano más glicerina, presentaron mejores propiedades mecánicas, que las de quitosano puro.
En cuanto a la degradación, las películas degradadas en Falcón presentaron una disminución en la velocidad de degradación con respecto a las degradadas en Los Teques de acuerdo al sistema evaluado, debido a las condiciones de humedad y posible ausencia o desactivación de microorganismos.
REFERENCIAS
1. Aslan, S., Calandrelli, L., Laurienzo, P., Malinconico, M., Migliaresi, C. (2000). Poly (D,L-lactic acid)/ poly(caprolactone) blend membranes: preparation and morphological characterization. J Mater Sci. 35. pp. 22-1615. [ Links ]
2. Brugnerotto, J., Lizardi, J., Goycoolea, F.M., ArgÜelles- Monal, W., Desbrières, J., Rinaudo, M. (2001). An infrared investigation in relation with chitin and chitosan characterization. Polymer 42. pp. 3569-3580. [ Links ]
3. Cárdenas, T.G., Sanzana, L.J., Inoccentini, M.L. (2002). Synthesis and Characterization of Chitosan-PHB Blends. Bol. Soc. Chil. Quím. 47(4). ISSN 0366-1644. pp. 529-535. [ Links ]
4. Castillo, V., Matos, M., MÜller, A.J. (2003). A new route towards the preparation of a biodegradable nanocomposite based on chitin whiskers from exoskeleton of shrimp and Polycaprolactone. Rev. Latin Am. Met. Mat. 23(2). pp. 12-19. [ Links ]
5. Cervera, M., Heinamaki, J., Krogars, K., Jorgensen, A., Guilbert, S. (1996). Food packaging and preservation. In: Mathlouthi, M. (ed). Theory and Practice in Technology and Application of Edible Protective Films. Elsevier Applied Science Publishing Co., London, England. pp. 371-394. [ Links ]
6. Correlo, V.M., Boesel, L.F., Bhattacharya, M., Mano, J.F., Neves, N.M. Reis, R.L. (2005). Properties of melt processed chitosan and aliphatic polyester blends. Material Science and Engineering A 403. pp. 57-68. [ Links ]
7. Karlsson, S. & Albertsson, A.C. (1998). Biodegradable Polymers and Enviromental Interaction. Polym. Eng. Sci. 38. pp. 8-15. [ Links ]
8. Khor, E. & Lim, L.Y. (2003). Implantable applications of chitin and chitosan. Biomaterials 24. pp. 2339-2349. [ Links ]
9. Lárez, C. (2003). Algunos usos del quitosano en sistemas acuosos. Revista Iberoamericana de Polímeros 4. pp. 91-109. [ Links ]
10. Li, J., Revol, J.F., Marchessault, R.H. (1997). Effect of Degree of Deacetylation of Chitin on the Properties of Chitin Crystallites. J. Appl. Polym. Sci. 65. pp. 373- 380. [ Links ]
11. Márquez, M., Martínez, G., Santoni, N., Matos, M., Arnal, M., MÜller, A.J., Rosales, C., Sabino, M., Ajami- Henríquez, D. (2006). Potencial uso de quitina y quitosano en materiales compuestos y nanocompuestos para aplicaciones biomédicas. Biomateriales, Polímeros Petroquímicos y sus Mezclas: Características y Nuevos Hallazgos. Editores: Marvelis Ramírez. CDCHT- ULA. Mérida, Venezuela. ISBN: 980-11-1003-1. pp. 227- 263. [ Links ]
12. Martínez, G., Matos, M., Sabino, M., Urbina, C., Barrios, C., Taddei, A., Castelli, C., Arnal, M., MÜller, A.J. (2008). Estudio de una mezcla binaria biodegradable: policaprolactona/quitina. Revista Iberoamericana de Polímeros 9. pp. 313-321. [ Links ]
13. Muzzarelli, R.A.A. (1973). Natural Chelating Polymers. Sidney, Braunchewig. First Edition (Oxford-New York-Toronto). pp. 215-281. [ Links ]
14. Nayak, P.L. (1999). Biodegradable Polymers: Opportunities and Challenges. J.M.S.-Rev. Macromol. Chem. Phys. C39. pp. 481-486. [ Links ]
15. Peniche, C. (2006). Estudios sobre Quitina y Quitosano. Universidad de la Habana. Facultad de Química. pp. 36-57. [ Links ]
16. Shu, X.Z., Zhu, K.J., Song, W. (2001). Novel pH-sensitive citrate cross-linked chitosan film for drug controlled release. International Journal of Pharmaceutics 212. pp. 19-28. [ Links ]