Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista de la Facultad de Ingeniería Universidad Central de Venezuela
Print version ISSN 0798-4065
Rev. Fac. Ing. UCV vol.26 no.4 Caracas Dec. 2011
Uso de películas de polianilina (PANI
) sobre aceros al carbonocomo protector contra la corrosión y sensor de hidrógenoAlejandra Oliva
*, Licel Codeghini*, Rosdely Quiroz*, Adalberto Rosales**
Laboratorio de Corrosión, Departamento de Ciencias de los Materiales, Universidad Simón Bolívar, Apdo. 89000, Caracas 1020A, Venezuela e-mail: alejandracarolinao@gmail.comRESUMEN
Se realizó la electrodeposición de polianilina (PANI) sobre láminas de acero al carbono (AISI 1010) con la finalidad de estudiar el comportamiento de dicho recubrimiento como posible sensor de hidrógeno y protector contra la corrosión. La deposición se realizó empleando la técnica de voltametría cíclica (VC), en una solución acuosa de ácido oxálico 0,3 M con 0,1 M de anilina. Se obtuvieron recubrimientos de PANI después de 15 ciclos en su forma reducida (emeraldina, de color verde) y de 15,5 en su estado oxidado (pernigranilina, de color azul oscuro). Usando la técnica clásica de Devanathan-Stachursky se estimó el flujo de hidrógeno que permea a través de la lámina de acero. Para evaluar al recubrimiento de PANI como sensor de hidrógeno se utilizó sólo el lado catódico de la celda de permeación, dejando libre el lado recubierto. Así se podía hacer seguimiento a los posibles cambios de color en la película de PANI durante la permeación de hidrógeno. La película mostró una gran potencialidad como sensor al apreciarse cambios en su coloración, lo que indica la ocurrencia de cambios de estado de oxidación en presencia de hidrógeno. Para evaluar el recubrimiento como protector contra la corrosión, se realizaron ensayos electroquímicos de polarización potenciodinámica y de inmersión, ambos en una solución de 3,5% NaCl, en los cuales se encontró que el PANI protege catódicamente al acero y muestra un comportamiento aceptable durante cortos plazos de tiempo expuesto al medio.
Palabras clave: Sensor de hidrógeno, Inhibición de la corrosión, PANI, Voltametría cíclica, Permeación de hidrógeno.
Use of polyaniline films (PANI) on carbon steelas corrosion protector and hydrogen sensor
ABSTRACT
The electrodeposition of polyaniline (PANI) on carbon steel plates (AISI 1010) was performed in order to study the PANIs behavior as possible hydrogen sensor and corrosion protection. The deposition was obtained using a cyclic voltammetry technique (CV) in an aqueous solution containing 0.3 M oxalic acid and 0.1 M aniline. The PANI deposition on steel was achieved after 15 cycles, to obtain its reduced state (Emeraldine, green) and 15.5 cycles to obtain its oxidized state (Pernigraniline, blue). Hydrogen permeation tests were carried out on steel sheets by the classical Devanathan-Stachursky technique to estimate the flow of hydrogen which diffuses through the steel. For the evaluation of PANI coating as a sensor the cathodic half of permeation cell was used. This permitted to follow possible changes in color of PANI during hydrogen permeation. The PANI coating showed a great potential as hydrogen sensor, experimenting changes in color due to its variation in oxidation states due to the presence of diffused hydrogen atoms. PANI was evaluated as corrosion protector using electrochemical techniques: potentiodynamic polarization and immersion, both of them in 3.5%NaCl solution. The PANI coating protected the steel cathodically, and it had an acceptable behavior during immersion, at least in the short period of evaluation.
Keywords: Hydrogen sensor, Corrosion inhibition, PANI, Hydrogen permeation, Cyclic voltammetry.
Recibido: diciembre de 2010 Recibido en forma final revisado: agosto de 2011
INTRODUCCIÓN
Durante muchos años y en la actualidad el daño por hidrógeno ha sido una de las grandes problemáticas industriales, porque dicho daño afecta el proceso de elaboración, fabricación y servicio de los aceros, especialmente en la industria siderúrgica y petroquímica, entre otras.
El daño por hidrógeno, está asociado con el deterioro mecánico y estructural causado por la interacción del hidrógeno con el metal, cuando se produce la reacción de evolución de hidrógeno (HER) en hierro y aceros en ambientes acuosos ácidos (Ng, 2001; Nj, 1956). Dicho daño en los aceros al carbono resulta de la absorción del hidrógeno atómico (H), el cual puede permanecer libre en la matriz (difundible) o acumularse en sitios preferenciales como: la intercara entre la matriz y las inclusiones no metálicas, precipitados, zonas de segregación y defectos microestructurales, entre otros (NJ, 1956; CHARCA, 2005). Este fenómeno podría ocasionar agrietamiento, ampollamiento o fragilización en el material, lo que conduciría a una modificación de las propiedades mecánicas del metal, tales como la ductilidad y tenacidad; debido a la difusión, concentración de esfuerzos internos/externos, procesos de relajación y a las altas presiones generadas por el hidrógeno molecular dentro de la matriz metálica (Lunarska et al. 1997; Rodríguez, 2003).
La Polianilina (PANI) es uno de los polímeros conductores electrónicos más estudiados en la actualidad debido a su notable estabilidad química, térmica y ambiental (Arias, 2007); tiene también una alta conductividad y se puede obtener usando métodos sencillos y económicos. Otra característica de la película de PANI es su capacidad de cambiar de color y de conductividad al experimentar variaciones en su estado de oxidación, propiedad que ha despertado considerable atención para su aplicación en la elaboración de dispositivos electrónicos (Arias, 2007; Echevarría et al. 2003). El PANI también se ha estudiado en numerosas investigaciones como recubrimiento protector contra la corrosión de los aceros (Özyilmaz et al. 2005; Lu et al. 1995; Deberry, 1985). En la mayoría de los ensayos, las muestras con el revestimiento, fueron expuestas a diferentes medios corrosivos y se evaluaron mediante la inspección visual dando como resultado una buena protección del acero. La polianilina actúa como un catalizador en la formación y la constante renovación de la capa de protección durante el ataque corrosivo (Huerta-Vilca et al. 2003). En un estudio previo del PANI sobre acero al carbono se corroboró su aplicación como protector a la corrosión del acero en medios salinos, mediante ensayos electroquímicos y de inmersión (Oliva et al. 2009). En conjunto parece como si la capa de óxido de metal, en combinación con la capa de PANI, son las responsables de la protección contra la corrosión (Lu et al
. 1995; Deberry, 1985).Debido a lo expuesto sobre las posibles propiedades protectoras de la polianilina, sus cambios de color debido a
sus distintos estados de oxidación y al interés que ha surgido en el campo de la investigación sobre dicho polímero, en el presente trabajo se estudiará la potencialidad de la película polimérica de polianilina como sensor de hidrógeno, debido a que responde de diferentes maneras físicas, entre ellas el cambio de color, ante la presencia de hidrógeno atómico. Adicionalmente, se evaluará a la película de PANI como un protector contra la corrosión del acero.MATERIAL Y MÉTODOS
Tipos de muestras, dimensiones y preparación
En todos los ensayos se empleó acero al carbono AISI 1010. Para los ensayos de permeación de hidrógeno y en la evaluación de PANI como sensor se emplearon probetas de 8 cm x 3,5 cm x 0,05 cm; y probetas de 1 cm
2 de áreas en los ensayos de polarización potenciodinámica. En los ensayos de inmersión las dimensiones expuestas de las probetas fueron de 8 cm x 1 cm x 0,05 cm. Todas las muestras se desbastaron con papel de carburo de silicio (SiC) desde grado 80 hasta grado 600. Posteriormente se lavaron con agua destilada, acetona y se secaron con aire caliente. Todos los ensayos se realizaron a temperatura ambiente.Ensayo de permeación de hidrógeno
La permeación de hidrógeno se empleó para poder estimar el flujo de hidrógeno que difunde a través de la lámina de acero desnuda, a fin de estimar la cantidad de hidrogeno que interactuará con la película de PANI. Para ello se utilizó la técnica de Devanathan–Stachursky; el montaje y consta de dos semiceldas de vidrio unidas entre sí con piezas de teflón, las cuales sostienen al electrodo de trabajo entre
ellas.En la semicelda anódica se usó una solución de NaOH 0,1 M, y en la semicelda catódica se empleó una solución de H2SO4 0,1 M con 15 ppm de meta-arsenito de sodio (Na2AsO4), el cual actúa como promotor de la entrada de hidrógeno en el acero y como inhibidor de la corrosión. Del lado anódico, se utilizó un potencial de polarización +150 mV vs. un electrodo de Calomel Saturado ECS a través de un potenciostato AMEL modelo 2049, conectado a un
multímetro Agilent modelo 34401A, que se utilizó para adquirir datos con el software IntuLink®. De este modo se podía apreciar la estabilización de la corriente base y la corriente de permeación. Del lado catódico, se utilizó un potencial de polarización de -900 mV vs. ECS mediante un potenciostato Microstat Sycopel Scientific LTD. A este potencial catódico se genera el hidrógeno que va a difundir a través de la membrana de acero. A esta lámina se le colocó paladio en la superficie expuesta al lado anódico, con el fin de proteger el acero de la corrosión y así evitar la formación de productos de corrosión que impidan el flujo de hidrógeno a través de la membrana. La estabilización de la corriente base se encontró después de una hora, alcanzando un valor de 500 nA/cm2, aproximadamente. La carga de hidrógeno se realizó por un período de 45 min, durante los cuales se registró la corriente anódica hasta su estado estacionario. Finalmente, se obtuvo la curva de permeación de hidrógeno a través de la lámina de acero. Dicho experimento se realizó por triplicado para evaluar su reproducibilidad.Electrodeposición de PANI
La electrodeposición de PANI sobre las láminas de acero se realizó mediante la técnica de voltametría cíclica (VC), utilizando una solución de ácido oxálico 0,3 M y anilina 0,1 M. El montaje se llevó a cabo en una celda electrolítica de tres electrodos, construida en plexiglás: en la cual el electrodo de trabajo corresponde a láminas de acero AISI 1010, el electrodo de referencia de calomelano saturado (ECS) y un contraelectrodo de acero inoxidable AISI 304. Dicha celda fue conectada a un potenciostato PARC 173, a un convertidor de datos Picolog ADC-16 y un generador de señales marca Elscint modelo ABA-26. Las láminas se prepararon de manera similar al caso de permeación. El voltragama se obtuvo a partir de un barrido cíclico de potencial desde -0,590 V vs ECS hasta 1,45 V vs ECS. Para obtener un recubrimiento de PANI en estado reducido (verde) se realizaban quince (15) ciclos voltamétricos, mientras que para PANI en estado oxidado (azul) se utilizaban 15,5; lo que indica que el fin del voltagrama era en el límite superior de potencial (1,45 V vs ECS). Sin embargo, para las pruebas del PANI como protector contra la corrosión se quiso evaluar su comportamiento a distintos espesores de recubrimiento, por lo cual se realizó la deposición a 10; 15; 15,5 y 20 ciclos de VC.
Utilización del PANI como sensor
Para realizar la evaluación del PANI como sensor al paso de hidrógeno, se utilizó solamente el lado catódico del montaje de permeación, para evitar que el polímero se degradara en la solución de NaOH, además del hecho de que el hidrógeno puede ser oxidado reduciendo el PANI, por lo que no se
registraría correctamente la corriente de permeación.El lado anódico de la probeta fue previamente recubierta con PANI. Esta cara de la probeta fue protegida para evitar el cambio de coloración por algún otro agente, como la luz solar. Del lado catódico, las conexiones y soluciones utilizadas fueron las mismas empleadas en permeación de hidrógeno. La película de PANI se estudió tanto en su estado reducido como oxidado. La evaluación del cambio de coloración se hizo de manera visual a diferentes intervalos de tiempo.
Utilización del PANI como protector
En la evaluación de las propiedades de la película de PANI como protector del acero ante la corrosión, se emplearon técnicas electroquímicas y de pérdida de peso, realizados en solución acuosa de cloruro de sodio, al 3,5% en peso aireada, a temperatura ambiente. Las técnicas electroquímicas consideraron medidas potenciométricas para medición del potencial a circuito abierto y polarización potenciodinámica, para evaluación de posibles cambios en la cinética de corrosión del material. En estos ensayos se utilizó una lámina de acero con y sin recubrimiento de PANI como electrodo de trabajo, un electrodo de calomel saturado como electrodo de referencia y contraelectrodos de grafito. La velocidad de barrido para las curvas de polarización fue de 10mV/min. Todo el sistema fue conectado a un potenciostato/galvanostato modelo Gamry PC4-750.
RESULTADOS
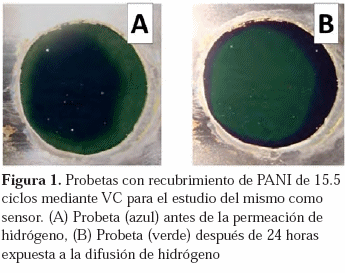
Utilizando a la película de PANI como sensor de hidrógeno que permea a través del acero, se registraron imágenes en las cuales se evidenciaban los cambios de coloración. En la Figura 1 se muestran láminas recubiertas con PANI para su estudio como sensor, antes y después de la permeación de hidrógeno, en las cuales se observa un cambio en la coloración de PANI de azul en la Figura 1.A a verde en la 1.B.
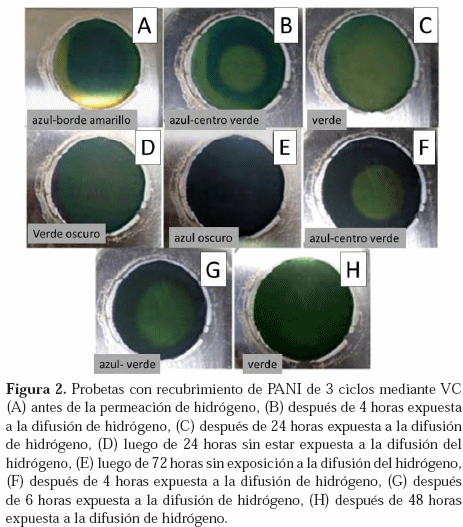
En la Figura 2 se presenta un registro fotográfico de los cambios de coloración en PANI durante el proceso de permeación. En ella se puede observar el cambio de coloración de la película de PANI al cargarla con hidrógeno; luego su exposición al aire sin carga de hidrógeno y finalmente sometida a carga de hidrógeno nuevamente. Para la realización de dicho registro se utilizó un recubrimiento de PANI de 3 ciclos de VC, con la finalidad de facilitar el cambio de coloración del mismo al interactuar con el hidrógeno que permea a través del metal.
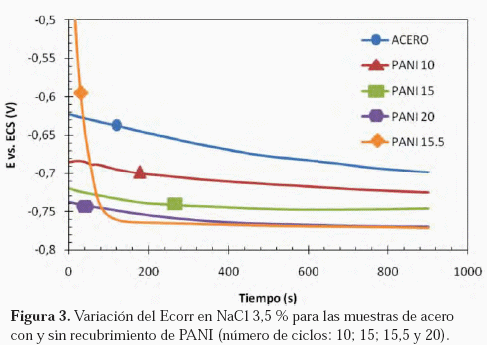
En cuanto a la evaluación del PANI como protector contra la corrosión y curvas de polarización. En la Figura 3 se muestra la variación del potencial de corrosión en el tiempo, al sumergir una probeta de acero sin recubrimiento y otras recubiertas con PANI a distintos espesores (números de ciclos en la VC).
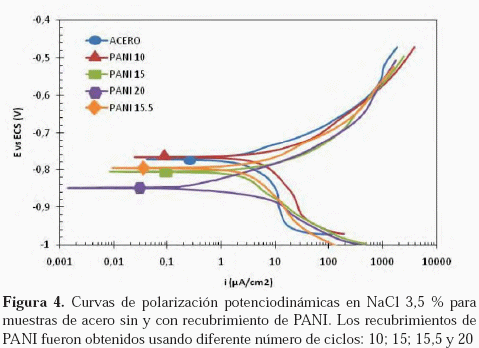
Los recubrimientos de PANI también fueron evaluados a través de las curvas de polarización y extrapolación de Tafel. Los resultados se muestran en la Figura 4.
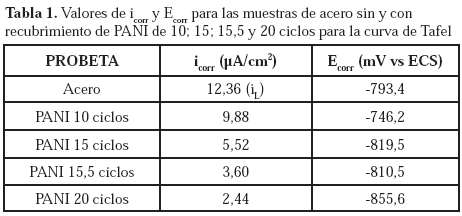
Los valores de la densidad de corriente de corrosión y los potenciales de corrosión, obtenidos de las curvas de polarización de la Figura 4, se muestran en la Tabla 1.
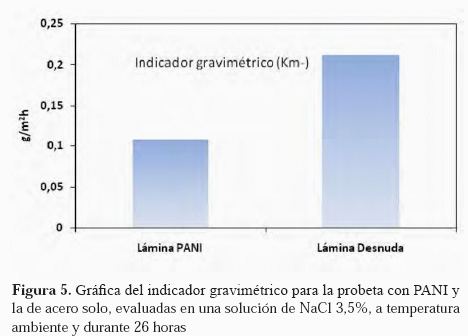
En la Figura 5 se presenta la pérdida de peso para 2 muestras, una de acero sin recubrimiento y la otra con una película de PANI de 15 ciclos, después de haber sido inmersas en la solución de NaCl 3,5% durante 26 horas. En la Figura 6 se muestran las imágenes de dicho montaje y los cambios
observados en la superficie y solución.DISCUSIÓN
Utilización del PANI como sensor de hidrógeno
Los cambios de estado de oxidación del PANI a través de reacciones de reducción u oxidación, que pueden apreciarse como cambios de coloración del polímero, pudieran ser aprovechados para la posible detección de hidrógeno atómico que permea a través de una lámina delgada de acero. Benítez (Benitez, 2002) mostró algunos ensayos preliminares en los cuales se aprecia el cambio de coloración de la película de PANI debido a su interacción con el hidrógeno que difundió a través de la lámina de acero.
Para evaluar la posibilidad del recubrimiento de PANI como sensor al interactuar con el hidrógeno que difunde a través de la lámina de acero, se usaron como base las condiciones empleadas en el estudio de la permeación de hidrógeno realizadas anteriormente (Benitez, 2002). La película de PANI fue utilizada en su estado más oxidado, es
decir, como pernigranilina, la cual es de color azul oscuro. La Figura 1 muestra las láminas de acero recubiertas con PANI antes y después de la permeación. Como se puede observar en la Figura 1(A), el recubrimiento de PANI tiene inicialmente dos regiones: una central de color azul oscuro y alrededor de esta una de color verde. Estas regiones corresponden a pernigranilina y emeraldina, respectivamente. Luego de aproximadamente 24 horas de permeación de hidrógeno, Figura 1(B), se aprecia un cambio de coloración de la región central del PANI, de color verde, indicando que el polímero se redujo en esta zona debido a su interacción con el hidrógeno. Así mismo, puede apreciarse que la región anular, inicialmente verde, se encuentra de color azul oscuro, lo que puede deberse a la interacción del polímero con el oxígeno del aire, como se explicará más adelante.Con la finalidad de estudiar los cambios de coloración durante el proceso de permeación, se hizo un registro fotográfico de la película de PANI, desde el inicio de la permeación. Posterior a esto, también se hizo un registro visual de los cambios que ocurrían al polímero en presencia solo del aire y, por último, se volvió a someter la misma lámina a la permeación de hidrógeno. Los resultados se muestran en la Figura 2. La Figura 2(A) muestra la coloración inicial de la película de PANI, presentando un centro azul oscuro (pernigranilina) y una región anular externa de color verde/ amarillo (emeraldina/leucoemeraldina), similar a la Figura 1(A).
Luego de someter la muestra a 4 horas de permeación, puede notarse en el centro de la Figura 2 (B) la aparición de una región circular de color verde. La localización de estos cambios coincide con el lugar por donde permea hidrógeno desde la cara opuesta de la lámina, sobre la cual ocurre la carga. Paralelamente, la región anular se torna de color verde. A medida que avanza el tiempo de permeación se pudo notar que el diámetro del círculo de la Figura 2 (B) aumentó progresivamente, hasta alcanzar casi la totalidad del diámetro de la película de polímero, después de 24 horas, tal y como lo muestra la Figura 2 (C). Esto sugiere que la difusión del hidrógeno que ocurre a lo largo y ancho de la lámina, hace que el polímero se reduzca al interactuar con el hidrógeno atómico.
Para mostrar la reversibilidad de los cambios en el PANI, se desmontó la muestra y se dejó expuesta al aire. Se observó que luego de 24 y 72 horas sin permeación de hidrógeno, la película de PANI vuelve a su estado oxidado (Figura 2, D y E, respectivamente), pasando por un color verde oscuro hasta llegar a un azul oscuro. Esto sugiere que existe una interacción del PANI con el oxígeno del aire, con el cual reacciona oxidándose. Después de más de 72 horas, cuando el polímero se encontraba en su estado más oxidado, se sometió la misma muestra nuevamente a permeación.
Después de 4 horas de permeación se volvió a observar el cambio de coloración a verde, en el centro (Figura 2 (F)). Este cambio de coloración también se fue extendiendo hasta cubrir todo el recubrimiento (Figura 6 (G) y (H), respectivamente). Sin embargo, este cambio no fue tan claro como el observado en la Figura 2 (A) a la (C) respectivamente, posiblemente por la degradación que pudo sufrir el polímero o la superficie del acero, oscureciendo a la película de PANI.
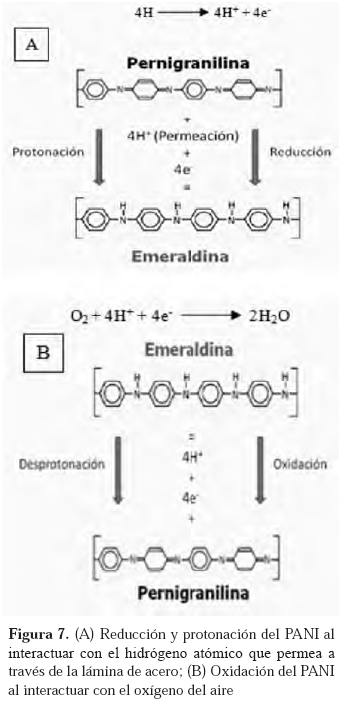
Para explicar los cambios de coloración mencionados, se proponen una serie de reacciones del PANI con el medio. En la Figura 7 aparece el esquema de la reacción que ocurre en el recubrimiento de PANI al interactuar con el hidrógeno y el esquema de la reacción que ocurre entre la polianilina y el aire al estar en contacto.
La primera reacción corresponde a la de reducción del PANI; es decir, cambios de color azul oscuro a verde. En las Figuras 1 y 2 se pudo apreciar cómo el recubrimiento de PANI sufre cambios de coloración al estar en contacto con el hidrógeno que permeaba a través de la lámina de acero. Esto ocurre debido a la difusión del hidrógeno a través del metal durante la permeación. El hidrógeno en forma atómica que atraviesa el metal y logra tener contacto con el polímero, se oxida. Esto hace que el PANI se reduzca y se protone, cambiando de pernigranilina a emeraldina como se presenta en la Figura 7 (A).
Por otro lado, la polianilina al estar en contacto con el aire interactúa con el oxígeno presente en el ambiente, oxidándose. Esto implicaría también un proceso de desprotonación. El PANI cambia de su estado reducido al oxidado de acuerdo a las reacciones que se sugieren en la Figura 7 (B).
En esta figura se muestra que el oxígeno toma los electrones del PANI e interactúa con los protones liberados para formar agua que pudiera quedarse absorbida o liberarse para formar parte de la humedad del ambiente.
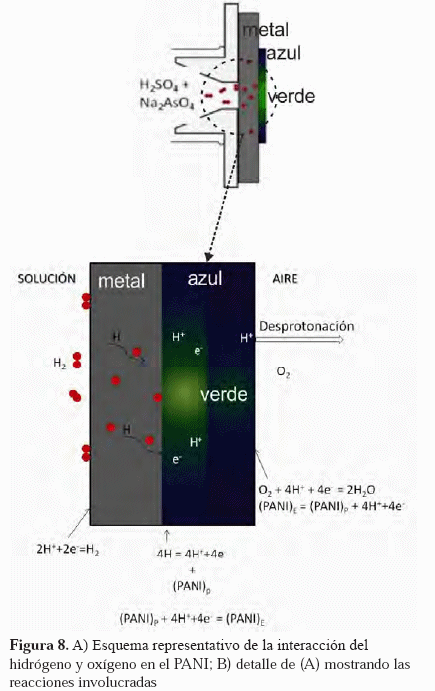
De acuerdo a las reacciones sugeridas en la Figura 7, debe existir una competencia entre ambas reacciones, cuando el PANI está recubriendo al acero que al mismo tiempo está siendo sometido a un proceso de permeación de hidrógeno. Dependiendo de la cinética de cada reacción se impondrá una o la otra. Esta competencia entre el hidrógeno y el oxígeno (Figura 8), puede presentar un retraso en la observación de los cambios de coloración del PANI que pudiera depender del espesor de la película del polímero. Es por ello que si la película de PANI es muy gruesa, debe dejarse un tiempo mayor; de hecho, en uno de los ensayos de permeación no se observaron cambios de coloración en la superficie del polímero a pesar del largo tiempo del ensayo. Parece entonces que es necesario películas delgadas para observar los cambios de manera más rápida, tal y como se observó en las Figuras 1 y 2.
La Figura 8 resume las reacciones que pueden estar ocurriendo cuando una lámina de acero recubierta con PANI es sometida a la permeación de hidrógeno. Puede observarse la ocurrencia de reducción del PANI y oxidación del hidrógeno en la intercara acero/PANI. Por otro lado, se puede observar la oxidación del PANI y reducción de oxígeno en la intercara PANI/aire.
PANI como protector contra la corrosión
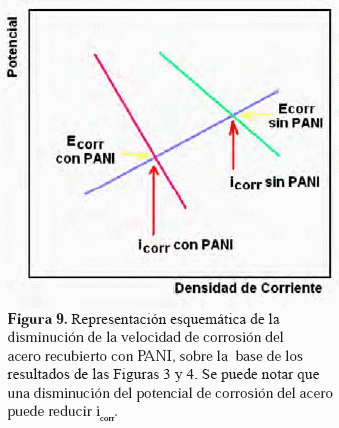
En la Figura 3 se muestran los potenciales de corrosión de las muestras de acero sin recubrimiento y con película de PANI después de 10; 15; 15,5 y 20 ciclos de VC. Puede observarse que el potencial de corrosión del acero sin recubrimiento, es más noble que para el caso de los aceros recubiertos con PANI. Para el caso de los aceros con PANI, puede apreciarse que a medida de que aumenta el espesor de la película de PANI el potencial se hace más negativo. La evidencia mostrada en dicha Figura (Ecorr vs. tiempo) muestra que el recubrimiento de PANI, de alguna forma está llevando al acero a potenciales más catódicos. En el caso del PANI a 20 ciclos, el potencial de corrosión cae alrededor de unos 100 mV por debajo del Ecorr del acero sin PANI. Esto sugiere o indica que el recubrimiento puede reducir la velocidad de corrosión como si se estuviese aplicando protección catódica, tal y como se representa es quemáticamente en la Figura 9, en la cual se muestra una curva fija para la oxidación del acero y una variable para la reacción de reducción, esta última mostrando el efecto de la disminución del potencial de corrosión. La reacción de reducción esquemática engloba la reacción de reducción del hidrógeno y del PANI simultáneamente (difícil de separar). Como se observó, el cambio de coloración del PANI corresponde a la formación de emeraldina (estado reducido del PANI).
Esta protección pudiera llevar al acero a su estado de inmunidad o simplemente reducir la velocidad de corrosión del mismo.
Un resultado interesante se muestra en la Figura 3, para el caso del acero recubierto con PANI después de 15,5 ciclos; en el cual el PANI se obtiene en su forma más oxidada (pernigranilina). En este caso se puede observar cómo el potencial de corrosión comienza en un potencial más noble que el del acero desnudo, cayendo rápidamente hasta alcanzar los valores de potencial del acero con PANI de 20 ciclos; potencial alcanzado después de 200 segundos de ensayo. Esto puede deberse a que la polianilina en su estado oxidado, al ser sumergido en una solución de NaCl, se reduce cambiando de pernigranilina (azul oscuro) a emeraldina (verde) en un tiempo relativamente corto, como consecuencia de la reducción del polímero al tomar los electrones del acero que se está corroyendo.
En la Figura 4, se puede observar que para el rango de potencial barrido, las curvas de polarización potenciodinámicas presentan un comportamiento similar: un comportamiento activo, en el cual los potenciales de corrosión son desplazados a valores más negativos, como se mostró esquemáticamente en la Figura 9. El desplazamiento del potencial del acero recubierto con PANI, hacia valores más negativos, se presenta gracias a que este recubrimiento corresponde a un polímero conductor eléctrico, permitiéndole cambiar sus estados de oxidación, presentándose más anódico que el acero a potenciales catódicos.
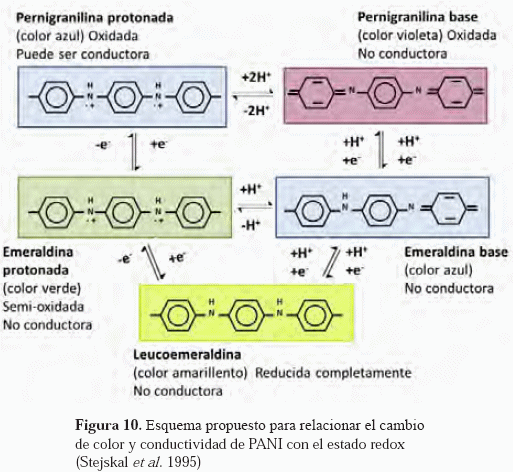
Sin embargo, las diferentes muestras presentan un comportamiento electroquímico del recubrimiento dependiente del número de ciclos empleados para la electrodeposición del PANI mediante voltametría cíclica. Es decir, la cinética catódica para el acero desnudo presenta un comportamiento mixto, tanto de polarización por activación como por concentración. Del mismo modo se observa para la muestra recubierta con PANI de 10 ciclos. Sin embargo, al aumentar el número de ciclos con los que se obtiene el recubrimiento de PANI sobre el acero, el control mixto de la rama catódica desaparece. Por otro lado, se obtiene un incremento en las cinéticas anódicas. Esto indica que la película de PANI influye tanto sobre la cinética catódica como anódica. Adicionalmente, debido a las características conductoras del PANI, puede esperarse que el polímero también responda a la polarización, proporcionando una respuesta cinética compuesta entre el acero y el polímero, este último puede cambiar de estado de oxidación, de acuerdo a las reacciones indicadas en la Figura 10.
Adicionalmente, aun teniendo en cuenta que las curvas de polarización presentadas en la Figura 4, corresponden a una respuesta cinética compuesta entre el acero y PANI, estas cinéticas muestran una disminución respecto al material desnudo. De aquí se puede establecer que el recubrimiento de PANI, produce un efecto protector sobre el acero. Esto se puede observar a partir de los datos extraídos de las curvas de polarización indicados en la Tabla 1, en la cual se puede notar que a medida que aumenta el número de ciclos disminuye la corriente de corrosión del acero, en consecuencia, la velocidad de corrosión; debido a dos efectos: el efecto barrera y el efecto de la reducción del PANI. El efecto barrera aumenta posiblemente por una disminución de la porosidad y el aumento del espesor, al aumentar la cobertura de la superficie del acero, al depositarse mayor cantidad de PANI. El efecto catódico se debe a la mayor cantidad de masa capaz de reducirse, haciendo más catódico el potencial de corrosión como lo muestra la figura 3. Como es de esperarse, estos resultados parecen indicar un efecto positivo del recubrimiento de PANI al aumentar la resistencia a la corrosión del acero.
El efecto protector del recubrimiento de PANI puede observarse a través de una medida más directa que no sea afectada por el comportamiento del polímero en los ensayos de inmersión. En la Figura 5 se presenta la pérdida de peso para 2 muestras: una de acero sin recubrimiento y la otra con una película de PANI de 15 ciclos. En esta Figura puede notarse que la pérdida de peso en la lámina recubierta con PANI es aproximadamente la mitad de la del acero desnudo después de haber sido expuestas a una solución salina durante 26 horas. Esto sugiere un efecto beneficioso del PANI como protector contra la corrosión. En próximas estudios se evaluarán tiempos más prolongados para conocer el comportamiento de estas películas de polianilina como protectoras contra la corrosión.
El estudio aquí presentado muestra que el PANI puede tener características protectoras de la corrosión, lo que resulta en una ventaja adicional para este recubrimiento, que además de presentar aplicaciones como sensor de hidrógeno, puede proteger de la corrosión. Es importante señalar que en la evaluación realizada del PANI como recubrimiento contra la corrosión, se consideró solamente tiempos cortos. Los resultados obtenidos sugieren que estas películas delgadas de PANI pudieran servir como protección temporal. Sin embargo, son necesarias evaluaciones a tiempos prolongados y pruebas de adherencia que permitan evaluar el correcto funcionamiento del recubrimiento. La Figura 6 muestra de manera cualitativa el comportamiento de la película de PANI en el ensayo de inmersión, ilustrando los cambios que puede sufrir el polímero. La Figura 6 (I) muestra las superficies del acero con y sin recubrimiento después de pocos segundos de haber sido sumergidas en la solución salina. En esta Figura se puede notar que la muestra de acero/PANI que se llevó a inmersión en su estado más oxidado (color azul oscuro, pernigranilina), cambió de estado (a un color verde, emeraldina) inmediatamente después de ser sumergida en la solución salina. Esto sugiere que el PANI pasó de pernigranilina a emeraldina, lo que implica un proceso de reducción. Este proceso pudiera ser el producto de las reacciones que se representan esquemáticamente a continuación:
Corrosión del acero: Fe = Fe2+ + 2e-
Reducción del PANI: PANIox + 2e- = PANIredEstas reacciones muestran que al inicio, la PANI pudiera facilitar el proceso de corrosión del acero, al tomar los electrones del mismo. No obstante, al completarse la reducción de PANI, no continuará facilitando el proceso corrosivo, sino que se convertirá en una barrera. Otro aspecto que se debe tener en cuenta, es la porosidad de la película de PANI y la ocurrencia de reacciones de corrosión en dichos poros, tal como muestra la Figura 6 II (A), en la cual se evidencia, debido a la coloración de la solución y la presencia de productos de corrosión sobre el recubrimiento y sobre el acero, que el proceso de corrosión puede ocurrir a través de los poros de la película y no se descarta la posibilidad de corrosión localizada.
El recubrimiento realizado se dejó lo suficientemente delgado para facilitar los cambios de color como consecuencia de su interacción con el hidrógeno que permea. A pesar de su morfología que se espera que sea muy abierta (porosa) debido a su método de síntesis: polimerización; la PANI resulta en recubrimiento protector de la corrosión, porque es capaz de disminuir las velocidades de corrosión a casi la mitad (Figura 5). Esto resulta particularmente importante si al sistema que se desea evaluar en cuanto a la posible permeación de hidrógeno, se le ha tenido que remover el recubrimiento anticorrosivo. En este caso, el metal no quedaría desprotegido, expuesto a los agentes corrosivos.
Para mejorar su efecto protector se puede tratar de mejorar la calidad del recubrimiento: reducir su porosidad, agregar algunos aditivos, mejorar su adherencia, entre otros. Lo que se está mostrando en el trabajo es su potencial uso como recubrimiento protector, diferente a los convencionales debido a que actúa como un recubrimiento de sacrificio al hacer más negativo el potencial de corrosión del acero.
CONCLUSIONES
La polianilina cambia a su estado reducido y protonado debido al hidrógeno, mientras que se oxida y desprotona por efecto del oxígeno; por lo cual el recubrimiento de PANI mostró una gran potencialidad como sensor al apreciarse cambios en su coloración, lo que indica la ocurrencia de cambios de estado de oxidación en presencia de hidrógeno.
El PANI muestra ciertas características protectoras que pudieran ser explotadas en la protección del acero en ciertas aplicaciones. Por ser un polímero conductor su comportamiento es diferente al de los recubrimientos orgánicos convencionales. Los experimentos preliminares mostrados en este trabajo indican que el PANI pudiera proteger catódicamente al acero, tal y como lo muestra el desplazamiento hacia potenciales más negativos del potencial de corrosión. Los ensayos de inmersión muestran una disminución de la pérdida de peso, al menos para ensayos cortos, alrededor de las 26 horas.
Agradecimientos
Los autores agradecen a la Universidad Simón Bolívar, al Decanato de Estudios Profesionales por el financiamiento y al Laboratorio de Corrosión por haber prestado sus instalaciones para el desarrollo de la presente investigación.
REFERENCIAS
1. A
rias, J. (2007). Síntesis y caracterización de polímeros conductores basados en anilinas sustituidas y su aplicación en electrocatálisis. Trabajo de Doctorado, Facultad de Ciencias, Departamento de Química Física, Universidad de Alicante, España. [ Links ]2. B
enítez, L. (2002). Permeación de hidrógeno en acero al carbono con recubrimientos de polianilina como sensor. Tesis de grado no publicada. Universidad Simón Bolívar, Sartenejas, Venezuela. [ Links ]3. C
harca, S. (2005). Study of hydrogen permation and diffusion in steels: predictive model for determination of desorbed hydrogen concentration. Tesis de Master. University of Puerto Rico Mayagüez Campus, Puerto Rico. pp. 16, 40. [ Links ]4. D
eberry, D.W. (1985). Modification of the electrochemical and corrosion behavior of stainless steels with an electroactive coating. J. Electrochem. Soc., 132 (5); 1022–1026. [ Links ]5. E
chevarria, R., Miras, M., Barbero, C. (2003). Síntesis y propiedades de películas compuestas de polianilina y polímeros dieléctricos. Jornadas SAM/CONAMET/Simposio Materia, pp.10-14. [ Links ]6. H
uerta-Vilca, D., Moraes, S., Motheo, A. (2003). Electrosynthesized Polyaniline for the Corrosion Protection of Aluminum Alloy 2024-T3. J. Braz. Chem. Soc. 14 (1); 52-58. [ Links ]7. L
u, W-K., Elsenbaumer, R.L., Wessling, B. (1995). Corrosion protection of mild steel by coatings containg polyaniline. Synth. Met. 71, 2163–2166. [ Links ]8. L
unarska, E., Ososkov, Y., Jgodzinsky, Y. (1997). Correlation between critical hydrogen concentration and hydrogen damage of pipeline steel. Int. J. Hydrogen Energy, 22, (2/3); 279-284. [ Links ]9. N
g, H. (2001). Hydrogen permeation measurement in low carbon steel with polymer electrolyte fuel cell. Proyecto de Grado, University of Manchester Institute of technology. Inglaterra. [ Links ]10. N
j, P. (1956). The lowering of fracture-stress due to surface adsorption. Phil. Mag 1; 331. [ Links ]11. O
liva, A., Codeghini, L., Quiroz, R., Rosales, A. (2009). Síntesis y evaluación de películas de polianilina (PANI) como protector contra la corrosión sobre acero al carbono. III Congreso de Latino metalurgia, Perú. [ Links ]12. Ö
zyilmaz, A.T., Kardas, G., Erbil, M., Yazici, B. (2005). The corrosion performance of polyaniline on nickel plated mild steel. Applied Surface Science, 242; 97–106. [ Links ]13. R
odríguez, M. (2003). Influencia de la estructura molecular de los inhibidores orgánicos en la permeación de hidrógeno en acero 0,04 %C. Tesis de Magister no publicada. Universidad Simón Bolívar, Sartenejas, Venezuela. [ Links ]14. S
tejskal, J., Kratochvil, P., Spirkova, M. (1995). Accelerating effect of some cation radicals on the polimerization of aniline. Polymer, 36, (21); 4135– 4140. [ Links ]