Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Zootecnia Tropical
versión impresa ISSN 0798-7269
Zootecnia Trop. v.28 n.1 Maracay mar. 2010
Control temporal de moscas (Musca domestica) en galpones avícolas mediante nebulizaciones con conidias de Beauveria brongniartii
Luís José Cova1, José Vicente Scorza D.1, Danny Eugenio García2*, Luís Miguel Cañizález3, Clemencia del Carmen Guedez3, Miguel Maffey4 y María Gabriela Medina2
1 Universidad de los Andes, Instituto de Investigaciones Experimentales José Witremundo Torrealba. Trujillo, Venezuela.
2 Instituto Nacional de Investigaciones Agrícolas, Trujillo, Venezuela. * Correo electrónico: dagamar8@hotmail.com.
3 Núcleo Universitario Rafael Rangel (NURR), Laboratorio de Fitopatología Dr. Carlos Díaz Polanco, Trujillo, Venezuela.
4 NURR, Laboratorio de Post-cosecha, Trujillo, Venezuela.
RESUMEN
Con el objetivo de determinar la efectividad de esporas de Beauveria brongniartii (Monilia: Moniliaceae) para el control de moscas doméstica (Musca domestica L.) mediante nebulización en el interior de galpones de cría de pollos (7 pollos/m2), a dosis de 9 x 107 conidias/ml (15 1 de preparado para cada 1200 m2), se llevó a cabo un experimento en unidades avícolas ubicadas en la cercanía de Isnotú, municipio Rafael Rangel, estado Trujillo, Venezuela. Se utilizaron dos tratamientos (T1: control con aplicación de placebo y T2: aplicación de suspensión del hongo a concentración fija). Al inicio del ensayo no se observaron diferencias en la media poblacional de moscas entre los galpones usados como control y los destinados al tratamiento con B. brongniartii (P>0,05); sin embargo, se observaron diferencias estadísticas entre los galpones tratados y el control en la segunda (P<0,05), tercera (P<0,01) y cuarta (P<0,001) semana post-primera aplicación. El porcentaje de reducción poblacional se indujo tras nebulizar una vez por semana, durante tres semanas, en 81; 31 y 100%, respectivamente. Los resultados permiten concluir que en las condiciones experimentales B. brongniartii constituye una alternativa viable para el control sanitario integral en las unidades de producción.
Palabras clave: bienestar animal, granjas avícolas, control biológico, Beauveria brongniartii.
Temporal control of flies (Musca domestica) in poultry sheds fogged with spores of Beauveria brongniartii
ABSTRACT
In order to determine the effectiveness of Beauveria brongniartii spores (Monilia: Moniliaceae) to control common flies (Musca domestica L.) through mist in the interior of sheds breeding chickens (7 chickens/m2), at doses of 9 x 107 conidias/mL (15 1 prepared for each 1200 m2), an experiment was conducted in poultry units located in the vicinity of Isnotú, Rafael Rangel municipality, Trujillo state, Venezuela. At the start of the trial no difference in the average population of flies among the control and treated sheds were observed (P>0,05). However, statistical differences among control and treated sheds in the second (P<0,05), third (P<0,01) and fourth (P <0,001) weeks after first application were observed. The percentage of population reduction was prompted after nebulizer once a week for three weeks, 81, 31 and 100%, respectively. Results showed that under the experimental conditions B. brongniartii constitutes a viable alternative for comprehensive health control in the production units.
Keywords: animal welfare, poultry sheds, biological control, Beauveria brongniartii.
Recibido: 03/06/08 Aceptado: 09/03/10
INTRODUCCIÓN
La mosca casera, Musca domestica L., es una plaga común y abundante en granjas avícolas (Axtell y Arends, 1990) y su densidad es proporcional a la acumulación de estiércol húmedo de ave. En granjas de Brasil, M. domestica integra más del 80% de la población muscoide (Avancini y Silveira, 2000) y en los Andes de Venezuela. Cedeño y Añez (2001) han advertido que es inconveniente el uso excesivo de estiércol de pollo o gallinaza como abono en horticultura, por la proliferación de moscas que produce, a la vez que han recomendado la aplicación de sanciones para los usuarios de gallinaza que no cumplan con exigencias sanitarias tales como su almacenamiento en seco o su mezcla con cal.
Por otra parte, las elevadas poblaciones de moscas aumentan la posibilidad de la difusión de enfermedades entre animales y humanos, además de crear un ambiente hostil que dificulta el desempeño de los animales y los trabajadores dentro de los sistemas productivos.
La excesiva producción de moscas se complica también, por su resistencia contra la mayoría de los insecticidas de uso general (Georghiou y Mellon, 1983), tolerancia que impone el uso de otros medios de control compatibles con la actividad avicultora.
Un medio efectivo de control podría ser la aplicación de hongos entomopátogenos. En este sentido, se ha reportado un grupo con más de 750 especies de casi 100 géneros que pueden infectar insectos (Kachatourians, 1991; 1996), sin embargo, pocos han sido estudiados en profundidad. Entre los más investigados se encuentran Beauveria brongniartii, Beauveria bassiana, Langenedium giganteum, Lecanicillium lecanii, Metarhizium anisopliae y Paecolomyces fumosoroseus, los cuales son utilizados comercialmente (Barson et al., 1994).
En este sentido, B. brongniartii se considera sin riesgo para humanos y animales, aún para aquellos que consumen alimentos provenientes de campos tratados con este entomopatógeno (Langle et al., 2003; Cova et al., 2009 a,b); también es considerado muy seguro para el ambiente; de hecho en Austria se registró a B. brongniartii como controlador comercial sin restricciones para la cucaracha europea (Melontha melontha y Melontha hipocastani), bajo el No 2582 de la Austrian Plant Protection Product Register (Strasser et al., 2009).
Adicionalmente, Scorza y Cova (2006) y Cova y Scorza (2006), a nivel de campo y en condiciones de laboratorio, han demostrado experimentalmente lo efectivo de aplicar estos tipos de organismos en el control de insectos dañinos.
Por tales motivos, el objetivo de este trabajo fue determinar el efecto entomopatógeno de B. brongniartii (cepa: LF-05) en M. domestica en granjas de producción avícola cercanas a la población de Isnotú, del estado Trujillo, Venezuela.
MATERIALES Y MÉTODOS
Localización y unidades experimentales
El experimento se llevó a cado en unidades avícolas de Sara Linda y Agua Clara, áreas muy próximas a la población de Isnotú, en el municipio Rafael Rangel del estado Trujillo, Venezuela, entre 600 y 800 m.s.n.m. con temperatura media de 25 °C a 2 kilómetros distantes entre sí, y conformadas por 2 y 3 galpones de 120 m de largo, 10 m de ancho y 3,5 m de alto, respectivamente. Los galpones se encontraban separados entre sí por 30 m. La infraestructura experimental estaba compuesta por piso de tierra pisada recubierta con cáscaras de arroz y techos de zinc, paredes de alambre de gallinero y zócalo de cemento armado de 50 cm de alto.
En ambos complejos se criaban 7 pollos/m2, hasta los 45 días. Según el diseño de trabajo, el mismo día, en los 3 galpones de Agua Clara, se aplicaron en el interior 3 dosis, una por semana de B. brongniartii mediante aspersiones de suspensiones de esporas (107 conidia/ml) como controladoras de las poblaciones de moscas, en tanto que los 2 galpones de Sara Linda, se asperjaron solamente con agua como placebo (tratamiento control).
Los productores no aplican insecticidas dentro de los galpones, ya que, es inconveniente para la salud de los pollos y debido a la alta densidad de moscas, usan como paliativo de control, el asperjar gasoil alrededor de los galpones, de acuerdo con sus criterios empíricos de alta densidad de moscas; esto implica la imposibilidad de tener controles sin ningún tratamiento. También es necesario indicar que en la zona cercana a los galpones de cría de pollos, se ubican también trapiches de caña paneleros, creándose así, un nicho ideal para el ciclo reproductivo de M. domestica. Evidenciando esta realidad la dificultad de aplicar con estricto rigor la metodología que se aplica en el laboratorio (Cova et al., 2009a).
El recuento de moscas se hizo con tres rejillas de madera (Scudder, 1947), utilizadas por Gómez-Núñez (1960), para contar moscas ínter domiciliares. En cada ocasión se colocaron las tres rejillas, inclinadas (ángulo respecto al suelo: 70°) en uno de los extremos internos de cada galpón, separadas unas de otras por al menos 3 m.
Se realizó el recuento de moscas durante un minuto entre las 9:00 y las 11:00 de la mañana, evitando movimientos bruscos para no alterar el comportamiento de los insectos. Las mediciones fueron hechas el mismo día, una vez por semana, cada vez por triplicado, contando las moscas en las tres rejillas, durante cuatro semanas desde el inicio de cría, no se efectuaron mediciones durante la semana de cosecha y limpieza de galpones; igualmente durante la semana del inicio de la nueva cosecha. Finalmente una última medición se ejecutó una semana después de iniciada la nueva cosecha, exactamente como fue realizada al inicio del ensayo.
La densidad de moscas se midió como promedio de las lecturas u observaciones de las tres rejillas. A los datos, para cada repetición, fue aplicado un análisis de comparación de medias utilizando la prueba de Duncan a P<0,05. Adicionalmente, el efecto del tratamiento en el tiempo se cuantificó calculando el porcentaje de reducción de moscas según la fórmula propuesta por Mulla et al. (1971).
% de reducción = 100-[C1/C2 x T2/T1] x100
Donde:
C1 y C2 = Número de moscas en los controles antes (C1) y después (C2) del tratamiento. T1 y T2 = Número de moscas en los galpones tratados antes (T1) y después (T2) del tratamiento.
En ambas localidades se hizo un primer recuento de moscas una semana después de introducidas los lotes de pollitos de 15 días de edad; luego otros cuatro recuentos, uno cada semana, y un sexto y último recuento, tres semanas después, para un estudio de las poblaciones de las moscas a lo largo de ocho semanas.
Preparación de las suspensiones de conidias de B. brongniartii (cepa: LF-05)
La cepa de B. brongniartii LF-05 fue sembrada mediante introducción de un taco de agar-papadextrosa conteniendo el cultivo del hongo, dentro de arroz humedecido al 30%, esterilizado en autoclave e incubado a temperatura ambiente durante tres semanas. El arroz esporulado fue suspendido en agua destilada a razón de 13 g/l con 0,1 ml de Tween 80 (0,01 % v/v), agitándolo suavemente para preparar una suspensión de conidias. Las conidias se contaron inmediatamente en el sobrenadante decantado, con una cámara de Neubauer, con aumento de 400x. Utilizándose la concentración de 9 x 107 conidias/ ml, ya que en estudios previos se determinó que a esta concentración de B. brongniartii observándose la mayor mortalidad de M. domestica en condiciones in vitro (Cova et al., 2009a).
Aplicación de B. brongniartii
La aplicación fue realizada a razón de 195 g de arroz en 15 1 de agua por cada 1.200 m2, la suspensión de 9 x 107 conidias/ml, se asperjó en los galpones experimentales, rociando toda el área cubierta de cáscaras de arroz, comederos, bebederos, cables, incluso las aves y la parte interna de los zócalos. En los tres galpones de Agua Clara, se aplicó el hongo mediante nebulización interna mecánica, de suspensión de conidias, con una bomba portátil de espalda de 20 1 de capacidad. De igual modo, pero nebulizando solamente agua con Tween 80 al 0,01 %, se rociaron los dos galpones de Sara Linda, siguiendo la misma secuencia de tratamiento de los galpones de Agua Clara. Se hicieron tres aspersiones en cada localidad, una por semana, inmediatamente después del recuento de las moscas. Un cuarto conteo fue efectuado tres semanas después de la última aspersión, posterior a la cosecha y limpieza de galpones e inicio del siguiente ciclo de cría.
Debido a las condiciones experimentales y que el ensayo se realizó en condiciones comerciales en una finca privada no se pudo evaluar de forma paralela algunos parámetros productivos de los pollos que hubieran permitido documentar in situ la inocuidad sobre los animales en cuanto a la aplicación de las esporas.
RESULTADOS Y DISCUSIÓN
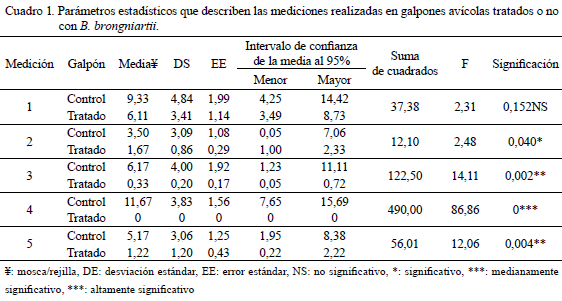
En el Cuadro 1 se muestran los parámetros estadísticos que describen las mediciones realizadas y la comparación estadística en cuanto a la densidad de moscas en los galpones avícolas utilizados como control y los tratados con B. brongniartii.
Numéricamente en todos los conteos realizados, la población de M. domestica fue superior en los galpones utilizados como control, comparado con aquellos en los que se aplicó el hongo entomopatógeno. Al realizar la comparación de medias se observaron diferencias estadísticas entre los galpones tratados y el control en la segunda (P<0,05), la tercera (P<0,01) y cuarta (P<0,001) semana post-primera aplicación. Al inicio del ensayo la densidad relativa de moscas en ambos tratamientos no presentó diferencias significativas entre sí.
Analizando la disminución porcentual de M. domestica en función de los tratamientos, las nebulizaciones consecutivas redujeron la densidad de moscas adultas en 100% en un período de tres semanas post-aplicación (semana 1: 81 %, semana 2: 31 %, semana 3: 100%) con presión entomicida adicional del 85% durante las 3 semanas siguientes (Cuadro 2).
En comparación, la nebulización con agua en los dos galpones de Sara Linda, con un área y cantidad similar de pollos, se registró una población promedio superior, durante todo el período de cría de ocho semanas. Es necesario indicar que en los dos galpones de Sara Linda no tratados con el entomopatógeno la cantidad de individuos contabilizados fue variable (semana 1: 9,33; semana 2: 12,17; semana 3: 3,50; semana 4: 6,17; semana 5: 11,67 y semana 8: 5,17 mosca/rejilla), ya que, fueron controlados mediante aspersiones periódicas con gasoil alrededor de los mismos, debido a la alta densidad poblacional de moscas, situación imposible de controlar, dado el componente económico involucrado. Sin embargo, hay que indicar que el gasoil tiene igualmente un efecto en la disminución de la densidad de mosca, ya que, reduce al menos al 50% la población, pero ocasiona efecto tóxico en los animales y daña el ambiente.
Por otro lado, la mayor densidad de moscas, al inicio, en los galpones control se debe probablemente a la menor distancia de estos a los trapiches paneleros, comparado con los galpones tratados.
En los galpones experimentales tratados con conidias de B. brongniartii, a partir de la primera semana de aplicación, fue constante el hallazgo de moscas casi inmóviles o incapaces de volar sobre las paredes de los zócalos de los galpones o de moscas cubiertas de micelio blanco en el perímetro adyacente.
Al respecto, también en un trabajo reciente se confirmó la acción patógena de B. bassiana contra adultos de M. domestica, capturadas en una granja avícola de las cercanías de Isnotú, en el estado Trujillo, Venezuela (Scorza y Cova, 2006). En dicha investigación se reportó que con una dosis de contaminación individual de 6 x 103 conidias en 0,5 mL de B. bassiana por imago tratado, el 95% de los adultos perecen en 6,23 días. Igualmente, Cova y Scorza (2006) informan un 100% de mortalidad de moscas domésticas con la aplicación de B. bassiana, en el rango similar durante 3 semanas, en galpones de cría de pollos, en la misma localidad de Sara Linda, en el Estado Trujillo de Venezuela.
Es importante indicar que el mecanismo por el cual el hongo realiza su acción cuando coloniza organismos vivos ocurre a temperatura igual o inferior a 30 ºC; por lo que es de esperar que en animales con temperatura corporal superior no aparezcan problemas de contaminación micótica. Sin embargo, cuando ocurre la infestación por el entomopatógeno en la mosca, pero ésta regresa al ambiente circundante, pudiera estar también enfermando a otros animales silvestres como insectos, peces, reptiles y anfibios, u otros con metabolismo térmico similar.
Otra posibilidad que también se debe considerar es que después que la mosca muere dentro de los galpones de pollos, el consumo del insecto infectado por los pollos pudiera generar en éstos problemas de micotoxinas, incluso luego extrapolables al humano.
En este sentido, los principales tópicos a investigar en ensayos futuros serían sobre el desequilibrio ecológico potencial que pudiera causar, la caracterización del hongo en la producción de micotoxinas acumulables en el pollo y el daño posterior que pudiera ocasionar en humanos.
Aún cuando en dicho trabajo los ensayos fueron realizados con B. bassiana también se evidencia la acción entomocida de una dosis semejante de conidias, nebulizadas en el interior de galpones de una granja avícola de la misma localidad, sitio de cría tradicional con excesivas poblaciones de moscas.
Aunque no se consideró la posibilidad de una acción epizoótica, el registro de una prolongada reducción de la densidad de moscas, hasta tres semanas después de la última nebulización de B. brongniartii en los tres galpones, sugiere que su acción letal, una vez desaparecida la población de hembras adultas, se prolonga mucho más allá de la duración del ciclo huevo- adulto de la especie, lo cual implica una relativa permanencia en el ambiente, según lo observado en otras especies por Kessler et al. (2004), quienes reportan el caso de la sobrevivencia del entomopatógeno B. brongniartii y su eficiencia contra M. melontha, que fue examinado durante 16 meses después de la aplicación del biocontrolador en diferentes tipos de suelos de Suiza. En ausencia de M. melontha en el suelo, la reducción de B. brongniartii fue 90%. En suelos donde M. melontha estaba presente, la sobrevivencia de B. brongniartii fue superior. El rápido decrecimiento del entomopatógeno evidenció la alta especificidad hacia ese huésped.
Al respecto, Kessler et al. (2004), constata que las larvas de M. melontha causan fuertes daños económicos anuales a la agricultura europea, sin embargo el control con B. brongniartii ha sido exitoso, aunque existe la preocupación sobre la virulencia sobre otros insectos beneficiosos del suelo. Traugott et al. (2008) realizaron ensayos preliminares en el laboratorio, sobre la patogenicidad de B. brongniartii en especies de Nebria brevicollis, Amara aulica y Pterostichus melanarius, no encontrando efectos nocivos extremos sobre estas especies.
Igualmente existe la preocupación sobre en efecto nocivo en humanos, al respecto estudios realizados en Austria, Italia, Suiza y Francia durante más de 20 años, demuestran lo contrario (Langle et al., 2003). Sin embargo, Henke et al. (2002) reportan en Alemania (Universidad de Goettingen), un caso de contaminación de un ser humano inmunosuprimido con Beauveria sp., sugiriendo como terapia el Itraconazole.
En el marco de esta investigación la virulencia de B. brongniartii para M. domestica ha sido bien documentada por Steinkrauss et al. (1990) y por Barson et al. (1994) empleando varias estrategias. Este ultimo trabajo revela actividad patógena para estadios larvales, de pupas y adultos a concentraciones de 104 y 105 conidias/ml con letalidad en moscas adultas de 95% a los 9 días de exposición. No obstante, existe poca información publicada en la cual se describa el efecto directo de B. brongniartii en sistemas de producción animal en Latinoamérica.
El resultado obtenido en cuanto a la acción epizoótica hace pensar en la posibilidad de realizar aplicaciones más espaciadas en el tiempo, con el objetivo de emplear menor cantidad de hongos entomopatógenos y utilizar menos mano de obra en los sistemas comerciales.
De forma integral, resultó evidente la acción patogénica de B. brongniartii en M. domestica y su factibilidad de uso en galpones avícolas y otras unidades de producción animal, donde el manejo del estiércol no sea adecuado por limitaciones económicas y/o prácticas.
CONCLUSIONES
En condiciones comerciales en 4 semanas, la densidad de moscas tratadas con 107 conidias/ml de B. brongniartii se reduce al 100%. En los galpones utilizados como control, con similar área y número de pollos, nebulizados con placebo solamente y a pesar del control externo con gasoil, la abundancia promedio de moscas/rejilla fue significativamente superior durante las semanas posteriores a la aplicación.
Sin embargo, en este ensayo no se determinó los posibles efectos sobre los pollos y otros seres vivos del galpón y sus alrededores. En este sentido, los efectos positivos de los hongos entomopatógenos en el combate de las moscas, no pueden por sí solo servir como recomendación de uso en galpones avícolas, ya que, se debe demostrar la inocuidad sobre los pollos y otros seres vivos de la zona de aplicación.
AGRADECIMIENTOS
Los autores agradecen al CDCHT, estado Mérida, por el financiamiento de esta investigación (NURR C-329-03-09-A). Al Laboratorio de Fitopatología Dr. Carlos Díaz Polanco del Núcleo Universitario Rafael Rangel, estado Trujillo, Venezuela por facilitar la cepa utilizada para la evaluación. A la familia Stanislao, por facilitar los galpones para efectuar los ensayos. Al Instituto Nacional de Tierras, Trujillo (INTI) en la persona del TSU Alexander Rafael Castro por su colaboración en las mediciones realizadas.
LITERATURA CITADA
1. Avancini R y G. Silveira G. 2000. Age structure and abundance in populations of muscoid flies from a poultry facility in Southeast Brazil. Mem. Inst. O. Cruz. 95: 259-264. [ Links ]
2. Axtell R.C. y J.J. Arends. 1990. Ecology and management of arthropod pest of poultry. Ann. Rev. Entomol. 35: 101-126.
3. Barson G., N. Reen y F. Bywater. 1994. Laboratory evaluation of six species of entomopathogenic fungi for control of the house fly (Musca domestica L.) a pest of intensive animal units. J. Invert. Pathol. 64: 107-113. [ Links ]
4. Cedeño L. y B. Añez. 2001. Breve reseña sobre beneficios e inconveniente derivados del uso del estiércol en la agricultura. Bol. Divulg. IIAP, Mérida. 26: 17-19. [ Links ]
5. Cova, L.J. y J.V. Scorza-Dagert. 2006. Control temporal de moscas caseras (Musca domestica) en galpones avícolas mediante nebulizaciones con conidias de Beauveria bassiana. Bol. Malariol. Salud Amb. XLVI (2): 137-142. [ Links ]
6. Cova, L.J., J.V. Scorza-Dagert, D.E. García, L.M. Cañizález, C.C. Guedez, M. Maffey y M.G. Medina. 2009a. Patogenicidad in vitro de Beauveria brongniartii (Sacc.) Petch en Musca domestica (Linn.) como posible estrategia de control biológico en áreas ganaderas. Zootecnia Trop. 27(2): 113-120. [ Links ]
7. Cova, L.J., J.V. Scorza, D.E. García, L.M. Cañizales, C.C. Guedez, L. Avendaño y M.G. Medina, 2009b. Efecto de Beauveria bassiana, Beauveria brongniartii y la aplicación de gasoil en el control de moscas caseras en galpones avícola. Avances en investigación agropecuaria 13(2): 41-53. [ Links ]8. Georghiou G.R. y R. Mellon R. 1983. Pesticida resistance in time and space. En: Pest resistance to pesticides. (Georghiou, G.P. y Saito, T.; Eds.) Plenum Press, New York. pp 1-46. [ Links ]
9. Gómez-Nuñez J. C. 1960. Índice de densidad de moscas. Bol. Inf. Div. Malariol. 2: 13-15. [ Links ]
110. Henke M.O., G. Sybren de Hoog, U. Gross, G. Zimmermann, D. Kraemer and M Weig. 2002. Human deep tissue infection with an Entomopathogenic Beauveria species. J. Clin. Microbiol. 40 (70): 2698-2702. [ Links ]
11. Khachatourians, G. G. 1991. Physiology and genetics of entomopathogenic fungi. En Arora DK, Ajello L, Mukerji KG (Eds.) Handbook of Applied Mycology Vol. 2: Humans, animals and insects. Dakker. Nueva York, EEUU. pp 613-661. [ Links ]
12. Khachatourians G.G. 1996. Biochemistry and molecular biology of entomopathogenic fungi. En: D.H. Howard and J.D. Miller (Eds.) The Mycota VI. Human and animal relationship. Springer. Berlin, Alemania. pp 331-364. [ Links ]
13. Langle, T., T. Bauer, B. Pernfub, C. Seger, J. Rafalt y H. Strasser. 2003. A GLP/GEP based field study on Beauveria brongniartii with respect to Commission Directive 2001/36/EC. Disponible en: http://www.act-gerhaus.com/download/IOBCKielGermany2003.pdf.(Consulta: 27-02-2009) [ Links ]
14. Mulla M., R. Norland, D. Fanara, H. Darwazeh y D. Menean. 1971. Control chironomid midges in recreational lakes. J. Econ. Entomol. 64: 300-307. [ Links ]
15. Scorza D. J. V. y L. J. Cova. 2006. Acción patógena de una cepa venezolana de Beauveria bassiana para Musca domestica (Diptera: Muscidae). Bol. Malariol. Salud Amb. 46: 119-130. [ Links ]
16. Scudder H. 1947. A new technique for sampling the density of house fly populations. Publ. Health Rep. 62: 681-686. [ Links ]
17. Steinkrauss D., C. Geden, D. Rutz y J. Kramer. 1990. First report of the natural occurrence of Beauveria bassiana (Moniliales: Moniliaceae) in Musca domestica (Diptera: Muscidae). J. Med. Entomol. 27: 309-312. [ Links ]
18. Strasser, H., T. Langle and B. Pernfub. 2009. Beauveria brongniartii (Saccardo) Petch is a safe insecticide to control the European cockchafer Proyect activity BIPESCO (FAIR6CT98-4105). Disponible en: http://bipesco.uibk.ac.at/ (rebeca workshops). (Consulta: 27-02-2009) [ Links ]