Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Zootecnia Tropical
versión impresa ISSN 0798-7269
Zootecnia Trop. v.28 n.1 Maracay mar. 2010
Producción de forraje verde hidropónico de maíz (Zea mays L.) en condiciones de iluminación deficiente
Alvis Rivera1, María Moronta1, Mario González-Estopiñán1, Diomary González1, Daniel Perdomo2, Danny E. García2* y Gustavo Hernández3
1 Universidad de Los Andes, Núcleo Universitario Rafael Rangel (NURR), Unidad de Investigaciones en Recursos Subutilizados (UNIRS), estado Trujillo, Venezuela.
2 Instituto Nacional de Investigaciones Agrícolas (INIA), estado Trujillo, Venezuela. *Correo electrónico: dagamar8@hotmail.com
3 Instituto Universitario de Tecnología del Estado Trujillo (IUTET), estado Trujillo, Venezuela.
RESUMEN
Se llevó a cabo un experimento en el estado Trujillo, Venezuela, con el objetivo de evaluar el efecto de dos soluciones nutritivas preparadas con fertilizante líquido comercial: Nitrofoska® (A) y Quimifol® (B) y tres métodos de cultivo: papel absorbente (P), malla (M) y malla-papel (MP) en la producción de forraje verde hidropónico de maíz, Zea mays L., bajo condiciones de iluminación natural deficiente. Se empleó un diseño de bloques al azar con arreglo factorial para seis tratamientos y 10 réplicas. Después de la etapa de pre-germinación se usaron bandejas plásticas de 0,13 m2 en las cuales se colocó el equivalente a 0,2 kg de semilla. Midiéndose el rendimiento (R), altura (A), cantidad de solución absorbida (SC), porcentaje de materia seca (MS) y de proteína bruta (PB). Solamente la PB presentó interacción significativa solución nutritiva x método de cultivo (P<0,05). El mayor Rend se consiguió con P y MP (772 g/bandeja); así como con la solución A (754 g/bandeja). Con la suatancia A se obtuvo la mayor A (30,27 cm), sin evidenciarse diferencias estadísticas respecto al método (P>0,05). No se observaron discrepancias entre tratamientos en el consumo de solución (1.377,0-1.462,5 ml). La MS no presentó diferencias significativas entre tratamientos (16,30-18,20 %) y la mayor concentración de PB se logró cuando se usó P con la solución B (18,13 %). Los resultados permiten concluir que, en condiciones de iluminación natural deficiente, el método P fue más eficiente para las variables R y PB. La solución A resultó mejor en función del R y la A.
Palabras clave: forraje, maíz, hidropónico, métodos de cultivo, soluciones nutritivas foliares.
Hydroponic forage production of corn (Zea mays L.) under natural conditions of light deficiency
ABSTRACT
In order to evaluate the nutritive solution and cultivation methods in Corn (Zea mays L.), an experiment was carried out in Trujillo state, Venezuela. hydroponic production under natural poor lighting conditions was examined using a completely randomized block design with factorial arrangement 2 (nutritive solutions prepared with commercial liquid fertilizer: Nitrofoska® (A) and Quimifol® (B) x 3 (cultivation methods: absorbent paper (P), mesh (M), mesh with absorbent paper (MP) with six treatments and ten replicates. After the pre-germination stage 0,13 m2 plastic trays were used with 0,2 kg of seed equivalent. Yield, height, amount of absorbed solution (CS), dry matter (DM) and crude protein (CP) percentage were measured. Significant interaction nutritive solution x culture method for CP level was observed (P<0,05). Using P and MP (772 g/tray) and solution A (754 g/tray) the highest yield was obtained. No significant statistical differences in height (30,27 cm) with the method and CS among treatments were observed (1377,0-1462,5 ml). The MS percentage showed little variation among treatments (16,30 -18,20). Using P method with B solution (18,13%) significant CP concentration was observed. Under natural poor lighting conditions, the P method of cultivation was more efficient for yield and CP concentration. Solution A was found to be the most appropriate according to the yield and height results.
Keywords: forage, corn, hydroponic, culture methods, nutritive foliar solution.
Recibido:20/01/09 Aceptado:01/03/10
INTRODUCCIÓN
En Venezuela, al igual que en otros países tropicales, las variaciones climáticas, aunadas a la baja calidad de los forrajes usados en la producción pecuaria, constituyen dos de los factores que restringen el desarrollo adecuado de la ganadería nacional. Por ello, los productores agropecuarios suministran a sus animales, dietas suplementarias basadas en alimentos concentrados (Espinoza et al., 2004), las cuales cada vez se hacen más costosas, porque los insumos para su elaboración son importados.
Por lo anterior, se deben implementar alternativas a fin de suministrar recursos alimenticios tales como plantas forrajeras, las cuales en la mayoría de los casos exhiben elevada calidad nutricional, se producen a bajo costo y son de fácil manejo para la producción animal (Guzmán, 1986; Parra, 1996).
El cultivo de plantas con fines forrajeros (maíz, cebada, avena, sorgo y alfalfa), en medio hidropónico, puede resultar provechoso en la alimentación animal; permitiendo cultivar especies altamente productivas en medios artificiales o substratos, en donde las raíces se desarrollan adecuadamente (Durany, 1984; Urias, 1997).
En la práctica, el Forraje Verde Hidropónico (FVH) consiste en la germinación de semillas de gramíneas o leguminosas, y posterior crecimiento bajo condiciones ambientales controladas (luz, temperatura y humedad) en ausencia del suelo (FAO, 2002). Su uso se destina para la alimentación de bovinos, ovinos, caprinos, equinos, porcinos, conejos y aves (Müller et al. 2005a,b; Herrera et al
., 2007).El FVH ofrece una serie de ventajas, como producción forrajera durante todo el año, desarrollo del cultivo en pequeñas áreas, aporte de complejos vitamínicos necesarios, no ocasionan trastornos digestivos y exhiben una rápida recuperación de la inversión (FAO, 2002; Müller
et al., 2005a).Una de las plantas más utilizadas con fines forrajeros ha sido el maíz (Zea mays L.) por su elevado
valor nutritivo y altos rendimientos (Parra, 1996; Chacón y Nieto, 1998, Amador y Boschini, 2000; Elizondo y Boschini, 2001; 2002), lo cual permite que en diversos medios de producción hidropónicos, se generen elevados y constantes volúmenes de FVH de maíz, produciendo alimento a la mitad del costo convencional de forrajes cultivados a campo abierto. Suministrada a diferentes animales, representa una dieta completa que incluye carbohidratos, proteínas, minerales y vitaminas, cuando es suministrada en su totalidad (Müller et al., 2005a,b; Campêlo et al., 2007).Por otra parte, entre los factores climáticos, la luz es un elemento básico para el crecimiento de las plantas, ya que, promueve la síntesis de compuestos nutricionales como las vitaminas, las cuales son de vital importancia en la nutrición animal (Urias, 1997; FAO, 2002). La producción de FVH en condiciones deficientes de iluminación se puede justificar debido a que las variaciones ambientales que se producen durante todo el año obligan a realizar el cultivo de FVH en lugares protegidos, aunado a los problemas de suministro eléctrico; problemática que se hace más evidente ante la corta duración del ciclo productivo.
Dada la necesidad de presentar una solución ante las limitaciones expuestas anteriormente, la presente investigación se orientó en la evaluación de FVH de maíz, comparando la eficiencia de tres métodos de cultivo y dos soluciones nutritivas, en condiciones de iluminación natural deficiente.
MATERIALES Y MÉTODOS
Ubicación
El ensayo se realizó en el Laboratorio ME-14 (Coordenada geográficas: 9º25´11" N y 70º28´22" O) de la Unidad de Investigaciones en Recursos Subutilizados (UNIRS), ubicada en el Núcleo Universitario "Rafael Rangel" de la Universidad de Los Andes (ULA) en el estado Trujillo, Venezuela, a 419 m.s.n.m.
Material vegetal
Se utilizaron semillas híbridas certificadas de maíz SEHIVECA de cultivar HIMECA 2001, lote y tipo k99 004 RED, obtenidas de la Empresa "Semillas Híbridas de Venezuela C.A.", certificadas para un 85% de germinación.
Condiciones del ensayo
La población del ensayo, estuvo conformada por 60 unidades hidropónicas representadas por bandejas de polietileno (41 x 30,5 x 1,5 cm), donde se colocaron 0,2 kg de maíz en cada una (1,5 kg/m
2), para contabilizar 12 kg de maíz en total.Pregerminación de semillas
Las semillas híbridas, se pesaron en balanza de plato a razón de 0,2 kg/bandeja. Seguidamente fueron lavadas y colocadas individualmente en botellones de vidrio cilíndricos (altura: 26 cm y diámetro: 15 cm) con 500 ml de agua/envase. Posteriormente los botellones con las semillas se ubicaron en un cuarto oscuro, limpio, seco y poco ventilado, donde permanecieron 24 horas, para que realizaran el proceso de imbibición o hidratación. Durante este tiempo se midió la temperatura ambiental del cuarto, mediante dos termómetros de mercurio Good Old Valves, determinando una temperatura promedio de 25,2 ±0,3 ºC.
Germinación de las semillas
Transcurridas 24 horas, se tomaron los botellones y las semillas fueron pasadas por un colador para eliminar el agua absorbida durante el proceso de imbibición. Seguidamente las semillas se ubicaron de manera uniforme en las bandejas plásticas, en las cuales previamente se habían colocado dos capas de papel absorbente.
Se aplicó riego empleando un rociador para mantener la humedad, y se cubrieron con otras dos capas de papel absorbente, el cual fue humedecido inmediatamente. Posteriormente, se situaron en el mismo cuarto oscuro usado para el proceso de imbibición, por un período de 48 horas.
Durante esta fase se aplicó diariamente riego con rociador durante las horas matutinas (08:00-10:00 a.m.), en cantidad suficiente para mantener húmedas las semillas. Se registró también diariamente la temperatura ambiental (termómetros Old Valves) la cual se mantuvo en 25,4 ±0,2 ºC.
Soluciones nutritivas
Se emplearon dos soluciones de fertilizante foliar comercial con las siguiente composición para la preparación de las soluciones nutritivas: Solución Nitrofoska® (A), dosis de 2 ml/l de agua (N: 10%;
P2O5: 4%; K2O: 7%; MgO: 0,2%; S: 0,8%; Fe: 200 ppm; B: 71 ppm; Cu: 40 ppm; Mn: 30 ppm; Zn: 8 ppm; Co: 5 ppm y Mo: 0,5 ppm). Solución Quimifol® (B), dosis de 2 ml/l de agua (N: amílico 5%; anhídrido fosfórico: 15%; K2O: 5%; B: 200 ppm; Fe: 800 ppm; Mg: 400 ppm; Zn: 800 ppm; Co: 40 ppm; Mo: 20 ppm; Cu: 200 ppm; Mn: 300 ppm; S: 1620 ppm y Ca: 300 ppm).Verificación d de pH
Una vez preparadas las soluciones, se tomó una muestra de A y B, por separado, aplicándose dos gotas de azul de bromotimol. Se agitó adecuadamente, y se observó la coloración de las soluciones, la cual se comparó con una tabla colorimétrica, determinando el valor de pH óptimo para la siembra del FVH, el cual se encontró durante todo el período entre 5,5 y 6,5 (FAO, 2002). Este procedimiento fue realizado diariamente, antes de aplicar las soluciones a las bandejas.
Siembra de semillas y métodos de cultivo
Luego de permanecer las semillas por 48 horas en el cuarto oscuro, se retiraron cuidadosamente las bandejas para efectuar la siembra a otras bandejas preparadas utilizando los siguientes métodos de cultivo:
Método de Cultivo con Papel (P)
En 20 bandejas preparadas con dos capas de papel absorbente, se colocaron las semillas germinadas, trasladándolas con las dos capas de papel absorbente utilizado en la germinación, para un total de cuatro capas de papel. Al momento de la siembra, se aplicaron las soluciones A y B (10 bandejas de cada una) correspondiente al método P.
Método de Cultivo con Malla (M)
En 20 bandejas recubiertas solamente con malla
de saco (orificios de 0,025cm2) sujetadas con cintas adhesivas, se colocaron las semillas germinadas de forma uniforme, retirándoles cuidadosamente el papel absorbente usado en la etapa de germinación. En el momento de la siembra, se aplicó las soluciones nutritivas en cada bandeja seleccionada.Método de Cultivo con Malla-Papel (MP)
En 20 bandejas previamente recubiertas con malla de saco limonero, se colocaron, dos capas de papel absorbente de manera tal que cubrieran la totalidad de la superficie de la malla.
Posteriormente se pasaron las semillas germinadas tomándolas por debajo del papel absorbente, para impedir el daño de las raicillas, utilizando un total de cuatro capas de papel absorbente, las dos capas iniciales usadas en la germinación y las dos nuevas capas que se adicionaron. En cada bandeja se aplicó al momento de la siembra la solución nutritiva.
Todas las bandejas se enumeraron y se sometieron al muestreo aleatorio simple y sin reemplazamiento. En las bandejas de los métodos M y MP las cantidades de soluciones nutritivas se incorporaron en el interior por inundación. En el caso de las bandejas correspondientes al método P se aplicó aspersión aérea. En todo el tiempo de cultivo la temperatura fue de 25,2 ±1,7 ºC.
Durante todo el período experimental en el laboratorio se mantuvo la luz artificial apagada y
escasa de luz natural (1-2 lux), de manera que todos los tratamientos recibieran similares condiciones de iluminación, humedad y temperatura durante el ensayo.Cosecha del FVH
La cosecha se realizó trascurridos 11 días después de la siembra de las semillas germinadas. Para las bandejas con el método P, la cosecha se realizó directamente recolectando el FVH, incluyendo el papel. En el caso de los métodos MP y M, se retiraron de las mallas las cintas adhesivas que la sostenían a las bandejas, amarándose por sus cuatro lados para proceder a pesar el FVH. Para obtención sólo del peso fresco del FVH se restó el peso de las mallas y papel impregnado, según el método de cultivo.
Mediciones realizadas
Rendimiento de forraje fresco (R)
Para pesar el FVH se empleó una balanza Laica con capacidad mínima de 5 g y máxima de 1 kg. En las bandejas con el método P, el pesaje se realizó directamente recolectando el FVH, retirando inicialmente el papel. En el caso de M y MP, se retiraron de las mallas las cintas adhesivas, procediendo a pesar el FVH, restando los pesos correspondientes.
Altura de la planta (A)
Transcurridos los 11 días a partir de la siembra (momento de cosecha), se procedió a medir la altura del FVH. Para ello se tomó aleatoriamente una planta de la región central de cada bandeja y se midió con cinta métrica desde la base del grano hasta la última hoja apical.
Cantidad de solución absorbida (SC)
Durante todo el período experimental no se realizó cambio de solución nutritiva, ni incorporación de agua adicional en los tratamientos. Sin embargo, diariamente se ajustó el volumen de solución original utilizando como referencia un envase plástico de 1 l, y reponiendo el volumen faltante con la solución correspondiente.
Porcentaje de materia seca (MS)
El material vegetal se introdujo en bolsas separadas. En las bandejas de los métodos de cultivo MP y M, fueron retiradas la mallas y posteriormente se envasaron herméticamente.
Separadas las muestras por tratamiento y número, se colocaron en bolsas herméticas y se identificaron debidamente para trasladarlas al Laboratorio de Análisis de Muestras de CONCAVA (Concentrados Valera, C.A), ciudad de Valera, estado Trujillo, Venezuela. La determinación de la MS se realizó utilizando una estufa con ventilación forzada por 72 horas a 60 °C.
Porcentaje de Proteína Bruta (PB)
La determinación de la PB se realizó mediante el método de Kjeldhal multiplicando el contenido de nitrógeno (N) x 6,25 (AOAC, 1990).
Diseño experimental y análisis estadístico
Se utilizó un diseño de bloques al azar con arreglo factorial 2 (soluciones de fertilizante foliar: A y B) x 3 (métodos de cultivos: P, M y MP). El modelo estadístico propuesto fue:
Yij = U + A
i + Bj + Kij + E, donde:Yij: Variable respuesta.
U: Constante.
A
i: Variable que mide el efecto del factor fila.Bj: Variable que mide el efecto del factor columna.
Kij: Variable que mide el efecto de la interacción.
E: Error. La combinación de tratamientos fueron:
T1: MP + A.
T2: M + A.
T3: P + A.
T4: MP + B.
T5: M + B.
T6: P + B.
Cada bandeja fue considerada como una unidad experimental. La información se procesó mediante el análisis de varianza (ANOVA) para un grado de significación de 5 %, usando el Test de Duncan. Todos los análisis se realizaron utilizando el paquete estadístico SPSS 10.0 para Windows® (Visauta, 1998).
RESULTADOS Y DISCUSIÓN
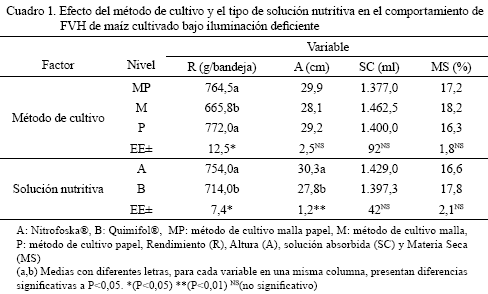
En el Cuadro 1 se muestra el efecto de los factores evaluados en las variables R, A, SC y %MS. El análisis de varianza para el R mostró diferencias altamente significativas entre los métodos de cultivo (P<0,05).
Al aplicar la prueba de Duncan se observó que los métodos P y MP no presentaron diferencias estadísticas en la producción de FVH. Sin embargo, con el método M se registraron los resultados más bajos.
Los valores de R promedios obtenidos con los
métodos P, MP y M, fueron de 3,86; 3,82 y 3,32 kg, por cada kilogramo de semilla; lo que se traduce, al considerar el área utilizada (0,125m2/bandeja), en una producción de 61.760; 61.160 y 53.200 kg de material fresco/hectárea, respectivamente; R que son considerados muy elevados para el cultivo en campo abierto.Para las soluciones aplicadas, el análisis de
varianza mostró también diferencias significativas (P<0,05). Con la solución A se obtuvo mayor R, y un valor promedio de diferencia de 0,4016 kg/bandeja, lo que se traduce como un incremento en rendimiento de 5,62% de la solución A, respecto a la B.Estos resultados son considerados buenos, bajo las condiciones en las cuales se realizó el ensayo, y visualiza la posibilidad de producir FVH con iluminación natural deficiente, aún cuando los valores obtenidos son inferiores a los que proporcionarían una iluminación adecuada natural o artificial (Rivera y Moronta, 2000; Müller et al., 2005a,b).
Para el caso del método M, el R fue menos favorable, debido a que en las condiciones experimentales donde se llevó a cabo el ensayo, con la utilización de los métodos P y MP posiblemente permitieron una mayor oxigenación y aprovechamiento de los nutrientes por las raíces. Dicho proceso es muy importante en todo sistema hidropónico, ya que, de esta forma se mejora el R; en cambio, con el uso del método M no se logró un resultado sobresaliente porque la malla sólo sirvió de soporte al FVH.
Estos resultados coinciden con lo planteado por Resh (1982) quien constató la importancia de la ventilación de las raíces y el uso óptimo de la solución nutritiva en el R de las plantas. Sin embargo, sería necesario someter las modalidades ensayadas, en función del método de cultivo, a un análisis económico tomando en cuenta todos los factores que pueden intervenir, a fin de conocer cual de los métodos de cultivo presentan mayores ventajas al respecto.
El resultado del análisis de varianza para la variable A no mostró diferencias significativas en cuanto a los métodos de cultivo (P>0,05). Con la solución A se registro una A mayor, comparado con la B. Se constató una diferencia promedio de 2,45 cm, lo que se traduce en un incremento del 8,81% en Alt en la solución A respecto a la B.
El aumento de la A, cuando se utilizó la solución A, demuestra el efecto positivo-activador de algunos fertilizantes foliares, comparativamente con otros de menor actividad, en el comportamiento productivo de los cultivos; aspectos señalados para condiciones controladas y en campo (Mesa et al., 2005).
El efecto de los métodos de cultivos sobre la A indica que esta variable depende fundamentalmente de condiciones externas inherentes al desarrollo de los cultivos temporales, tales como la luminosidad y estado nutricional, lo cual ha sido tratado de forma exhaustiva por Pineda (2004) al describir los patrones de crecimiento de muchas especies vegetales.
En cuanto a la cantidad de SC, los métodos de cultivo empleados no presentaron diferencias estadísticas entre sí (P>
0,05). No obstante, se visualizó una pequeña ventaja del método MP, con el cual se produjo el menor consumo de solución.Aunque tampoco se evidenciaron diferencias en el análisis de varianza realizado a las cantidades de soluciones absorbidas (P>
0,05). Numéricamente, el consumo observado fue mayor en la solución A, respecto a la B. En este sentido, considerando el ahorro potencial de fertilizante foliar, con relación al consumo, la solución B aventajó levemente a la solución A.Las pocas diferencias, en cuanto a la cantidad de SC, tanto para el método de cultivo como para el tipo de solución nutritiva denota que el maíz sometido a los tratamientos experimentales, presenta una tasa de absorción similar, aspecto que parece ser inherente
a la fisiología de cada especie y sólo depende de la capacidad del sistema radical (Pineda, 2004). Sin embargo, las diferencias observadas en otras variables (R, A), respecto al tipo de solución, pudiera indicar que algún elemento o compuesto químico presente en el fertilizante foliar, influyó en el comportamiento del FVH, y que ninguno de los métodos de cultivo favorece la absorción de material nutritivo.Por otra parte, el uso de soluciones nutritivas es adecuado para estos sistemas, ya que aunque representa un gasto adicional, el cultivo de FVH
sobre cama de residuos vegetales fibrosos, usado tradicionalmente, le confiere a la mezcla forrajesustrato menor valor nutritivo en términos de consumo de MS, digestibilidad aparente y ganancia media diaria de peso en rumiantes (Herrera et al., 2007).El análisis de varianza aplicado a la variable % MS, aportó resultados sin diferencias significativas
entre los métodos de cultivo y entre las soluciones (P>0,05). La poca fluctuación numérica observada en esta variable, se explica por el hecho de que los porcentajes de MS no se afectan drásticamente por factores externos y ambientales, ya que, este parámetro se encuentra regido por control genético y es intrínseco de cada especie vegetal (Pineda, 2004), independientemente de la forma en que se cultive. Resultados similares se han obtenido en cultivos de interés agrícola en diferentes condiciones experimentales (Parra, 1996; Müller et al., 2005b).El valor de MS (promedio: 17,2%) obtenido en este experimento es superior al registrado por Campêlo et al., 2007 (promedio: 11,54%) quienes cultivaron maíz
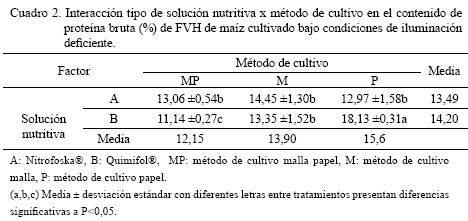
en condiciones similares a las de esta evaluación, pero usando sustrato vegetal para el crecimiento del FVH, prescindiendo de la utilización de fertilizante foliar.Por otra parte, se observó interacción significativa
entre los métodos de cultivo con el tipo de solución nutritiva, en el caso de la concentración de PB (P<0,05).El Cuadro 2 se muestra el efecto de los factores combinados en el nivel proteico del FVH.
En la interacción entre los métodos de cultivosolución nutritiva, la combinación P-B presentó el mayor valor porcentual de PB, en comparación con las demás combinaciones. Los valores de PB obtenidos con MP-A, M-A, P-A y M-B no presentaron diferencias estadísticas entre sí. Sin embargo, con la utilización de MP-B se obtuvieron los contenidos más bajos.
Desde el punto de vista comparativo, se observaron excelentes resultados al analizar el contenido proteico logrado con el método P (15,60%), con respecto al porcentaje exhibido por Sorgum bicolor (PB: 15,74%) y cebada, Hordeum vulgare, (PB: 13,80%) y a los informados para el arroz, Oriza sativa, (PB: 8,15%) y Penisetum americanum (PB: 12,79%), todas en condiciones en hidroponia a los 10 días de siembra (Rivera y Moronta, 2000; Müller et al., 2005a); tomando en cuenta que la iluminación natural del FVH de maíz fue deficiente, en comparación con las óptima para el resto de las especies.
La variación en la concentración de PB cuando se combinaron los factores en estudio (interacción significativa) se puede explicar, ya que, aunque el
contenido de nitrógeno (N) es particular de cada especie, es un elemento de elevada movilidad en la planta y en los primeros estadíos de desarrollo se concentra en las partes en crecimiento, en función del método de cultivo; donde su concentración es altamente dependiente del estado de desarrollo (Pineda, 2004). Al respecto, en otras especies, es conocido que existe una relación inversa entre el contenido foliar de N y la edad de la biomasa (Fundora y Arzola, 1992).La mayor cantidad de PB del forraje fertilizado con B, también podría deberse a que la forma en la cual se encuentra el N de dicha solución es orgánica (amílica), mientras que la de A se encuentra en forma inorgánica. En este sentido, se conoce que muchas plantas absorben N, tanto inorgánico como orgánico (Fundora y Arzola, 1992); pero la síntesis proteica, en algunas gramíneas y especies no leguminosas cultivadas, se ve estimulada por las formas orgánicas de N absorbido (Pineda, 2004).
Aunque el valor de PB fue inferior al informado por Herrera
et al. (2007), el contenido del FVH de maíz afirma el potencial nutricional de los cultivos hidropónicos, comparado con la utilización de gramíneas de pastoreo que exhiben, aún en el momento óptimo de cosecha, contenidos de PB y valor nutricional inferior (Minson, 1992; Elizondo y Boschini, 2001).El contenido proteico del FVH, correspondiente a la planta entera, fue ligeramente inferior al informado por Espinoza et al., 2004 (PB: 19,44%), cuando el cultivo se hizo sin la adición de soluciones nutritivas. Sin embargo, los resultados obtenidos en condiciones deficientes de iluminación, son superiores a los informados por la FAO, 2002 (PB: 9,00%) para el
maíz cultivado a plena luz.En este sentido, varios autores han informado que algunas gramíneas presentan mayor contenido de PB cuando son cultivadas bajo sombra, a diferencia de cuando se encuentran bajo plena iluminación (Simón,
2005). Aunque estas plantas son heliófitas, la baja iluminación influye positivamente en el contenido de N foliar.Específicamente en maíz, Müller
et al. (2005b) informaron que a menor edad del germinado y mayor densidad de semilla por unidad de área, se obtienen mayores valores de PB. No obstante, con otras variedades de maíz, (grano amarillo (PB: 20,41%) y blanco (PB: 16,83%)) se han obtenido concentraciones proteicas mayores a las de este experimento (Flores et al., 2004). Adicionalmente, los valores de PB de FVH reseñados en esta investigación son superiores a los informados en el cultivo de maíz en condiciones de campo (Parra, 1996).Analizando los resultados integralmente, en función de las soluciones utilizadas en este estudio, la A presentó ventajas para las variables R y A, ya que, el maíz absorbió cantidades similares de líquido y las diferencias en la composición integral de cada
fertilizante pudo haber influido en el comportamiento.Esto podría explicarse debido a que la proporción y concentración en que se encuentran los nutrientes en solución A sea la más adecuada a las necesidades del maíz en cultivos hidropónicos, bajo las condiciones
de experimentación; confirmando la observación realizada por Urias (1997) cuando mencionó que no existe una única fórmula para nutrir los cultivos hidropónicos y la mejor es la que se experimenta con óptimos resultados.En sentido general, los métodos de cultivo
presentaron una influencia menos marcada, solo ocasionando variaciones sustanciales en el R. En este sentido, sería pertinente utilizar los métodos MP y P para la producción masiva de FVH en condiciones de iluminación deficiente.CONCLUSIONES
Se encontró efecto significativo en el uso de los métodos de cultivo empleados (papel, malla y malla- papel) y las soluciones nutritivas preparadas con fertilizante líquido comercial (Nitrofoska® y Quimifol®) en la producción de FVH de maíz.
En las condiciones experimentales, los métodos con papel y malla-papel mostraron ser más eficientes en función del R. Sin embargo, el tipo de método no produjo variaciones sustanciales en la altura, cantidad de solución absorbida y porcentaje de MS.
RECOMENDACIONES
Las seis combinaciones en las cuales fue cultivado el FVH de maíz, resultaron factibles para ser utilizadas en la producción de FVH a mayor escala para la alimentación animal.
LITERATURA CITADA
1. Amador, A.L. y C. Boschini. 2000. Fenología productiva y nutricional de maíz para la producción de forraje. Agronomía Mesoamericana. 11(1): 171-177. [ Links ]
2. Official Methods of Analysis (AOAC). 1990. 15 ed. Association of Official Agricultural Chemistry. Washington, D.C., USA. p. 500. [ Links ]
3. Campêlo, J., J. Gomes, A. Silva, J. Carvalho, G. Coutinho, M. Oliveira, J. Lopes, J. Silva, V.
Marchão and L. Morais. 2007. Forragem de milho hidropônico produzida com diferentes substratos. Rev. Bras. Zootec., 36(2): 276-281. [ Links ]4. Chacón, C. y G. Nieto. 1998. Evaluación agronómica y alimenticia de la asociación maíz – lablab para vacas lecheras de alta producción. In: Tejos, R.; Zambrano, C.; Mancilla, L.; García, W. y M. Camargo (Eds.). IV Seminario Manejo y Utilización de Pastos y Forrajes en Sistemas de Producción Animal. UNELLEZ. Barinas,
Venezuela, pp. 115-127. [ Links ]5. Durany, U. 1984. Hidroponía. Cultivo de Plantas sin
tierra. 5ta Ed. Editorial Sintes, S.A, Barcelona, España. [ Links ]6. Elizondo, J. y C. Boschini. 2001. Efecto de la densidad de siembra sobre el rendimiento y calidad del forraje de maíz. Agronomía Mesoamericana, 12(2): 181-187. [ Links ]
7. Elizondo, J. y C. Boschini. 2002. Producción de forraje
con maíz criollo y maíz híbrido. Agronomía Mesoamericana, 13(1): 13-17. [ Links ]8. Espinoza, F., P. Argenti, G. Urdaneta, C. Araque,
A. Fuentes, J. Palma y C. Bello. 2004. Uso del forraje de maíz (Zea mays) hidropónico en la alimentación de toretes mestizos. Zootecnia Trop., 22(4): 303-315. [ Links ]9. Food and Agriculture Organization (FAO). 2002. Manual Técnico: Forraje Verde Hidropónico. Oficina Regional de la FAO para América Latina y El Caribe. Santiago de Chile, Chile. [ Links ]
10. Flores, Z., G. Urdaneta y J. Montes. 2004. Densidad de siembra del maíz (Zea mays) para la producción de forraje verde hidropónico. Resumen del XII Congreso de Producción e Industria Animal. Maracay, estado Aragua, Venezuela p. 136. [ Links ]
11. Fundora, B. y P. Arzola. 1992. Agroquímica. Editorial Pueblo y Educación. La Habana Cuba. p 54 [ Links ]
12. Guzmán, J. 1986. Pastos y Forrajes en Venezuela. 2
da Ed. Espasande S.R.L, Caracas, Venezuela. [ Links ]13. Herrera, A. M., L. Depablos, R. López, M. Benezrra y L. Ríos. 2007.
Degradabilidad y digestibilidad de la materia seca del forraje hidropónico de maíz (Zea mays). Respuesta animal en términos de consumo y ganancia de peso. Revista Científica FCV-LUZ, XVII (4): 372-379. [ Links ]14. Mesa, A.R., S. Hussein y D.E. García. 2005. Efecto del Liplant en el rendimiento de materia seca de Morus alba
. Pastos y Forrajes 28(2): 141-147. [ Links ]15. Minson, 1992. Composición química y valor nutritivo de las gramíneas tropicales.
In: (Skerman, P Ed.), FAO, Roma pp. 181-202. [ Links ]16. Müller, L., O. Santos, P. Manfron, V. Haut, E. Binotto, S. Medeiros e D. Dourado. 2005a. Produção e qualidade bromatológica de gramíneas em sistema hidropônico, Uruguaiana. Revista da FZVA (Brasil). 12(1): 88-97.
17. Müller, L., P. Manfron, O. Santos, S. Medeiros, V. Haut, D. Dourado, E. Binotto e A. Bandeira.
2005b. Produção e composição bromatologica da forragem hidropônica de milho, Zea mays L., com diferentes densidades de semeadura e datas de colheita. Zootecnia Trop., 23(2): 105-119. [ Links ]18. Parra, A. 1996. Evaluación de cultivares criollos e híbridos de maíz (Zea mays L.) para uso forrajero bajo condiciones de bosque seco tropical. Rev. Fac. Agron. (LUZ), 13(3): 251-260. [ Links ]
19. Pineda, M. 2004. Resúmenes de fisiología vegetal.
Servicios de publicaciones de la Universidad de Córdoba, Córdoba, España. p. 204. [ Links ]20. Resh, H. 1982. Cultivos hidropónicos. Ediciones Mundi Prensa. Primera edición. España p. 180. [ Links ]
21. Rivera, A. y M. Moronta. 2000. Producción de forraje verde hidropónico (FVH) de maíz (
Zea mays L.) comparando la eficiencia de tres métodos de cultivo y dos soluciones nutritivas, en condiciones de iluminación natural deficiente. Tesis de grado. Técnico Superior Pecuario. Núcleo Universitario "Rafael Rangel", Universidad de los Andes, Trujillo, Venezuela p. 132. [ Links ]22. Simón, L. 2005. El silvopastoreo: un nuevo
concepto de pastizal. (Simón, L. Ed.) Editorial Universitaria, San Carlos de Guatemala, Guatemala p. 214. [ Links ]23. Urias, E. 1997. Hidroponía. Como cultivar sin tierra. Red de Hidroponía. Lima, Perú. p. 7. [ Links ]
24. Visauta, B. 1998. Análisis Estadístico con SPSS para Windows. En: Estadística Multivariante. McGraw-Hill-Interamericana de España. Madrid, España. p. 200. [ Links ]