Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Zootecnia Tropical
versión impresa ISSN 0798-7269
Zootecnia Trop. v.28 n.1 Maracay mar. 2010
Propiedad fungistática in vitro de propóleos sobre tres aislamientos de Colletotrichum gloeosporioides
Juan Pineda1*, Judith Principal2, Carlos Barrios2, Deivis Milla3, Yohan Solano3, y Elizabeth Gil3
1 Universidad Centroccidental Lisandro Alvarado (UCLA), Laboratorio de Micología. Decanato de Agronomía. Posgrado de Fitopatología. *Correo electrónico: jpineda@ucla.edu.ve.
2UCLA. Decanato de Ciencias Veterinarias. Estación de Apicultura.
3Programa de Ingeniería Agronómica. Tarabana, estado Lara.
RESUMEN
La antracnosis causada por el hongo Colletotrichum gloeosporioides, es una patología que ocasiona pudriciones postcosecha y reduce el valor comercial de muchas frutas en Venezuela. Con el propósito de evaluar la acción fungistática del propóleos de Apis mellifera sobre cepas de C. gloeosporioides que afecta frutos de aguacate (Persea americana), lechosa (Carica papaya) y parchita (Passiflora edulis), se utilizó un propóleos proveniente de la Estación de Apicultura, Sub-estación Guaremal, UCLA. Los tratamientos fueron: Testigo (sin tratar) y diluciones del propóleos en etanol al 0%, 15%, 20% y 30%. En medio de cultivo Agar-Papa-Dextrosa (APD), se colocó en cada cápsula 4 círculos de papel filtro, previamente remojados durante 5 minutos en el propóleos a la dilución necesaria y un disco de la cepa respectiva de C. gloeosporioides en el centro de la misma. Las mediciones se realizaron diariamente hasta que el testigo alcanzó el máximo radio. En la dilución se determinó la presencia de metabolitos secundarios. Se observaron diferencias significativas entre los tratamientos, al compararlos con el testigo, el menor desarrollo del hongo ocurrió, para las cepas provenientes de aguacate y parchita, con propóleos al 30% (27,6 mm y 28,9 mm, respectivamente), y para la de lechosa, con propóleos al 20% (25,3 mm). La inhibición del crecimiento estuvo alrededor del 30%. Las diluciones del propóleos al 15%, 20% y 30% estadísticamente no presentaron diferencias significativas entre sí, por lo cual resultaron similares en su efecto. Se demostró el efecto supresor del propóleos sobre el crecimiento micelial de C. gloeosporioides y la presencia de compuestos flavonoides en el extracto.
Palabras Clave: antracnosis, Colletotrichum gloeosporioides, propóleos, fungistático.
In vitro fungistatic property of propolis on three Colletotrichum gloeosporioides isolates
ABSTRACT
Antracnose caused by the fungus Colletotrichum gloeosporioides, is a pathology that causing fruit rot and reducing the commercial value of many fruits in Venezuela. In order to evaluate the antifungic property of Apis mellifera propolis on isolates of C. gloeosporioides that affect fruits of avocado (Persea americana), papaya (Carica papaya) and passion fruit (Passiflora edulis), a study was done using a propolis collected from the Guaremal Apicultural Station, UCLA. The treatments were: control (no treated) and dilutions of the propolis in ethanol to 0%, 15%, 20% and 30%. On PDA culture medium, was placing in each Petri dish four circles of paper filter, previously soaked during 5 minutes in the propolis to the necessary dilution, and a disc of the respective strain of C. gloeosporioides in the center of the same one. The measurements were made daily until the control treatment reached the maximum ratio. In the propolis dilution the presence of secondary metabolites was determined. Significant differences between treatments were observed as far as development of the fungus, when comparing them with control treatment, the smaller development of the fungus happened, for the stocks of avocado and passion fruit, with propolis to 30% (27.6 mm and 28.9 mm, respectively), and for the one of papaya, with propolis to 20% (25.3 mm). The inhibition of the growth was around 30%. The propolis dilutions at 15, 20 and 30% statistically did not present significant differences to each other, thus those were similar in their effect. A suppressor effect of the propolis on the micelial growth of C. gloeosporioides and presence of flavonoids compounds in extract were demonstrated.
Keywords: antracnose, Colletotrichum gloeosporioides, honeybee propolis, fungistatic.
Recibido: 20/04/09 Aceptado: 14/02/10
INTRODUCCIÓN
El propóleos es una sustancia resinosa, color verde oscuro a castaño, sabor amargo, olor generalmente agradable, que es recolectado por las abejas obreras (Apis mellifera L.) de las yemas jóvenes y corteza de algunas especies de plantas, que durante el proceso de recolección, transporte y almacenaje, le adicionan ceras y secreciones salivales (Principal et al., 2002), lo cual le confiere propiedades terapéuticas al producto. La composición química del propóleos es bastante compleja y depende de la fuente vegetal de donde las abejas lo colectan (Peña, 2008). En estado natural contiene ceras, resinas, bálsamo, polen, aceites vegetales y aromáticos, minerales, vitaminas, aminoácidos y flavonoides (Abd El Hady y Hegazi, 2002; Bankova et al., 2002; Machado et al., 2004). Los flavonoides se encuentran ampliamente distribuidos en el reino vegetal, en las plantas superiores y especialmente en aquellas con sistema vascular; se encuentra en las partes aéreas de las plantas, en los capullos y hojas jóvenes, además que son los compuestos responsables de la coloración de numerosas flores y de ciertas frutas (Sosa López et al., 2000).
La antracnosis del fruto causada por el hongo patógeno C. gloeosporioides (Penz.) Sacc., es una enfermedad que afecta muchos cultivos frutales que se producen en Venezuela, ocasionando pudriciones y reduciendo drásticamente su valor comercial. Entre los frutos más afectados por el agente causal de la antracnosis en el país se encuentran: aguacate (Persea americana Miller), lechosa (Carica papaya L.), parchita (Passiflora edulis Sims.), mango (Mangifera indica) y cambur (Musa spp).
Esta patología se expresa principalmente cuando los frutos comienzan a madurar, causando manchas necróticas depresivas sobre la superficie del tejido, especialmente en condiciones de mal manejo durante el transporte y almacenamiento del producto. Además de las lesiones externas que causa, el hongo penetra el interior del fruto, alterando la pulpa y causando pudriciones de tejidos internos (Avilán et al., 1992).
El hongo C. gloeosporioides presenta colonias con abundante micelio blanco al principio en el medio de cultivo APD, pero luego se tornan grisáceas a oscuras con la edad, con masas de esporas o conidios color rosado a salmón principalmente en el centro de la colonia. Conidios cilíndricos, con extremos obtusos a redondeados, hialinos, sin septos y uninucleados (Sutton, 1992, Afanador-Kafuri et al., 2003; Freeman et al., 1998; Oliveira et al., 2005).
En varios trabajos de investigación se ha indicado que las cepas de C. gloeosporioides obtenidas de diversos hospedantes, muestran un amplio rango de variabilidad en morfología y patogenicidad, las mismas han sido referidas como una especie colectiva o compleja (Afanador-Kafuri et al., 2003; Freeman et al., 1998; Thaung, 2008). Al respecto, Thaung (2008) acota que los nombres de las especies de Colletotrichum no han tenido mucha significancia debido a su extenso rango de hospedantes, formas intermedias y variaciones morfológicas y patológicas relacionadas a influencia ambiental. Alternativamente, se han realizado investigaciones utilizando métodos moleculares y criterios morfológicos (Johnston, 2000; Afanador-Kafuri et al., 2003; Thaung, 2008), para reducir las incongruencias reportadas en la identificación de especies de Colletotrichum.
El uso de productos químicos para el control de esta enfermedad ha ocasionado diversos problemas ecológicos; ante esta situación, el propóleos se presenta como una alternativa de control que puede actuar de forma equilibrada con el ambiente debido a su origen natural (Principal et al., 2002). La actividad antimicrobiana del propóleos ha sido bien documentada por diversos autores a escala mundial (Garedew et al., 2004; Lu et al., 2005; Oliveira, 2006; Koru et al., 2007; Quintero-Mora et al., 2008). En Venezuela, los estudios del propóleos se han orientado al uso en la medicina humana y animal (Principal et al., 2002, 2004; Principal, 2005), a pesar de estas contribuciones, pocos trabajos se han reportado sobre su uso como antifúngico en el control de hongos fitopatógenos. El estudio de la acción antimicótica del propóleos sobre hongos fitopatógenos permitirá el control de éstos con estrategias no contaminantes, lo cual significará un avance hacia la agricultura sostenible (Sosa López et al., 2000).
Investigaciones realizadas en Brasil (Fernándes et al., 2007) para evaluar la actividad antimicótica in vitro del extracto de propóleos en diferentes concentraciones sobre una cepa ATTC90112 de Cryptococcus neoformans, demostraron una actividad fungistática del extracto del propóleos sobre el crecimiento del hongo en concentraciones que oscilaron desde 0,2 mg.ml – 1,6 mg.ml. Otros estudios (Oliveira et al., 2006; Quintero-Mora et al., 2008) evaluaron la actividad antifúngica in vitro de extractos de propóleos contra levaduras presentes en pacientes afectados de onychomycosis, así como la evaluación in vitro de extractos de propóleos procedentes de tres diferentes orígenes geográficos sobre el crecimiento de Candida albicans en pacientes humanos respectivamente, reportando efectos fungistático a bajas concentraciones y efecto fungicida a altas concentraciones de los extractos utilizados.
En este sentido, la presente investigación tiene como objetivos evaluar la acción antifúngica in vitro de diferentes diluciones de propóleos de A. mellifera L. sobre tres cepas del hongo C. gloeosporioides, aisladas de frutos de aguacate, lechosa y parchita afectados por este patógeno, así como determinar la presencia de metabolitos secundarios, con propiedades fungistáticas, en el propóleos estudiado.
MATERIALES Y MÉTODOS
El estudio se realizó en el Laboratorio de Micología del Posgrado de Fitopatología de la Universidad Centroccidental Lisandro Alvarado (UCLA) Lara, Venezuela, a una temperatura ambiente de 25°C ± 2 °C. Se utilizó propóleos colectados en la Estación de Apicultura, Sub-estación Guaremal, del Decanato de Ciencias Veterinarias de esta institución, ubicada en el Municipio Peña, estado Yaracuy, a 500 m.s.n.m., con precipitación anual de 164,9 mm distribuida entre mayo-noviembre; la temperatura promedio es 25,8 oC y la humedad relativa 80%. En cuanto a las especies de plantas más importantes en relación a su abundancia, se encuentra Cannavalia brasiliensis, Ludwigia octovalvis, L. peruviana, Ipomoea indica, Bidens pilosa, Solanum hyporhodium, Melantera aspera, Aldama dentata, Tridax procumbens, Acalypha cuspidata y Sida acuta (Méndez, 2007).
Este estudio se enmarcó en un diseño experimental completamente al azar con 5 tratamientos y 5 repeticiones para cada una de las cepas de C. gloeosporioides pertenecientes al cepario del Laboratorio de Micología ya mencionado, aisladas de frutos de aguacate (Persea americana), provenientes de Terepaima, Cabudare, estado Lara; lechosa (Carica papaya), provenientes del campo experimental del Postgrado de Agronomía-UCLA, Cabudare-estado Lara; parchita (Passiflora edulis), procedentes del municipio Sucre del estado Zulia, las cuales están identificadas en el registro del cepario con los números 74, 137 y 47 respectivamente.
Se utilizó una cápsula como unidad experimental. Los tratamientos fueron los siguientes: Testigo (sin tratar) y diluciones del propóleos al 0% (sólo etanol), 15, 20 y 30%. Como medio de cultivo del hongo se utilizó Agar –Papa- Dextrosa (APD) como medio de cultivo.
Las diluciones del propóleos se realizaron con etanol 96 °GL, ya que se ha demostrado que este diluyente permite la extracción de principios activos como los flavonoides (Machado et al., 2004; Salamanca et al., 2007). Para obtener la dilución necesaria de cada tratamiento se mezcló, en morteros por separado, las cantidades de 7,5 g; 10 g y 15 g de propóleos con 42,5 ml; 40 ml y 35 ml de etanol al 96 °GL, respectivamente. El propóleos crudo se maceró en el mortero hasta obtener una dilución de color oscuro la cual se conservó en frascos ámbar previamente esterilizados. Se agitó durante tres días por una hora diariamente. Al finalizar el período de agitación se procedió a filtrar la solución de propóleos, haciendo uso de una gasa estéril doble, para descartar cualquier partícula sólida presente en la solución, obteniéndose así el extracto etanólico de propóleos (EEP).
Los aislamientos utilizados para llevar a cabo el estudio provenían de cepas purificadas que se encuentran en el laboratorio de Micología antes señalado e identificadas, de acuerdo a sus características morfológicas y culturales en APD, como pertenecientes a la especie C. gloeosporioides (Penz.) Penz y Sacc.
De cada cepa se tomaron 25 muestras de aproximadamente 0,5 cm de diámetro, colocando una muestra en el medio de cultivo APD en el centro de cada cápsula de Petri. Para cada aislamiento se formaron 5 grupos a partir de las 25 cápsulas, de las cuales 5 representaron el testigo y a 15 de ellas se les aplicó la metodología propuesta por Álvarez et al. (2004) modificada, con la intención de aumentar el número de radios a medir y disminuir el error. A cada cápsula se le colocó 4 círculos de papel de filtro de aproximadamente 1 cm de diámetro, que previamente fueron remojados durante 5 minutos en la dilución de propóleos, a la concentración necesaria para cada tratamiento.
Los círculos de papel, luego de ser remojados, se dejaron secar en la cámara de flujo laminar para ser colocados en las cápsulas, a una separación equidistante aproximada del inóculo (C. gloeosporioides) de 3 cm. A las cinco cápsulas restantes se les aplicó la misma metodología antes descrita para los círculos de papel de filtro, sólo que éstos fueron remojados en Etanol puro (96 °GL), como un tratamiento para descartar el posible efecto del alcohol sobre el patógeno.
Finalmente, las cápsulas se expusieron a la luz del laboratorio y se dejó desarrollar el hongo. Las evaluaciones se iniciaron 24 horas después de la inoculación, para lo cual se marcaron 8 radios de la cápsula a partir de los cuales se midió el crecimiento del micelio del hongo. Estas mediciones se realizaron diariamente hasta que el testigo alcanzó el máximo radio de la cápsula de Petri.
Los datos colectados fueron organizados en una matriz y posteriormente procesados y analizados mediante un análisis de varianza y prueba de medias de tratamientos de Tukey, usando el software Statistix, versión 8.0..
Determinación de metabolitos secundarios (MS) En la dilución del propóleos se determinó la presencia de MS de forma cualitativa, siguiendo la metodología recomendada por Marcano y Hasegawa (2002), la cual consiste en aplicar determinadas sustancias y reactivos a un extracto específico que se desea estudiar, de lo cual resulta una respuesta cualitativa que indica la presencia o ausencia del metabolito requerido. Para cada tipo de MS la metodología es la siguiente:
Alcaloides
En un embudo de separación fue colocado 1ml de propóleos, se añadió igual cantidad de HCl concentrado y fue agitado hasta lograr una mezcla homogénea, que posteriormente se alcalinizó aplicandole NH4OH, hasta lograr el cambio de pH (alcalino); se agregó 2 ml de cloroformo y luego fue separada la primera fase.
El contenido restante en el embudo, la fase acuosa, fue tratada nuevamente con NH4OH, lográndose dos nuevas fases, cada una de estas se retomó en envases separados. En un pedazo de cromatofolio de Silica/ gel 60 F254 (MerckMR) de 10x2 cm, se colocaron tres gotas de cada una de las fases y fueron rociadas con el reactivo de Meyer. Si los alcaloides estaban presentes, observandose un cambio en la coloración y en este se corroboraron los resultados con reactivo de Dragendorff, aplicado de la misma manera.
Polifenoles y taninos
A 1 ml de propóleos se le añadió igual cantidad de una solución de cloruro Férrico (FeCl3) al 1%. La presencia de una coloración parda al reaccionar la mezcla era indicativo de la presencia de esta clase de MS. Con el fin de corroborar los resultados se le agregó 1 ml de gelatina disuelta en NaCl, ambos al 1%; la presencia de un precipitado demostró que los polifenoles y taninos estaban presentes.
Saponinas
En un vial se colocó 1 ml de propóleos y se le añadió 2 ml de agua de grifo. La mezcla fue agitada fuertemente y se dejó reposar por 20 min; la permanencia de una espuma consistente por este mismo tiempo demuestra la presencia de ésta clase de MS.
Antraquinonas
El propóleos se trató con 1 ml de KOH 0,5%, se acidificó con ácido acético (hasta el cambio de pH) y se agitó con 1ml de Benceno. La mezcla se alcalinizó con NH4OH, la aparición de una coloración rojiza demuestra la presencia de esta clase de MS.
Flavonoides
Se colocó 1ml de propóleos en un beaker y se le agregó igual cantidad de HCl concentrado y 2 ó 3 virutas de Magnesio. La aparición de una coloración rojiza al dejar la mezcla en reposo por 20 min, demostró la presencia de esta clase de MS.
RESULTADOS Y DISCUSIÓN
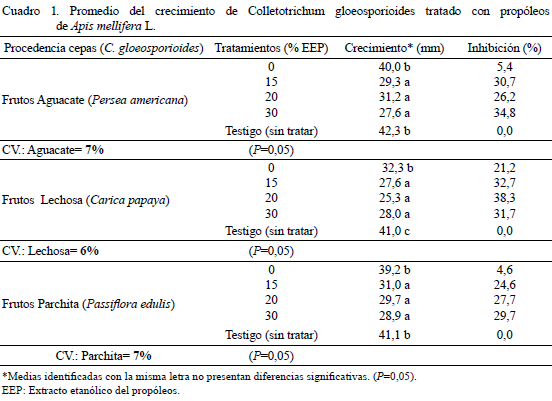
Se observaron diferencias estadísticas significativas (P=0,05) con un bajo coeficiente de variación entre los tratamientos usados para las cepas de C. gloeosporioides provenientes de frutos de aguacate, lechosa y parchita respectivamente, en cuanto a crecimiento micelial del hongo, lo cual refleja las propiedades fungistáticas del propóleos sobre los aislamientos de C. gloeosporioides, al ser comparados individualmente con el testigo (Cuadro 1) . El tratamiento con etanol (sin propóleos o control) se mostró estadísticamente igual al testigo (sin tratar) o en todo caso diferente a los tratamientos con propóleos (como ocurrió con la cepa de lechosa), lo cual indica que el alcohol tuvo poco o ningún efecto inhibitorio sobre el crecimiento micelial del patógeno, en las condiciones en las que se realizó este ensayo.
Los porcentajes de inhibición del crecimiento de C. gloeosporioides estuvieron alrededor del 30% para el caso de las cepas provenientes de aguacate y lechosa, siendo un poco más bajos para la cepa obtenida de parchita (cercanos al 27%), lo cual es muy importante para el tratamiento de frutos postcosecha, ya que una inhibición del patógeno a estos niveles porcentuales puede retardar en buena parte el desarrollo de la enfermedad por un período durante el cual puede ser consumido o procesado el producto sin que se manifiesten daños o pudriciones no deseadas que afectan la calidad del fruto. Estos resultados son congruentes con los obtenidos por Álvarez et al. (2004), quienes reportaron que las diluciones de propóleos al 5% fueron efectivas en el control de Colletotrichum sp.
En este mismo orden de ideas, Sosa López et al. (2000), al evaluar diferentes alícuotas de diluciones al 1% de propóleos proveniente de tres provincias de Corrientes, Argentina, demostraron que el mismo posee propiedades antifúngicas.
Al respecto, Obasa et al. (2007) evaluaron la eficacia del extracto etanólico de doce concentraciones de propóleos sobre el crecimiento del hongo C. lindemuthianum obtenido de hojas de judías infectadas con antracnosis. Estos investigadores reportaron una inhibición del crecimiento del micelio del hongo hasta por 21 d en los medios de crecimiento contentivos de extractos de propóleos en concentraciones entre 6% y 10%. De igual manera, los autores observaron que los medios de cultivo que contenían concentraciones de extractos de propóleos entre 20-30%, presentaron un efecto fungicida sobre el hongo C. lindemuthianum.
Los tratamientos con diferentes diluciones de propóleos evaluados en esta investigación, no presentaron diferencias estadísticamente significativas entre sí, por lo tanto; las concentraciones de 15%, 20% y 30% de propóleos resultaron similares en su efecto sobre el crecimiento micelial del patógeno en cada caso (Cuadro 1) y numéricamente la variación en el porcentaje de inhibición dentro de ellas no fue superior al 6,6%.
Este hecho sugiere, que cualquiera de las tres puede ser utilizada en pruebas para el control de la enfermedad en frutos postcosecha, recomendándose por supuesto la de menor concentración, sin embargo, es probable que concentraciones del propóleos inferiores al 15% también pudieran tener el mismo efecto supresor sobre el crecimiento de C. gloeosporioides, por lo cual deberían ser probadas para tratar de bajar la concentración a utilizar en estudios de control de la antracnosis en frutos, con miras a una mayor eficiencia del producto.
En relación a la determinación de metabolitos secundarios en los extractos del propóleos estudiado en esta investigación, se detectó la presencia de compuestos flavonoides, alcaloides y taninos (Cuadro 2). La presencia de tales compuestos en el propóleos utilizado en este estudio, podría explicar en parte la acción antifúngica que el extracto de propóleos ejerció en el desarrollo de C. gloeosporioides, teniendo en consideración lo señalado por Obasa et al. (2007) en cuanto a que el efecto antimicótico sobre el crecimiento de C. lindemuthianum puede ser atribuído a la presencia de compuestos fenólicos encontrados en los extractos usados en esa investigación.
En otros trabajos de investigación, se han estudiado algunas propiedades antibacterianas, fungicidas y antivirales que los flavonoides confieren al propóleos (Sosa López et al., 2000; Machado et al., 2004), observándose que estos compuestos en sinergia con el ácido nicotínico, caféico, ferúlico y ascórbico actúan como barrera química contra los microorganismos. Por su parte Lu et al., 2005 determinaron la actividad antibacterial del extracto etanólico de propóleos colectado en diferentes períodos y varias regiones en Taiwan, contra Staphylococcus aureus, reportando varios grados de actividad antibacteriana dependientes de la concentración, área y época de recolección del propóleos; estos autores reportan la mínima concentración inhibitoria (MIC) del extracto entre 3.75 a 60 ug/ml mientras que la mínima concentración bactericida (MCB) osciló entre 7.5 y 120 ug/ml contra S. aureus.
En este mismo orden de ideas, Quiroga et al. (2006) demostraron que la pinocembrina y la galangina fueron parcialmente responsables de la actividad tóxica presentada por el propóleos sobre varias cepas de hongos fitopatógenos. Melliou et al. (2007) estudiaron la actividad antimicrobiana de los constituyentes volátiles de propóleos de varias regiones de Grecia, en los cuales predominaron terpenoides especialmente, α-pinene, sobre seis bacterias y tres hongos, encontrando que la mayor actividad fue observada contra hongos.
Es importante resaltar, que a pesar de la gran variedad de compuestos químicos que han sido reportados en las muestras de propóleos a escala mundial, los flavonoides son detectados frecuentemente en las mismas, los cuales probablemente contribuyen en la actividad antimicrobiana (Salatino et al., 2005). En esta investigación, se encontraron presentes compuestos flavonoides, los cuales podrían ser responsables de la acción antifúngica exhibida por el propóleos procedente de la estación de apicultura Guaremal.
CONCLUSIONES
En esta investigación se evidenció la propiedad antifúngica del propóleos sobre el crecimiento micelial del hongo fitopatógeno C. gloeosporioides procedente de cepas obtenidas de frutos de aguacate (Persea americana), lechosa (Carica papaya) y parchita (Passiflora edulis) observándose un porcentaje de inhibición del 30%, el cual se considera importante en el caso de hacer aplicaciones preventivas de propóleos en frutos cosechados con la finalidad de retardar la infección y el desarrollo de la enfermedad, y adicionalmente permitir alargar el período de almacenamiento y comercialización del producto.
Las diluciones del propóleos al 15%, 20% y 30% ejercieron un efecto similar sobre el crecimiento de C. gloeosporioides, considerándose que resultaron iguales en su acción sobre el patógeno. Por lo tanto, teniendo en cuenta la utilización del propóleos en una forma más eficiente y económica, se pudiera manejar la dilución más baja (15%) en pruebas de aplicación del propóleos en frutos de aguacate (Persea americana), parchita (Passiflora edulis) y lechosa (Carica papaya) con miras a la prevención y control de la enfermedad producida por este patógeno.
Se evidenció la presencia de compuestos flavonoides y alcaloides en el extracto de propóleos utilizado en este estudio, los cuales pueden explicar la acción antifúngica ejercida sobre el desarrollo de C. gloeosporioides.
RECOMENDACIONES
De acuerdo a los resultados obtenidos en esta investigación se puede recomendar el uso del propóleos como alternativa en la prevención y control de las pudriciones de los frutos ocasionadas por C. gloeosporioides en aguacate, lechosa y parchita.
LITERATURA CITADA
1. Abd El Hady, F.K. and A.G. Hegazi. 2002. Egyptian propolis: 2 Chemical composition, antiviral and antimicrobial activities of East Nile Delta propolis. Z. Naturforsch. 57c: 386-394. [ Links ]
2. Afanador-Kafuri, L., D. Minz, M. Maymon and S. Freeman. 2003. Characterization of Colletotrichum isolates from tamarillo, passiflora, and mango in Colombia and identification of a unique species from the genus. Phytopathology 93:579-587. [ Links ]
3. Álvarez, D., M. Castañeda, N. Montero, A. Rodríguez, Y. Rodríguez y J. Pineda. 2004. Aplicación del propóleos de abejas (Apis mellifera) para el control de la antracnosis causada por Colletotrichum gloeosporioides, patógeno en frutos de mango. Manuscrito. UPEL. Barquisimeto, Venezuela. p. 40. [ Links ]
4. Avilán, L., F. Leal y D. Batista. 1992. Manual de fruticultura: Principios y manejo de la producción. Editorial América. 2da. Edición. (II Tomos). Caracas, Venezuela. [ Links ]
5. Bankova, V., M. Popova, S. Bogdanov, and A. Sabatini. 2002. Chemical composition of European propolis: Expected and unexpected results. Z. Naturforsch. 57c: 530-533. [ Links ]
6. Fernandes, F.F., A.L.T. Dias, C.L. Ramos, M. Ikegaki, A.M. Siqueira and M.C. Franco. 2007. The in vitro antifungal activity evaluation of propolis G12 ethanol extract on Cryptococcus neoformans Rev. Inst. Med.Trop. S. Paulo 49 (2): 93-95. [ Links ]
7. Freeman, S., T. Katan, and E. Shabi. 1998. Characterization of Colletotrichum species responsible for Anthracnose diseases of various fruits. Plant Dis. 82: 596-605. [ Links ]
8. Garedew, A., E. Schmolz and I. Lamprecht. 2004. Microbiological and calorimetric investigations on the antimicrobial actions of different propolis extracts: an in vitro approach. Thermochimica Acta 422: 115-124. [ Links ]
9. Johnston, P.R. 2000. The importance of phylogeny in understanding host relationships within Colletotrichum. In: Prusky, D.; Freeman, S.; Dickman, M. (eds.). Colletotrichum. Host specificity, pathology, and host-pathogen interaction. APS Press, St. Paul, Minnesota. p. 393. [ Links ]
10. Koru, O., F. Toksoy, C.H. Acikel, Y.M. Tunka, M. Baysallar, A.U. Guclu, E. Asli, O. Tuylu, K. Sorkum, M.T. Ksel and B. Salih, B. 2007. In vitro antimicrobial activity of propolis samples from different geographical origins against certain oral pathogens. Anaerobe 13: 140-145. [ Links ]
11. Lu, L.C., Y.W. Chen and C.C. Chou. 2005. Antibacterial activity of propolis against Staphylococcus aureus. International Journal of Food Microbiology 102: 213-220. [ Links ]
12. Machado, I., M. Osorio, G. Salamanca y J. Cabrera.2004. In: Memorias 1er Encuentro Latinoamericano de Apicultores. Cuba. [ Links ]
13. Marcano, D. y M. Hasegawa. 2002. Fitoquímica Orgánica. Universidad Central de Venezuela. Caracas, Venezuela. p. 588. [ Links ]
14. Melliou, E., E. Stratis and I. Chinou. 2007. Volatile constituents of propolis from various regions of Greece-Antimicrobial activity. Food Chemistry 103: 375-380. [ Links ]
15. Méndez, C.P. 2007. Flora apibotánica presente en la Estación de Apicultura de la UCLA (Guaremal, Municipio Peña. Estado Yaracuy). Universidad Centroccidental Lisandro Alvarado. Decanato de Agronomía. Cabudare-estado Lara. Trabajo especial de grado. [ Links ]
16. Obasa, K.C., A.Y.A. Adeoti, O.A. Enikuomehin and J.G. Bodunde. 2007. Efficacy of Bee-propolis in the control of Colletotrichum lindemuthianum (Sacc. And Magn.) Briosi and Cav. In vitro. Research Journal of Microbiology 2 (2): 175-179. [ Links ]
17. Oliveira, R., J. Moral, K. Bouhmidi y A. Trapero. 2005. Caracterización morfológica y cultural de aislados de Colletotrichum spp causantes de la antracnosis del olivo. Bol. San. Veg. 31: 531-548. [ Links ]
18. Oliveira, A.C.P., C.S. Shinobu, R. Longhini, S.L. Franco and T.I.E Svidzinski. 2006. Antifungal activity of propolis extract against yeasts isolated from onychomycosis lesions. Memorias do Instituto Oswaldo Cruz. 101 (5): 493-497. [ Links ]
19. Peña, R. 2008. Estandarización en propóleos: Antecedentes químicos y biológicos. Cienc. In. Agr. 35 (1): 17-26. [ Links ]
30. Principal, J., I. Hernández, R.DAubeterre y J.G. Rodríguez. 2002. Eficacia del propóleos en el control de la helmintiasis de ovinos naturalmente infestados. Revista Científica FCV. Universidad del Zulia. Vol. XII. Suplemento 2. 604-607. [ Links ]
21. Principal, J. 2005. El propóleos: Perspectivas terapéuticas en la medicina humana y Veterinaria. Memorias I Congreso Internacional de Apicultura de Los Andes: III Convención de Apicultores. Universidad Nacional Experimental del Táchira, San Cristóbal. Venezuela. pp 57-59. [ Links ]
22. Principal, J., R.D´Aubeterre y Z. Graterol. 2004. El Propóleos: antibiótico natural de la colmena. Importancia en la medicina Humana y Veterinaria. Agroservicios Año 5 (9): 58-60. [ Links ]
23. Quintero-Mora, M.L., A. Londoño-Orozco, F. Hernández-Hernández, P. Manzano-Gayosso, R. López-Martínez, C.I. Soto-Zárate, L. Carrillo-Miranda, G. Penieres-Carrillo, C.G. García-Tovar y T.A. Cruz-Sánchez. 2008. Efectos de extractos de propóleos mexicanos de Apis mellifera sobre el crecimiento in vitro de Candida albicans. Rev. Iberoam. Micol. 25: 22- 26. [ Links ]
24. Quiroga, E.N., D.A. Sampietro, J.R. Soberon, M.A. Scariglia y M.A Vattuone. 2006. Propolis from the Northwest of Argentina as a source of antifungal principles: J. of Appl. Microbiol. 101: 103-110. [ Links ]
25. Salamanca, G., I. Correa-Carvajal and J. Principal. 2007. Perfil de flavonoides e índices de oxidación de algunos propóleos colombianos. Zootecnia Tropical 25 (2): 95-102. [ Links ]
26. Salatino, A., E.W. Texeira, G. Negri and D. Message. 2005. Origin and Chemical variation of Brazilian propolis: Evid. Based complem. alternat. Med. 2: 33-38. [ Links ]
27. Sosa López, A., G. Cabrera, R. Alvarez y C. Verdun. 2000. Búsqueda de usos alternativos de propóleos en el control biológico de hongos fitopatógenos. Facultad de Ciencias Agrarias UNNE. Corrientes - Argentina. En: http://web.unne.edu.ar/cyt/agrarias/a-036.pdf (8-02-2005). [ Links ]
28. Sutton, B.C. 1992. The genus Glomerella and its Colletotrichum anamorph. In: Bailey J.A.,Jeger M.J. (eds) Colletotrichum: biology, pathology and control. CABI, Wallingford. pp. 1-28. [ Links ]
29. Thaung, M.M. 2008. Coelomycete systematics with special reference to Colletotrichum. Mycoscience 49: 345-350. [ Links ]