Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Zootecnia Tropical
versión impresa ISSN 0798-7269
Zootecnia Trop. v.28 n.1 Maracay mar. 2010
Frecuencia cardíaca como indicador de estrés calórico en pollos de engorde
Tony Chacón 1*, Simón Comerma-Steffensen1, Yrina Colina4, Jesús Rojas1, Mario Rossini1, Héctor Zerpa1 Ingrid Oliveros3, Charly Farfán2 y Vasco De Basilio2
1 Universidad Central de Venezuela (UCV), Facultad de Ciencias Veterinarias. Maracay, estado Aragua Venezuela. *Correo electrónico: mvtonych@hotmail.com.
2 UCV, Facultad de Agronomía. Maracay, Venezuela.
3 Instituto Nacional de Investigaciones Agrícolas, Centro Nacional de Investigaciones Agropecuarias, Maracay, estado Aragua. Venezuela.
4 Ejercicio Privado
RESUMEN
Para evaluar la frecuencia cardíaca (FC) en pollos de engorde como un indicador de estrés calórico (EC), se realizó un ensayo en una sala experimental con ambiente semi-controlado en la unidad experimental de aves del Centro Nacional de Investigaciones Agropecuarias (CENIAP) del Instituto Nacional de Investigaciones Agrícolas (INIA). Se utilizaron 32 pollos de la línea Hubbard; identificados por sexo. Los pollos fueron asignados a dos tratamientos constituidos por 16 pollos cada uno (8 machos y 8 hembras). Los pollos del tratamiento 1 (T1) fueron ubicados en una sala caliente y los del tratamiento 2 (T2) en una sala fresca. Cada tratamiento se dividió en 4 corrales (repeticiones) por tratamiento de 4 pollos por réplica. Dentro de la sala fresca, la temperatura ambiental (TA) registró un valor máximo de 30ºC durante toda la fase experimental y la TA de la sala caliente tuvo un máximo de 32ºC. Durante 7 días continuos, entre los 28 y 35 días de edad de los pollos, se midió 4 veces al día, la temperatura corporal (TC) y temperatura ambiental (TA). El peso corporal (PC) y FC (lat/min), se midieron sólo los días 28 y 35 de vida. Los resultados muestran que no se produjeron cambios significativos en la TC (T1: 41,43±0,05ºC vs. T2: 44,50±0,05ºC). En el T1, se registró una FC menor (P<0,05) al T2 (T1: 345,8±2,9 lat/min vs T2: 353,9±2,5 lat/min). No se observó un efecto de la variable sexo sobre la FC, aunque los machos mostraron una tendencia a una menor FC. Se concluye que la FC pudiera ser un indicador sensible para establecer el grado de EC moderado en pollos de engorde sometidos a TA promedio entre 30 y 32°C. Se recomienda incluir esta variable para estudiar variaciones en el nivel de EC en pollos.
Palabras clave: frecuencia cardíaca, estrés calórico, pollos, ecocardiografía.
Heart rate as an indicator of heat stress in broilers
ABSTRACT
Experiments were conducted in a semi-controlled environmental condition, to assess heart rate (HR) as an indicator of heat stress (HS) in broilers. Thirty two broilers (Hubbard) were used. Chickens were identified by sex and were allocated to two treatments: treatment 1 (T1); hot room and treatment 2 (T2); fresh room. Each group was constituted by 16 broilers (eight males and eight females). Chickens from each treatment were placed in four fences (repetitions) per treatment of four broilers per repetition. The fresh room was characterized by a maximum environmental temperature (ET) of 30ºC during the experimental phase, while the maximum ET of the hot room was 32ºC. Both, body temperature (BT) and ET were measured (four times a day) for seven days between 28 and 35 days old. The body weight (BW) and HR (beats/min) was measured on days 28 and 35. The BT was similar (P>0,05) between treatments (T1: 41,43±0,05ºC vs T2: 44,50±0,05ºC). The HR of broilers from T1 was significantly (P<0,05) lower than T2 (T1: 345,8±2,9 lat/min vs T2: 353,9±2,5 lat/min). No significant differences were observed in HR between sexes, although males tended to have a lower HR. It is concluded that HR could be a sensible variable to determine the moderate HS level in broilers under an average ET between 30 and 32°C. It is recommended to include the HR to study variations in the level of heat stress in broilers.
Keyswords: heart rate, heat stress, broilers, echocardiography.
Recibido: 24/04/09 Aceptado: 25/02/10
INTRODUCCIÓN
El centro termorregulador en las aves está ubicado a nivel del hipotálamo y su principal función es controlar el balance calórico, determinando el mantenimiento de la temperatura corporal (TC). Cuando el ave se expone a aumentos de temperatura ambiental (TA), se activan una serie de mecanismos que promueven la disipación del calor, destacándose entre ellos, la vasodilatación periférica y extensión de las alas, lo cual incrementa el área de superficie de contacto con el ambiente, intensificando la convección calórica.
Adicionalmente, es posible disipar calor a través de la excreta de orina y heces, siempre y cuando esta pérdida esté compensada por un aumento en el consumo de agua fresca (Borges et al., 2007).
Cuando la humedad relativa y la TA exceden las zonas de confort del pollo, las aves se vuelven susceptibles a desarrollar estrés calórico, lo que conlleva a un aumento en la TC en detrimento de su rendimiento físico. Se ha sugerido que el máximo crecimiento de los pollos, entre la cuarta y la sexta semana, es obtenido a una temperatura ambiental de 22°C (Berrong et al., 1998). En estas condiciones, los animales muestran un rápido crecimiento con una alta demanda de oxígeno (Khajali et al., 2007).
Una de las respuestas fisiológicas ante el estrés calórico en las aves, está representada por el incremento en la frecuencia respiratoria sin modificar el volumen ventilatorio (jadeo). Sturkie en (1968), sugirió que la evaporación representa el método más eficaz para la disipación de calor a través del aumento en el ritmo respiratorio y a partir de las membranas que tapizan las vías respiratorias.
El aumento del intercambio gaseoso tiene poco incremento en la producción de calor metabólico en las aves, gracias a la presencia de los sacos aéreos adosados a los pulmones, lo cual permite aumentar los niveles de intercambio gaseoso a muy bajo costo energético (Pereira, 1987).
En el ave bajo estrés calórico (EC), se produce un incremento de la temperatura interna, lo que aumenta la tasa de mortalidad, producto de su ineficiencia para regular la TC, bajo condiciones de EC extremo (Berrong et al., 1998). Paradójicamente, temperaturas ambiéntales elevadas durante tres días, son suficientes para incrementar la resistencia al EC, observándose un nivel protectivo de adaptación (May et al., 1986).
Algunos eventos que acontecen en los últimos días del ciclo productivo del pollo son causales de severo estrés, el cual se evidencia por un incremento concomitante de los valores de corticosterona en plasma y frecuencia cardiaca (FC). Cuando la intensidad del estrés se mantienen constante, la corticosterona puede ser liberada en cantidades tan elevadas que se hace citotóxica y suprime las funciones inmunológicas al afectar el tejido linfático provocando la involución de la bolsas de Fabricio y del timo. De esta forma se produce inmunodeficiencia con incremento de la mortalidad y mayor presencia de enfermedades (Fraga, 1999).
Se ha demostrado (Cabanac y Guillemete, 2001) que las condiciones ambientales extremas del galpón durante la última fase del ciclo productivo, se caracterizan por altas tasas de crecimiento y alto metabolismo, los cuales pueden crear un déficit de oxígeno en los pollos de engorde, el cual se trata de compensar con un incremento en el gasto cardíaco del ventrículo derecho, para procurar aumentar la tasa de hematosis pulmonar. Esta respuesta compensatoria resulta en hipertrofia del ventrículo derecho y, posteriormente, insuficiencia congestiva del ventrículo derecho y ascitis en algunas de las aves.
La incorporación de herramientas diagnósticas como la electrocardiografía y la ecocardiografía, proporcionan evidencias fundamentales sobre los efectos del estrés sobre el funcionamiento cardiovascular. A través de estas metodologías, se pueden valorar los cambios en la FC y el ritmo cardíaco, así como la adecuación de las respuestas termorreguladoras cuando estos animales se encuentran bajo EC. (Kettlewell et al., 1997). La ecocardiografía ha sido usada principalmente para determinar la morfología y contractilidad miocárdica (Martínez et al., 1998).
Al mismo tiempo, la valoración de la FC a través de telemetría, representa una de las técnicas más eficientes y sensibles, para evaluar las modificaciones en esta variable durante períodos de cambios en las condiciones ambientales. (Valance et al., 2007). Sin embargo, los altos costos y la inminente necesidad de implantar transductores en las aves, representan importantes limitaciones para su uso, incluso bajo condiciones experimentales.
Existen reportes que sugieren que el desarrollo de arritmias cardíacas y el colapso cardiovascular agudo, están asociadas a la muerte súbita en pollos de engorde (Olkowski, 2007). Considerando los posibles efectos del EC sobre el sistema cardiovascular, el objetivo de este trabajo fue evaluar la FC en pollos de engorde mediante ecocardiografía, determinando las posibles variaciones durante el desarrollo de EC experimental.
MATERIALES Y MÉTODOS
Ubicación
Los experimentos se realizaron en la unidad experimental de aves (CENIAP – INIA: coordenadas 10º, 17, 14´´Oeste: 67º, 36´, 2´´), bajo condiciones de ambiente semicontrolado. La unidad experimental está ubicada a 480 m.s.n.m., con una temperatura media de 25ºC, humedad relativa de 67,5% y una precipitación promedio anual: 1100 mm.
Instalaciones
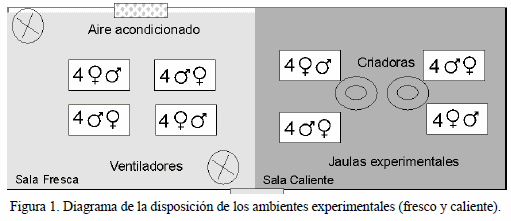
En la Figura 1 se observa un diagrama de la sala experimental de ambiente semi-controlado (14 x 5m), la cual contó con ventiladores, aire acondicionado, criadoras a gas y cortinas para separar dos salas: fresco (30ºC) y caliente (32ºC) tal como se refleja en el Cuadro 1.
En el interior de cada sala se ubicaron cuatro corrales de malla metálica de 2 x 2 m para los diferentes grupos experimentales sometidos a los ambientes en estudio. Para cada corral se utilizó un comedero rectangular y un bebedero de galón.
Animales Setenta (70) pollos, 35 hembras y 35 machos, pertenecientes a la línea Hubbard, fueron criados en condiciones estándar desde el día 1 al día 21 de vida. Posteriormente, se seleccionaron 32 pollos; dividiéndose en 2 grupos de 16 aves cada uno, un grupo para el tratamiento 1 (T1: sala caliente) y otro para el tratamiento 2 (T2: sala fresca). Se asignaron 8 machos y 8 hembras para cada grupo y fueron colocados en 4 corrales (repeticiones) por tratamientos de 4 pollos cada réplica (2 machos y 2 hembras), distribuidos al azar en los corrales de cada grupo.
Diseño del experimento
El estudio fue realizado bajo un diseño completamente al azar, donde fueron utilizadas 2 salas experimentales (caliente y fresca), de 16 pollos cada una, con 4 corrales por sala y 4 pollos por corral.
Equipos y variables evaluadas
Temperatura corporal (TC)
Se midió con una sonda de inmersión/penetración, marca Testo® 110 calibrado con precisión de 0,10ºC desde 0 a 60ºC para TC. Las 32 aves experimentales fueron evaluadas introduciendo la sonda en la cloaca, hasta aproximadamente 5 a 6,4 cm. de profundidad a nivel del colon terminal, dependiendo de la edad y talla del animal. Este procedimiento se realizó 4 veces al día (7:00 a.m.; 11:00 a.m.; 14:00 p.m. y 17:00 p.m.), a lo largo de los 7 días del tiempo experimental.
Temperatura ambiental (TA) y humedad relativa
Se evaluó con un equipo Tannus® de lectura rápida con precisión de 0,1ºC para TA y de 0,1% para humedad relativa. Las variables fueron registradas durante todo el día al inicio y al final de cada período de medición, entre cada variable medida dentro de ambos corrales experimentales.
Frecuencia Cardíaca (FC)
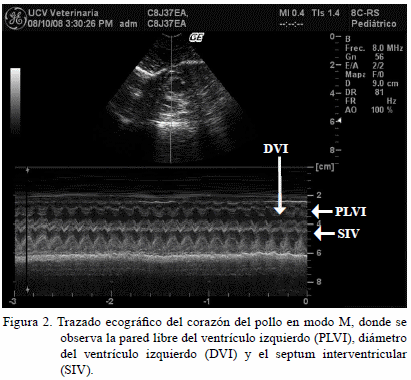
Utilizando un aparato de ultrasonido (ecocardiógrafo) equipo Logic Book XP GE® con transductor micro-convex de 4 a 10 MHz, se evaluó el índice cardíaco a 32 aves. Las imágenes fueron obtenidas con una mínima restricción de las aves y en posición de pie, para minimizar el estrés de la restricción.
También se empleó una frecuencia de 8 MHz, (Martínez et al., 1998), colocando el transductor del lado izquierdo del animal, a una distancia de 1 a 2 cm dorsal a la línea media ventral, por delante de la articulación de la rodilla. Usando el modo B para focalizar la imagen y el modo M, para realizar las mediciones entre sístole y sístole, tomando dos ciclos cardíacos para calcular la FC, la cual fue expresada en latidos por minuto (lat/min). La FC se registró el día 35, durante las horas de máxima temperatura en cada sala (Figura 2).
ANÁLISIS ESTADÍSTICO
Los indicadores de las variables fueron analizados de acuerdo a un arreglo factorial 2 x 2, utilizándose pruebas de ANOVA y pruebas de media de Fisher, para determinar si hubo significación estadística (P<0,05). El paquete estadístico utilizado fue el Stat View®.
RESULTADOS Y DISCUSIÓN
La TC de las aves sometidas al T2 (Cuadro 2), no mostró diferencia significativa (P=0,4) con respecto a las aves sometidas al T1. Los valores absolutos de TC en ambos grupos, coinciden con los reportados por De Basilio et al. (2001), quienes señalaron una TC de 41,09±0,23oC durante las horas frescas y de 41,78±0,28oC en las horas calurosas. Otros grupos de investigación han obtenido TC superiores (41,90oC) en ambientes frescos (May et al., 1986). El incremento de la TC ha sido registrado como un indicador de estrés (Cabanac y Guillemette, 2001).
En contraste con el efecto sobre la TC, el incremento moderado de la TA (T1), se acompañó de valores de FC significativamente (P<0,05) mayores con respecto a los valores obtenidos en aves provenientes del T2 (Cuadro 2). El desarrollo de una mayor FC en estos pollos, podría asociarse al desarrollo de estrés (Cabanac y Guillemete, 2001). Es posible que la sujeción de las aves, pudiera haber generado algún nivel de estrés en las mismas.
Sin embargo, si este fuese el caso, el estrés de la sujeción estuvo incluido en ambos grupos, por lo tanto, cualquier variación en la FC entre los mismos, podría ser atribuible a otros factores estresantes desarrollados durante la modificación de las condiciones ambientales (sala fresca o caliente).
Más aún, los valores absolutos de FC, independientemente de la sala, fueron menores a los obtenidos mediante electrocardiografía en otras aves, en donde se registran valores superiores de FC, de hasta 100 lat/min en gallinas sometidas a un ambiente frío y caliente (Whittow et al., 1966).
Resultados similares han sido obtenidos a través de electrocardiografía por Liu y Li (2005) en aves (perdices) salvajes (Alectories magnas) en diferentes temperaturas. Estos resultados soportan la posibilidad de que las FC menores reportadas en el presente ensayo, podrían sugerir que en la metodología aplicada, el estrés de la sujeción fue reducido.
Los valores de FC obtenidos, por ecocardiografía coinciden con los valores reportados por telemetría, lo cual sugiere que la utilización de la técnica ecocardiográfica desarrollada en las aves de pie y con una sujeción mínima, ofrece un alternativa práctica para evaluar la FC, tanto en condiciones experimentales como de campo (Kettlewell et. al., 1997).
En presencia de un estímulo que cause estrés, se produce un efecto simpático-medular y simpático-cortical, con la consiguiente liberación de catecolaminas y cortisol, respectivamente. La liberación de catecolaminas como la epinefrina y norepinefrina, primariamente produce un aumento de la FC a través de la estimulación directa de receptores beta-adrenérgicos en el miocardio. No obstante, el sistema nervioso autónomo no sólo tiene una incidencia sobre la FC.
Existen otras variables cardiovasculares que podrían determinar modificaciones en la FC. De hecho, se reporta que la presión arterial y la resistencia periférica total de los vasos sanguíneos, disminuye durante la hipertermia, presumiblemente como resultado de la vasodilatación que se produce en las extremidades (Kettlewell et. al., 1997). Simultáneamente, el aumento del gasto cardíaco y del volumen sanguíneo circulante garantizan que aumente la velocidad del flujo de sangre a través de las extremidades, de las áreas de evaporación (vías aéreas superiores) y de los músculos respiratorios, los cuales intervienen en el jadeo (Kettlewell et. al., 1997).
Este aumento del gasto cardíaco ocurre a expensas de la reducción del volumen de fin de sístole (aumento de contractilidad miocárdica), pero también de la FC, lo cual reafirma la importancia de esta constante fisiológica en el mecanismo compensatorio ante el estrés por calor.
En los últimos estadios de la hipertermia, cuando disminuye la frecuencia respiratoria con un patrón lento y profundo, disminuye el gasto cardíaco y la presión sanguínea, comprometiendo la oxigenación tisular, logrando llevar a un colapso circulatorio y muerte (Kettlewell et. al., 1997). Estos eventos también han sido sugeridos como factores estresantes por Cabanac y Guillemete (2001), quienes plantean que en los últimos días de la vida del pollo (días de alta mortalidad por EC), diferentes factores determinan la presencia de estrés severo, el cual se evidencia por altos valores de corticosterona en plasma.
Los niveles elevados de corticosteroides, podrían asociarse a un incremento de la actividad simpática a nivel del efector (ejemplo: corazón), al reducirse la recaptación extraneuronal del neurotransmisor (norepinefrina) y prolongar su acción sobre receptores adrenérgicos presentes en el miocardio.
Adicionalmente, Druyan et al., (2007) refiere que el aumento en ganancia de masa muscular en pollos de engorde (especialmente en la pechuga) son determinados genéticamente, y estos no se acompañan de un incremento proporcional en el aporte de oxígeno a los distintos órganos, entre ellos el corazón y los pulmones. Este aumento en el consumo de oxígeno, se podría asociar a una elevación compensatoria del gasto cardíaco, lo cual puede inducir cambios hemodinámicos en la presión arterial sistémica y pulmonar.
Es interesante señalar que la FC obtenida en pollos provenientes del T2 (345,8±2,9 lat/min) y del T1 (353,9±2,5 lat/min) se sitúan dentro de un rango de temperaturas consideradas como un ambiente de confort (termoneutralidad), el cual se ubica en valores de TA dentro de un rango de 21°C a 32°C (Pereira y Nääs, 2008). Esto sugiere, que a pesar de no haberse observado cambios bruscos en la TA y en la TC, la determinación de la FC permitió evidenciar cambios que sugieren el desarrollo de estrés, incluso dentro de la termoneutralidad.
A lo largo de la presente investigación, se pudo determinar que no existió una diferencia estadísticamente significativa (P=0,26) en la FC cuando esta se comparó en pollos de diferentes sexo provenientes del T1 (machos: 343±5 lat/min; hembras: 348±3 lat/min;) con respectos a los provenientes de T2 (machos: 350±4 lat/min; hembras: 355±3 lat/min). Por esta razón, los valores se expresaron como el promedio de machos y hembras agrupados como una unidad, durante las comparaciones de los animales en forma global, entre cada uno de los tratamientos.
CONCLUSIONES
La ecocardiografía con una restricción mínima de los pollos, permitió evaluar la FC en pollos sometidas a un EC moderado. A pesar de no observarse cambios significativos en la TC, se pudo evidenciar valores mayores en la FC en los pollos sometidos a un ambiente ligeramente más caluroso. Los valores absolutos de FC obtenidos a través de ecocardiografía, coinciden con los reportados por telemetría, lo cual sugiere que el nivel de estrés de sujeción al cual se someten las aves durante la ejecución de las mediciones, es relativamente menor, permitiendo detectar cambios asociados al estrés.
Más allá de la evaluación de la actividad miocárdica y de la anatomía del corazón, la ecocardiografía podría estudiar adicionalmente la FC, en condiciones experimentales y potencialmente en el campo.
AGRADECIMIENTO
Esta investigación fue financiada por el Proyecto Fonacit UCV-INIA 2005000420.
LITERATURA CITADA
1. Borges, S., A. Fischer Da Silva and A. Mayorka. 2007. Acid-base balance in broilers. World Poultry Science Journal, 63: 73-81. [ Links ]
2. Berrong, S., W. Kenneth and W. Washburn. 1998. Effects of Genetic Variation on total plasma protein, body weight gains, and body temperature responses to heat stress. Poultry Science, 77: 379-385. [ Links ]
3. Cabanac, A. y M. Guillemete. 2001. Temperature and heart rate as stress indicators of handled common eider. Physiology and Behavior, 74: 475-479. [ Links ]
4. De Basilio, V.; M. Vilariño, A. León y M. Picard. 2001. Efecto de la aclimatación precoz sobre la termotolerancia en pollos de engorde sometidos a un estrés térmico tardío en condiciones de clima tropical. Revista Científica FCV-LUZ, 11(1): 60-68. [ Links ]
5. Druyan, S., A. Shlosberg and A. Cahaner. 2007. Evaluation of growth rate, body weight, heart rate, and blood parameters as potential indicators for selection against susceptibility to the ascites syndrome in young broilers. Poultry Science, 86: 621-629. [ Links ]
6. Fraga, L. 1999. Manejo del estrés calórico en las aves. V Encuentro sobre nutrición y producción de animales monogástricos. FAGRO. UCV. Maracay. pp. 21 - 36. [ Links ]
7. Khajali, F., A. Zamani and E. Asadi. 2007. Appliction of an early skip-a-day feed restriction on physiological parameters, carcass traits and development of ascitis in male broilers reared under regular or cold temperatures at high altitude. Animal Science Journal, 78: 159-163. [ Links ]
8. Kettlewell, P., M. Mitchell and I. Meeks. 1997. An implantable radio-telemetry system for remote monitoring of heart rate and deep body temperature in poultry. Computers and Electronics in Agriculture, 17: 161-175. [ Links ]
9. Liu, C. and R. Li. 2005. Electrocardiogram and heart rate in response to temperature acclimation in three representative vertebrates. Comparative Biochemestry and Physiology, Part A, 142: 416- 421. [ Links ]
10. Martínez-Lemus, L., M. Miller, J. Jeffrey and T. Odom.1998. Echocardiographic evaluation of cardiac structure and funtion in broiler and leghorn chickens. Poultry Science, 77: 1045- 1050. [ Links ]
11. May, J., W. Deaton and S. Branton. 1986. Body temperature of acclimated broilers during exposure to high temperature. Poultry Science, 66: 378-380. [ Links ]
12. Olkowski A. 2007. Pathophysiology of heart failure in broiler chickens: structural, biochemical, and molecular characteristics. Poultry Science, 86: 999-1005. [ Links ]
13. Pereira, N. 1987. Fisioclimatologia de los animales domésticos aplicada a la producción animal en el trópico americano. Editorial América. Caracas. 1ra edición. p. 296. [ Links ]
14. Pereira, D. and I. Nääs. 2008. Estimating the thermoneutral zone for broiler breeders using behavioral analysis. Computers and Electronics in Agriculture. 6(2): 2 – 7. [ Links ]
15. Sturkie, P.D. 1968. Fisiología Aviar. Editorial Acribia, segunda edición. España. pp. 124-165. [ Links ]
16. Valance, D., G. Desprès, A. Boissy, S. Mignon- Grasteau, P. Constantin and C. Leterrier. (2007). Genetic selection on a behavioral fear trait is associated with changes in heart rate variability in quail. Genes, Brain and Behavior 6: 339-346. [ Links ]
17. Whittow, G., P. Sturkie y G. Stein. 1966. Cardiovascular differences between coldacclimatized and heat-acclimatized chickens. Research Veterinary Science, 7: 296-301. [ Links ]