Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Zootecnia Tropical
versión impresa ISSN 0798-7269
Zootecnia Trop. vol.30 no.1 Maracay mar. 2012
Nota Técnica
Evidencia molecular de transmisión transplacentaria de Anaplasma marginale en becerros neonatos cebú de Venezuela
Jesús Maldonado 1-2*, Alfredo Coronado2, Andrés Kowalski 1 y Juan Medina3
1 Universidad Centroccidental Lisandro Alvarado, Decanato de Agronomía, Laboratorio de Diagnóstico Molecular– Laboratorio de Embriología y Endocrinología Molecular, Núcleo Tarabana, Cabudare, estado Lara, Venezuela.
2 Universidad Centroccidental Lisandro Alvarado. Decanato de Ciencias Veterinarias, Núcleo Héctor Ochoa Zuleta. Barquisimeto, estado Lara, Venezuela.
3 Universidad Central de Venezuela. Facultad de Ciencias Veterinarias. Estación Experimental La Cumaca. San Felipe, estado Yaracuy, Venezuela. *Correo electrónico: jesusmaldonado@ucla.edu.ve.
RESUMEN
Anaplasma marginale es la protobacteria de mayor prevalencia en el ganado bovino a nivel mundial. Este patógeno se multiplica en los eritrocitos y endotelio causando la enfermedad hemolítica denominada anaplasmosis, que en su fase aguda se acompaña de anemia, pérdida de peso e incluso la muerte. Se asume que el microorganismo es transmitido biológicamente por ixódidos, mecánicamente por dípteros hematófagos, iatrogénicamente o por vía transplacentaria. Con el fin de detectar la presencia de A. marginale en becerros neonatos de un rebaño Brahman del estado Yaracuy, Venezuela, se colectaron muestras de sangre de 29 crías con menos de 24 horas de nacidas y sus correspondientes madres recién paridas. El ADN obtenido de las 58 muestras fue sometido a una PCR anidada (PCRa) específica para el diagnóstico de Anaplasma spp. Adicionalmente a los sueros de las 29 madres se les realizó un ELISA competitivo (ELISAc) para el diagnóstico de anaplasmosis utilizando el protocolo señalado por la casa comercial VMRD. Los resultados mostraron que en el 20,69% de las crías (6 neonatos) se obtuvo amplificación del gen msp5 de Anaplasma spp, mientras que todas las muestras de las madres eran positivas a la PCRa y al ELISAc. La evidencia experimental obtenida indica que la presencia de la protobacteria en animales con menos de 24 horas de nacidos es producto de la transmisión transplacentaria de la madre infectada al feto durante la gestación y pone de manifiesto que bajo las condiciones estudiadas esta vía de transmisión es importante en la diseminación del patógeno.
Palabras clave: Anaplasmosis neonatal, Anaplasma marginale, PCR anidado, ELISA competitivo, msp5, transmisión transplacentaria.
Molecular evidence of transplacental transmission of Anaplasma marginale in zebu neonatal calves of Venezuela
ABSTRACT
Anaplasma marginale is the most prevalent protobacteria in cattle worldwide. This pathogen multiplies in the erythrocytes and endothelium causing a hemolytic disease called anaplasmosis, which in its acute phase is accompanied by anemia, weight loss and even death. It is assumed that the organism is transmitted biologically by ixodides, mechanically by haematophagous dipterans, iatrogenically or by transplacental transmission. In order to detect neonatal anaplasmosis in a Brahman herd of the Yaracuy State, Venezuela, blood samples were collected from 29 calves less than 24 hours old and their postpartum mothers. The DNA obtained from 58 samples was subjected to a nested PCR (nPCR) specific for the diagnosis of Anaplasma spp. In addition the serum of the 29 mothers was evaluated by a competitive ELISA (ELISAc) for diagnosis of anaplasmosis using the protocol indicated by the commercial house VMRD. The results showed that in 20.69% of the offspring (6 calves) gene amplification was obtained from msp5 of Anaplasma spp, while all the samples from the mothers were positive for nPCR and ELISAc. The experimental evidence obtained indicates that the presence of protobacteria in animals less than 24 hours of birth is the result of transplacental transmission from the infected mother to the fetus during pregnancy and shows that under the studied conditions this route of transmission is important in the spread of the pathogen.
Key words: Neonatal anaplasmosis, Anaplasma marginale, nested PCR, competitive ELISA, msp5, transplacental transmission.
Recibido: 11/06/12 Aprobado: 03/11/12
INTRODUCCIÓN
La anaplasmosis es una importante enfermedad del ganado bovino, con alta prevalencia en las regiones tropicales y sub-tropicales del mundo (Valdez et al., 2002), constituyendo uno de los principales factores limitantes en el desarrollo de la ganadería en gran parte de las regiones tropicales y sub-tropicales (Gringoli et al., 2002; Kocan et al., 2003).
La enfermedad es causada por Anaplasma marginale, una protobacteria del orden Rickettsiales, Familia Anaplasmataceae (Dumler et al., 2001), que se multiplica en el interior de los eritrocitos de los bovinos (Kocan et al., 2003), células endoteliales (Munderloh et al., 2004; Carreño et al., 2007) y en varios tejidos de ixódidos (De la Fuente et al., 2003). De manera similar a otros patógenos Rickettsiales, es transmitido biológicamente por ixódidos, de manera mecánica por dípteros hematófagos, iatrogénicamente o por vía transplacentaria (Aubry y Geale, 2010).
El diagnóstico clínico de la anaplasmosis es complejo porque los síntomas son comunes a varias hemoparasitosis, tales como la babesiosis y la tripanosomosis (Coronado, 2001). Se considera que la inoculación de eritrocitos infectados con A. marginale en becerros esplenectomizados susceptibles es la prueba definitiva para el diagnóstico de anaplasmosis, pero este procedimiento no es práctico como prueba de rutina (OIE, 2008; Torioni et al., 1998). En este sentido, la identificación microscópica del patógeno en frotis, constituye una evidencia diagnóstica importante, pero esto sólo es posible cuando la rickettsemia es alta, y además, posibles artefactos pueden arrojar falsos positivos (OIE, 2008).
Por otro lado, ensayos serológicos de diagnóstico, tales como el ELISA indirecto (Eleizalde et al., 2007) y ELISA competitivo (ELISAc) (OIE, 2008), que emplean antígenos recombinantes de la proteína MSP5, y que en el caso del ELISAc han mostrado valores de sensibilidad y especificidad que permiten su validación en estudios epidemiológicos (OIE, 2008). No obstante y a pesar de sus ventajas, el diagnóstico serológico no es aplicable en todas las circunstancias, pues requiere una respuesta inmune adecuada por parte del huésped infectado para que se genere suficiente cantidad de anticuerpos que puedan ser detectados (Aubry y Geale, 2010).
Por último, se han desarrollado técnicas moleculares con fines diagnósticos, y más específicamente, la reacción en cadena de la polimerasa anidada (PCRa) (OIE, 2008; Torioni et al., 1998), que puede ser considerada como potencial prueba definitiva o Prueba de Oro para identificar los animales verdaderamente infectados, fundamentalmente por tres razones: a. La PCRa tiene una sensibilidad cinco órdenes de magnitud superior a la visualización del patógeno en frotis. b. La técnica puede identificar inequívocamente bajos niveles de rickettsemia en animales persistentemente infectados, independientemente de la fluctuación en el número de eritrocitos infectados. c. Los análisis de la secuencia del gen blanco (msp5), amplificado por la técnica, se mantienen altamente conservados en regiones de alta prevalencia de la enfermedad (Torioni et al., 1998).
A pesar de los avances realizados en la comprensión de la anaplasmosis, se requieren más estudios tendientes a profundizar el conocimiento de la epidemiología de esta patología en los países de América Latina (Coronado, 2001). En este sentido se posee escasa información sobre el papel de la transmisión transplacentaria, a pesar de que en Venezuela se han reportado evidencias indirectas de esta vía de transmisión (Rey et al., 2003), e incluso de evidencias directas mediante detección molecular
de ADN del patógeno en becerros con más de 8 días de nacidos (Añez et al., 2010). En este orden de ideas y con la finalidad de contribuir al conocimiento de esta importante enfermedad, se realizó un estudio tendiente a detectar molecularmente a Anaplasma spp en neonatos de menos de 24 horas de nacidos en un rebaño Brahman del estado Yaracuy, Venezuela y comprobar la transmisión transplacentaria de la madre infectada al feto durante la gestación, como una vía de transmisión importante en la diseminación del patógeno y mantenimiento de la enfermedad.
MATERIALES Y MÉTODOS
Para el estudio se colectaron, mediante venipunción yugular, muestras de sangre completa en tubos al vacío con y sin anticoagulante con agujas desechables (Vacutainer®) a un total de 29 becerros neonatos y sus correspondientes 29 madres recién paridas pertenecientes a un rebaño Brahman de una estación experimental propiedad de la Facultad de Ciencias Veterinarias de la Universidad Central de Venezuela, ubicada en el estado Yaracuy (09º 50´08, 10º 46´ 31 de latitud norte y 68º 14´ 14, 69º 13´ 55 de longitud oeste), bajo condiciones de bosque seco tropical, a una altitud de 130 m.s.n.m., con valores promedio anuales de 27ºC de temperatura y 1700 mm de precipitación.
Al momento de llevar a cabo el muestreo ninguno de los animales seleccionados presentaban síntomas clínicos de anaplasmosis. Las muestras de sangre con anticoagulante fueron alicuotadas en tubos de 2 mL con tapa de rosca y se almacenaron a -80°C hasta su procesamiento para la extracción de ADN, mientras que la sangre sin anticoagulante fue centrifugada a 4.000 r.p.m durante 5 minutos y el suero colectado fue trasvasado a tubos debidamente rotulados de 1,5 mL y conservados a -20ºC, para su posterior examen serológico. El tamaño de la muestra fue estimado mediante el programa Epiinfo versión 3.3.2 (2005) para prevalencia desconocida.
Las pruebas de ELISAc se realizaron con un estuche comercial, siguiendo las recomendaciones del fabricante (Anaplasma Antibody Test Kit, c-ELISA elaborado por VMRD, Inc., 4641 Pullman–Albion Rd., P.O. Box 502, Pullman, Washington 99163, USA. Las densidades ópticas de las muestras analizadas fueron registradas por un lector de ELISA (μQuant Microplate Spectrophotometer, BioTek Instruments, Inc., Winooski, Vermont, USA) usando el Software KC Junior (KCJunior Data Analysis Software, BioTek Instruments, Inc., Winooski, Vermont, USA). Los Porcentajes de Inhibición (% I) fueron calculados en la hoja de cálculo Excel 2007.
En el Laboratorio de Diagnóstico Molecular adscrito al Laboratorio de Embriología y Endocrinología Molecular DA-UCLA, a partir de las muestras de sangre colectadas con anticoagulante, se realizó la extracción del ADN utilizando un estuche comercial y siguiendo las recomendaciones del fabricante (QIAamp®DNA Mini Kit – Qiagen). Para el diagnóstico molecular de A. marginale, se empleó la metodología de dos ciclos de amplificación denominada PCR anidada (PCRa), propuesta por Torioni et al., (1998), usando el estuche comercial PCR Master Mix (Promega) en un termociclador Eppendorf Mastercycler gradient Modelo 22331.
En la primera ronda se emplearon los oligonucleótidos msp5/1:
5-GCATAGCCTCCGCGTCTTTC-3 y msp5/2: 5-TCCTCGCCTTGGCCCTCAGA-3 que amplifican parte de la secuencia del gen msp5 obtenido de la cepa Florida de A. marginale (acceso en GeneBank N° M933992), que genera una banda de 458 pb. La mezcla de reacción fue: 5 μL del ADN problema, 12,5 μL PCR Master-Mix; 1 μL de cada uno de los oligonucleótidos cebadores msp5/1 y msp5/2 (cada uno a una concentración 20 μM) y 5,5 μL de agua megapura estéril libre de ADNasa y ARNasa.
Las amplificaciones fueron hechas con un precalentamiento a 95°C durante 4 minutos, seguido de 35 ciclos de desnaturalización a 95°C durante 30 segundos, alineamiento a 60,2°C durante 58 segundos y extensión a 72°C durante 30 segundos, complementada con una extensión final a 72°C durante 10 minutos.
Para la segunda ronda se emplearon los oligonucleótidos msp5/2:
5-TCCTCGCCTTGGCCCTCAGA-3 y msp5/3: 5-TACACGTGCCCTACCGAGTTA-3que amplifican una sección interna de la secuencia previamente amplificada en la primera ronda, y que genera una banda de 344 pb. La mezcla de reacción fue: 1 μL del producto de PCR amplificado en la primera ronda, 12,5 μL PCR Master-Mix; 1 μL de cada uno de los oligonucleótidos cebadores msp5/2 y msp5/3 (cada uno a una concentración 20 μM) y 9,5 μL de agua
megapura estéril libre de ADNasa y ARNasa. Las amplificaciones de la segunda ronda fueron hechas con un precalentamiento inicial a 95°C durante 4 minutos, seguido de 25 ciclos de desnaturalización a 95°C durante 30 segundos, alineamiento a 62,2°C durante 58 segundos y extensión a 72°C durante 30 segundos, con una extensión al final de los 25 ciclos a 72°C durante 10 minutos. Los productos de PCR (primera ronda) y PCRa (segunda ronda) fueron visualizados en geles de agarosa al 1% coloreados con Bromuro de ethidio después de realizada la electroforesis a 86 Volt, durante 45 minutos.
RESULTADOS Y DISCUSIÓN
El análisis de las muestras estudiadas permitió la detección molecular de ADN de A. marginale, mediante la amplificación del gen msp5 del patógeno, en 6 de las 29 muestras colectadas de vacunos neonatos con menos de 24 horas de nacidos, lo que corresponde al 20,69% de las crías estudiadas (Figura 1).
Por otro lado, en las 29 muestras provenientes de las madres de los neonatos se observó amplificación específica del gen estudiado, al mismo tiempo, que en todas las muestras de suero de las madres se encontró la presencia de anticuerpos específicos contra la proteína MSP5 de Anaplasma spp mediante la prueba de ELISAc, lo que indica que en el rebaño estudiado la presencia de la bacteria es muy alta.
Con el fin de determinar la presencia de A. marginale en las crías recién nacidas estudiadas, se empleó la técnica de PCRa debido su extremadamente alta sensibilidad, lo que permite la detección del patógeno aún cuando la tasa de infección sea muy baja en los neonatos (Aubry y Geale, 2010; OIE, 2008).
Los resultados obtenidos concuerdan con reportes previos que demuestran la transmisión transplacentaria de A marginale, realizados bajo condiciones de laboratorio (Potgieter y Rensburg, 1987) y de campo (Zauug y Kutler, 1984; Zauug, 1985) y refuerza el estudio realizado por Rey et al., 2003, quienes infirieron la posibilidad de trasmisión transplacentaria bajo las condiciones tropicales de Venezuela.
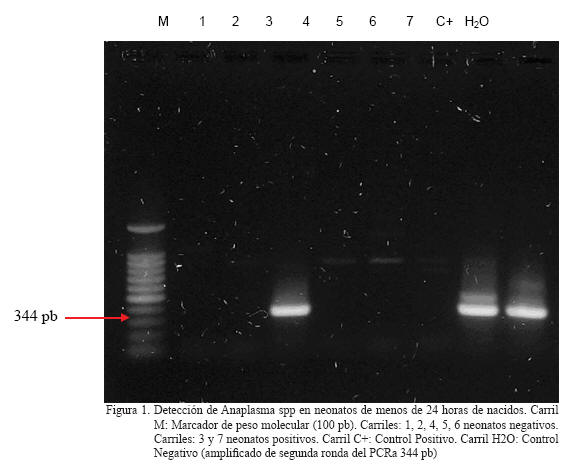
Al mismo tiempo, ésta investigación complementa el reporte realizado por Añez et al., 2010, quienes trabajando con becerros mayores a 8 días de edad, sugieren la posibilidad de transmisión transplacentaria en 5 de los 10 becerros que resultaron positivos al PCR para el diagnóstico de anaplasmosis en dicho estudio, no obstante, debido a la naturaleza del trabajo no fue posible controlar fuentes de infección iatrogénica o vectorial mecánica que hayan podido ser la fuente de infección para los becerros y de hecho los autores reportan como positivos dos becerros de 10 y 17 días de edad, cuyas madres eran negativas para A. marginale.
Con la finalidad de superar posibles ambigüedades a la hora de interpretar los resultados, en el presente estudio se muestrearon neonatos con menos de veinticuatro horas de nacidos, razón por la cual la evidencia obtenida indica que la presencia de la protobacteria en estos becerros recién nacidos es producto de la transmisión transplacentaria de la madre infectada al feto durante la gestación y no de la evolución del periodo de incubación de A. marginale que oscila entre los 7 y 60 días post-infección (Kocan et al., 2003).
Los resultados de esta investigación ponen de manifiesto que, bajo las condiciones estudiadas, la transmisión transplacentaria es importante en la diseminación del patógeno correspondiéndose con las afirmaciones hechas por otros autores (Añez et al., 2010; Kocan et al., 2003), donde esta vía de trasmisión resulta relevante.
CONCLUSIONES
El estudio de las muestras mediante la PCRa permitió la amplificación del gen msp5 en el 20,69% de los becerros neonatos de menos de 24 hora de vida y en el 100% de las hembras recién paridas madres de los neonatos estudiados, demostrando la eficacia del uso de herramientas moleculares para evidenciar la presencia de A. marginale, independientemente de la tasa de infección y ausencia de síntomas clínicos de la enfermedad en el animal infectado.
La demostración molecular de la presencia de A. marginale en becerros neonatos resalta la importancia de la vía transplacentaria en el mantenimiento y diseminación de de la bacteria en los rebaños y refuerza la argumentación de que en países como Venezuela, donde la garrapata de un solo hospedador Rhipicephalus (Boophilus) microplus es el ixodido más prevalentemente observado sobre los vacunos, otras vías de transmisión del patógeno, tales como la transplacentaria, la mecánica o la iatrogénica pueden tener un papel más relevante en la epidemiología de la enfermedad.
LITERATURA CITADA
1. Añez-Rojas, N., O. Romero, H. Valbuena, G. Crisante, A. Rojas, A. Bolívar y N. Añez. 2010. Detección de Transmisión Transplacentaria de Anaplasma marginale en Bovinos Asintomáticos. Revista Científica, FCV-LUZ. 20 (4): 377-382.
2. Aubry, P. and D. Geale. 2010. A Review of Bovine Anaplasmosis. Transboundary and Emerging Diseases. 58 (2011): 1-30.
3. Carreño, A., A. Alleman, A. Barbet, G. Palmer, A. Moh and C. Johnson. 2007. In vivo Endothelial Cell Infection by Anaplasma marginale. Veterinary Pathology. 44: 116-118.
4. Coronado, A. 2001. Is Boophilus microplus the main vector of Anaplasma marginale?. Technical Note. Revista Científica, FCV-LUZ. 11 (5): 408- 411.
5. De la Fuente, J., E. Blouin and K. Kocan. 2003. Infection Exclusión of the Rickettsial Pathogen Anaplasma marginale in the Vector Dermacentor variabilis. Clinical and Diagnostic Laboratory Immunology. 10 (1): 182-184.
6. Dumler S., A. Barbet, C. Bekker, G. Dasch, G. Palmer, S. Ray, Y. Rikihisa and F. Rurangirwa. 2001. Reorganization of genera in the families Rickettsiaceae and Anaplasmataceae in the order Rickettsiales: unification of some species of Ehrlichia with Anaplasma, Cowdria with Ehrlichia and Ehrlichia with Neorickettsia, descriptions of six new species combinations and designation of Ehrlichia equi and HGE agent as subjective synonyms of Ehrlichia phagocytophila. International Journal of Systematic and Evolutionary Microbiology. 51: 2145–2165.
7. Eleizalde, M., H. Caballero y A. Reyna. 2007. Evaluación y mejoramiento del ensayo inmunoenzimático (ELISA) para el diagnostic de la anaplasmosis bovina, utilizando la MSP5 recombinante como antígeno. Revista Científica, FCV-LUZ. 17 (4): 349-356.
8. Gringoli, G., D. Otranto, G. Testini, V. Buono, G. DiGiulio, D. Traversa, R. Lia, L. Rinaldi, V. Veneziano and V. Puccini. 2002. Epidemiology of bovine tick-borne diseases in southern Italy. Veterinary Research. 33: 421-426.
9. Kocan, K., J. De la Fuente, A. Gucliemone and R. Meléndez. 2003. Antigens and Alternatives for Control of Anaplasma marginale Infection in Cattle. Clinical Microbiology Reviews. 16 (4): 698-712.
10. Munderloh, U., M. Lynch, M. Herron, A. Palmer, T. Kurtti, R. Nelson and J. Goodman. 2004. Infection of endothelial cells with Anaplasma marginale and A. phagocytophilum. American Veterinary Microbiology. 101: 53-64.
11. OIE. Organización Internacional de Epizootias. 2008. Capítulo 2.4.1 Anaplasmosis Bovina. En: Manual de las Pruebas de Diagnóstico y de las Vacunas para los Animales Terrestres. Sexta Edición, Paris, pp. 599-610.
12. Rey, C., P. Aso, A. Coronado. 2003. Prevalence of Anaplasma marginale and specific antibodies in new born calves. Acta Científica Venezolana, 54 (2): 121-126.
13. Torioni, S., D. Knowles, T. McGuire, G. Plmer, C. Suárez and T. McElwain. 1998. Detection of Cattle Naturally Infected with Anaplasma marginale in Region of Endemicity by Nested PCR and a Competitive Enzyme-Linked Immunosorbent Assay Using Recombinant Major Surface Protein 5. Journal of Clinical Microbiology. 36 (3): 777-782.
14. Valdez, R., T. McGuire, W. Brown, W. Davis, J. Jordan and D.Knowles. 2002. Selective In Vivo Depletion of CD4+ T Lymphocytes with Anti-CD4 Monoclonal Antibody during Acute Infection of Calves with Anaplasma marginale. Clinical and Diagnostic Laboratory Immunology. 9 (2): 417-424.
15. Zaugg, J. 1985. Bovine anaplasmosis: transplacental transmission as it relates to stage of gestation. American Journal Veterinary Research. 46 (3): 370-572.
16. Zaugg, J. and K. Kutler. 1984. Bovine anaplasmosis: in utero transmission and the immunologic significance of ingested colostral antibodies. American Journal Veterinary Research. 45 (3): 440-443.
17. Potgieter, F. and L. Rensburg. 1987. The persistence of colostral Anaplasma antibodies and incidence of in utero transmission of Anaplasma infections in calves under laboratory conditions. The Journal of Onderstepoort Veterinary Research. 54 (4): 557-560.













