Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Zootecnia Tropical
versión impresa ISSN 0798-7269
Zootecnia Trop. vol.31 no.1 Maracay mar. 2013
Cultivo de los mejillones Perna perna y Perna viridis (Bivalvia: Mytilidae) en la laguna de Chacopata, península de Araya, estado Sucre, Venezuela
Cultivation of mussels Perna perna and Perna viridis (Bivalvia: Mytilidae, Linnaeus) in the lagoon of Chacopata, Araya Peninsula, Sucre state, Venezuela
César Lodeiros1,5*, Aulo Aponte2,5, Vanessa Acosta3,5, Adrián Marquez5, Luis Freites1,5, Eduardo Uribe4,5, William Lozada5,6
1 Universidad de Oriente. Instituto Oceanográfico de Venezuela. Laboratorio Acuicultura. Cumaná 6101, estado Sucre, Venezuela. *Correo electrónico: cesarlodeirosseijo@yahoo.es.
2 Universidad de Oriente. Vicerrectorado Académico. Centro de Investigaciones Ecológicas Guayacán. Península de Araya, estado Sucre, Cumaná. 6101, Venezuela.
3 Universidad de Oriente. Escuela de Ciencias. Departamento de Biología, Núcleo Sucre. Cumaná 6101, estado Sucre, Venezuela.
4 Universidad Católica del Norte. Departamento Acuicultura. Sede Coquimbo. Chile.
5 Universidad de Oriente. Consejo de Investigación. Grupo de Investigaciones sobre Biología de Moluscos. Cumaná 6101, estado Sucre, Venezuela.
6 Consejo Comunal de Chacopata. Península de Araya, estado Sucre, Venezuela.
RESUMEN
Se evaluó de manera simultánea el crecimiento de los mejillones Perna perna y P. viridis bajo cultivo horizontal suspendido entre estacas en la laguna de Chacopata, Península de Araya, Venezuela, durante 8 meses. Las semillas fueron colectadas en localidades adyacentes a la laguna. Como elemento de cultivo se empleó una malla plástica de 50 cm de largo x 8 cm de ancho. Un total de 24 réplicas para cada una de las especies fueron sembradas y colocadas en suspensión en estacas. A cada grupo de mejillones se les determinó mensualmente la longitud de la concha, así como la biomasa seca del músculo, lóbulos gonadales, resto de tejidos somáticos y la supervivencia, mientras que semanalmente se tomaron registros de diferentes parámetros ambientales. Ambas especies mostraron una supervivencia > 90% durante todo el experimento. Los patrones de crecimiento fueron similares, con algunas variantes. P. viridis mostró mayor tasa crecimiento en longitud de la concha, alcanzando al fi nal del estudio 82,1±0,92 mm (P. perna 76,7±2,61 mm); sin embargo, P. perna mostró mayor rendimiento en relación masa de tejidos-longitud. Al fi nal del estudio, la masa de la gónada de P. perna superó en más de un 100% a la de P. viridis. Durante el último mes de estudio, las masas de todos los tejidos de ambas especies disminuyeron signifi cativamente, debido a la disminución de la biomasa fi toplanctónica. El sistema lagunar de Chacopata se presenta como un excelente ambiente para iniciar la producción de ambas especies mejillones, lo cual podría constituir una alternativa económica para las comunidades costeras de la zona.
Palabras clave: Bivalvos, moluscos, mejillón, estrés ambiental, laguna Chacopata.
ABSTRACT
Growth of mussels Perna perna and P. viridis growing in suspension in horizontal arrangement in stakes in Lagoon of Chacopata Araya Peninsula, Venezuela was evaluated simultaneously, during 8 months. Spats were collected at locations adjacent to the lagoon. The cultivation element was a plastic mesh of 50 cm x 8 cm wide, with which were formed a total of 24 replicates for each species, being sown manually and placed in suspension on wooden stakes. Each species of mussel was evaluated every month in shell length and muscle, gonadal lobes, other somatic tissues dry biomass and survival, while weekly records were taken from different environmental parameters. Both species showed a survival > 90% throughout the experiment. The growth patterns of both species were similar, with some variations. P. viridis showed higher growth rate in shell length, reaching at the end of the study 82.1±0.92 mm and P. perna 76.7±2.61 mm, but P. perna showed improved performance relative tissue mass-length. At study end, the gonad of P. perna reached more than 100% with respect to P. viridis. In both species during the last month of study, the masses of all tissues decreased signifi cantly suggesting a stress event associated with high temperatures and decreased phytoplankton biomass. The lagoon of Chacopata system is presented as an excellent environment to start the production of both mussels, which could be an economical alternative for coastal communities in the area.
Key words: Shellfi sh, mollusks, mussels, environmental stress, Chacopata lagoon.
Recibido: 31/01/13 Aprobado: 03/05/13
INTRODUCCIÓN
En la acuicultura marina los moluscos representan uno de los grupos más importantes desde el punto de vista económico, debido a los bajos costos de producción y a su alta rentabilidad. Entre las especies más cultivadas se encuentran los mejillones, caracterizados por poseer tasas elevadas de fi ltración, crecimiento y fecundidad. Todo esto ha permitido que la mitilicultura sea una de las actividades acuícolas más importantes en todo el mundo, donde más del 50% de la producción se atribuye a países como China y España, siendo las especies más cultivadas aquellas pertenecientes a los géneros Mytilus (M. edulis, M. galloprovincialis, M. trossulus) y Perna (P. perna, P. viridis y P. canaliculus) (Hickman, 1992; Labarta et al., 2004).
En Venezuela, particularmente en la zona nororiental, se explotan dos especies de mejillones, el mejillón marrón Perna perna y el verde Perna viridis, este último introducido de manera accidental en la década de los 90, cuando empezó a colonizar las costas del nororiente de Venezuela (Lodeiros et al., 1999). La costa norte del estado Sucre es una de las zonas más deprimidas de Venezuela, y en la actualidad algunos bancos comparten las dos especies y su explotación se estima en unas 2.500 t/año, donde intervienen, en esta importante actividad socioeconómica, varias familias de las comunidades costeras; sin embargo, la extracción carece de vigilancia adecuada para la administración del recurso y por ende algunos bancos han mermado y ya muestran tendencias a su desaparición. Por lo tanto, las actividades de cultivo podrían contribuir a la conservación de los bancos naturales, y a la vez coadyuvar a disminuir la pobreza en la zona.
Uno de los métodos propuestos para un mejor desarrollo social de la zona son los módulos de producción familiar, siendo el cultivo en suspensión horizontal en estacas una alternativa adecuada. La presente investigación describe el crecimiento de las dos especies de mejillones bajo este sistema y su interacción con los cambios de los factores ambientales en la laguna de Chacopata, costa norte del estado Sucre, Venezuela.
MATERIALES Y MÉTODOS
Se recolectaron semillas de P. perna y P. viridis mediante buceo en apnea a profundidades de 1-2 m de localidades cercanas a Chacopata (Península de Araya), transportándose en contenedores isotérmicos a la zona de trasplante, ubicada en la boca de la laguna de Chacopata (Figura 1), donde se separaron por especies, seleccionándose tallas homogéneas en longitud dorso-ventral de la concha de 29,5±2,23 mm para P. viridis y 38,2±3,29 mm para P. perna, con las cuales se comenzó el experimento.
Para cada especie, las semillas fueron sembradas en 24 láminas de malla plástica de 50 cm de largo x 8 cm de ancho, con un ojo de luz de 9,5 mm y espesor de la malla de 3,0 mm, y mantenidas en un módulo de producción construido con estacas de madera clavadas en el sustrato, a una profundidad de 1-2 m y distancia entre estacas de 2 m. Ambas especies se sembraron con un volumen similar de 0,4 L por área de la malla (25 mejillones verdes y 15 mejillones marrones en un área de 25 cm de la tira de malla). La siembra de los mejillones se realizó manualmente con una malla especialmente diseñada para este tipo de cultivo, la cual tiene la consistencia para soportar las semillas de 24 a 48 horas, tiempo sufi ciente para que se fi jen a la lámina mediante su biso. El cultivo se mantuvo durante ocho meses (mayo-diciembre 2009).
Mensualmente se tomaron tres réplicas del módulo de producción. A cada grupo de mejillones se les determinó la longitud en los axis dorso-ventral y antero-posterior de la concha, utilizando un calibrador vernier digital de 0,01 mm de precisión, así como el peso de la biomasa seca del músculo, lóbulos gonadales y resto de tejidos somáticos con una balanza analítica (0,001 g de precisión), luego de un proceso de deshidratación por tratamiento al calor en una estufa a 60oC, hasta lograr peso constante. Como índice reproductivo se utilizó el porcentaje de la masa de la gónada con respecto a la masa total de los tejidos (Hickman y Illingworth, 1980)
Semanalmente se colectaron (por triplicado) muestras de agua entre 1-0,5 m de la superficie en la zona de cultivo con la ayuda de una embarcación y un cubo de plástico de 6 L, teniendo cuidado de no alterar el ambiente de cultivo, de donde se obtuvieron submuestras para la determinación de la salinidad mediante un refractómetro de 1 de apreciación, así como muestras de agua previamente filtrada con una malla de 153 μm de tamaño de poro, para eliminar el macroplancton, la cual posteriormente fue transferida a botellas plásticas (2 L), con la finalidad de estimar la biomasa fitoplanctónica mediante la concentración de clorofila a y el seston en sus componentes total, inorgánico y orgánico.
Estos análisis se realizaron reteniendo las partículas de las muestras en filtros Whatman GF/F de 0,7 μm de diámetro de poro, utilizando un equipo de filtración al vacío Millipore. Para el análisis de clorofila a se empleó el método espectrofotométrico y del seston se realizó mediante técnicas gravimétricas siguiendo las recomendaciones en Strickland y Parsons (1972). La temperatura se registró continuamente cada 30 min utilizando un termógrafo electrónico (Sealog, Vemco).
Para determinar las diferencias entre dos medias de los valores absolutos entre una misma especie en el tiempo (meses) o entre las especies en un mismo muestreo (mes) se utilizó una t-student. La relación longitud-peso de tejidos somáticos se realizó mediante regresiones simples signifi cativas (ANOVA), contrastando las curvas entre las especies con un análisis para la comparación de pendientes, todas estos estadísticos se aplicaron con un nivel de signifi cancia de P=0,05, siguiendo las recomendaciones en Zar (1984).
RESULTADOS Y DISCUSIÓN
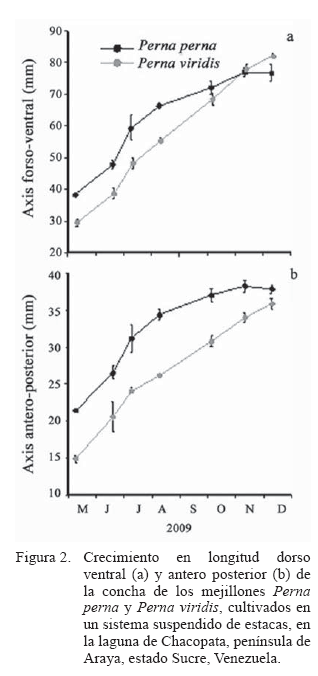
Las más altas tasas de crecimiento en la longitud de la concha de ambas especies de mejillones fueron observadas en los dos primeros meses de cultivo, luego éstas disminuyen (Figura 2). En P. viridis el crecimiento fue continuo hasta el final del estudio, sin embargo, en P. perna, el crecimiento disminuye o se hace nulo en el último mes de estudio, cuando la especie alcanza la talla en longitud dorso-ventral de 76,7±2,61 mm, mientras que, P. viridis alcanza los 82,1±0,92 mm, talla significativamente mayor que la de P. perna (P<0,05; Figura 2a) aunque las semillas de P. viridis fueron signifi cativamente menores al inicio del experimento (P<0,05). Al final del experimento, la longitud antero-posterior fue de 37,8±0,60 mm para P. perna y 35,9±0,71 mm para P. viridis (Figura. 2b).
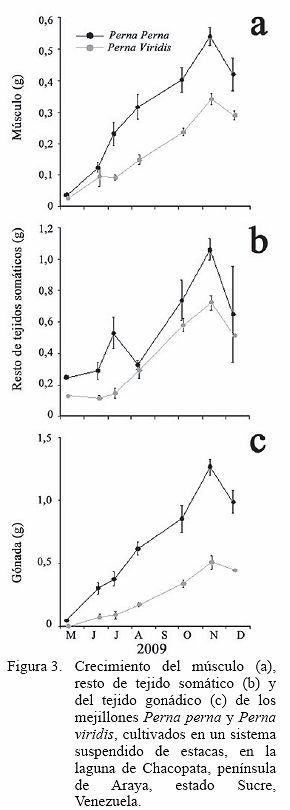
Aún cuando ambas especies de mejillones mostraron tasas de crecimiento similares al inicio de la experiencia, la masa del músculo del mejillón P. perna alcanzó valores signifi cativamente más altos al final del estudio: 0,42±0,052 g para P. perna y 0,30±0,012 g para P. viridis (Figura 3a). En el caso de P. viridis, esta especie mostró una caída de la masa del músculo entre mediados de junio y julio 2009, mientras que, en ambas especies estas caídas fueron observada de manera simultánea en noviembre. En general, este patrón fue similar en los demás compartimientos de los tejidos (Figuras 3b, c), donde también fueron observadas disminuciones de estos tejidos en el último mes del experimento (mediados de noviembre y diciembre).
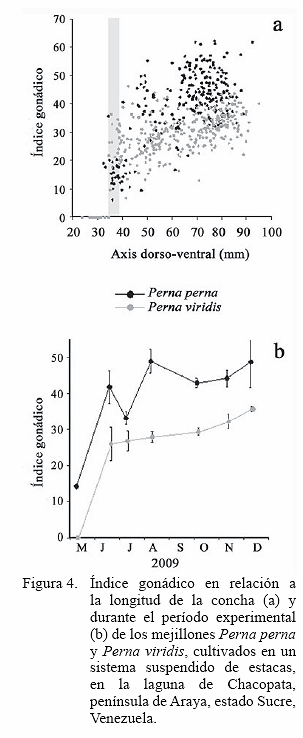
La mayor masa de tejido producida por P. perna fue la del tejido reproductivo, evidenciado por el mayor índice gonádico (Figura 4a), el cual muestra un patrón de condición reproductiva elevado en los primeros meses, para luego estancarse hasta el final del estudio, con la excepción de un decrecimiento entre mediados de julio y principios de agosto, cuando el índice disminuye por efectos de una disminución de masas del resto de tejidos somáticos (Figura 3b), que permite descartar la expulsión de los gametos. Caso contrario ocurrió al final del estudio, donde ambas especies muestran una disminución de la masa gonádica que evidencian un probable desove, a pesar de que se mantiene el índice gonádico, como resultado de las caídas de la masa de los otros tejidos (Figuras 3 a,b, c).
La relación de la longitud de la concha (axis dorsoventral) y el índice gonádico (Figuras 4a, b) muestra que ambas especies a partir de los 35 mm generan actividad reproductiva, dado los índices altos y bajos a dicha talla, mostrando que esa talla fue la mínima de reproducción, presentada en el experimento.
Relaciones longitud peso
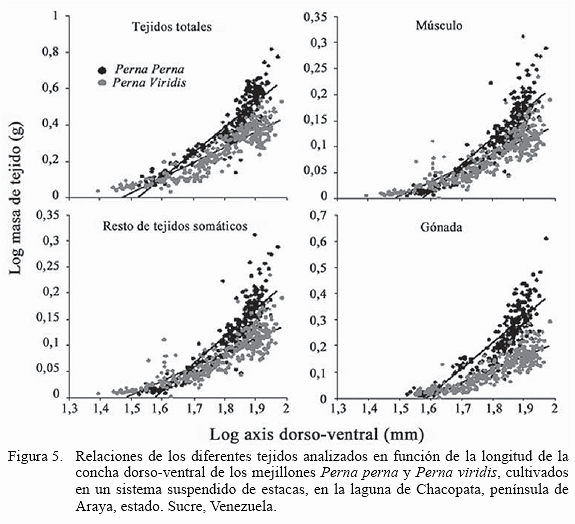
Todas las relaciones obtenidas para la longitud de la concha (axis dorso-ventral) con cada una de los compartimientos de los tejidos (músculo, resto de tejido somático, gónada y el total de los tejidos; Figura 5) fueron significativas (P<0,001) con elevados coeficientes de regresión (r2>0,85) y en todas estas relaciones las pendientes del mejillón marrón P. perna fueron signifi cativamente mayores (P<0,05).
Supervivencia
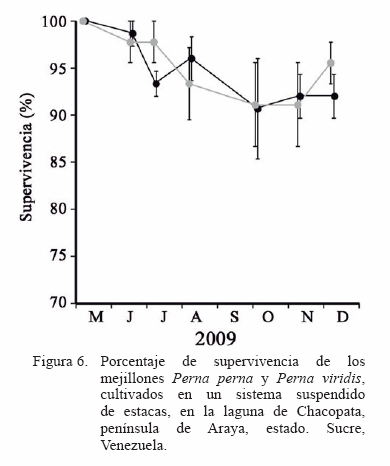
La supervivencia fue alta (mayor del 90%) tanto para P. perna como P. viridis, durante todo el estudio, a pesar de la disminución que se produjo desde el inicio de la siembra hasta el mes de septiembre, a partir de donde mantiene sin variabilidad signifi cativa (P>0,05; Figura 6).
Factores ambientales
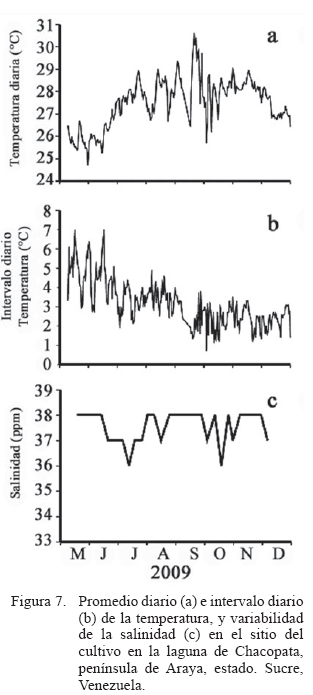
La temperatura diaria (Figura 7a) mostró los menores valores a fines de mayo con valores de unos 24°C. Las temperaturas máximas se registraron a fines de septiembre, alcanzando los 30°C. Al inicio del experimento entre mayo y mediado de junio se registró una temperatura estable con promedio alrededor de los 26°C. Desde esta última fecha la temperatura diaria presentó un incremento de sus valores (29°C) hasta fines de julio. Entre esta última fecha hasta principio de octubre cambia la estructura térmica del mar, presentándose fluctuaciones frecuentes entre los 26 y 30°C; luego hasta inicios de diciembre la estructura térmica del agua vuelve a estabilizarse a una temperatura próxima a los 28°C, y posteriormente baja a los 26° al final del experimento (Figura 7a). Sin embargo, el intervalo diario de temperatura fue elevado durante los 2 primeros meses del experimento con valores que oscilaron de 3 a 7°C. A partir de julio se produjo una disminución entre 2 a 4°C que se mantuvo hasta mediados de septiembre cuando vuelve a bajar para mantenerse entre valores de 1 a 3°C (Figura 7b).
Durante el experimento los valores de salinidad fluctuaron entre los 35,9 a 38 ppm (Figura 7c). Cabe señalar que los valores presentaron mayor estabilidad hacia a los 38 ppm en los mese de fluctuación térmica del agua y por el contrario durante la época de estabilidad térmica la salinidad presentó sus mayores fluctuaciones entre 35,9 y 38 ppm (Figura 7c).
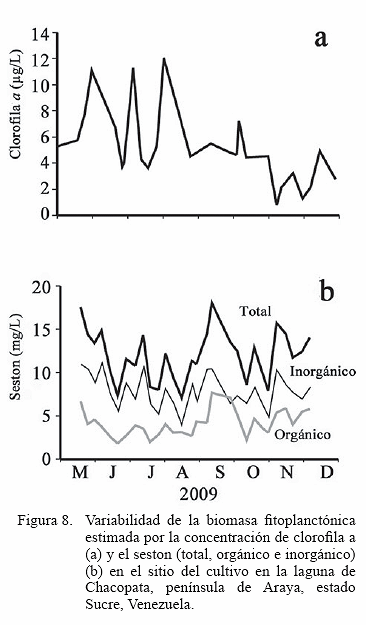
La biomasa fitoplanctónica presentó un patrón definido de distribución temporal de clorofila a, registrándose entre mayo y agosto elevadas concentraciones (>11 μg/L). A partir de septiembre hasta principios de noviembre los valores de clorofila a fueron cercanos a 5 μg/L, concentraciones que vuelven a caer (< 2 μg/L) en el mes de noviembre; sin embargo en fin del experimento en el mes de diciembre la concentración de este pigmento fotosintético incrementa a valores superiores a 4 μg/L. (Figura 8a)
El seston total estuvo por encima de 7 y hasta los 18 (generalmente entre 5 y 10 mg/L), mientras que el seston orgánico se mantuvo entre 2 y 6 mg/L, registrándose los mayores valores en septiembre 2009 (Figura 8 b). A pesar que el experimento se inició con tallas con longitud de la concha diferentes (casi 10 mm de diferencia en talla dorso-ventral), Perna viridis mostró mayor crecimiento, alcanzando al final del estudio 82,1 ± 0,92 mm, mientras que P. perna alcanzó 76,7±2,61 mm); sin embargo, P. perna mostró un mayor rendimiento en relación a la masa de tejidos longitud.
Los patrones de crecimiento de ambas especies en las masas de los tejidos fue similar, aunque con mayor crecimiento en P. perna, hecho que fue particularmente evidenciado en los tejidos del músculo y de la gónada. Al final del estudio, la masa de la gónada de P. perna rebasó en más del 100% a la obtenida por P. viridis. Estas diferencias generaron un mayor índice de relación entre la longitud y los diferentes tejidos estudiados, donde la pendiente de dichas relaciones mostró ser siempre significativamente mayor en P. perna, evidenciando también un mayor rendimiento.
El alto rendimiento de P. perna en condiciones de cultivo horizontal en estacas en la laguna de Chacopata es similar, al obtenido por Acosta et al. (2006; 2009) en cultivo suspendido en el Golfo de Cariaco, concluyendo que P. perna mantiene buenas tasas de crecimiento en condiciones de suspensión horizontal y en un ambiente con elevado material en suspensión, como el que existe en el presente sistema lagunar. En contraste, en el presente estudio P. viridis alcanzó un mayor rendimiento que el obtenido en el Golfo de Cariaco, en donde la producción de tejido somático y reproductivo fue muy baja, siendo el alimento el factor limitante (Acosta et al., 2006; 2009). Perna viridis se caracteriza por vivir en zonas estuarinas donde hay una alta resuspensión de partículas y en áreas costeras donde los niveles de seston son elevados; debido a que esta especie posee un aparato filtrador que le permite eliminar la sobrecarga de sedimento y seleccionar las partículas nutritivas que requiere para su crecimiento (Seed y Richarson, 1999; Wong y Cheung, 2001), por lo que el sistema lagunar parece ser un ambiente adecuado para el desarrollo del cultivo de P. viridis.
Aunque se observaron diferencias de crecimiento a favor del mayor rendimiento cárnico de P. perna, éste no es muy notable como para descartar el cultivo de P. viridis, ello dependerá más bien de la disponibilidad de semillas de P. perna, que en la actualidad es escasa. En este estudio se obtuvieron tasas de crecimiento altas, en ambas especies (unos 5-8 mm/mes en todo el experimento), alcanzando organismos con tallas de 60 mm en tan solo 3-4 meses, a partir de las semillas sembradas con tallas adecuadas para iniciar cultivos comerciales.
De esta manera, el sistema lagunar de Chacopata se presenta como un excelente ambiente, para iniciar la producción de ambos mejillones. Dicha ventaja estaría asociada al alimento presente en la zona, el cual estaría biodisponible para ambas especies. De acuerdo con lo antes señalado, se sugiere la implementación de este sistema de cultivo con las comunidades aledañas a la zona, a manera de módulos familiares, conjuntamente con estudios de factores ambientales y capacidad de carga, en función de un desarrollo sustentable de la comunidad de Chacopata.
Las masas de todos los tejidos de ambas especies de mejillones disminuyeron significativamente al final del experimento, sugiriendo que probablemente las condiciones ambientales fueron estresantes para las mismas por la baja biomasa fitoplanctónica de diciembre del 2009. Esta aseveración se sustenta en la observación de una marcada disminución de las masas de todos los tejidos, incluido el reproductivo, a pesar de no haber evidenciado un proceso de desove. Además, la disminución el índice gonádico observada entre octubre y diciembre pudo estar más bien asociada con una paralela disminución del resto de tejidos somáticos, lo que también sugiere que el estrés al final del estudio, pudo estar más bien asociado a eventos ambientales.
En este estudio el índice gonádico no parece seguir un patrón relativo al comportamiento de la gónada, por lo tanto se recomienda hacer estudios histoquímicos a nivel del tejido reproductivo, para dilucidar realmente la naturaleza de las variables que infl uyen los cambios que se suceden en el tejido reproductivo, en ambas especies de mejillones.
De los factores ambientales estudiados, la temperatura mostró un patrón variable a través del tiempo y pudo haber actuado como factor infl uyente en el crecimiento de los mejillones. Así, durante el periodo de temperaturas bajas asociadas a los periodos de surgencia costera (mayo, junio, julio), el intervalo diario de temperatura fue elevado, hasta unos 7°C, el cual pudo condicionar la fi siología de los mejillones cultivados; no obstante, no fue observada una caída en la tasa de crecimiento de ambas especies en ese periodo, lo que muestra la adaptabilidad térmica que estos bivalvos exhiben ante los cambios de temperatura interdiaria. No obstante, hacia el fi nal del estudio, la disminución de los tejidos estuvo asociada posiblemente a bajas en la biomasa fitoplanctónica, cuando las temperaturas se mantienen elevadas pero con intervalos diarios menores.
Ambas especies han mostrado un incremento del metabolismo, evidenciado por la aumento en la tasa de consumo de oxígeno, a partir de los 30°C (Rajagopal, 2006), sugiriendo que las altas temperaturas observadas a lo largo del día en el sistema lagunar de Chacopata podrían generar el estrés observado al fi nal del estudio. Un estudio realizado por Segnini et al. (1998) muestra mortalidad del 20% en P. perna cuando se expuso a temperaturas de 33,5°C, siendo estas temperaturas cercanas a las obtenidas al final del estudio.
Este mismo estudio muestra una mayor resistencia termohalina de P. viridis, sin mortalidad a 33,5°C, por otra parte, Arriechi, et al. (2010) demostraron que en condiciones de laboratorio P. viridis puede ajustar su metabolismo a condiciones de temperaturas oscilantes, lo cual sugiere una ventaja de esta especie para el cultivo en aguas someras tropicales, como la laguna de Chacopata.
En contraparte a las variaciones observadas en la temperatura, la salinidad mostró oscilaciones de solo unos 3 UPS, la cuales se encuentran dentro del rango fi siológico en la cual los moluscos bivalvos y particularmente estas especies de mejillones no son perturbados (Griffi ths y Griffi ths 1987; Segnini et al., 1998; Segnini, 2003); por otra parte, no hubo evidencia de correlatividad de la variabilidad del seston en sus fracciones tanto orgánicas como inorgánicas con la variabilidad de las masas de los tejidos y la concha.
CONCLUSIONES
Ambas especies mostraron un crecimiento continuo y una alta supervivencia en cultivo suspendido horizontal en estacas en la laguna de Chacopata.
Aunque P. viridis mostró mayores tasas de crecimiento en longitud de la concha, P. perna muestra mayor rendimiento en relación a la producción de tejidos y talla. La interacción temperatura y biomasa fitoplanctónica juegan un papel influyente en el crecimiento de los organismos, en el sistema lagunar.
AGRADECIMIENTOS
Este estudio fue financiado por el Consejo de investigación de la Universidad de Oriente, a través del proyecto CI-2-030603-1618-09. Se agradece la colaboración prestada por la Fundación para la Investigación y Desarrollo de la Acuicultura (FIDAES).
LITERATURA CITADA
1. Acosta, V., A. Prieto y C. Lodeiros. 2006. Índice de condición de los mejillones Perna perna y Perna viridis (Bivalvia: Mytilidae) bajo un sistema suspendido de cultivo en la ensenada de Turpialito, Golfo de Cariaco, Venezuela. Zootecnia Trop., 24(2): 177-192. [ Links ]
2. Acosta, V., M. Glem, T. Urbano, Y. Natera, J. Himmelman, M. Rey-Méndez and C. Lodeiros. 2009. Differential growth of the mussels Perna perna and Perna viridis (Bivalvia: Mytilidae) in suspended culture in the Golfo de Cariaco, Venezuela. J World Aquacult. Soc., 40(2): 227- 236.
3. Arrieche, D., A. Maeda-Martínez A., V. Acosta, L. Freites, H. Acosta-Salmón y C. Lodeiros. 2010. Efecto de la temperatura sobre el potencial de crecimiento de Perna viridis. Memorias III Jornadas de ecotoxicología. Universidad de Oriente, Cumaná, 34 p.
4. Griffiths, C. and R. Griffiths. 1987. Bivalvia. In: Pandian, J.H. and Vernberg F.J. (Ed.) Animals Energetics, Vol. 2. Academy Press, pp. 1-88.
5. Hickman, R. 1992. Mussel cultivation. In E. Gosling (ed), The mussel Mytilus: ecology, physiology, genetics and culture. Developments in Aquaculture and Fisheries Science, vol. 25, Elsevier Science Publishers, NY., pp. 465-510.
6. Hickmand, R. and I. Illingworth. 1980. Condition cicle of green lipped mussel Perna canaliculus in New Zealand. Mar. Biol., 60: 27-38.
7. Labarta U., M. Fernandez-Reiriz, A. Pérez-Camacho y E. Pérez-Corbacho. 2004. Bateiros, mar, Mejillón. Una perspectiva bioeconómica. Centro de Investigaciones Económicas y Financieras, Fundación Caixa Galicia (Serie de estudios sectoriales). 262p.
8. Lodeiros, C., B. Marín y A. Prieto. 1999. Catálogo de moluscos del nororiente de Venezuela. Clase Bivalvia. Edición APUDONS, 9 láminas. 109 p.
9. Rajagopal, S., V. P. Venugopalan, G. Nair, K. van der Velde and H. A. Jenner. 2006. Greening of the coast: a review of the Perna viridis success story. Aquat. Ecol., 40: 273-297.
10. Viñoles I., M. Segnini., M. Bracho y K. Chung. 2000. Efecto de la temperatura de aclimatación sobre el crecimiento instantáneo de Perna viridis (Bivalvia:Mytilidae), según el coefi ciente ARN/ ADN. Rev. Biol. Trop., 48 (1): 159-170.
11. Seed, R. and C. Richardson. 1999. Evolutionary traits in Perna viridis (Linnaeus) and Septifer virgatus (Wiegmann) (Bivalvia: Mytilidae). J. Exp. Mar. Biol. Ecol., 239:273–287.
12. Segnini, M., K. Chung and J. Perez. 1998. Salinity and temperature tolerance of green mussel Perna viridis and Perna perna (Bivalvia: Mytilidae). Rev. Biol. Trop., 46: 121-125.
13. Segnini, M. 2003. Infl uence of salinity on the physiological conditions in mussels, Perna perna y Perna viridis (Bivalvia:Mytilidae). Rev. Biol. Trop., 51, 153-158.
14. Strickland, J. and T. Parsons. 1972. A practical handbook sea water analysis. Bull. Fish. Res. Board Can., 167: 1-10.
15. Wong, W. and S. Cheung. 2001. Feeding rhythms of the green lipped mussel, Perna viridis (Linnaeus, 1758) (Bivalvia:Mytilidae) during spring and neap tidal cycles. J. Exp. Mar. Biol. and Ecol., 257: 13-36. Zar, J. 1984.
16.Biostatistical analysis. 2nd Edition. Prentice- Hall, Inc., New Jersey. 120 p.