Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista de Investigación
versão impressa ISSN 1010-2914
Revista de Investigación vol.41 no.90 Caracas abr. 2017
Análisis del efecto de la temperatura de cocción
en la calidad nutritiva del jugo natural de guayaba (Psidium guajava L.) utilizando el fruto maduro sin piel
Analysis of the effect of cooking temperature
on the nutritional quality of the guava natural juice (Psidium guajava L.) using the ripe fruit without skin
Marine Rosario greylimariana@hotmail.com Maryorie Delgado Rojas maryoriedelgado@gmail.com
Universidad Pedagógica Experimental Libertador. Instituto Pedagógico de Caracas, Venezuela
RESUMEN
Las muestras de jugo natural de guayaba (Psidium guajava L.) se analizaron utilizando el fruto maduro sin piel natural y cocido a 90 °C, los frutos eran originarios del estado Zulia. El tipo de investigación fue de campo de tipo descriptiva. Para la determinación de los metales K, Fe y Ca se empleó un espectrofotómetro de absorción atómica de atomización en llama Analisys 100. Los resultados obtenidos de metales para el jugo del fruto natural fueron: 234,87 ± 0,43 mg/g potasio; 14,42 ± 0,05 mg/g calcio y 0,192 ± 0,026 mg/g hierro. Mientras que para el jugo con el fruto cocido a 90 ºC fueron: 205,36 ± 0,39 mg/g potasio; 12,47 ± 0,069 mg/g calcio y 0,100 ± 0,023 mg/g hierro. Los valores obtenidos permitieron comprobar que la calidad nutritiva es mejor en el jugo natural sin cocer la fruta, por lo que es recomendable su consumo.
Palabras clave: Guayaba; calidad nutritiva; temperatura de cocción
ABSTRACT
Samples of natural guava juice (Psidium guajava L.) were analyzed using the mature fruit without natural skin and cooked at 90 ° C, the fruits were originally from the Zulia state. The type of research was descriptive in the field. For the determination of the K, Fe and Ca metals an atomic absorption spectrophotometer was used in the Atomis 100 Flame Atomization. The results obtained from metals for the juice of the natural fruit were: 234,87 ± 0,43 mg / g potassium; 14,42 ± 0,05 mg / g calcium and 0,192 ± 0,026 mg / g iron. While for the juice with the fruit cooked at 90 ºC were: 205,36 ± 0,39 mg / g potassium; 12,47 ± 0,069 mg / g calcium and 0,100 ± 0,023 mg / g iron. The obtained values allowed to verify that the nutritive quality is better in the natural juice without cooking the fruit, reason why its consumption is advisable.
Key words: Guajava; nutritional quality; cooking temperature.
Artículo recibido en junio 2016 y publicado en enero 2017
INTRODUCCIÓN
El consumo de frutas en la dieta humana es de vital importancia por el aporte de vitaminas, minerales, fibra, proteínas, agua y otros nutrientes, además de la satisfacción de consumir un producto de características sensoriales tan variadas y agradables (Camacho, 2002). En los países tropicales como Venezuela, la diversidad de frutas producidas es amplia gracias a los diferentes climas y ecosistemas que naturalmente existen en nuestra geografía (Wiley, 1997).
En el caso de la guayaba (Psidium guajava L.) es una fruta tropical muy popular en Venezuela, tanto para consumo fresco como para procesamiento y obtención de diversos productos como: jugo, néctar, concentrados, jalea, bocadillo, colado y relleno para dulces. Esta gran aceptación se debe a su valor comercial, digestibilidad, palatabilidad, sabor agradable y valor nutritivo: excelente fuente de las vitaminas C, B y provitamina A, tiamina, riboflavina, proteína, fibras y ácido nicotínico, así como de los minerales potasio, calcio, hierro y fósforo, además de carbohidratos (Wills, 1997)
La guayaba pertenece a un género de unas cien especies de arbustos tropicales y árboles pequeños en la familia Mirtácea, nativa del Caribe. Es 104 un fruto que procede de Centroamérica, aunque se cultiva en casi todos los países tropicales. El jugo de la guayaba tiene acción hipoglucemiante, es decir, que disminuye los niveles de glucosa en la sangre; fue comprobada mediante numerosas observaciones clínicas. Su utilidad se relaciona con las propiedades antioxidantes de los componentes del jugo de guayaba (Wills, 1997). Hoy en día la mayoría de los jugos naturales suelen ser realizados con la fruta previamente cocida para darle un sabor agradable, más sabroso, apetecible y digerible (Vázquez, Cos y López, 2005).
La guayaba (Psidium guajava L.), es el fruto del guayabo, que es un árbol de la familia de las mirtáceas; la guayaba es la única fruta hasta descubierta hasta ahora que contiene 16 vitaminas: es un gran alimento, sano, digestivo y muy útil para la nutrición y además se le denomina la fruta reina en lo que se conoce frutoterapia (Morales, 2002). Los principales países productores de la guayaba son: Brasil, Colombia, Perú, Estados Unidos, Ecuador, México, Venezuela, Costa Rica, Cuba, Puerto Rico, India, Sudáfrica y Filipinas (Crockrell y Barrantes, 1992).
Dentro de las principales características de la Guayaba se puede señalar que puede ser de piel rugosa o completamente lisa; su interior puede ser de color rosado pálido, o rosado intenso. Ésta suele tener una primera capa firme y con consistencia, y otra más interna jugosa, cremosa y blanda, con semillas pequeñas (Crockrell y Barrantes, 1992).
Según Roger (2006), su principal componente es el agua y las vitaminas. La pulpa de la guayaba es baja en proteínas, grasas (menos de 1 % de ambas) e hidratos de carbono (6 %). Sin embargo, posee un alto contenido de: Vitamina C, Carotenoides, fibra vegetal, además cantidades significativas de vitaminas del grupo B (excepto la B12) vitamina E, así como calcio, magnesio, fósforo y hierro. El mineral más abundante es potasio. Además la guayaba es relativamente rica en oligoelementos como el zinc, cobre y manganeso (ver Cuadro 1).
Dentro de las vitaminas de mayor importancia en la guayaba, se destacan la vitamina C y la vitamina A. La primera denominada vitamina C o ácido ascórbico, corresponde al grupo de las vitaminas hidrosolubles, es muy inestable y se puede almacenar en el organismo, aunque no se almacena por largos períodos de tiempo y se elimina en pequeñas cantidades a través de la orina. Por este motivo, es importante su ingesta diaria, ya que es más fácil que se agoten sus reservas y con ella las otras vitaminas que se obtienen en los frutos cítricos y vegetales (Martín y Portal, 2000)
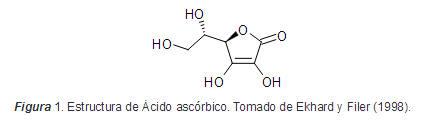

En este sentido, Roger (2006) establece que sus funciones son diversas, pues es un antioxidante, y cofactor de muchas enzimas, sin embargo, su principal actividad es como antiescorbútica. Al tener gran capacidad de captar y liberar hidrógeno (oxido-reducción), su papel en el metabolismo es de gran importancia, donde se debe resaltar su función como reductora del ión férrico al ferroso (Fe+3 a Fe+2) que asegura mayor absorción de hierro a nivel del intestino.
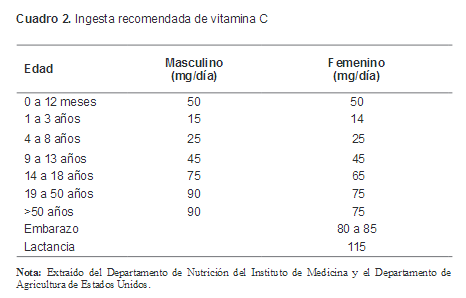
En el siguiente cuadro se establece la ingesta diaria de vitamina C que es recomendada para niños y adultos por el Departamento de Nutrición del Instituto de Medicina y el Departamento de Agricultura de Estados Unidos.
La vitamina C, interviene en la formación de colágeno y repara las células de los tejidos, encías, huesos, dientes, glóbulos rojos, favorece la absorción del hierro de los alimentos, protege contra enfermedades infecciosas y el cáncer (Marcano y Hasegawa, 2002)
Según la Organización de las Naciones Unidas para la Alimentación y la Agricultura (FAO), la vitamina C es un agente antioxidante y reductor poderoso, puede reducir la acción perjudicial de los radicales libres y es también importante para mejorar la absorción del hierro en alimentos de origen vegetal.
En una persona que tiene carencia de ácido ascórbico, las células endoteliales de los capilares carecen de solidez normal. Son, por lo tanto, frágiles y se presentan hemorragias. De modo semejante, la dentina de los dientes y el tejido óseo de los huesos no se forman bien. Además, esta propiedad de fijación celular explica la cicatrización pobre y la lentitud en el proceso de curación de las heridas que se ve en personas con carencia de ácido ascórbico.
La Vitamina A. Es un nutriente esencial para las funciones fisiológicas normales del ser humano, es una vitamina liposoluble que se encuentra en dos formas en la naturaleza. La primera es vitamina A preformada que proviene de los alimentos de origen animal (hígado, leche entera y mantequilla, principalmente) y la segunda es provitamina A o carotenoides, precursores de vitamina A que provienen de alimentos de origen vegetal como son las verduras; hortalizas y algunas frutas (Machlin, 1984).
El beta-caroteno, es un antioxidante que protege las células del daño causado por los radicales libres, por ende contribuyen a retardar los procesos del envejecimiento. La vitamina A, es esencial para la visión, el buen estado de la piel, el cabello, las mucosas, los huesos y para el buen funcionamiento del sistema inmunológico (Marcano y Hasegawa, 2002). Según la FAO, la conversión de beta-caroteno a vitamina A se realiza en las paredes del intestino. El mismo solo puede absorber y convertir tan sólo una porción del beta-caroteno de la dieta; por lo tanto, 6 mg de beta-caroteno en el alimento equivale más o menos a 1 mg de retinol.
La FAO y la Organización Mundial de la Salud (OMS) recomiendan el consumo de 750 μg de retinol por día para adultos; las madres lactantes necesitan 50 por ciento más, y los niños y bebés cantidades menores. Se debe tener en cuenta que estas cifras se basan en dietas mixtas que contienen vitamina A y caroteno. Cuando la dieta es en su totalidad de 107 108 origen vegetal, se sugieren cantidades mayores de caroteno, debido a que la conversión del caroteno a retinol no es muy eficaz.
De acuerdo con Ekharde y Filer (1998), la función más conocida de la vitamina A esta relacionada con la visión de los ojos, la diferenciación celular y el desarrollo embrionario. No obstante, también interviene en muchos procesos fisiológicos, entre ellos la espermatogénesis, la respuesta inmunitaria, el gusto, la audición, el apetito y el crecimiento infantil y xeroftalmía.
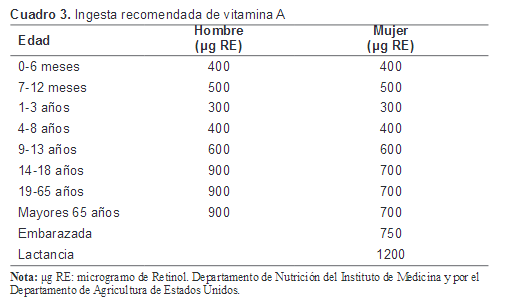
En el siguiente cuadro se establecen la ingesta diaria de vitamina A recomendada para infantes, niños y adultos por el Departamento de Nutrición del Instituto de Medicina y por el Departamento de Agricultura de Estados Unidos.
En cuanto a los minerales, el calcio junto con el fósforo son los componentes principales del esqueleto. Además, son importantes en funciones metabólicas, como la función muscular, el estímulo nervioso, actividades enzimática y hormonal y el transporte del oxígeno. Por otra parte, el hierro está presente en los glóbulos rojos, como componente de la hemoglobina. La función biológica principal del hierro es el transporte de oxígeno a varios sitios del cuerpo. Y cuanto al potasio, es un mineral que permite que las células conserven su equilibrio osmótico, contribuye al correcto funcionamiento muscular, ya que participa de forma clave en la relajación y contracción de los músculos, además de ser importante el control que ejerce para evitar el exceso de sodio. Un exceso de sodio puede tener consecuencias negativas para la salud como la hipertensión, o problemas de tipo cardiovascular (FAO). En tal sentido, la manera en que: almacenamos, conservamos y cocinamos nuestros alimentos afecta su contenido de nutrientes (Burgess y Glasauer, 2006).
El potasio, elemento químico cuyo símbolo es K, es un metal alcalino, blanco-plateado que abunda en la naturaleza, se oxida rápidamente en el aire, es muy reactivo, especialmente en agua, y se parece químicamente al sodio. Es un electrolito esencial para el crecimiento y para fomentar la buena salud. Dentro de sus funciones, el potasio potencia la actividad del riñón ayudando en la eliminación de toxinas (Johnson, 1999).
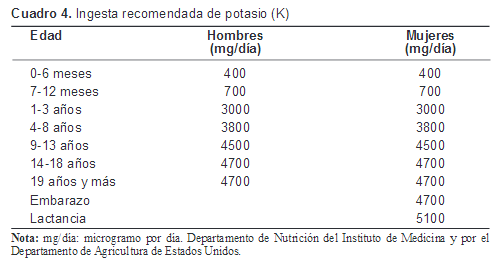
En el siguiente cuadro se establecen la ingesta diaria de potasio recomendada para infantes, niños y adultos por el Departamento de Nutrición del Instituto de Medicina y por el Departamento de Agricultura de Estados Unidos.109 110
El hierro, elemento químico cuyo símbolo es Fe, se encuentra en la naturaleza como parte de los reinos mineral, vegetal y animal. En los vegetales y en los animales, el hierro constituye un componente de la célula. En el organismo humano tiene una función principal, formar parte de la hemoglobina y mioglobina, que es el pigmento respiratorio de los glóbulos rojos de la sangre transportando el oxígeno (Badui, 1993). En el siguiente cuadro se establecen la ingesta diaria de hierro recomendada para infantes, niños y adultos por el Departamento de Nutrición del Instituto de Medicina y por el Departamento de Agricultura de Estados Unidos.

El calcio, elemento químico, mineral que tiene muchas propiedades, siendo la más conocida nutrir los huesos, prevenir la osteoporosis y ser relajante muscular. Es el mineral que más abunda en el cuerpo humano y se necesita en cantidades importantes por desempeñar múltiples funciones fisiológicas (Johnson, 1999).
En el cuadro 6, se establecen la ingesta diaria de calcio recomendada para infantes, niños y adultos por el Departamento de Nutrición del Instituto de Medicina y por el Departamento de Agricultura de Estados Unidos.
Debido a la gran aceptación y amplia comercialización de los productos derivados de la guayaba, en la presente investigación se plantearon como objetivos: Analizar el efecto de la temperatura de cocción en la calidad nutritiva del jugo natural de guayaba (Psidium guajava L.), utilizando el fruto maduro sin piel. Determinar la concentración de beta-caroteno presente en el jugo de guayaba natural utilizando el fruto maduro sin piel a temperatura ambiente y cocido por espectrofotometría UV-VIS. Determinar la concentración de minerales (K, Fe y Ca) presentes en el jugo natural de guayaba utilizando el fruto maduro mediante espectrofotometría de absorción atómica en llama y comparar la calidad nutritiva del jugo de guayaba cocido y natural en cuanto al contenido de vitaminas C y A, los minerales K, Fe y Ca, considerando además el % de humedad, cenizas y °Brix.

MÉTODO
El trabajo responde a un diseño de campo, de tipo descriptivo, que según Sabino (2002), se refiere a investigaciones donde los datos se acercan al conocimiento de la realidad en estudio y se obtienen de forma directa. Y descriptivo, ya busca especificar propiedades, características y rasgos importantes de cualquier fenómeno que se analice (Sampieri, Fernández y Baptista, 2006). La población estuvo formada por todas las variedades de la fruta de guayaba presentes en el mercado municipal de Coche ubicado en Caracas-Venezuela y la muestra quedó representada por frutos de guayaba tipo criollas que presentaban piel verde y pulpa rosada, fruto maduro.
Tratamiento de la muestra
Para la preparación de la muestra (jugo de guayaba) tanto natural como cocida, se manipuló un lote de 20 Kg de guayaba. La preparación del jugo fresco fue llevada a cabo a temperatura ambiente, según se indica: se Lavaron 6 guayabas con agua y se colocaron en un envase, se les quitó la piel y se lavaron con agua destilada. La fruta se cortó en trozos pequeños y se licuaron con 1000 ml de agua destilada en una licuadora, se trasvasó el jugo a un envase hermético empleando un colador para eliminar las semillas, el jugo se conservó en el refrigerador durante tres días. Para la elaboración del jugo de guayaba cocida, se repitió el mismo procedimiento pero con la diferencia que se dejaron en cocción por 40 min a 90 °C; el procedimiento se repitió hasta realizar todas las determinaciones necesarias.
Determinación de Potasio, Hierro y Calcio por Espectrofotometría de Absorción Atómica de Llama en el jugo natural de guayaba. Para ello se calibró el instrumento siguiendo las instrucciones del equipo (espectrofotómetro de absorción atómica de atomización en llama marca Analisys100), para ello se lavó el atomizador con agua desionizada y se preparó la solución patrón para la realización de la curva patrón. Se determinó la concentración del analito en la muestra mediante una regresión lineal por mínimos cuadrados, a partir del cual se obtuvo la ecuación de la recta (y= mx + b).
Preparación del patrón de Ca (500 mg/L) para el análisis Espectrofotométrico. Requirió tomar la medida de 1,248 g carbonato de calcio CaCO3, se disolvió en 50 mL de agua, se añadieron 10 mL de ácido clorhídrico concentrado y se diluyó a 1000 mL con agua desionizada.
Preparación del patrón de Fe (1000 mg/L) para el análisis Espectrofotométrico. Se llevó a cabo mediante la medición de la masa de 1,000 g de hierro (Fe) en polvo, se disolvió en 50 mL de agua, se añadió 1 mL de ácido nítrico concentrado y se diluyó a 1000 mL con agua desionizada.
Preparación del patrón de K (1000 mg/L) para el análisis Espectrofotométrico. Para lo cual se midió la masa de 1,907 g cloruro de potasio (KCl), se disolvió en 100 mL de agua, se aforó a 1000 mL con agua desionizada.
Preparación de la muestra para el análisis espectrofotométrico. Se llevó a cabo mezclando por agitación magnética el producto (jugo de guayaba) 10 mL, para asegurar una muestra uniforme, se filtró a través de papel de filtración rápida, se midieron 2 mL de la muestra y se diluyó a 100 mL con agua desionizada.
Determinación de cenizas. Este proceso se realizó según las normas oficiales AOAC (1996) Nº 923.03
Determinación de Humedad. Se llevó a cabo según las normas oficiales AOAC (1996) Nº920.151
Determinación de la cantidad de º Brix en el jugo de guayaba por un refractómetro. En el jugo de guayaba, los º Brix permitirán el análisis de sólidos solubles, que puede utilizarse como un estimador del contenido en azúcares en la muestra (López, 2006). La técnica más común de medición de este parámetro, está basada en la refractometría, lo que requiere de instrumentos relativamente económicos. Se empleó un refractómetro manual Atago de escala 0 a 32 º Brix. Para la obtención de los º Brix se siguieron los siguientes procedimientos utilizando jugo de guayaba, 113 114 para ello se mezcló 5 mL de la muestra con agitación magnética para asegurar que fuese uniforme, se filtró a través de un algodón absorbente y se hizo circular agua a una temperatura 20 °C, a través de la camisa del refractómetro. La muestra previamente preparada se colocó con una varilla una porción de ± 2 gotas en el refractómetro y se esperó 1 minuto antes de realizar la lectura, para que la temperatura de los prismas de la muestra fuera la misma y constante, se registró los ºBrix obtenidos. Este procedimiento se realizó por triplicado.
Extracción de los carotenoides en el jugo de guayaba utilizando el fruto maduro a temperatura ambiente y de cocción. Esta técnica se emplea para separar un producto orgánico de una mezcla de reacción o de sus fuentes naturales, para esta investigación se realizó la extracción de carotenoides en el jugo natural de guayaba, tanto para el fruto a temperatura ambiente, como para el fruto cocido. Y para la preparación del patrón: se midió la masa de una tableta de beta-caroteno conocida como natural systems beta caroteno, se agregó en un vaso precipitado de 100 mL previamente secado, se añadió 25 mL de alcohol isopropílico y 75 mL de cloroformo se agregaron10 mL de la solución concentrada de beta-caroteno en un matraz aforado de 100 mL y se diluyó con éter de petróleo.
RESULTADOS
Los resultados de la humedad (cuadro 7), arrojaron que el jugo de guayaba cocida posee menor humedad, a diferencia del jugo natural de guayaba, lo que permite inferir que este procedimiento disminuye la cantidad de agua. Según Marquina y otros (2008), quienes trabajaron con la pulpa de guayaba obtuvieron un valor de 86,10 % para la pulpa. El Instituto Nacional de Nutrición (1994), reporta que la guayaba rosada posee 89% de humedad y según Kirk y otros (1996), los métodos de secado son los más comunes para valorar el contenido de humedad en los alimentos. Sin embargo, es necesario tener presente que: a) algunas veces puede quedar agua ligada dependiendo de la naturaleza de las sustancias; b) a cierta temperatura el alimento es susceptible de descomponerse, además que volatilizan otras sustancias, además de agua. De allí que es probable que los valores obtenidos en los distintos autores y en la presente investigación se pueden deber a estos efectos así como a los factores climáticos y lugar de cosecha de la fruta.

Con respecto a las cenizas totales, se analizaron de acuerdo con el método descrito por las normas AOAC (1990), obteniéndose valores que coinciden con algunos rangos señalados en la literatura, tales como Córdoba (1969), Plate (1987), Instituto Nacional de Nutrición (2001), y Roger (2006), que muestran un rango entre 0,3- 0,7 % para las guayabas (Psidium guajava. L.). Otros autores como Medina y Pagano (2003), obtuvieron un rango entre 0,2 – 0,8% para las guayabas cosechadas en granjas del municipio Mara del estado Zulia; estos valores se hacen bastante similar al obtenido en el presente trabajo. Es necesario mencionar que las cenizas de un alimento con un término analítico equivalente al residuo inorgánico que queda después de calcinar la materia orgánica (Moreno y otros, 1999)
En seguimiento a los análisis químicos realizados, los sólidos solubles se determinaron de acuerdo con las normas COVENIN N° 924-83, usando un refractómetro. Los resultados se expresaron en ºBrix a 20º C con una media de 2,1ºBrix para el jugo de guayaba utilizando la fruta natural y 1,8 ºBrix para el jugo de guayaba utilizando la fruta cocida. Moreno y otros (1999), obtuvieron el rango de 2,34 – 7,93º Brix (con un coeficiente de variación de 7,33). Cabe destacar que los sólidos solubles son los contenidos de azúcares y ácidos, cuyo contenido varía según la variedad 116 de la fruta, técnica de cultivo y grado de madurez principalmente, ya que éste permite el aumento de los sólidos solubles (López, 2006).
Por otro lado, con respecto al contenido de minerales (K, Fe y Ca), se determinaron a través de la técnica de espectrofotometría atómica; se puede evidenciar en el cuadro 7 que los resultados fueron mayores para el jugo de guayaba natural que para el cocido. Estos resultados suelen ser un poco bajo en comparación a los reportado en la literatura por Instituto Nacional de Nutrición (1994) y Roger (2006), ya que se reporta para Ca, K y Fe, mostrando de 17-21, 284 y 0,300 mg/100g para cada mineral, respectivamente.
La determinación de beta-caroteno se realizó mediante espectrofotometría de UV-visible, los resultados obtenidos exponen evidentemente que la fruta sin cocer conserva en mayor proporción el beta-caroteno, por lo cual, es conveniente resaltar que la población debe aprovechar el enriquecimiento vitamínico del jugo de guayaba utilizando el fruto a temperatura ambiente. En tal sentido, es necesario recalcar que el valor reportado por el Instituto Nacional de Nutrición (1994) de vitamina A para la guayaba rosada, es 0,079 mg/g, siendo similar al obtenido experimentalmente en el jugo con la guayaba sin cocer (0,078 mg/g).
Cuadro 8. Evaluación del método mediante parámetros estadísticos con respecto a las determinaciones de Fe, Ca, K y β-caroteno.
| Determinaciones | Límite de detección LOD (mg/dm3) | Límite de cuantificación LOQ (mg/dm3) |
| Fe | 0,296 | 0,100 |
| Ca | 0,247 | 0,083 |
| K | 1,825 | 1,825 |
| β-caroteno | 2,79.10-6 | 3,38.10-6 |
Además, el valor de LOQ como de LOD son pequeños, el cual se puede estimar que se tiene buena capacidad del método para cuantificar y detectar concentraciones pequeñas de analito.
CONCLUSIONES
Se encontró que el efecto de la temperatura afecta la calidad nutritiva del jugo natural de Guayaba utilizando el fruto maduro sin piel. En cuanto a la pro-vitamina A (beta-caroteno), en el jugo de guayaba utilizando el fruto maduro sin piel natural se obtuvo una mayor concentración que para el jugo con el fruto cocido, lo que indica que el β-caroteno disminuye con un aumento de temperatura. Para la la concentración de los minerales K, Fe y Ca en el jugo natural de guayaba fue cuantiosamente superior en el jugo natural que en el jugo cocido.
En cuanto al porcentaje de humedad es ampliamente provechosa en el jugo natural de guayaba, debido a que se obtuvo mayores resultados que en el jugo cocido. Y el porcentaje de cenizas es cuantiosamente superior en el jugo natural de guayaba que en el jugo cocido.
La cantidad de ºBrix, sólidos solubles, presentes en el jugo natural de guayaba fue superior que en el fruto cocido, lo que muestra que se pierde carbohidratos por causa del efecto de la temperatura.
Conforme a los resultados obtenidos, se concluye que es importante consumir jugos naturales de guayaba utilizando la fruta sin piel ya que se mantiene las características nutricionales del jugo, mientras que cocidos se pierde gran parte de los mismos.
REFERENCIAS
1. AOAC. (1990). Official Methods of Analysis (15 ed.) Association of Official Analytical Chemists, Inc. Virginia: Arlington
2. AOAC. (1996). Official Methods of Analysis Nº 920.151 (16 ed.) Association of Official Analytical Chemists, Inc. Virginia: Arlington
3. AOAC. (1996). Official Methods of Analysis Nº 923.03 (16 ed.) Association of Official Analytical Chemists, Inc. Virginia: Arlington
4. Badui, S. (1993). Química de los alimentos. (1ed.). Madrid. Alhambra mexicana
5. Burgess, A y Glasauer, P. (2006). Guía de Nutrición de la Familia. Organización de las Naciones Unidas para la Agricultura y la Alimentación117 118
6. Camacho, G. (2002). Transformación y conservación de frutas. [Documento en línea]. Disponible: https://goo.gl/cHKZ2V . [Consulta: 2010, Diciembre 23]
7. Córdoba, J. (1969). La Guayaba. Artículo personal. Agricultor Venezolano
8. Crockrell, M y Barrantes, A. (1992). Coco, Pejibaye, Guayaba y Cas, Fruticultura especial. [Documento en línea]. Disponible: https://goo.gl/1q1epW [Consulta: 2010, Diciembre 21]
9. Ekhard, E. Filer, L. (1998). Conocimientos Actuales Sobre Nutrición (7 ed.).
10. Instituto Nacional de Nutrición (1994). Tabla de Composición de alimentos para uso práctico. Caracas-Venezuela: Publicación Nº 50
11. Instituto Nacional de Nutrición (2001). Tabla de Composición de alimentos para uso práctico. Caracas-Venezuela: Publicación Nº 50
12. Johnson, R. (1999). Introducción a la Química descriptiva. [Documento en línea].Disponible:http://books.google.co.ve/books?id=ppFBedg [Consulta: 2011, Enero 11]
13. Kirk S, Sawyer R y Egan, H. (1996).Composición y análisis de alimentos de Pearson. México: Compañía Editorial Continental SA de CV
14. López, R. (2006). Caracterización Físico-Química del Membrillo Japonés (Chaenomeles sp. Lindl.): Desarrollo fisiológico y conservación frigorífica. [Tesis en línea]. Disponible: http://www.tdr.cesca.es/TDX/TDR_UM/TESIS/AVAILABLE/TDR-0302107-113535//vilalopez.pdf [Consulta: 2011, Enero 26]
15. Machlin, L. (1984). Handbooks of vitamins nutritional, biochemical and clinical aspects. [Documento en línea]. Disponible: http://www.bensoninstitute.org/Publication/RELAN/V14/Contenido.asp . [Consulta: 2010, Diciembre 22]
16. Marcano, D y Hasegawa, M. (2002). Fitoquímica orgánica. Caracas: Universidad. Central de Venezuela
17. Marquina V; Araujo L;Ruíz J y Rodríguez A. (2008). Composición química y. Capacidad antioxidante en fruta, pulpa y mermelada de guayaba (Psidium guajava L.)
18. Martín, M y Portal, J. (2000). Vitaminas y Minerales. [Documento en línea]. Disponible:http://books.google.co.ve/books?id=naHaEunu
19. ZkQC&printsec=frontcover#v=onepage&q&f=false. [Consulta: 2011, Enero 06]
20. Medina, M y Pagano, F. (2003). Caracterización de la pulpa de guayaba (Psidium guajava L.) tipo Criolla Roja. Caracas: Universidad central de Venezuela
21. Morales, A. (2002). Frutoterapia: Nutrición y Salud. [Documento en línea]. Disponible:http://books.google.co.ve/books?id=F_VMo 0IIR68 C&printsec=frontcover#v=onepage&q&f=false. [Consulta: 2011, Enero 06]
22. Moreno L, Marín D, Peña Ey Toyo L. (1999). Contenido de humedad, materia seca y cenizas totales en guayabas (Pisidium guajava. L.)
23. Norma Covenin. Frutas, vegetales y productos derivados. Determinación de sólidos solubles por refractometría N°924-83. Caracas: Fondonorma
24. Organización de las Naciones Unidas para la alimentación y la agricultura (FAO). Nutrición Humana en el mundo en Desarrollo. Minerales y Vitaminas. (Disponible: http://www.fao.org/docrep/006/W0073S/w0073s0e.htm#TopOfPage ).
25. Plate, L. (1987). Myrtaceae. Guava. En: Fruits of Warm Climates. Editorial: Curtis
26. Roger, J. (2006). Salud por los alimentos. (1 ed.). Madrid: Safeliz
27. Sabino, C. (2002). El proceso de investigación. Caracas: Panapo
28. Sampieri, R. Fernández, C y Baptista, P. (2006). Metodología de la investigación. (4ªed). México: Mc Graw-Hill
29. Universidad Pedagógica Experimental Libertador. (2006). Manual de Trabajos de Grado de Especialización y Maestría y Tesis Doctoral. (4ª. ed.). Caracas: FEDUPEL.
30. Vázquez, C. Cos, A. y López, C. (2005). Alimentación y Nutrición: manual. Teórico-Práctico. [Documento en línea]. Disponible: http://books.google.co.ve/books?id=FxV6Rul96kC&printsec=frontcoverdq=Alimentaci%C3%B3n+y+Nutrici% [Consulta: 2011, Enero 10]
31. Wiley, R. (1997). Frutas y hortalizas mínimamente procesadas y refrigeradas. España: A. Zaragoza. Ed. Acribia S
32. Wills, R. Lee, H. McGlasson, B. y Graham,D. (1997). Fisiología y Manipulación de Frutas y Hortalizas Postrecolección. Editorial: Acribia 119













