Saber
versão impressa ISSN 1315-0162
Saber vol.26 no.2 Cumaná jun. 2014
Identificación de algunos metabolitos secundarios del extracto en acetato de etilo de Muricea sp.
Identification of some secondary metabolites from the ethyl-acetate-extract of the octocoral, Muricea sp.
Ángel Camacho1, Haydelba DArmas2, Gabriel Ordaz2, Shailili Moreno2, Juan Hernández3, Dayanis Yañez1
1 Universidad de Oriente, Núcleo de Monagas, Unidad de Estudios Básicos, Departamento de Ciencias, Sección de Química, Maturín, Venezuela,
2 Universidad de Oriente, Núcleo de Sucre, Escuela de Ciencias, Departamento de Química, Laboratorio de Productos Naturales y Lípidos, Cumaná, Venezuela,
3 Coca-Cola FEMSA, Laboratorio de Control de Calidad, Valencia, Venezuela. E-mail: gabrieljordazgonz@yahoo.com
RESUMEN
Del extracto en acetato de etilo de una especie no identificada de octocoral del género Muricea, se obtuvieron fracciones cromatográficas que mostraron actividad antibacteriana frente a Escherichia coli, Salmonella enteritidis, Citrobacter freundii, Staphylococcus aureus y Bacillus subtilis, lo que indica la presencia de constituyentes bioactivos en las mismas. El análisis por CG/EM de algunas fracciones obtenidas mediante separación cromatográfica continua, permitió identificar los constituyentes: (Z)-9-octadecenoato de metilo, octadecanoato de metilo, 4-etoxi-1-metil-δ(3)-pirrolin-2-ona, endo-1-bourbonanol, dibutilftalato, 4,5-epoxi-1-isopropil-4-metilciclohexeno, 3,6-epoxi-2,2,6-trimetilciclohexanocarboxilato de etilo, (E)-2,6-dimetil-2,6-octadieno, farnesol, colesta-5,22-dien-3β-ol, colesterol, (3β,22E,24S)-ergosta-5,22-dien-3-ol, 3-hidroxilongifolol, por comparación con las bases de datos WILEY y NIST y el estudio de los patrones de fragmentación de sus espectros de masas.
Palabras clave: Octocoral, actividad antibacteriana, CG/EM, terpenoides, colestanos.
ABSTRACT
Some chromatographic fractions obtained from the ethyl-acetate-extract of the unidentified octocoral species of the genus, Muricea, showed antibacterial activity against Escherichia coli, Salmonella enteritidis, Citrobacter freundii, Staphylococcus aureus, and Bacillus subtlis, which indicates the presence of bioactive compounds in it. The GC/MS analysis of some fractions obtained by continuous chromatographic separation, allowed identification of metabolites, such that: (Z)-9-octadecenoic acid methyl ester, octadecenoic acid methyl ester, 1-methyl-4-ethoxy-δ(3)-pyrrolin-2-one, endo-1-bourbonanol, dibutylphtalate, 4,5-epoxy-1-isopropyl-4-methyl-1-cyclohexene, 1,3,3-trimethyl-7-oxabcyclo[2.2.1]heptane-2-carboxylic acid ethyl ester, 2,6-dimethyl-2-trans-6-octadiene, farnesol, 3β-cholesta-5,22-dien-3-ol, cholesterol, (3β,22E,24S)-ergosta-5,22-dien-3-ol, (3β,5α)-2-methylenecholestan-3-ol, 3-hidroxylongifolol, by comparison with the WILEY and NIST databases and the study of the fragmentation patterns of their mass spectra.
Key words: Soft corals, antibacterial activity, GC/MS, terpenoids, cholestanes.
Recibido: enero 2014. Aprobado: marzo 2014. Versión final: mayo 2014.
INTRODUCCIÓN
Los octocorales del género Muricea (orden Gorgonacea, familia Gorgoniidae), a pesar de ser un componente importante de la fauna invertebrada marina de las Indias occidentales (Romero y Rada 1999, Guzmán et al. 2004, Sánchez et al. 2011, Abeytia et al. 2013), no han sido objeto de un abundante acercamiento quimiotaxonómico. Algunas investigaciones, sin embargo, muestran que este género Gorgonio puede ser una fuente de metabolitos secundarios con estructuras únicas y propiedades farmacodinámicas importantes (Rodríguez 1995, Ortega et al. 2002, Murillo-Álvarez y Encarnación-Dimayuga 2003, Gutiérrez et al. 2006, Lorenzo et al. 2006).
El presente trabajo informa sobre algunos metabolitos secundarios identificados mediante CG/EM presentes en el extracto en acetato de etilo del octocoral Muricea sp., así como las propiedades antibacterianas de algunas fracciones, como un aporte a la quimiotaxonomía de este género Gorgonio en latitudes venezolanas.
MATERIALES Y MÉTODOS
Recolección
Las muestras de Muricea sp., fueron obtenidas del Golfo de Cariaco, estado Sucre, Venezuela (10°30-10°32 N y 64°12-64°13 W). La identificación taxonómica fue realizada en la Fundación Pro-desarrollo de las Ciencias del Mar (FUNDEMAR) del Instituto Oceanográfico de Venezuela de la Universidad de Oriente.
Extracción
Las muestras del octocoral, fueron lavadas con abundante agua destilada, troceado y sometido a extracción con metanol puro (99,9%) por espacio de 96 h y luego por 120 h. El extracto crudo en metanol se obtuvo por concentración a presión reducida (aprox. 11 mbar) en un rotaevaporador Hidolph. Una suspensión del extracto en una solución acuosa de metanol al 90% fue desgrasada con éter de petróleo puro (grado analítico) y luego se sometió a extracción con acetato de etilo. La fase en acetato de etilo fue secada con sulfato de sodio anhidro, filtrada y evaporada a presión reducida para obtener la fracción soluble en este solvente (FA).
Fraccionamiento cromatográfico
La FA (8,12 g), fue particionada mediante cromatografía de columna (CC), en una columna de vidrio de 4 × 65 cm empaquetada con sílica gel 35-70 mesh y hexano a una proporción en masa 1:30 (extracto:sílica). La fase móvil estuvo constituida por sistemas de solventes de polaridad creciente, iniciándose con hexano y luego, mezclas de éste con acetona y metanol en distintas proporciones en volumen. Se recolectaron 95 eluatos de aproximadamente 50 mL cada uno, los cuales fueron analizados por cromatografía de capa fina (CCF), empleándose placas de vidrio (20 × 20 cm) recubiertas con sílica gel 60 mesh, con un espesor de 0,5 mm y, como agente revelador, una solución de molibdato de amonio al 5% en H2SO4 al 5%, agrupándose en 18 fracciones identificadas con las letras A hasta la Q (8,06 g; 99,26%). Con base en el análisis por CCF y los rendimientos obtenidos de las fracciones, se seleccionaron A (0,3411 g; 4,20%), C (0,3251 g; 4,00%), E (0,1873 g; 2,31%) y J (0,2937 g; 3,62%) para ser particionadas sucesivamente mediante CC (sílica gel 35-70 mesh) y CCF preparativa (sílica gel 10-40 μ, 1 mm de espesor).
Actividad antibacteriana
Los principios antibacterianos se detectaron utilizando cepas pertenecientes al Centro Venezolano de Colección de Microorganismos de Bacillus subtilis (CVCM438), Citrobacter freundii (CVCM924), Staphylococcus aureus (CVCM48), Escherichia coli (CVCM39), Salmonella enteritidis (CVCM497) y Pseudomonas aeruginosa (CVCM625) sembradas en agar Müller-Hinton a 37°C con hisopo estéril a partir de suspensiones microbianas de concentración conocida (108 células·mL-1). La acción antibacteriana se evidenció midiendo el diámetro (mm) del halo de inhibición del crecimiento bacteriano alrededor de los discos impregnados con la fracción a probar (40 mg·mL-1) (Bauer et al. 1966).
Caracterización
Las fracciones obtenidas de Muricea sp., previamente disueltas en cloroformo, se inyectaron en un cromatógrafo de gases marca Hewlett-Packard modelo 5890, serie II, con inyector de tipo Split-Splitless, el cual estaba acoplado con un espectrómetro de masas de la misma marca modelo 5971 A, con fuente de ionización por impacto electrónico de 70 eV. La temperatura del inyector fue de 280°C. Se utilizó una columna de metil-silicona de 25 m × 0,18 D.I × 0,18 mm de espesor y helio como gas de arrastre. La temperatura inicial del horno fue de 70°C con una rampa de 10°C/min hasta llegar a 300°C. La identificación de los metabolitos secundarios se realizó por comparación computarizada con las librerías WILEY y NIST.
RESULTADOS
En la partición inicial del extracto crudo en metanol (25,6 g), se lograron solubilizar 8,12 g (32,98%) en acetato de etilo (FA). Los resultados de algunos ensayos químicos y de bioactividad realizado a estos extractos han sido informados previamente (Ordaz et al. 2010).
Actividad antibacteriana de las fracciones
Las fracciones C y J, mostraron actividad bactericida leve contra todos los microorganismos empleados, presentando halos de inhibición entre 7 y 10 mm de diámetro (Tabla 1). La bacteria C. freundii, fue el único microorganismo sensible a todas las fracciones ensayadas (A, C, E, y J), las cuales mostraron halos de inhibición bactericida leve entre 9 y 11 mm de diámetro (Tabla 1). La fracción A también mostró inhibición bactericida frente a B. subtilis (7 mm), mientras que la fracción E también inhibió el crecimiento de E. coli (6 mm) (Tabla 1).
Análisis de la fracción A
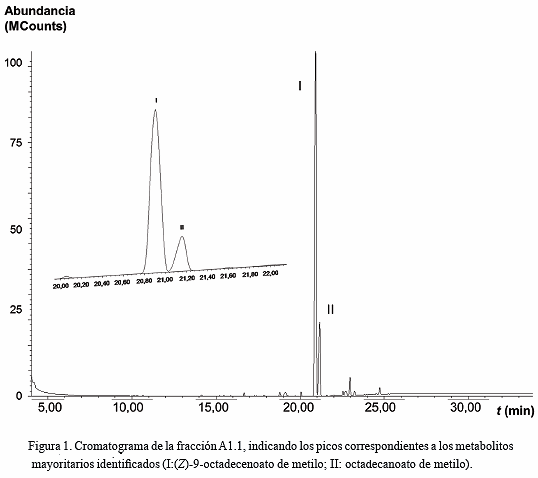
La fracción A (0,3411 g) fue particionada mediante CC con mezclas de hexano-cloroformo, obteniéndose 9 fracciones (A1 a A9; 99,91%), de las cuales A1 (0,0336 g) fue fraccionada por CC con mezclas de hexano-diclorometano en 8 nuevas fracciones (A1.1 a A1.8; 95,10%). La fracción A1.1 (0,0213 g, sólido blanco) fue purificada en una placa preparativa en una mezcla hexano-cloroformo (8:2), recuperándose 0,0081 g de un posible compuesto puro (Rf 0,63). Sin embargo, el análisis por CG/EM reveló que se trataba de una mezcla de compuestos estructuralmente semejantes. La Figura 1, muestra el cromatograma para esta fracción con dos señales que se corresponden con los compuestos

Análisis de la fracción C
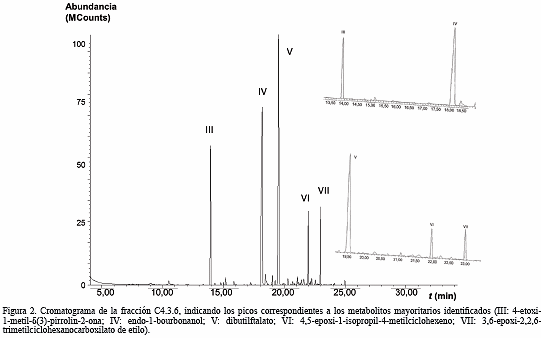
La fracción C (0,3251 g) fue particionada mediante CC con mezclas de hexano-acetato de etilo, obteniéndose 13 fracciones (C1 a C13; 97,72%), de las cuales C4 (0,1060 g) fue fraccionada por CC con mezclas de hexano-acetato de etilo en 8 nuevas fracciones (C4.1 a C4.8; 95,10%). De estas, la fracción C4.3 (0,0759 g) se fraccionó mediante CC con mezclas de hexano-cloroformo en 10 nuevas fracciones (C4.3.1 a C4.3.10; 98,16%). De acuerdo a la separación observada en el análisis por CCF, se seleccionó C4.3.6 (0,0038 g, sólido blanco) para el análisis por CG/EM.
El cromatograma obtenido para esta fracción (Fig. 2), muestra 5 constituyentes identificados como:


Análisis de la fracción E
La fracción E (0,1823 g) fue particionada mediante CC con mezclas de hexano-acetato de etilo y acetato de etilo-acetona, obteniéndose 8 fracciones (E1 a E8; 99,29%), de las cuales E5 (0,0588 g) se fraccionó mediante CC con mezclas de hexano-acetato de etilo en 8 nuevas fracciones (E5.1 a E5.8; 92,52%). De éstas, se seleccionó E5.4 para el análisis por CG/EM, cuyo cromatograma (Fig. 3) muestra cinco constituyentes mayoritarios identificados como

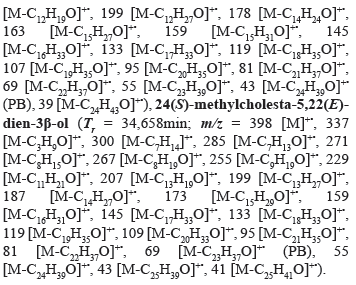
Análisis de la fracción J
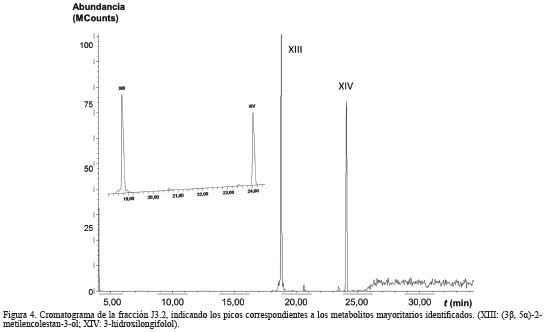
La fracción J (0,2937 g) fue particionada mediante CC con mezclas de hexano-acetona, obteniéndose 10 fracciones (J1 a J10; 99,24%). La fracción J3 (0,0591 g) fue fraccionada por CC con mezclas de hexano-acetona en 4 nuevas fracciones (J3.1 a J3.4; 99,15%), de la cuales J3.2 (0,0468 g), fue purificada en una placa preparativa en una mezcla hexano-acetona (1:1), recuperándose 0,0260 g de un sólido blanco posiblemente puro (Rf 0,79). Sin embargo, el análisis por CG/EM para esta fracción, reveló que se trataba de una mezcla de dos compuestos como se muestra en el cromatograma de la Figura 4, cuyos picos se identificaron como:
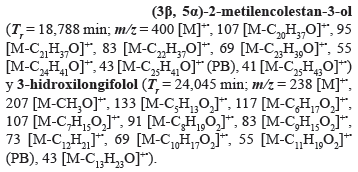
DISCUSIÓN
Los resultados de los ensayos antibacterianos realizados a las fracciones A, C, E y J (Tabla 1), muestran que el octocoral Muricea sp., puede ser una fuente importante de metabolitos secundarios con propiedades bioactivas. La actividad antibacteriana leve mostrada frente a los organismos empleados, que no superó diámetros de 11 mm, puede estar relacionada con bajas concentraciones de los constituyentes fisiológicamente activos en estas fracciones. La actividad de algunas fracciones del extracto lipídico de este género Gorgonio ha sido informada previamente (Camacho et al. 2011).
De los metabolitos identificados mediante CG/EM, los compuestos I (20,95 min) y II (21,18 min) registrados en el cromatograma de la fracción A1.1 (Fig. 1), desplegaron iones moleculares a m/z 296 y 298 en sus respectivos espectros de masa, los cuales se correlacionan con las fórmulas C19H36O2 (calculado 296,49 g·mol-1) y C19H38O2 (calculado 298,51 g·mol-1) de los ésteres metílicos del ácido (Z)-9-octadecenoico y del ácido octadecanoico, respectivamente. Las demás señales observadas en cada caso se corresponden con la desintegración de estos ésteres metílicos de cadena lineal. Algunos ácidos y ésteres metílicos de cadena lineal han sido informados también en fracciones del extracto poco polar de Eunicea sp. (Ordaz et al. 2009, Ordaz et al. 2013), por lo que dichos constituyentes lipídicos pueden cumplir una función importante en los procesos bioquímicos y ecológicos de los octocorales y otros organismos marinos.
El compuesto III (13,94 min), señalado en el cromatograma de la fracción C4.3.6 (Fig. 2), desplegó un ion molecular a m/z 141 en su espectro de masas, que se correlaciona con la fórmula C7H11NO2 (calculado 141,17 g·mol-1) del 4-etoxi-1-metil-δ(3)-pirrolin-2-ona, un derivado nitrogenado de estructura molecular relativamente estable debido a que el ion molecular y el pico base corresponden a la misma señal m/z. El compuesto IV (18,18 min), mostró en su espectro de masas un ion molecular a m/z 222, el cual se corresponde con la fórmula molecular C15H26O (calculado 222,37 g·mol-1) del derivado sesquiterpenoide endo-1-bourbanol. El espectro de masas del compuesto V (19,54 min), reveló un ion molecular a m/z 278, correlacionado con la fórmula C16H22O4 (calculado 278,35 g·mol-1) del dibutilftalato. Los compuestos VI (22,97 min) y VII (23,27 min), desplegaron en sus respectivos espectros de masa iones moleculares a m/z 152 y 211, los cuales se corresponden con las fórmulas C10H16O (calculado 152,24g·mol-1) y C12H20O3 (calculado 212,29g·mol-1) de los derivados oxigenados de monoterpenos 4,5-epoxi-1-isopropil-4-metilciclohexeno y 3,6-epoxi-2,2,6-trimetilciclohexanocarboxilato de etilo, respectivamente. La presencia de derivados nitrogenados sugiere que este organismo puede biosintetizar compuestos alcaloidales como los informados para Muricea austera (Gutiérrez et al. 2006). La biosíntesis de constituyentes de tipo mono y sesquiterpenoides es muy común en octorales (Rodríguez 1995, Changyun et al. 2008, Lu et al. 2011), mucho de los cuales presentan propiedades farmacodinámicas importantes. La identificación del dibutilftalato y otros alquilftalatos como metabolitos secundarios no es muy aceptada, atribuyéndose al proceso de extracción y purificación (Bhakuni y Rawat 2005), sin embargo, algunos autores sugieren que sí pueden ser biosintetizados (Namikoshi et al. 2006).
Del cromatograma de la fracción E5.4, los constituyentes VIII (24,04 min) y IX (24,17 min), corresponden a derivados isoprenoides C10 y C15 que desplegaron iones moleculares a m/z 139 y 222 en sus respectivos espectros de masas, los cuales se correlacionan con las fórmulas C10H18 (calculado 138,25 g·mol-1) y C15H26O (calculado 222,37g·mol-1) de (E)-2,6-dimetil-2,6-octadieno y farnesol (3,7,11-trimetil-2,6,10-dodecatrien-1-ol), respectivamente. Los constituyentes X (32,74 min), XI (33,69 min) y XII (34,66 min), identificados también en esta fracción, corresponden a estructuras esteroidales tipo colestano y ergostano que mostraron iones moleculares a m/z 384, 386 y 398 en sus respectivos espectros de masas, correlacionados con las fórmulas C27H44O (calculado 384,64 g·mol-1), C27H46O (calculado 386,66 g·mol-1) y C28H46O (calculado 398,67 g·mol-1) del 3β-colesta-5,22-dien-3-ol, colesterol (3β-colest-5-en-3-ol) y (3β,22E,24S)-ergosta-5,22-dien-3-ol (o 24(S)-metilcolesta-5,22(E)-dien-3β-ol), respectivamente. Estos tres esteroles de núcleo Δ5, también han sido identificados en una fracción de Eunicea laciniata que resultó activa frente a algunas bacterias marinas (Cuadrado et al. 2010), mientras que otros terpenoides esteroidales han sido informados en una variedad de octocorales (Lorenzo et al. 2006, DArmas et al. 2008, Ordaz et al. 2009, Sarma et al. 2009), lo cual indica que estos constituyentes pueden ser útiles para estos organismos marinos en funciones como defensa, comunicación y procesos biológicos propios.
El constituyente XIII (18,79 min), registrado en el cromatograma de la fracción J3.2 (Fig. 4), mostró en su espectro de masas un ion molecular a m/z 400, que se correlaciona con la fórmula molecular C28H48O (calculado 400,69 g·mol-1) del (3β, 5α)-2-metilencolestan-3-ol, otro derivado esteroidal tipo colestano. El espectro de masas del compuesto XIV (24,04 min), desplegó un ion molecular a m/z 238, correspondiente a la fórmula C15H26O2 (calculado 238,37 g·mol-1) del derivado oxigenado sesquiterpenoide 3-hidroxilongifolol (decahidro-4,8,8-trimetil-1,4-etanoazuleno-9,10-diol).
CONCLUSIONES
La antibiosis mostrada por las fracciones A, C, E y J frente a las bacterias S. aureus, B. subtilis, C. freundii y S. enteritidis pudo ser causada, en parte, por alguno de estos constituyentes de tipo colestano y mono- y sesqui-terpenoidales, identificados en las fracciones analizadas mediante CG/EM, lo que indica que la biosíntesis de este tipo de compuestos pueden ser importantes para la interacción ecológica de este género Gorgonio.
REFERENCIAS BIBLIOGRÁFICAS
1. Abeytia R, Guzmán H, Breedy O. 2013. Composición de especies y distribución batimétrica de gorgonios (Anthozoa: Octocorallia) en la costa sur del Pacífico mexicano. Rev. Biol. Trop. 61(3):1157-1166. [ Links ]
2. Bauer A, Kirby A, Sherris J, Turk M. 1966. Antibiotic susceptibility testing by standardized single disk method. Am. J. Clin. Pathol. 45(4):493-496. [ Links ]
3. Bhakuni D, Rawat D. 2005. Bioactive marine natural products. Anamaya/Springer, India, pp. 396. [ Links ]
4. Camacho A, DArmas H, Ordaz G, Hernández J. 2011. Constituyentes químicos de algunas fracciones bioactivas del extracto apolar del octocoral caribeño Muricea sp. identificados mediante CG/EM. Ciencia. 19(4):285-292. [ Links ]
5. Changyun W, Haiyan L, Changlun S, Yanan W, Liang L, Huashi G. 2008. Chemical defensive substances of soft corals and gorgonians. Acta Ecol. Sin. 28(5):2320-2328.
6. Cuadrado C, Castellanos L, Osorno O, Ramos F, Duque C. 2010. Estudio químico y evaluación de la actividad antifouling del octocoral caribeño Eunicea laciniata. Quim. Nova. 33(3):656-661.
7. D Armas H, Bermúdez D, Méndez, B. 2008. Aislamiento y caracterización estructural de un nuevo triterpeno del octocoral Plexaura flexuosa Lamoroux. Interciencia. 33(9):680-686.
8. Gutiérrez M, Capson T, Guzmán H, González J, Ortega-Barría E, Quinoá E, Riguera R. 2006. Antiplasmodial metabolites isolated from the marine octocoral Muricea austera. J. Nat. Prod. 69(10):1379-1383.
9. Guzmán H, Guevara C, Breedy O. 2004. Distribution, diversity, and conservation of coral reefs and coral communities in the largest marine protected area of Pacific Panama (Coiba Island). Environ. Conserv. 31(2):111-121.
10. Lorenzo M, Cueto M, DCroz L, Maté J, San-Martín A, Darias J. 2006. Muriceanol, a 24(28)-epoxide sterol link in the carbon flux toward side-chain dealkylation of sterols. Eur. J. Org. Chem. 2006(3):582-585.
11. Lu Y, Li P, Hung W, Su J, Wen Z, Hsu C, Sheu J. 2011. Nardosinane sesquiterpenoids from the Formosan Soft Coral Lemnalia flava. J. Nat. Prod. 74(2):169-174.
12. Murillo-Álvarez J, Encarnación-Dimayuga R. 2003. New bioactive pregnadiene-derived glycosides from the Gulf of California gorgonian Muricea cf. austera. Pharm. Biol. 41(7):531-535.
13. Namikoshi M, Fujiwara T, Nishikawa T, Ukai K. 2006. Natural abundance 14C content of dibutyl phthalate (DBP) from three marine algae. Mar. Drugs 4(1):290-297.
14. Ordaz G, DArmas H, Hernández J, Camacho A. 2009. Identificación mediante CG/EM de algunos constituyentes con actividad biológica del extracto apolar del celenterado Eunicea sp. Ciencia. 17(3):245-254.
15. Ordaz G, DArmas H, Yañez D, Hernández J, Camacho A. 2010. Metabolitos secundarios, letalidad y actividad antimicrobiana de los extractos de tres corales y tres moluscos marinos de Sucre, Venezuela. Rev. Biol. Trop. 58(2):677-688.
16. Ordaz G, DArmas H, Camacho A, Hernández J, Yañez D. 2013. Identificación mediante RMN de algunos metabolitos secundarios del coral Gorgonio Eunicea sp. Saber. 25(3):309-316.
17. Ortega M, Zubia E, Rodríguez S, Carballo J, Salva J. 2002. Muricenones A and B: new degraded pregnanes from a gorgonian of the genus Muricea. Eur. J. Org. Chem. 2002(19):3250-3253.
18. Rodríguez A. 1995. The natural products chemistry of West Indian gorgonian octocorals. Tetrahedron. 51(16):4571-4618.
19. Romero N, Rada M. 1999. Octocorales de las aguas costeras de la Isla de Margarita, estado Nueva Esparta, Venezuela. Mem. Soc. Cienc. Nat. 151(49):95-115.
20. Sánchez J, Gómez C, Escobar D, Dueñas L. 2011. Diversidad, abundancia y amenazas de los octocorales de la isla Malpelo, Pacífico Oriental Tropical, Colombia. Bol. Invest. Mar. Cost. 40(Supl. Esp.):139-154.
21. Sarma N, Krishna M, Pasha S, Rao T, Venkateswarlu Y, Parameswaran P. 2009. Marine Metabolites: The Sterols of Soft Coral. Chem. Rev. 109(6):2803-2828.












 uBio
uBio