Saber
versão impressa ISSN 1315-0162
Saber vol.26 no.2 Cumaná jun. 2014
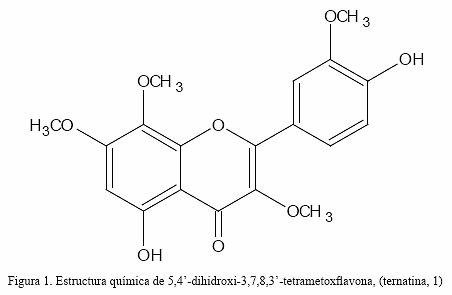
Actividad antioxidante de 5,4-dihidroxi-3,7,8,3-tetrametoxiflavona aislada de egletes postrata (Plantae: Asteraceae)
Antioxid ant activit y of 5,4-dihydrox y-3,7,8,3-tetr amethoxyflavone isolated from Egletes postrata (Plantae: Asteraceae)
Ysolanda Salazar1, Willian Henríquez2, Oscar Crescente2, Carlos Sevcik3, Gina DSuze3, Carsten Christophersen4
1 Universidad de Oriente, Núcleo de Nueva Esparta, Unidad de Estudios Básicos, Guatamare, Isla de Margarita, Venezuela,
2 Universidad de Oriente, Núcleo de Sucre, Escuela de Ciencias, Departamento de Química, Laboratorio de Productos Naturales, Cumaná, Venezuela,
3 Instituto Venezolano de Investigaciones Científicas (IVIC), Centro de Biofísica y Bioquímica, Laboratorio de Neurofarmacología Celular, Caracas, Venezuela,
4 University of Copenhagen, Department of Chemistry, Copenhagen, Denmark. E-mail: whenriquez66@gmail.com
RESUMEN
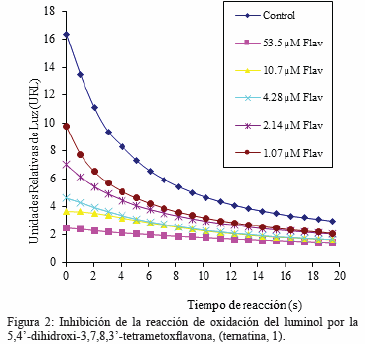
La 5,4-dihidroxi-3,7,8,3-tetrametoxiflavona (ternatina, 1) fue aislada de Egletes prostrata (Plantae: Asteracea) y la estructura fue elucidada por interpretación de datos espectroscópicos y por comparación con datos reportados para estructuras modelos. Esta flavona exhibió un fuerte efecto antioxidante determinado mediante inhibición de la oxidación del luminol inducida por H2O2. El grado de inhibición de la oxidación del luminol determinado fue de 85 a 41% a las concentraciones de 53,5 y 1,07 μM de ternatina, respectivamente, es considerado fuerte.
Palabras clave: Ternatina, efecto antioxidante, citotoxicidad, Egletes postrata.
ABSTRACT
The 5,4-dihydroxy-3,7,8,3-tetramethoxyflavone (ternatin, 1) was isolated from Egletes postrata (Plantae: Asteracea), and the structure was elucidated by interpretation of spectroscopic data and by comparison with reports of models structure in the literature. The flavone exhibits strong antioxidant properties as determined by inhibition of the oxidation of luminol by H2O2. The determined degree of inhibition of the oxidation of luminol was from 85 to 41% at concentrations of 53.5 and 1.07 μM of ternatin, respectively.
Key words: Ternatin, antioxidant effect, cytotoxicity, Egletes postrata.
Recibido: enero 2014. Aprobado: abril 2014. Versión final: mayo 2014.
INTRODUCCIÓN
Egletes postrata (Sw.) Kuntze, Asteracea, es una hierba distribuida en las regiones tropicales del Norte de Suramérica e Islas del Caribe (Medina et al. 2008). Es común en regiones cercanas a playas o lagunas. En la Isla de Margarita-Venezuela se conoce como mariita o margarita de playa y sus flores son utilizadas como un sustituto de la manzanilla. De esta especie se conoce que, decocciones de las flores son utilizadas para tratar infecciones en la piel (Schnee 1984). Investigaciones químicas la describen como una fuente importante de compuestos fenólicos activos biológicamente y extractos obtenidos de órganos de ésta exhiben actividad antibacteriana y fungicida (Salazar 1996). Los polifenoles son ampliamente distribuidos en las plantas y constituyen una parte importante de la dieta humana debido a que pueden ser obtenidos por la ingesta de vegetales, semillas, frutos y bebidas tales como vino tinto, cerveza o té (Van Acker et al. 1996, Pietta 2000). Los flavonoides constituyen una clase de polifenoles que se caracterizan por ejercer marcados efectos antioxidantes e inhibir enzimas responsables de la producción de anión superóxido tales como la xantina oxidasa y la proteína quinasa C, además de inhibir enzimas como las ciclooxigenasa, lipoxigenasa, monoxigenasa microsomal, glutationa S-transferasa, succinoxidasa mitocondrial y NADH oxidasa, todas involucradas en la generación de especies de oxígeno reactivo (Rice-Evans et al. 1996, Van Acker et al. 1996, Pietta 2000).
Numerosas investigaciones reportan el aislamiento y actividad antitrombótica, antiinflamatoria, antidiarreica, anti-ulcera, además de efecto protector contra lesiones hepáticas ejercidas por la ternatina, un biflavonoide aislado a partir de Egletes viscosa Less (Rao et al. 1994, 1997, 2003, Souza et al. 1994, 1998), actividades relacionadas con el efecto antioxidante. Conociendo que la ternatina ejerce efecto antioxidante, en el presente estudio se evaluó la actividad antioxidante de la ternatina sobre la oxidación del luminol inducida por H2O2, encontrándose que este biflavonoide ejerce una marcada capacidad para reducir este proceso de oxidación, confirmándose así lo reportado y esperado de acuerdo a las características estructurales del compuesto.
MATERIAL Y MÉTODOS
Equipo experimental
El punto de fusión (Pf) se determinó en un aparato micro Yanagimoto. Los espectros de UV-Visible se registraron en un espectrofotómetro Genesys 2. Los análisis de cromatografía de gases-espectrometría de masas (CG/EM) se realizaron en un cromatógrafo de gases Hewlett Packard modelo 5890 serie II acoplado a un espectrómetro de masas Hewlett Packard modelo 5971, con ionización por impacto electrónico. Los experimentos de resonancia magnética nuclear (RMN) se registraron en un espectrómetro Bruker operando a 300 MHz para protones (RMN 1H) y 100,13 MHz para carbono (RMN 13C), usando CDCl3 como solvente. Las mediciones de quimioluminiscencia se registraron en un luminómetro Luminoscan Ascent.
Material vegetal
Las flores de E. postrata (Sw.) Kuntze (Asteraceae) fueron recolectadas en los alrededores de una laguna en la localidad de El Cercado, Isla de Margarita, Venezuela. La planta fue identificada por el Prof. J. L. Cumana y un ejemplar de muestra fue depositado, con el número de recolecta 3625, en el Herbario Isidro Ramón Bermúdez Rodríguez (IRBR) del Departamento de Biología de la Universidad de Oriente, Cumaná, Venezuela. Las flores fueron secadas a temperatura ambiente y posteriormente molidas en un molino eléctrico, Thomas Miller.
Purificación
Las flores molidas (600 g) se extrajeron con n-hexano y posteriormente con MeOH. El extracto metanólico seco (80 g) se fraccionó en una columna empacada con gel de sílice, eluyendo con CH2Cl2 para dar siete fracciones. Luego, la tercera fracción (2,3 g) fue particionada sobre gel de Sephadex LH 20, obteniéndose seis fracciones. De éstas, la quinta fracción (0,37 g) fue purificada mediante cromatografía en columna al vacío sobre gel de sílice, obteniéndose ocho fracciones al ser agrupados los eluatos de acuerdo a su comportamiento mediante análisis por cromatografía de capa fina analítica (CCFA). Finalmente la sexta fracción (53 mg), esta última, fue purificada mediante cromatografía en papel, usando n-hexano-CH2Cl2 (7:3) como fase móvil para obtener la 5,4-dihidroxi-3,7,8,3-tetrametoxiflavona (32 mg), Rf = 0,54. El proceso de purificación se evaluó guiado por la fluorescencia de las diferentes fracciones, impregnadas sobre papel de filtro, al ser expuestas a vapores de NH3.
Análisis espectroscópicos
La 5,4-dihidroxi-3,7,8,3-tetrametoxiflavona, se aisló como un sólido amarillo con un rendimiento de

Actividad antioxidante
El efecto antioxidante del flavonoide aislado se evaluó mediante la inhibición de la oxidación del luminol (5-aminoftalhidrazida) inducida por peróxido de hidrógeno (H2O2), para producir 2-aminoftalato y un fotón de luz como reacción control. Los reactivos se mezclaron en pocillos de una placa de 96 pozos. El análisis control consistió en mezclar luminol (1,4 mM, 50 μL), H2O2 (1 mM, 50 μL) y agua desionizada (50 μL). La inhibición de la oxidación fue medido mediante la sustitución del agua desionizada por soluciones de la 5,4-dihidroxi-3,7,8,3-tetrametoxiflavona (50 μL) a diferentes concentraciones para hacer las soluciones finales. El proceso se realizó por cuadruplicado para medir la quimioluminiscencia de la reacción y se utilizó el valor promedio para la determinación grafica. Los ensayos de inhibición de la oxidación del luminol, por la 5,4-dihidroxi-3,7,8,3-tetrametoxiflavona fueron realizados a las concentraciones de 53,5; 10,7; 4,28; 2,14 y 1,07 μM. Las mediciones se compararon con el control a tiempo cero. La reacción se registró durante 20 segundos a temperatura ambiente por medio del método de flujo continuo.
Citotoxicidad
La actividad citotóxica se determinó frente a la línea celular de cáncer de colon humano (HT-29) y la línea celular de riñón de mono (MA-104), de acuerdo con el método de Mosmann (1983).
RESULTADOS Y DISCUSIÓN
Purificación y caracterización estructural
El extracto metanólico obtenido después de desengrasar las flores de E. postrata con n-hexano proporcionó un compuesto puro tras un extenso proceso de purificación cromatográfica, como un sólido de color amarillo. Este sólido de color amarillo fue analizado mediante CG/EM, dando como resultado un pico de un ion molecular con relación m/z 374 unidades de masas [M+, m/z 374], el cual concuerda para la fórmula molecular C19H18O8. Esto es compatible con una flavona que contiene dos grupos hidroxilo y cuatro grupos metoxilo. El espectro de masas mostró una fuerte señal [M+ - CH3] con m/z 359 como pico base, esto es indicativo de la presencia de un grupo metoxilo en la posición 8, como se reporta en la literatura para estructuras semejantes, trisustituidas en el anillo A (Pangon et al. 1974, Goudard et al. 1978, Jay et al. 1978). También, se observa una señal característica de flavonoides metoxilados en C-3 con un pico de relación m/z 331 correspondiente al fragmento M+ - COH3. Esto se refuerza con la relación de intensidades de pico para flavonoides C-8 metoxilados, donde la intensidad de pico es [M+ - CH3] 100%, [M+] ≥ 50%, [M+ - COH3] ≤ 20%, tal como es reportado en la literatura (Goudard et al. 1978, Jay et al. 1978). Otro señal de ion fragmento, que genera buena información, corresponde al pico de relación m/z 151, el cual sugiere la existencia de un anillo B fragmento sustituido con un grupo hidroxilo y otro metoxilo.
Los espectros RMN 1H y 13C mostraron la presencia de cuatro señales de protones metoxílicos con dH de 3,97 (3H, s, MeO-C7), 3,93 (3H, s, MeO-C8), 3,90 (3H, s, MeO-C3) y 3,86 (3H, s, MeO-C3), en correlación con cuatro señales de carbono con δC 56,3 (MeO-C7), 55,9 (MeO-C3), 60,1 (MeO-C3) y 61,6 (MeO-C8) ppm. La diferencia en desplazamiento químico de 56 a 61,6 ppm entre los carbonos metoxílicos se produce cuando los átomos de carbono están flanqueados por dos átomos de oxígeno, desplazándose hacia campo bajo a ~60-62 ppm (Calvert et al. 1979), además el grupo metoxilo en posición C-3 se observa a un δC de 59,5 ppm. Adicionalmente, las señales con δC de 128,8 y 95,4 ppm son asignadas a los átomos de carbono C-8 y C-6, respectivamente, en concordancia con lo reportado por Calvert et al. (1979). Una señal de protones a campo bajo con dH de 12,45 ppm es característica del protón de un grupo hidroxilo en la posición C-5 (Roitman y James 1985), este desplazamiento químico a campo tan bajo se debe a la fuerte interacción tipo puente de hidrógeno entre el protón hidroxílico y el átomo de oxígeno del grupo carbonilo en posición C-4 (Horie et al. 1995). Otra señal que aparece con dH de 6,00 ppm es asignada a un grupo hidroxilo en posición C-4, sustentado por la banda de absorción (B I) del anillo B en los análisis UV con adición de reactivos de desplazamiento. Además, el espectro de RMN 1H presenta cuatro señales aromáticas que integran para un protón cada una, una de ellas con dH de 6,40 (H-6) ppm, y las otras tres acopladas entre si correspondientes a protones en posición orto y meta en el anillo B, con dH de 7,79 (s, H-2), 7,78 (dd, J = 6,9, 2,0 Hz, H- 6 ) y 7,05 (d, J = 9,0 Hz, H-5). El espectro de RMN de 13C mostró una señal a un dC de 178,9 ppm correspondiente al carbono carbonílico (C-4), característico de flavonoides con un grupo hidroxilo en C-5, y una señal a 138,6 ppm asignada al carbono C-3, siendo esta una característica de flavonoides oxigenados con grupo metoxilo en posición C-3 (Calvert et al. 1979, Horie et al. 1995).
El experimento de correlación homonuclear COSY 1H-1H permitió establecer conectividad entre las señales con δH de 7,78 y 7,05 ppm correspondientes a los protones H-6 y H-5, respectivamente. Adicionalmente, el experimento de correlación heteronuclear a un enlace HMQC 1H-13C generó un conjunto de señales que permitieron establecer conectividades precisas, como la correlación a campo bajo entre la señal del protón con δH de 7,79 ppm y la del carbono con δC de 110,7 correspondientes al par HC-2, así como los desplazamientos químicos 7,78 – 122,6 ppm del par HC- 6, 7,05 – 114,7 ppm del par HC-5 y 6,40 – 95,4 ppm del par HC-6.
La combinación de datos espectroscópicos de RMN 1H y 13C, además de experimentos de correlación 1H-1H y 1H-13C, así como la comparación con datos reportados para estructuras relacionadas (Calvert et al. 1979, Horie et al. 1995, Iinuma et al. 1980, Pietta 2000), permitieron deducir que la estructura molecular es compatible con un anillo A trisustituido [un grupo –OH (C-5) y dos MeO- (C-7 y C-8)], un anillo B doblemente sustituido [un grupo –OH (C-4) y otro MeO- (C-3)] y el anillo C monosustituido [un grupo MeO- (C-3)]. Sobre la base de estas asignaciones, la estructura fue establecida como 5,4-dihidroxi-3,7,8,3-tetrametoxiflavona, conocida como ternatina.
Estas asignaciones atómicas son fuertemente sustentadas por los datos de análisis de UV-Visible en MeOH, más la adición de reactivos de desplazamiento. La solución de 5,4-dihidroxi-3,7,8,3-tetrametoxiflavona (1) en MeOH muestra una banda de absorción de B I a 365/339 nm, lo cual sugiere la presencia de un grupo – OH/–OR en posición C-3, mientras que la absorción de la banda B II se observa como una banda doble a 267 y 272 nm. La adición de base (NaOH) causó un desplazamiento batocrómico de B I a 416 nm, con hombro a 395 nm, indicativo de la presencia de un grupo –OH en la posición C-4 y un grupo –OH/–OR en posición C-3. La adición de NaOAc generó un cambio en la absorción de B I de 365 a 419 nm con un hombro a 429 nm, confirmando así la presencia de –OH en C-4, mientras que la absorción de B II se observó a 269 y 260 nm, prácticamente igual a lo ocurrido en MeOH. Esto sugiere ausencia de grupo –OH en posición C-7. La adición de H3BO3 no causó cambio alguno en las bandas de absorción, es decir el espectro es idéntico al obtenido de la solución en MeOH, esto sugiere la ausencia de grupos orto-OH. La adición de AlCl3 dio como resultado cambios de absorción de 365 a 422 nm para B I y de 281 a 305 nm para B II. La adición de HCl a esta última solución no generó cambio en los máximos de absorción de las diferentes bandas, indicando así oxigenaciones en posiciones C-5 y C-3. Estos resultados espectroscópicos apoyan fuertemente la presencia de grupos –OH en C-5 y C-4, además de –OH/–OR en C-3.
La combinación e interpretación de todos los resultados espectroscópicos del flavonoide aislado, además de la comparación con datos de estructuras relacionadas (Pangon et al. 1974, Goudard et al. 1978, Jay et al. 1978, Calvert et al. 1979, Iinuma et al. 1980, Horie et al. 1995, Saija et al. 1995, Rice-Evans et al. 1996), permitieron establecer inequívocamente que la estructura molecular del compuesto se corresponde con la 5,4-dihidroxi-3,7,8,3-tetrametoxiflavona (1). Esta flavona ha sido aislada de otra especie vegetal del género Egletes (Rao et al. 1994, 1997, 2003, Souza et al. 1994, 1998), lo cual puede indicar un posible marcador quimiotaxonómico para estas especies vegetales.
En numerosos estudios se ha demostrado que la actividad antioxidante de los flavonoides está estrechamente relacionada con la estructura química de éstos, es decir con los sustituyentes que posee. La ortooxigenación en el anillo B participa en la deslocalización de electrones, confiriéndole mayor estabilidad a los radicales flavonoides formados. El doble enlace en posición C2-C3 conjugado con la función 4-oxo en el anillo C es responsable de la deslocalización electrónica con el anillo B entre ambos anillos. Además, la oxigenación en las posiciones 5 y 7 en el anillo A, combinado con la función 4-oxo, son las características estructurales requeridas para una buena actividad antioxidante, las cuales están presentes en la molécula de ternatina (Fig. 1).
Efecto antioxidante
La 5,4-dihidroxi-3,7,8,3-tetrametoxiflavona aislada de E. postrata inhibó la oxidación del luminol inducida por H2O2. El grado de inhibición de oxidación del luminol determinado fue de 85; 78; 72; 57 y 41 % a las concentraciones de 53,5; 10,7; 4,28; 2,14 y 1,07 μM, respectivamente (Fig. 2). Estos hallazgos del fuerte efecto antioxidante confirman la existencia de un grupo –OH en posición C-4 y un grupo MeO- en C-3, además del doble enlace conjugado con la función 4-oxo en el anillo C que potencia la actividad antioxidante. Así como también, la existencia de un grupo MeO- orto a un grupo- OH en C-4 contribuye al aumento de esta actividad en los flavonoides. Estos resultados sustentan lo descrito con respecto a la relación estructura-actividad para las flavonas.
Citotoxicidad
La flavona (ternatina, 1) fue inactiva en el ensayo contra la línea celular de cáncer de colon humano (HT- 29) y la línea celular de riñón de mono (MA-104) a concentraciones ≤ 0,3 mg/mL.
El fuerte efecto antioxidante combinado con la baja citotoxicidad de la ternatina, es prometedor para ser usada como protector celular contra daños inducidos por radicales libres, sin efectos tóxicos colaterales. Estos resultados corroboran estudios realizados sobre efectos antioxidantes de la ternatina y en general de flavonoides hidroxilados y hacen sugerir que el consumo de vegetales y frutos ricos en estos componentes es beneficioso para conservar la salud humana, por lo que se recomienda su ingesta a través de la dieta.
CONCLUSIONES
La 5,4-dihidroxi-3,7,8,3-tetrametoxiflavona (ternatina, 1) aislada de E. postrata, ejerce un marcado efecto antioxidante a bajas concentraciones, inhibiendo la oxidación del luminol inducida por H2O2. El potente efecto antioxidante en contraposición con la baja citotoxicidad de esta sustancia hace que sea excelente candidata para proteger al organismo contra el daño celular causado por especies reactivas de oxígeno sin efectos citotóxicos colaterales. La existencia de esta flavona en E. postrata hace catalogarla como un posible marcador quimiotaxonómico para este género de plantas, puesto que ha sido aislada de otra especie de Egletes.
AGRADECIMIENTOS
Los autores agradecen al Dr. Franklin Vargas, Centro de Química, IVIC, Venezuela, por las mediciones de quimioluminiscencia, a la Lic. Yoliver Higuerey, CBB, IVIC, Venezuela, por el apoyo técnico en los cultivos celulares, y al Prof. Luis Jose Cumana, Departamento de Biología, UDO, Núcleo de Sucre, Venezuela, por la identificación de la planta.
REFERENCIAS BIBLIOGRÁFICAS
1.Calvert DJ, Cambie RC, Davis BR. 1979. 13CNMR spectra of polymethoxy- and methylenedioxyflavonols. Org. Magn. Reson. 12:583-586. [ Links ]
2. Goudard M, Favre-Bonvin J, Lebreton P, Chopin J. 1978. Differentiation des dihydroxy-5, 7 methoxy-6 ou 8 flavones flavonols et methyl-3 flavonols par spectrometrie de masse. Phytochem. 17(1):145- 146. [ Links ]
3. Horie T, Kawamura Y, Yamamoto H, Yamashita K. 1995. Studies of the selective O-alkylation and dealkylation of flavonoids. XIX. A convenient method for synthesizing 3, 5, 6, 7, 8-pentaoxygenated flavones. Chem. Pharm. Bull. 43(12):2054-2063.
4. Iinuma M, Matsuura S, Kusuda K. 1980. 13C-Nuclear magnetic resonance (NMR) spectral studies on polysubstituted flavonoids. I. 13C-NMR spectra of flavones. Chem. Pharm. Bull. 28(3):708-716.
5. Jay M, Hasan A, Voirin B, Viricel MR. 1978. Les flavonoids du Lotus corniculatus. Phytochem. 17:827-829. [ Links ]
6. Medina E, Francisco AM, Wilgfield R, Casañas OL. 2008. Halofitismo en plantas de la costa Caribe de Venezuela: halófitas y halotolerantes. Acta Bot. Venez. 31(1):49-80. [ Links ]
7. Mosmann T. 1983. Rapid colorimetric assay for cellular growth and survival: Application to proliferation and cytotoxicity assays. J. Immunol. Meth. 65(1- 2):55-63. [ Links ]
8. Pangon JF, Jay M, Voirin B. 1974. Les flavonoids du dryas octopetala. Phytochem. 13(9):1883-1885. [ Links ]
9. Pietta PG. 2000. Flavonoids as antioxidants. J. Nat. Prod. 63(7):1035-1042. [ Links ]
10. Rao VS, Figueiredo EG, Melo CL, Viana GS, Menezes DB, Matos MS, Silveira ER. 1994. Protective effect of ternatin, a flavonoid isolated from Egletes viscosa Less., in experimental liverinjury. Pharmacol. 48(6):392-397. [ Links ]
11. Rao VS, Santos FA, Sobreira TT, Souza MF, Melo CL, Silveira ER. 1997. Investigations on the gastroprotective and antidiarrhoeal properties of ternatin, a tetramethoxyflavone from Egletes viscosa. Planta Med. 63 (2):146-149.
12. Rao VS, Paiva LA, Santos FA, Da Silva RM, Gurgel LA, De Souza ET, Silveira ER. 2003. Antiinflammatory effect of ternatin, a flavonoid from Egletes viscosa Less; in the rat model of colitis induced by acetic acid. Bol. Latinoam. Caribe Plant. Med. Aromat. 2(4):48-51.
13. Rice-Evans CA, Miller NJ, Paganga G. 1996. Structure-antioxidant activity relatinships of flavonoids and phenolic acids. Free Radical Biol. Med. 20(7):933-956.
14. Roitman JN, James L. 1985. Chemistry of toxic range plants highly oxygenated flavonol methyl ethers from Gutierrezia microcephala. Phytochem. 24(4):835-848.
15. Saija A, Scalese M, Lanza M, Marzullo D, Bonina F, Castelli F. 1995. Flavonoids as antioxidant agents: importance of their interaction with biomembranes. Free Radical Biol. Med. 19:481- 486.
16. Salazar Y. 1996. Estudio fitoquímico y actividad biológica de Egletes postrata. Cumaná-Venezuela: Universidad de Oriente, Escuela de Ciencias, Departamento de Química (Tesis de Grado Lic. en Química), pp. 131.
17. Schnee L. 1984. Plantas Comunes de Venezuela. Caracas, Universidad Central de Venezuela, pp. 451.
18. Souza MF, Cunha MA, Fontenele JB, Viana GS, Rao VS, Silveira ER. 1994. Antithrombotic activity of ternatin, a tetramethoxy flavone from Egletes viscosa Less. Phytother. Res. 8(8):478-481.
19. Souza MF, Rao VS, Silveira ER. 1998. Prevention of acetaminophen-induced hepatotoxicity by ternatin, a biflavonoid from Egletes viscosa Less. Phytother. Res. 12(8):557-561.
20. Van Acker SA, Van Den Berg DJ, Tromp MN, Griffioen DH, Van Bennekom WP, Van Der Vijgh WJ, Bast A. 1996. Structural aspects of antioxidant activity of flavonoids. Free Radical Biol. Med. 20(3):331-342.












 uBio
uBio