Saber
versão impressa ISSN 1315-0162
Saber vol.26 no.3 Cumaná set. 2014
Florúla, clave y estructura comunitaria de las angiospermas de isla larga, parque nacional Mochima, estado Sucre, Venezuela
Florula, identification key and community structure of the angiosperms presents in isla larga, Mochima national park, Sucre state, Venezuela
Jesús Bello Pulido1,2, Roger Velásquez Arenas1,Vanessa Acosta3, Claudio Marchan4
Universidad de Oriente, Núcleo de Sucre, Cumaná, Venezuela.
1 Centro de Investigaciones Ecológicas de Guayacán (CIEG), Laboratorio de Ambiente Terrestre,
2 Herbario Isidro Ramón Bermúdez Romero (IRBR),
3 Escuela de Ciencias, Departamento de Biología,
4 Centro de Sismología, Cumaná, Venezuela. E-mail: jesusantoniobello@gmail.com / velasquezarenas@hotmail.com
RESUMEN
El Parque Nacional Mochima, está constituido por un grupo de islas, así como también de una zona montañosa, que desde el punto de vista florístico ha sido muy documentada, registrándose 1.124 especies de angiospermas. Sin embargo, el escaso conocimiento de la flora vascular del área insular, motivó el objetivo de describir la florúla y estructura comunitaria de Isla Larga. Se establecieron 28 cuadratas de 100 m2, donde se midieron, identificaron y cuantificaron todos los individuos en ellas, y se determinaron los índices ecológicos. Se contabilizaron 2.225 individuos, distribuidos en 59 especies de angiospermas, incluidas en 54 géneros, pertenecientes a 33 familias. Las familias mejor representadas fueron: Euphorbiaceae (9 spp.), Cactaceae (5 spp.), Poaceae (5 spp.) y Mimosaceae (4 spp.) las cuales representaron el 38,98% del total de especies presentes en zona. La diversidad fue de 2,84 bits/ inds; sin embargo, la equitatividad fue baja 0,59 reflejando una distribución no equitativa de las especies en la zona. Los mayores valores del índice de valor de importancia (IVI), lo mostraron Rhizophora mangle (262,78), Croton pungens (172,82), Caesalpinia coriaria (139,36) y Opuntia caracassana (125,45). La dominancia de estas especies, puede estar relacionada con los cambios morfo-anatómicos desarrollados en estas especies y que les permite sobrevivir en las condiciones ambientales presentes en la zona, a las cuales se adaptaron más eficazmente que otras especies. Además, son especies características de los tipos de vegetación presentes en el área (bosques tropófilo y de manglar).
Palabras clave: Bosque tropófilo, bosque de manglar, estructura comunitaria, angiospermas.
ABSTRACT
Mochima National Park comprises a group of islands, as well as a mountainous area that has been well documented from the floristic point of view, registering1124 species of angiosperms. However, the limited knowledge of the vascular flora of the island area, was proposed as the objective of describing the flora and community structure of Isla Larga. A set of 28 quadrats of 100 m2 was established, and all individuals within them were measured, identified and quantified, and ecological indices were determined. A total of 2.225 individuals were registered, distributed in 59 species of angiosperms, including 54 genera belonging to 33 families. The best represented families were Euphorbiaceae (9 spp.), Cactaceae (5 spp.), Poaceae (5 spp.) and Mimosaceae (4 spp.) which accounted for 38.98% of the total number of species in the area. The diversity was 2.84 bits/inds; however, evenness was low 0.59 reflecting an inequitable distribution of species in the area. The highest value of importance value index (IVI), was for Rhizophora mangle (262,78), Croton pungens (172,82), Caesalpinia coriaria (139.36) and Opuntia caracassana (125.45). The dominance of these species may be related to the morpho-anatomical changes developed in these species to survive in the environmental conditions of the area, which allowed them to adapt more effectively than other species. Furthermore, they are species characteristic of the types of vegetation present in the area (tropophyle and mangrove forests).
Key words: Tropophyle forest, mangrove forest, community structure, angiosperms.
Recibido: enero 2014. Aprobado: junio 2014. Versión final: julio 2014.
INTRODUCCIÓN
Venezuela, con una superficie continental e insular de 916.445 km2, se encuentra geográficamente en plena zona tropical, con características climáticas y geológicas que determinan una amplia variedad de ecosistemas. Estos factores ambientales, aunados a la variedad fisiogeográfica, definen una vasta gama de nichos ecológicos, que en parte son los responsables de una enorme riqueza florística en el país (Llamozas et al. 2003, Hokche et al. 2008).
Es así como, en un mismo espacio geográfico, existen diferentes zonas de vidas. Los principales ecosistemas que se distribuyen en la geografía venezolana incluyen bosques secos, bosques húmedos, bosques ribereños, manglares, selvas húmedas, sabanas y morichales, entre otros; los cuales presentan un alto índice de especies ampliamente distribuidas y endémicas (Huber y Alarcón 1988, Bello 2006).
De forma general, estos ecosistemas tropicales se encuentran bajo diferentes grados de amenaza, debido a las diferentes perturbaciones antropogénicas, ya que han sido trasformados para la agricultura, ganadería, urbanismos y turismo, actividades que han amenazado con la pérdida de biodiversidad por desertificación, fragmentación de hábitats, sobrexplotación de la biota y contaminación, por lo que muchos de estos ambientes, se encuentran catalogados en peligro o en peligro crítico, de acuerdo a los criterios establecidos en el Libro Rojo de los Ecosistemas Terrestres de Venezuela (Oliveira- Miranda et al. 2010).
Basándose en lo señalado anteriormente, el Ejecutivo Nacional consciente de tal problemática, ha tratado de preservar este patrimonio biológico en diferentes Áreas Bajo Régimen de Administración Especial (ABRAE). Las áreas naturales protegidas en Venezuela ocupan cerca de una superficie de 315.717 km2 que representan aproximadamente 34,45 % del territorio nacional. En la misma quedan incluidos 43 parques nacionales, 36 monumentos naturales, 7 refugios de fauna silvestre, 7 reservas de fauna silvestre, 2 reservas de biosfera y 79 parques de recreación (Plonezak y Rodríguez 2002, Cumana 2008). El estado Sucre posee una superficie de 11.800 km2 y cuenta con cuatro parques nacionales: Parque Nacional Mochima en la región noroccidental compartida con el estado Anzoátegui, Parque Nacional Península de Paria ubicado hacia el extremo nororiental, Parque Nacional Turuépano en el sureste de la costa del golfo de Paria y una porción del Parque Nacional El Guácharo en conjunto con el estado Monagas (Marcano 2003, Lárez 2005, Cumana 2008).
El Parque Nacional Mochima, tiene una superficie de 94.935 hectáreas, con dos bioregiones claramente definidas, la primera integrada por el área continental, la cual presenta un relieve accidentado con diversos tipos de vegetación y es la más impactada por las perturbaciones antrópicas y la segunda que corresponde al área insular que incluye aproximadamente 15 islas y se caracterizan por estar constituidas por relictos de la vegetación original de diversas formaciones vegetales del parque (Cumana 1998). Dentro del parque se encuentran un grupo de islas que contienen escenarios de bahías, acantilados, golfos, costas de aguas profundas, playas de arena blanca, arrecifes de coral, así como también zonas montañosas de frondosa cobertura vegetal, por lo que representa varios ecosistemas donde se manifiestan un sin número de riquezas naturales. En el interior de la Bahía se localizan cuatro pequeños islotes (Ceñidura, Santa Ana, Isla Larga e Isla Redonda).
El conocimiento de la flora vascular del Parque Nacional Mochima, se tiene como una de las mejores documentadas del estado. En tal sentido, se cuenta con un levantamiento preliminar realizado por Cumana (2008) en el cual se enlistan 1.124 especies y 632 géneros de 156 familias de plantas vasculares; así como también una descripción general de cada formación vegetal y de forma muy puntual destacan los inventarios florísticos llevados a cabo por Quijada (2004) en un bosque de galería en la quebrada Arrojata, Urbáez (2004) en las sabanas del Cerro Arrojata y Bello (2006) en los bosques ribereños de la microcuenca del río El Tacal o Barbacoa.
Es de hacer notar que gran parte de estas colecciones se han realizado en el área continental del parque, teniéndose un vacío de conocimiento florístico-estructural sobre la vegetación que concierne a la región insular. Es por ello, que los lineamientos del presente estudio se enmarcan en conocer la florúla y estructura comunitaria de la vegetación de Isla Larga, Parque Nacional Mochima en el estado Sucre.
MATERIALES Y MÉTODOS
Área de estudio
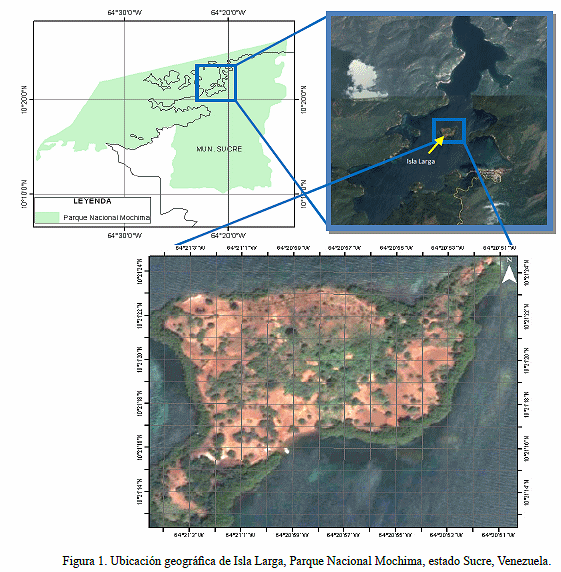
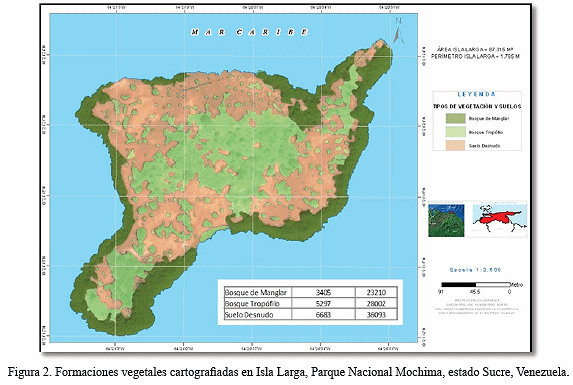
El presente estudio se realizó en Isla Larga, la cual presenta una extensión de 87.315 m2 y se encuentra ubicada en la zona sur de la bahía de Mochima, a unos 1.500 m al norte del pueblo de Mochima, en las coordenadas 10°2112´´ - 10°21´25´´ latitud norte y 64°21´03´´ - 63°20´51´´ longitud oeste aproximadamente (Fig. 1). Se caracteriza por presentar elevaciones hasta los 100 msnm con una temperatura media anual superior a los 28ºC y una pluviosidad media anual entre 300-1.000 mm (Cumana 2008). Está enmarcada dentro de una zona semiárida cubierta por una vegetación mezclada entre: un bosque tropófilo, presente en casi toda la porción continental de la isla y un bosque de mangle que ocupa casi la totalidad de la periferia de la misma (Fig. 2).
Métodos de campo
El trabajo de campo se realizó a partir de muestreos periódicos durante los meses de mayo-julio del 2012 y agosto-octubre del 2013. Para caracterizar la estructura comunitaria de la isla se establecieron 28 cuadratas (14 en el bosque de manglar y 14 en el bosque tropófilo) de 10 x 10 m2 (100 m2) que abarcaron 2.800 m2 (0,28 ha) de superficie analizada, siguiendo la metodología de Gentry (1982) y Matteucci y Colma (1982). Dichas cuadratas fueron dispuestas al azar y orientadas en diferentes direcciones, ya que la estructura fisonómica de la zona es homogénea con pocos cambios apreciables. Para realizar un estimado de la estructura poblacional de las especies involucradas en la zona, en cada parcela se contabilizó el número de individuos por especie.
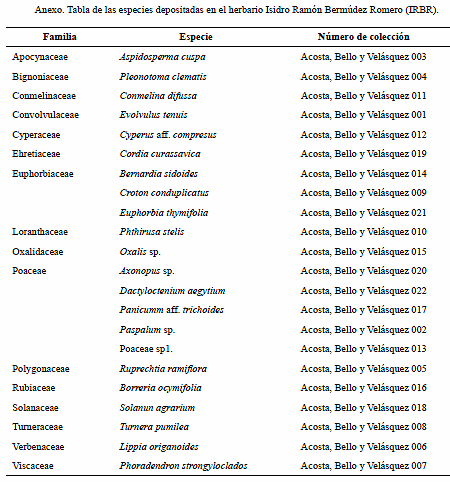
La clasificación taxonómica específica de las plantas, se realizó con la ayuda de diferentes fuentes bibliográficas: Cumana (1998), Quijada (2004), Urbáez (2004), Bello (2006). La corroboración de las mismas se llevó a cabo por comparación con las muestras depositadas en el herbario Isidro Ramón Bermúdez Romero (IRBR), de la Universidad de Oriente. Los nombres científicos se actualizaron según el Nuevo Catálogo de la Flora Vascular Venezolana (Hokche et al. 2008). La clasificación de las formaciones vegetales presentes en el área, se realizó mediante el mapa de vegetación de Venezuela (Huber y Alarcon 1988) y la descripción de la forma de crecimiento de las especies se hizo mediante el método propuesto por Jones (1987) y Lindorf et al. (1999).
Para georeferenciar la vegetación involucrada en la zona se realizaron recorridos en toda la superficie de la isla, empleando un GPS (G Nuvi 2597LMT 5´´),
permitiéndonos obtener los datos de campo necesarios para lograr una visión general de la cobertura vegetal de la zona. Información con la que posteriormente se realizó la interpretación de la imagen satelital Landsat 8 disponible. La composición de las bandas que se utilizaron para determinar las clases son: Vegetación (5,4,3) y Tierra, Agua (5,6,4) con una resolución espectral y espacial Landsat 8 OLI. La interpretación de la imagen digital se hizo mediante el programa software ENVI 5 para el procesamiento de la imagen satelital Landsat 8 OLI, Path = 2, Row = 53, Fecha de toma 19-10-2013 en las bandas R, G, B (5,4,3 - 5,6,4) a resolución de 30 metros respectivamente. También se realizó una clasificación supervisada en una imagen multi-espectral que consta de varias bandas, seleccionando las áreas de entrenamiento (ROI); cada banda puede ser exhibida como una imagen en escala de grises o en combinación de tres bandas, a la vez como una composición de color. El método que se aplicó fue el de máxima verosimilitud (Maximun Like Lihood), por el cual se asigna a cada pixel de la imagen la categoría para la cual posee mayor probabilidad de pertenencia. Luego las imágenes obtenidas de esta clasificación se convirtieron en formatos vectoriales para ser exportadas al software ArcGis 10.2; que permite obtener un mapa de clases temáticas. Finalmente, se combinó la información de la base cartográfica y los datos satelitales para generar el mapa definitivo.Análisis de los datos
El análisis estructural del estrato vegetal en cada tipo de vegetación se realizó utilizando parámetros y fórmulas de amplio uso en ciencias biológicas. Se calculó el Índice de Valor de Importancia (IVI) porcentual para las especies presentes, que está compuesto por la suma de la abundancia, frecuencia y densidad absolutas y relativas (Lamprecht 1990, Stiling 1999). Su máximo valor es de 300 e indica la importancia estructural de una especie en particular respecto a la comunidad florística muestreada. Con el fin de determinar la diversidad de especies presentes en la zona se calculó el índice de diversidad de Shannon-Wiener (1948) y el índice de equidad de Lloyd y Ghelardi (1964) según Krebs (1989), que expresa la uniformidad de los valores de importancia a través de todas las especies de la muestra, asumiendo que los individuos son seleccionados al azar y que todas las especies están representadas en la muestra.
RESULTADOS Y DISCUSIÓN
Composición florística y diversidad
En los 2.800 m2 de superficie estudiada se contabilizaron 2.225 individuos, distribuidos en 59 especies de angiospermas incluidas en 54 géneros, pertenecientes a 33 familias. Del total de ejemplares que integran la diversidad vegetal, el 94,92%, se identificó hasta nombre científico, mientras que el 5,08% restante está integrado por tres ejemplares, donde una se logró identificar hasta la categoría taxonómica de familia (Poaceae) y dos hasta la categoría de género (Oxalis sp. y Axonopus sp.), por la falta de suficiente material fértil. Las dicotiledóneas estuvieron representadas por 27 familias, 44 géneros y 47 especies y las monocotiledóneas por 6 familias, 10 géneros y 12 especies. La forma de crecimiento de las especies identificadas (Tabla 1), estuvo integrada por 31 especies de hierbas (49,21%), 14 arbustos (22,22%), 12 árboles (19,05%), 2 epífitas (3,17%), 2 hemiparásitas (3,17%) y una especie con hábito trepador (1,59%).

En Isla Larga, existen dos tipos de formaciones vegetales (bosque tropófilo y bosque de mangle) (Fig. 2), que por lo general se encuentran en menor o mayor extensión asociadas en diferentes ambientes litorales en el país (Hoyos 1985, Steyermark et al. 1994, Cumana et al. 2010, García 2012). Por lo tanto, es pertinente comparar el número de especies encontradas en Isla Larga (59 spp.) con otros ambientes similares ubicados en las zonas costeras de Venezuela, a pesar de que en estos no se reporten la presencia de manglar; por lo que es importante destacar que en este estudio, los valores son superiores a los conseguidos por González (1980) en La Peonia (estado Zulia), que presentó 52 especies. Vera et al. (2009) en Punta de Piedras, estado Nueva Esparta (45 spp.) y Steyermark et al. (1994) quienes reportaron un total de 29 especies en la zona los Cayos del Parque Nacional Morrocoy del estado Falcón, pero resultó inferior a las 133 especies en listadas por Castillo et al. (1992) en un monte espinoso tropical no intervenido del estado Vargas, y a las 72 especies conseguidas por Bello et al. (2011) en un arbustal xerófilo de Punta de Araya, estado Sucre y las 98 especies de angiospermas inventariadas por Valerio et al. (2013) para la Laguna El Morro, Isla de Margarita.
En este estudio se reportan como novedades florísticas a: Bernardia sidoides, Lippia origanoides (orégano), Melocactus curvispinus (melón de monte), Opuntia caracassana (tuna brava), Prosopis juliflora (yaque), Pseudanamomis umbellulifera (pajui) y Turnera pumilea (cuamaná). Sin embargo, estas especies han sido documentadas en otras zonas áridas del país (Hoyos 1985, Steyermark et al. 1994) y en el estado Sucre, su distribución esta informada para la península de Araya (Cumana 1999, García 2012). En las colecciones depositadas en el herbario IRBR, y cuyos registros aún no están publicados, demuestran la amplia distribución de estas especies en otras regiones áridas del estado, aunque el Nuevo Catálogo de la Flora Vascular de Venezuela no hace discriminación de la zona de vida de ocurrencia de estas especies (Hokche et al. 2008).
Cabe destacar que T. pumilea representa el tercer reporte para el oriente del país, y el segundo para el estado Sucre (García 2012), ya que su registro en el estado Anzoátegui se tiene como dudoso, quedando su distribución restringida a los estados Bolívar, Falcón, Monagas y Sucre (Hokche et al. 2008), por lo que dicha especie debe ser estudiada para conocer su estructura comunitaria actual, ya que sus poblaciones hoy en día se encuentran restringidas en bosques secos y sabanas, y zonas con formaciones vegetales muy perturbadas y/o fragmentadas.
Las familias que mostraron el mayor número de especies fueron Euphorbiaceae (9 spp.), Cactaceae (5 spp.), Poaceae (5 spp.) y Mimosaceae (4 spp.) que representan el 12,12% del total de familias presentes y en conjunto comprenden el 38,98% de la composición específica presentes en la zona estudiada; el resto de las familias están integradas por una o dos especies. Estas familias, también comprenden uno de los taxones mejor representados en el país en cuanto al número de especies, tal y como ha sido referido en estudios realizados para el bosque xerófilo de la región de Las Peonías y el matorral xerófilo espinoso en Punta de Piedras (Zulia); en el ecosistema semiárido de la meseta de Mamo (Vargas), en la vegetación xerófila de las lagunas de Caparú, cuenca media del río Chama (Mérida) y la laguna El Morro (Isla de Margarita) (González 1980, Castillo et al. 1992, Rico et al. 1996, Vera et al. 2009, Valerio et al. 2013).
Particularmente, para el estado Sucre, la importancia taxo-ecológica de estas familias se destacan en los trabajos de Cumana (1999), Franco et al. (2009), Bello et al. (2011) y Jiménez et al. (2011) en arbustales xerófilos en diferentes localidades del extremo occidental de la Península de Araya, y por García (2012) en Guayacán, ubicada en el extremo oriental de la misma península. La notoria representación específica de las familias antes mencionadas, en estos tipos de ambientes secos, probablemente se deba a que muchas de ellas poseen adaptaciones físico-anatómicas características de plantas típicas de estos ambientes áridos, tales como hojas transformadas en espinas (Cactaceae), son caducifolias y presentan hojas compuestas (Mimosaceae) que le permiten evitar la pérdida de agua por evapotranspiración y la presencia de aroma y látex (Euphorbiaceae), como mecanismo de defensa contra la herbivoría (Cumana 1999).
El valor general del índice de diversidad (H) obtenido fue relativamente alto 2,84 bits/inds, con relación en la abundancia de especies (59 spp.) y el número de individuos que estás presentaron, en especial las especies que mostraron los valores más altos de IVI, sugieren ser las mejores adaptadas en el área. Este índice de diversidad es característico de estos tipos de formación vegetal de zonas secas; por ejemplo Gallardo et al. (2005) en la selva baja caducifolia del Cerro Verde, Nizanda (Oaxaca), ubicado en la costa México, identificaron un número de especies y índice de diversidad casi parecida (52 spp. y 2,78 bits/inds), mientras que Bello et al. (2011), en el arbustal xerófilo de Punta de Araya, estado Sucre, registraron valores de diversidad mayores entre 3,87 y 4,67 bits/inds, debido a que presentaron un mayor número de especies e individuos por especies; por otro, lado el índice de equidad obtenido (J) en la isla fue regular 0,59; lo cual se interpretó como una distribución no homogénea de las especies en la zona evaluada, especialmente para las especies que presentaron pocos individuos.
Tipos de vegetación presentes en Isla Larga
Bosque tropófilo
La parte continental de la isla está dominada por una vegetación del tipo bosque tropófilo, que se caracteriza por presentar un estrato arbóreo con pocos ejemplares que no superan los 6 m de alto, siendo la especie más representativa Aspidosperma cuspa (cuspaquina). También se observaron individuos aislados en el paisaje de Capparis pachaca (pachaco) y escasos ejemplares de Copaifera officinale (palo de aceite), Pereskia guamacho (guamacho) y Tabebuia serratifolia (puy). Asociadas a estas especies se encontraron la trepadora Pleonotoma clematis, las epífitas Tillandsia paucifolia y Tillandsia recurvata y las hemiparásitas Phthirusa stelis y Phoradendron strongyloclados. El estrato arbustivo en esta zona lo integran generalmente dos especies del género Croton (C. pungens y C. ruizianus), conocidos por los lugareños como carcanapires, y Caesalpinia coriara (dividivi). En la zona existe un estrato herbáceo integrado por especies de diferentes familias anuales y perennes, que se desarrollan bajo la sombra de la vegetación leñosa antes mencionadas.
Bosque de manglar
El ecosistema de manglar bordea casi en su totalidad la periferia de la isla que es de 1.785 m; el bosque está integrado en 95% por un monoespecífico de Rhizophora mangle (mangle rojo) que rodea continuamente toda la costa sur y noroeste de la isla, presentando individuos que alcanzan alturas promedio entre los 6-7 m de alto, mientras que en la parte noreste se presentan parches discontinuos de esta especie con ejemplares con altura promedio entre 3-4 metros. El otro 5% del bosque está integrado por pocos individuos de Avicennia germinans (mangle negro) que llegan alcanzar alturas de 12 m y escasos ejemplares de Conocarpus erectus (mangle botoncillo) y Laguncularia racemosa (mangle blanco) que presentaron promedio de 6-7 m de altura. Estas especies por lo general poseen una amplia distribución, desde la Florida en los Estados Unidos hasta el Atlántico en Brasil, incluyendo las islas del Caribe (Schaeffer- Novelli et al. 1990, Lacerda et al. 1993, Steyermark 2004, Zamora-Trejos y Cortés 2009). En lo referente a Venezuela su presencia comprende desde el estado Zulia hasta el delta del Orinoco, incluyendo algunas islas del Caribe venezolano (Steyermark et al. 1994, Medina y Barboza 2003, Bello et al. 2009, Cumana 2010, Del Mónaco et al. 2010, López et al. 2011).
La presencia de pocas especies de mangle negro, blanco y de botoncillo en la isla, se debe a la ausencia parcial de playa; que no le permite a estas especies establecer una población más extensa, por la necesidad de suelos más altos y consolidados que se extiendan más allá de la zona de pleamar. Como efecto secundario a la problemática del suelo inundable, no se observó durante este estudio, la presencia de plántulas de ninguna de las especies de mangles presentes, sólo se observaron algunos jóvenes de mangle blanco. La baja distribución de los mangles antes mencionados, hacia la parte sur, junto con la presencia de parches de mangle rojo hacia la parte noreste, es consecuencia directa de la caída abrupta del afloramiento rocoso que presenta el relieve hacia el mar, quedando expuesta a la acción abrasiva de los vientos y las fuertes mareas que contribuyen con la erosión del suelo, que no permite el establecimiento o colonización total de esta área de la isla por R. mangle, ni la distribución de las demás especies de mangle.
Las constantes inundaciones por las mareas, probablemente sean las limitantes para el establecimiento de la vegetación herbácea, que se consideran acompañantes del manglar, por lo que sólo se identificaron halofitas-psamófilas facultativas: Sporobolus pyramidatus (Poaceae), Trianthema portulacastrum (Aizoaceae) y un árbol típico de las costas orientales del país Hippomane mancinella (manzanillo). Estas fanerógamas poseen una amplia distribución en estos ecosistemas litorales en el país y particularmente en el estado Sucre (Cumana y Cabeza 2003, Medina y Barbosa 2003, Cumana et al. 2012). En estrecha relación con el mangle rojo (R. mangle) se observaron las hemiparásitas Phthirusa stelis (Loranthaceae) y Phoradendron strongyloclados (Viscaceae). Esta eventualidad ecológica también ha sido reportada para los manglares de la ciénaga Los Olivitos en el estado Zulia (Vera et al. 2011), con la diferencia de que en esta zona solo se mencionan las especies Phoradendron mucronatum, Phoradendron venezuelense (Viscaceae) y Struthanthus dichotrianthus 7.(Loranthaceae). Aunque la especie más afectada por la infestación fue C. erectus; mientras que A. germinans no presentó hemiparásitas, al igual que la zona del presente estudio.
Estructura comunitaria en el bosque tropófilo y bosque de mangle
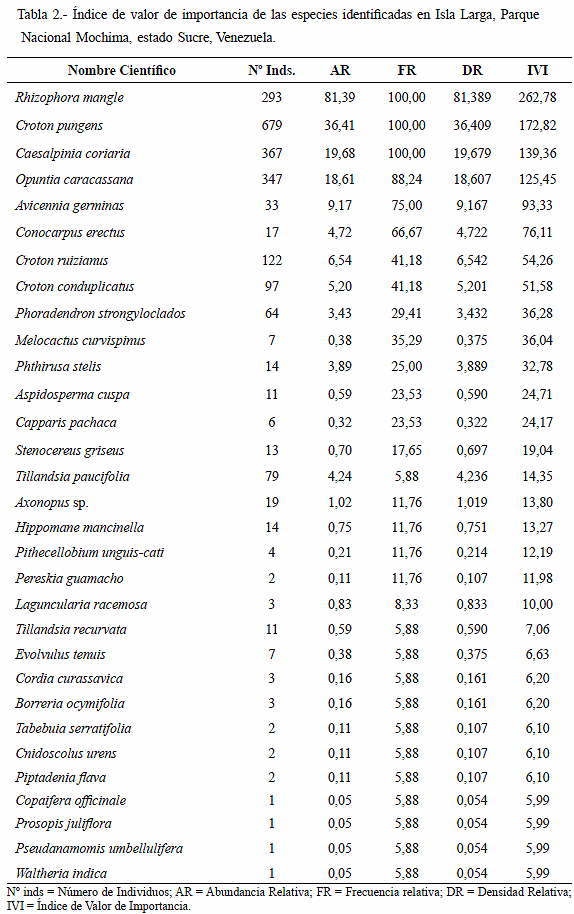
En los dos tipos de vegetación antes descritas, las especies que presentaron el mayor número de individuos fueron las que obtuvieron los mayores índices de valor de importancia (IVI): Rhizophora mangle (293 ind/262,78%), Croton pungens (679 ind/172,82%), Caesalpinia coriaria (367 ind/139,36%) y Opuntia caracassana (347 ind/125,45%); en estas especies se concentró el 75,77% del total individuos contabilizados (Tabla 2). Estos resultados indican que la vegetación insular está conformada principalmente por arbustos y herbáceas, lo cual concuerda con la alta frecuencia relativa que presentaron dichas especies. Los índices de frecuencia, abundancia y densidad relativa de la gran mayoría de las especies restantes son bajos, lo que se ajusta al índice de equidad obtenido. A pesar de que el mangle rojo (R. mangle) presentó el menor número de individuos con respecto a otras especies, este mostró el mayor IVI; debido a que el manglar que rodea toda la isla es prácticamente un bosque monoespecífico.
Con base en el listado oficial del Libro Rojo de la Flora Venezolana (Llamozas et al. 2003), se citan 7 especies en diferentes categorías. Como vulnerable se citan a: Copaifera officinale (palo de aceite), Pereskia guamacho (guamache); en Menor Riesgo casi amenazadas (MR/ ca) se encuentran Avicennia germinans (mangle negro), Rhizophora mangle (mangle rojo) y Tabebuia serratifolia (puy); en Menor Riesgo preocupación menor (MR/pm) se mencionan a Conocarpus erectus (mangle botoncillo) y en la categoría Insuficientemente Conocida (Ifc) a Melocactus curvispinus (melón de monte). A nivel local, el grado de amenaza que presentan las especies señaladas dentro de la categoría "Vulnerable" se debe a la intervención antropogénica por la destrucción del hábitat, la cual ha sido utilizada para cultivo de sábila (Aloe vera) y el pastoreo caprino de forma esporádica, generalmente en época de lluvia donde la vegetación herbácea es más abundante.
CONCLUSIONES
A pesar de la pequeña extensión de la isla, se reporta un notable componente florístico integrado por 59 especies de angiospermas incluidas en 54 géneros, perteneciente a 33 familias.
Se reportan seis nuevas especies para las colecciones florísticas del Parque Nacional Mochima (depositadas en el IRBR), además de una especie introducida (Aloe vera) y siete que se encuentran mencionadas en cuatro categorías del Libro Rojo de la Flora Venezolana.
Las familias con mayor número de especies fueron Euphorbiaceae, Poaceae, Cactaceae y Mimomosaceae.
El hábito mejor representado fue el herbáceo, seguido del arbustivo-arbóreo, posteriormente las hierbas epífitas-hemiparásitas y finalmente las trepadoras.
Las especies con mayor número de individuos e índice de valor de importancia (IVI) fueron: Rhizophora mangle, Croton pungens, Caesalpinia coriaria y Opuntia caracassana.
REFERENCIAS BIBLIOGRÁFICAS
1. B
ello J. 2006. Florística en bosques ribereños del río El Tacal, municipio Sucre, estado Sucre. Cumaná: Universidad de Oriente, Escuela de Ciencias, Departamento de Biología (Disertación Grado Licenciado en Biología), pp. 396. [ Links ]2. B
ello J, Velásquez R, Cumana L, Anderson R, González M. 2009. Inventario florístico de la laguna El Maguey, Barcelona, estado Anzoátegui, Venezuela. Saber. 21(2):24-34. [ Links ]3. B
ello J, Velásquez R, Prieto A. 2011. Estructura comunitaria de los arbustales xerófilos del sector Punta de Araya, Península de Araya, estado Sucre, Venezuela. Informe técnico del Centro de Investigaciones Ecológicas de Guayacán- CAMUDOCA, Venezuela, 89 pp.4. Castillo A, Gómez S, Moreno O. 1992. Aspectos florísticos y fisionómicos de un ecosistema semiárido del Litoral Central, Municipio Vargas, Distrito Federal. Acta Biol. Venez. 13:94-115. [ Links ] 5. Cumana L.
6. Cumana L. 1999. Caracterización de las formaciones vegetales de la Península de Araya, estado Sucre, Venezuela. Saber. 11(1):7-16.
7. Cumana L. 2008. Plantas vasculares del Parque Nacional Mochima, estados Anzoátegui y Sucre, Venezuela. Ernstia. 18(2):107-164.
8. Cumana L, Cabeza P. 2003. Clave para las especies silvestres de angiospermas de la región occidental de la Península de Araya, estado Sucre, Venezuela. Ernstia. 13(1-2):61-93.
9. Cumana L, Sanabria M, Leopard I, Guevara Y. 2010.
Plantas vasculares de los manglares del estado Sucre, Venezuela. Acta Bot. Venez. 33(2):273- 298.10. Cumana L, Sanabria M, Leopard I, Guevara Y. 2012. Inventario y clave para especies en herbazales halófilos y psamófilos litorales terrestres del estado Sucre, Venezuela, depositadas en el herbario IRBR. Pittieria. 36:117-140.
11. Del-Mónaco C, Giménez E, Narciso S, Alfonso F, Bustillos F. 2010. Caracterización de los bosques de manglar y las praderas de Thalassia testudinum de la Isla La Tortuga y cayos adyacentes, Venezuela. Bol. Centro Invest. Biol. 44(3):297- 316.
12. Franco V, Bello J, Vásquez A. 2009. Valoración taxo-ecológica de arbustales xerófilos en la localidad de Araya, Península de Araya, estado Sucre, Venezuela. Informe técnico Departamento de Biología y Centro de Investigaciones Ecológicas de Guayacán, Universidad de Oriente, Venezuela. 96 pp.
13. Gallardo J, Meave J, Pérez E. 2005. Estructura, composición y diversidad de la selva baja caducifolia del Cerro Verde, Nizanda (Oaxaca), México. Bol. Soc. Bot. Mex. 76:19-35:19-35.
14. García N. 2012. Inventario florístico en arbustales xerófilos en la localidad de Guayacán, vertiente norte de la Península de Araya, estado Sucre, Venezuela. Cumaná: Universidad de Oriente, Escuela de Ciencias, Departamento de Biología [Disertación Licenciado en Biología], pp. 109.
15. Gentry A. 1982. Patterns of neotropical plant diversity. Evol. Biol. 15:1-84.
16. González E. 1980. Estudio preliminar de la vegetación del bosque xerófilo de la región de Las Peonías (estado Zulia, Venezuela). Bol. Centro Invest. Biol. 14:83-99.
17. Hokche O, Berry P, Huber O. 2008. Nuevo catálogo de la flora vascular de Venezuela. Fundación Instituto Botánico de Venezuela. "Dr. Tobías Lasser". Caracas, Venezuela, pp. 859.
18. Hoyos J. 1985. Flora de Isla de Margarita, Venezuela. Monografía, Nº 34, Fundación de Ciencias Naturales La Salle, Caracas, Venezuela, pp. 927.
19. Huber O, Alarcón C. 1988. Mapa de vegetación de Venezuela. MARNR, Departamento de suelo, flora y fauna. Base cartográfica MOP 1:200.000.
20. J
iménez E, Bello J, Jiménez S, Boada K, Narvaéz L, Velásquez A, Colón E. 2011. Composición florística, fenológica y estructura comunitaria de los arbustales xerófilos del sector Tras de la Vela, Península de Araya, estado Sucre, Venezuela. Informe técnico del Centro de Investigaciones Ecológicas de Guayacán, Venezuela. 86 pp.21. J
ones S. 1987. Sistemática vegetal. McGraw-Hill de México, pp. 527.22. Krebs C. 1989. Ecological Methodology. Harper Collins. New York, Estados Unidos, pp. 158-187.
23. Lacerda L, Conde J, Alarcón C, Álvarez-León R, Bacon P, DCroz L, Kjerfve B, PolainaJ, Vannucci M. 1993. Mangrove ecosystems of LatinAmerica and the Caribbean: a summary. In: LacerdaL. (Ed.). Conservation and sustainable utilization of mangrove forest in the Latin America and Africa regions. Part I. Latin America, pp. 211-243. The International Society for Mangrove Ecosystems (ISME) & The International Tropical Timber Organization. Okinawa, Japan. Disponible en: http://striweb.si.edu/publications.
24. Lamprecht H. 1990. Silvicultura en los trópicos. Ed. GTZ. Eschborn, Alemania, 335 pp.
25. Lárez A. 2005. Lista de especies del Parque Nacional «El Guácharo», estados Monagas y Sucre. Ernstia. 13(1-2):1-28.
26. Lindorf H, Parisca L, Rodríguez, P. 1999. Botánica, clasificación, estructura y reproducción. Ediciones de la Biblioteca de la Universidad de Venezuela. Caracas, pp. 584.
27. López B, Barreto B, Conde J. 2011. Caracterización de los manglares de zonas semiáridas en el noroccidente de Venezuela. Interciencia. 36(12):888-893.
28. Llamozas S, Rodrígo D, MeierW, Riina R, Stauffer F, Aymard G, Huber O, Ortiz R. 2003. Flora venezolana en peligro de extinción. Provita, Fundación Polar, Fundación Instituto Botánico de Venezuela. "Dr. Tobías Lasser", Conservación Internacional. Caracas, Venezuela, pp. 555.
29. Marcano M. 2003. Etnobotánica de nueve comunidades litorales de la costa norte de la Península de Paria, estado Sucre. Cumaná: Universidad de Oriente, Escuela de Ciencias, Departamento de Biología [Disertación Licenciado en Biología], pp. 96.
30. Matteucci S, Colma A. 1982. Metodología para el estudio de la vegetación. Secretaría General de la Organización de los Estados Americanos. Programa Regional de Desarrollo Científico y Tecnológico. Monografía Nº 22. Washington, D.C., pp. 168.
31. Medina E, Barbosa F. 2003. Manglares del sistema del lago de Maracaibo: Caracterización fisiográfica y ecológica. Ecotrópicos. 16(2):75-82.
32. Oliveira-Miranda M. 2010. Riesgo de eliminación de los ecosistemas terrestres de Venezuela. En: Libro Rojo de los Ecosistemas Terrestres de Venezuela. Rodríguez J, Rojas-Suarez F, Giraldo- Hernández D(Eds.). Provita, Shell Venezuela, Lenovo (Venezuela). Caracas, Venezuela, pp. 109-231.
33. Plonezak M, Rodríguez L. 2002. Conceptos, fundamentos y métodos para el manejo forestal de Venezuela. Rev. Forest. Venez. 46(1):83- 90.
34. Quijada M. 2004. Evaluación florística de galerías en la quebrada Arrojata, Parque Nacional Mochima, estado Sucre. Cumaná: Universidad de Oriente, Escuela de Ciencias, Departamento de Biología [Disertación Licenciado en Biología], pp. 106.
35. Rico R, Rodríguez L, Pérez R, Valero A. 1996. Mapa y análisis de la vegetación xerófila de las lagunas de Caparú, cuenca media del río Chama, estado Mérida. Plantula. 1(1)83-94.
36. Schaeffer-Novelli Y, Cintrón-Molero G, Rothleder R. 1990. Variability of mangrove ecosystems along the Brazil coast. Estuaries. 13(2):204-218.
37. Steyermark J. 2004. Rhizophoraceae. In: Berry P, Holst B, Yatskievych K, (Eds). Flora of the Venezuelan Guayana.Vol. 8: Poaceae-Rubiaceae. Missouri Botanical Garden Press, St. Louis, Missouri, pp. 484-490.
40. Steyermark J, Debrot H, Delascio F, Goméz R, González A, Guariglia M, Morillo G, Vera B. 1994. Flora del Parque Nacional Morrocoy. Agencia Española de Cooperación Internacional y Fundación Instituto Botánica de Venezuela, pp. 415.
41. Stiling P. 1999. Ecology; Theories and Applications.3rd edition. Prentice Hall. New Jersey, USA, pp. 840.
42. Urbáez Y. 2004. Evaluación florística en sabanas del cerro Arrojata, Parque Nacional Mochima, estado Sucre. Cumaná, Universidad de Oriente, Escuela de Ciencias, Departamento de Biología (Disertación Licenciado en Biología), pp. 91.
43. Valerio L, García Y, Levy S, Lacabana P. 2013. Inventario florístico de plantas vasculares litorales de la laguna El Morro, Isla de Margarita, estado Nueva Esparta, Venezuela. Saber. 25(2):151- 159.
44. Vera A, Martínez M, Ayala Y, Montes S, González A. 2009. Florística y fisonomía de un matorral xerófilo espinoso intervenido en Punta de Piedras, municipio Miranda, estado Zulia, Venezuela. Rev. Biol. Trop. 57(1-2):271-281.
45. Vera A, Martínez M, Nava W. 2011. Hemiparásitas de las especies de mangle de la Ciénaga de La Palmita, estado Zulia, Venezuela. Rev. Fac. Agronomía. 28(1):110-119.
46. Zamora-Trejos P, Cortés J. 2009. Los manglares de Costa Rica: El Pacífico norte. Rev. Biol. Trop. 57:473-488.












 uBio
uBio