Saber
versão impressa ISSN 1315-0162
Saber vol.26 no.4 Cumaná dez. 2014
Crecimiento y contenido iónico de Aloe vera (L.) Burm. f. (Sábila) bajo diferentes concentraciones de NaCl
Growth and ionic content of Aloe vera (L.) Burm. F. (aloe) under different nacl concentrations
Miguel E. García Rodríguez, Víctor A. Franco-Salazar, José A. Véliz
Universidad de Oriente, Núcleo de Sucre, Escuela de Ciencias, Departamento de Biología, Laboratorio de Fisiología Vegetal, Cumaná, Venezuela E-mail: velizja@gmail.com / vafrancos@gmail.com
RESUMEN
Con el propósito de evaluar el efecto de la salinidad sobre Aloe vera, se estudió la sintomatología, el crecimiento (hojas nuevas, hojas basales necrosadas, volumen foliar, biomasa fresca y seca) y el contenido iónico (K+, Na+, Cl-, Ca2+ y Mg2+) en plantas cultivadas hidropónicamente durante 75 días bajo distintas concentraciones salinas: 0, 50, 100, 150, 200, 250 y 300 mol.m-3 de NaCl. En general, las plantas sobrevivieron al experimento; sin embargo, en los tratamientos salinos, el número de hojas nuevas, volumen foliar, biomasa fresca y seca disminuyeron. Además, el número de hojas basales necrosadas aumentó y también se evidenció deshidratación y necrosis radical. Los tratamientos salinos incrementaron la concentración de K+, Na+, Cl-, Ca2+ y Mg2+ en las plantas pero disminuyeron la concentración de K+. Los resultados revelaron que, aun cuando las plantas sobrevivieron a salinidades de hasta 300 mol.m-3 de NaCl, el crecimiento de las mismas fue afectado a partir de 50 mol.m-3 de NaCl, llegando a ser más drásticos los efectos en la medida en que la salinidad va en aumento, al mismo tiempo que muestran síntomas visuales y contenidos iónicos alterados.
Palabras clave: Biomasa, volumen foliar, cultivo hidropónico, salinidad.
ABSTRACT
In order to evaluate the effect of salinity on Aloe vera, visual symptoms, growth (new leaves, necrotic basal leaves, leaf volume and fresh and dry biomass), and ionic content (K+, Na+, Cl-, Ca2+ and Mg2+) were studied in hydroponically cultivated plants during 75 days under different saline concentration: 0, 50, 100, 150, 100, 150, 200, 250 and 300 mol.m-3 NaCl. In general, the plants survived the experiment; however, the number of new leaves, leaf volume, fresh and dry biomass decreased in the salt treatments. Furthermore, the number of necrotic basal leaves increased, and dehydration and roots necrosis were observed. Salt treatments increased the concentration of K+, Na+, Cl-, Ca2+ and Mg2+ but that of K+ decreased. The results revealed that, although plants survived to salinities as far as 300 mol.m-3 NaCl, their growth was adversely affected as of 50 mol.m-3 NaCl, with more drastic effects as the salinity increases, at the same time that visual symptoms appear and ion contents are altered.
Key words: Biomass, leaf volume, cultured hydroponic, salinity.
Recibido: mayo 2014. Aprobado: julio 2014. Versión final: agosto 2014.
INTRODUCCIÓN
La sábila, Aloe vera (L.) Burm. f. (Aloaceae), es una xerófita con metabolismo ácido de crasuláceas (MAC), la cual tiene importancia comercial debido a los diversos productos medicinales, cosméticos y alimentarios que se extraen de sus hojas. En Venezuela esta planta se explota desde el siglo XIX, principalmente en la región costera semiárida del estado Falcón (Díaz 2001, Añez y Vásquez 2005). En estas y en otras zonas áridas y semiáridas, esta especie es frecuentemente cultivada por su suculencia y alta eficiencia en el uso del agua, propia de plantas MAC (Lüttge 2004), pues los cultivos tradicionales de plantas con metabolismo C3 y C4 son más afectados por la sequía y la salinidad imperante en sus suelos; dicha salinidad es mayor en las zonas xerófilas cercanas a la costa e irrigadas, debido a la acumulación de residuos salinos (Velasco 1983).
En las zonas mencionadas, la sequía y la salinidad ocasionan estrés iónico, osmótico y tóxico que limita la sobrevivencia y el crecimiento de muchas plantas. Sin embargo, algunas plantas con MAC suelen crecer en regiones desérticas, semidesérticas y marismas, donde el agua es escasa o de difícil acceso, allí deben enfrentar varias limitantes fisiológicas, como obtener agua de un suelo que tiene un potencial osmótico negativo y concentraciones elevadas y potencialmente tóxicas de iones de sodio, carbonatos y cloruros (Taiz y Zeiger 1998). Como respuestas a estas limitantes, muchas de estas plantas provocan potenciales osmóticos celulares bastante negativos (≤ 0,3 MPa), de manera que pueden absorber agua, almacenarla y utilizarlas, sobrellevando así el estrés hídrico (Ting 1985, Dodd et al. 2002).
Algunos efectos de la salinidad sobre las plantas provocan reducción de los parámetros de crecimiento de raíz y vástago (Naqvi et al. 1997), disminución en la absorción de potasio (Nobel et al. 1984, Berry y Nobel 1985, Girija et al. 2002, Franco-Salazar y Véliz 2007), la conductancia estomática, asimilación de CO2 y en la acumulación de materia seca (Brugnoli y Lauteri 1991, Franco-Salazar y Véliz 2008).
Aloe vera se ha señalado como una planta tolerante a la salinidad (Sun et al. 2003), además se encontró que su metabolismo del nitrógeno no se ve afectado en plantas irrigadas con agua de mar (Liu et al. 2006). Sin embargo, algunos trabajos han demostrado que la cercanía al mar, la aplicación de NaCl y agua de mar afectan parámetros como biomasa, formación de nuevas hojas, contenido de agua foliar, dimensiones foliares, acidez titulable, pigmentos, carbohidratos, proteínas, prolina e iones (Jin et al. 2007, Franco-Salazar et al. 2012, Moghbeli et al. 2012, Murillo- Amador et al. 2014). En vista que muchas plantaciones de sábila se están llevando a cabo en zonas donde la salinidad es un problema para los sembradíos, sobretodo en las regiones costeras, se planteó estudiar el crecimiento y contenido iónico de A. vera cultivada hidropónicamente bajo diferentes concentraciones de NaCl.
METODOLOGÍA
Cultivo hidropónico y tratamientos
Se utilizaron plantas de Aloe vera (L.) Burm. f. (Aloaceae) de aproximadamente cuatro meses de edad, propagadas vegetativamente a partir de rizomas de plantas recolectadas en la península de Araya, estado Sucre, Venezuela. A las plantas propagadas de esa manera, se les eliminaron las raíces y hojas dañadas, se rotularon y cultivaron hidropónicamente en solución Hoagland según Fuentes-Carvajal et al. (2006) y Franco-Salazar y Véliz (2007). Luego de seis semanas se aplicaron los tratamientos salinos; para lo cual se adicionó NaCl gradualmente cada dos días, a una solución de cultivo renovada; teniéndose finalmente concentraciones de 0, 50, 100, 150, 200, 250 y 300 mol.m-3 de NaCl. El experimento fue conducido durante 75 días en el vivero del Departamento de Biología, Universidad de Oriente, Cumaná, Venezuela.
Sintomatología y crecimiento
Se realizaron observaciones periódicas a las hojas y raíces para visualizar la presencia de posibles síntomas ocasionados por la salinidad. Al final del experimento se registró el número de hojas nuevas formadas por planta y el número de hojas basales que se necrosaron completamente durante el experimento. Por otro lado, se utilizaron cuatro hojas basales (por ser las más desarrolladas) por planta y, en cada una, se midió la longitud (L), espesor (E) y ancho central (A), y se determinó el volumen (V) mediante la ecuación V = (L/12)πEA, considerando la hoja como un cono con sección transversal elíptica más que circular (Hernández-Cruz et al. 2002). La biomasa fresca de las plantas fue determinada haciendo uso de una balanza analítica digital. Luego, estas mismas plantas se introdujeron en una estufa a 80ºC hasta conseguir peso constante, obteniéndose así la biomasa seca.
Contenido iónico
Una vez obtenida la biomasa seca, se escogieron cuatro plantas al azar por cada tratamiento, se molieron (malla 40) y luego, 1 g de cada muestra resultante se calcinó durante 3 h a 300ºC. Las cenizas de cada tratamiento se disolvieron en ácido clorhídrico 2 mol.L-1, se diluyeron con agua desionizada y se filtraron a través de papel Whatman Nº 2. En cada filtrado se determinó K+ y Na+ por fotometría de llama y Mg2+ y Ca2+ por espectrofotometría de absorción atómica. Se utilizó la misma metodología, previa adición de 0,25 g de óxido de calcio y agua al gramo de material vegetal molido, para estimar el contenido de Cl-, titulando con nitrato de plata (Chapman y Pratt 1973).
Análisis estadístico
Se aplicó un diseño de bloques completos al azar de siete tratamientos (0, 50, 100, 150, 200, 250 y 300 mol.m-3 NaCl), cuatro repeticiones y cuatro plantas por unidad experimental, para un total de 112 plantas. Se aplicó ANOVA de una vía, con prueba a posteriori de Duncan para establecer los grupos. Para el caso del Nº de hojas nuevas y Nº hojas basales necrosadas, al no cumplir los datos con el supuesto de normalidad, incluso con transformaciones, se aplicó la prueba de Kruskal-Wallis (Sokal y Rohlf 1979). Los datos se analizaron mediante el paquete estadístico computarizado STATGRAPHICS Centurion XV.II.
RESULTADOS Y DISCUSIÓN
Sintomatología y crecimiento
En general, todas las plantas sobrevivieron al experimento; sin embargo, se pudo observar que en la medida que incrementó la salinidad, el crecimiento de las plantas se vio afectado. Bajo el tratamiento 0 mol.m-3 NaCl, A. vera mostró el mejor crecimiento, con mayor número de hojas, más desarrolladas y turgentes; además de un aumento en el número de raíces desarrolladas, con coloración amarilla clara y de gran longitud (19,53 cm). Con 50 mol.m-3 NaCl la especie mostró un comportamiento parecido (aunque con un escaso menor crecimiento). A partir de estas concentraciones, el aumento de la salinidad ocasionó síntomas más severos, reduciendo la producción de hojas y deshidratando las ya existentes, al punto de llegar a ser muy acanaladas y con los ápices necrosados. En los tratamientos con mayor concentración de sal las hojas más viejas se necrosaron completamente, al mismo tiempo que las raíces estaban necrosadas, colapsadas y disminuidas en cantidad (en algunos plantas con ausencia total de raíces cuando fueron sometidas a las máximas salinidades, donde sólo se observaba el rizoma necrosado) (Fig. 1a-g).
La necrosis foliar, radical y demás síntomas presentes en A. vera (Fig. 1), también han sido observadas en plantas C3 como frijol, remolacha y tomate (Silveira et al. 2001, Ghoulam et al. 2002, Fernández-García et al. 2004), en C4 como caña de azúcar (Villafañe 1997) y en ejemplares MAC como cardón y tuna (Berry y Nobel 1985, Murillo-Amador et al. 2001) sometidas a altas salinidades. Es probable que la necrosis foliar y radical sea causada por la deficiencia de elementos esenciales como el K+ en los tejidos, siendo éste necesario para la regulación osmótica, la síntesis de proteínas y la activación de enzimas involucradas en la respiración y fotosíntesis (Taiz y Zeiger 1998); dicha deficiencia ocurre debido a que el Na+ (presente en la solución salina) compite con el K+ en el medio radical (Yokoi et al. 2002, Rodríguez-Navarro y Rubio 2006), limitando la entrada de este último elemento esencial a la planta. La necrosis en hojas y raíces también ha sido observada por Fuentes-Carvajal et al. (2006) en A. vera cultivada hidropónicamente bajo deficiencia de K+.
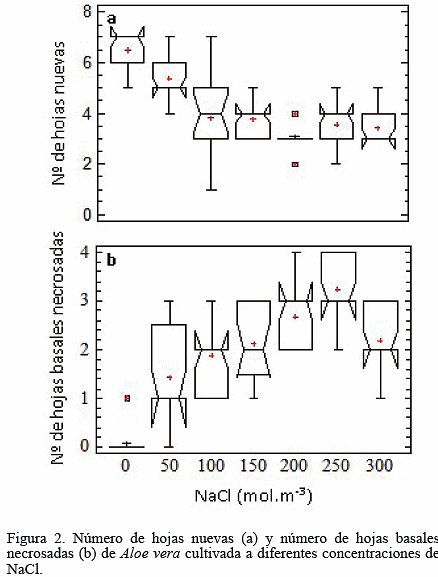
En la Figura 2a el número de hojas nuevas formadas durante el experimento fue menor en los tratamientos salinos con respecto al tratamiento 0 mol.m-3 NaCl (KW = 68,58; p < 0,001), al mismo tiempo que el número de hojas basales necrosadas fue mayor (KW = 64,00; p < 0,001) en las plantas cultivadas bajo salinidad (Fig. 2b).
El menor número de hojas nuevas en concordancia con el mayor número de hojas basales necrosadas en los tratamientos salinos, sugiere que las plantas bajo las condiciones de estrés salino impuesto, pudieron trasladar agua y reservas nutricionales desde las hojas basales para formar nuevos brotes, pero en menor cantidad y tamaño que las del tratamiento no salino, a costa de la pérdida de las hojas más viejas. Tal vez esta movilización y formación de nuevas hojas pudo llevarse a cabo por poco tiempo, después de la aplicación del NaCl, pero la persistencia del estrés hasta el final del experimento, provocó que las plantas cesaran la producción de nuevos órganos vegetativos en los tratamientos experimentales. Además, fue posible que con la formación de nuevos brotes, el ciclo vital de la planta estuviese comprometida, pues se ha señalado que en los nuevos órganos puede funcionar el metabolismo C3 y, por lo tanto, su demanda hídrica, debido a que la transpiración es mayor (Pimienta-Barrios et al. 2002, 2005, Lüttge 2004). La movilización de agua y reservas también se ha señalado para otras plantas MAC cultivadas bajo déficit hídrico como Delosperma tradescantioides, Prenia sladeniana (Tüffers et al. 1995), O. ficus-indica (Wang et al. 1998) y Peperomia carnevalii (Herrera et al. 2000).
En otra investigación (Moghbeli et al. 2012), también fue reducido el número de hojas en A. vera al aumentar la salinidad. Además, para la cactácea O. ficus-indica, similarmente se observó una reducción en la formación de nuevos cladodios, al incrementar la salinidad (Murillo- Amador et al. 2001, Franco-Salazar y Véliz 2008).
El volumen foliar de A. vera (Fig. 3a) fue reducido (Fs = 71,47; p < 0,001) incluso a baja salinidad (50 mol.m-3 NaCl) cuando se comparan con el tratamiento no salino. De igual manera disminuyó la biomasa fresca (Fig. 3b; Fs = 91,55; p < 0,001) y seca (Fig. 3c; Fs = 38,65; p < 0,001) de las plantas, siendo estas dos últimas variables menores e iguales estadísticamente entre sí desde 100 hasta 300 mol.m-3 NaCl. Esta reducción o disminución se relaciona con el estrés osmótico y tóxico (Taiz y Zeiger 1998) que debió propiciar el exceso de NaCl, con el consecuente daño del sistema radical, reduciéndolo conforme aumentaba la salinidad, hasta el punto de estar completamente ausente en algunas plantas sometidas a las máximas salinidades y en donde sólo se observó el rizoma necrosado (Fig. 1). Esto limitó la entrada de agua y nutrientes a la planta, necesarios para mantener la turgencia y, con ello, el volumen y biomasa apropiada. Igualmente, la reducción del volumen y la biomasa fresca (Fig. 3) también se asoció con la deshidratación de los tejidos, pues al crearse tal situación a nivel radical que limitó la entrada de agua, la planta queda a expensa del agua almacenada en su hidroparénquima para mantener sus funciones metabólicas, aunque por ser una especie MAC limita más la pérdida de agua por transpiración que las plantas con metabolismo C3 y C4 (Lüttge 2004). Al respecto, en otros trabajos se ha señalado que el estrés por sequía ocasionó mayormente la deshidratación del hidroparénquima en las especies MAC A. barbadensis (Van Schaik et al. 1997), O. ficus-indica (Goldstein et al. 1991) e Hylocereus undatus (Nobel 2006). Para A. vera, la pérdida de agua del hidroparénquima se traduce en la reducción de la producción del gel, necesario para la industria. La reducción de las mencionadas variables (Fig. 3), se refleja en la falta de turgencia, el menor número de hojas nuevas, la necrosis de las hojas basales, el aspecto débil y acanalado de las hojas y la reducción o escasez radical mostrados por esta especie en la presente investigación.
En otro trabajo, encontraron que el contenido de agua foliar (responsable del volumen y la biomasa) de dos cultivares de sábila fue reducido por la salinidad del agua de mar al 60% (Jin et al. 2007). Similarmente, volumen, biomasa fresca y seca fueron menores en hojas de A. vera cosechadas de una parcela cercana al mar (~0,52 km) que en aquellas provenientes de otra parcela alejada (~1,47 km) y también menores en la estación seca que en la lluviosa (Franco-Salazar et al. 2012, 2014). Mientras que Rodríguez-García et al. (2007) y Silva et al. (2010) encontraron que el bajo potencial hídrico o la poca disponibilidad de agua en el medio radical de la sábila, reduce su biomasa fresca foliar y crecimiento. Por su parte, Franco-Salazar y Véliz (2007, 2008) reportaron que el aumento de la concentración de NaCl en solución hidropónica, también afectó el volumen de los cladodios y la biomasa seca de O. ficus-indica.
Los menores valores de las variables medidas en la sábila (Fig. 2a y 3), producto del estrés osmótico, hídrico y tóxico ocasionado por el NaCl, esencialmente a las mayores salinidades, debieron estar asociados al cierre estomático, la reducción en la fijación nocturna de CO2 y a la disminución del contenido de clorofila. Silverman et al. (1988) y Aguilar y Peña (2006) demostraron que estos tres parámetros se han visto afectados en las especies MAC O. humifusa y O. ficus-indica cultivadas bajo salinidad (NaCl) y sequía, y al verse afectados estos parámetros, se reduce la formación de estructuras carbonadas y, por ende, el crecimiento, lo que conllevó a la presencia de menor número de hojas nuevas, volumen, biomasa fresca y seca (Figs. 2a y 3).
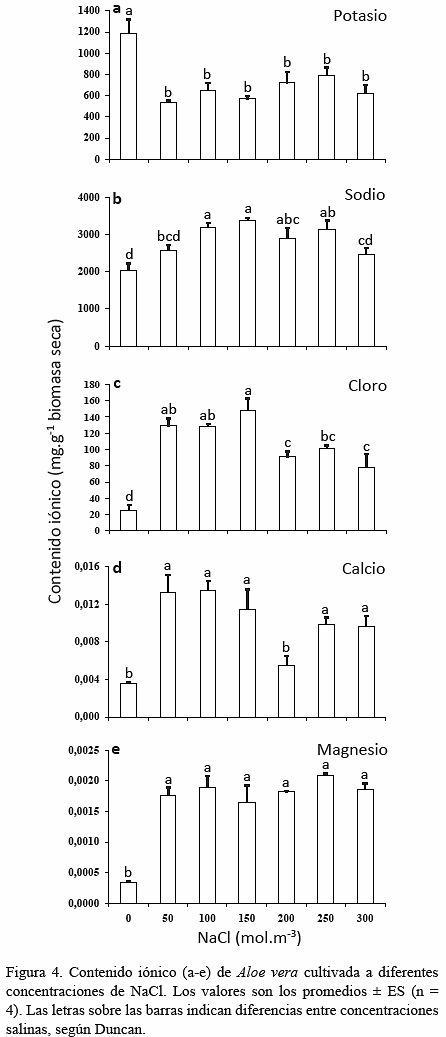
Contenido iónico Los resultados demostraron que la absorción de K+ disminuyó (Fs = 7,55; p < 0,001) en las plantas sometidas a los distintos tratamientos salinos, cuando se compararon con el tratamiento no salino (Fig. 4a). A salinidades más bajas, es posible que este ión compitiera con el Na+, ya que usan los mismos canales de entrada como los transportadores HKT (Yokoi et al. 2002, Rodríguez- Navarro y Rubio 2006). Sin embargo, en la medida que aumentó la concentración de NaCl, el daño radical ocasionado por la misma, con la consecuente pérdida de las raíces, impidió la absorción de potasio. Similarmente, en otros trabajos el contenido de K+ disminuyó en plantas de la misma especie, producto de la salinidad en el medio radical; teniéndose que en hojas de A. vera cosechadas de una parcela cercana al mar, se encontró menor contenido de K+ que en aquellas provenientes de una parcela alejada (Franco-Salazar et al. 2012). El contenido de K+ también disminuyó en plantas de sábila bajo concentraciones crecientes de NaCl (Murillo-Amador et al. 2014); por su parte, Jin et al. (2007) también encontraron menores contenidos de este ión en hojas de un cultivar de la mencionada especie, cuando fueron irrigadas con agua de mar 60%.
Se sabe que el K+ desempeña un papel clave en la osmorregulación que tiene lugar durante la apertura y cierre de los estomas (Marschner 1995), interviene en distintas etapas de la fotosíntesis relacionadas con la síntesis de carbohidratos y la traslocación de fotosintatos en el floema (Azcón-Bieto y Talón 2000). Al ser la concentración de K+ menor en los tejidos foliares, menor será la absorción y fijación nocturna de CO2 durante la fase I del MAC (Dodd et al. 2002, Lüttge 2004). Todo esto pudo incidir en la sintomatología (Fig. 1), el menor número foliar (Fig. 2) y la menor biomasa (Fig. 3) observada en las plantas sometidas a los tratamientos salinos. Al respecto, Fuentes-Carvajal et al. (2006), cultivando A. vera hidropónicamente bajo deficiencia de K+, también observaron necrosis en las hojas adultas, retardo en el crecimiento y pérdida de la turgencia, lo que indica la importancia de dicho elemento para esta especie. Los tratamientos salinos incrementaron los niveles de sodio (Fs = 6,40; p < 0,001) y cloruro (Fs = 16,70; p < 0,001) en la sábila (Fig. 4b y c). El Na+ es un elemento importante en plantas MAC, ya que ayuda a la regeneración del fosfoenol piruvato (PEP) y el Cl- es un elemento necesario para el funcionamiento óptimo de los sistemas de evolución de oxígeno durante la fotosíntesis (Azcón-Bieto y Talón 2000). El aumento en el contenido de estos iones en plantas se debe a su alta movilidad a través de las membranas celulares y baja reactividad bioquímica (Marschner 1995); sin embargo, los síntomas visuales, la poca acumulación de biomasa seca y el poco crecimiento observado con altas concentraciones de sodio y cloro en las plantas (Fig. 1 a 3), debieron ser ocasionados por sus efectos tóxicos y osmóticos, ya que estos iones afectan el potencial hídrico, el potencial eléctrico de las membranas (Greenway y Munns 1980) y el estatus iónico de las células (Sultana et al. 2001). Por su parte, Jin et al. (2007) hallaron que la irrigación de dos cultivares de sábila con agua de mar 60% aumentó los niveles de Na+ en hojas, tallos y raíces. Además, Franco-Salazar et al. (2012), encontraron mayores contenidos de Na+ y Cl- en hojas de A. vera cosechadas de una parcela cercana al mar que en aquellas provenientes de una parcela alejada, mientras que Murillo-Amador et al. (2014) también hallaron valores elevados de estos iones en plantas de la misma especie cuando se incrementó la salinidad. Similarmente, altas concentraciones de estos iones también se han observado en otras plantas MAC como Cereus validus (Nobel et al. 1984) y O. ficus-indica (Franco-Salazar y Véliz 2007).
En general, la absorción de Ca2+ aumentó en los tratamientos salinos (Fs = 8,38; p < 0,001) cuando se compara con el tratamiento no salino (Fig. 4d).
Concentraciones moderadamente altas de Ca2+ se han citado para A. vera (Yamaguchi et al. 1993) y en la presente investigación se observó que en esta especie, cultivada a salinidades superiores de 50 mol.m-3 NaCl, hay mayor incorporación de este ión en comparación con plantas no tratadas con NaCl, aunque Murillo-Amador et al. (2014) encontraron que el aumento de NaCl disminuyó el contenido de Ca2+ en hojas de sábila. Por su parte, Jin et al. (2007), también reportaron un aumento en el contenido Ca2+ en las raíces pero una disminución en hojas y tallos de estas plantas al ser tratadas con agua de mar 60%. Otro trabajo realizado en cactus Ferocactus acanthodes y O. ficus-indica, señala que las concentraciones de Ca2+ aumentaron cuando se incrementó la concentración de NaCl (Berry y Nobel 1985). En plantas de A. vera cultivadas con deficiencia de potasio, el contenido de calcio aumentó (Fuentes-Carvajal et al. 2006) y en el presente estudio se pudo observar que la salinidad limitó el ingreso de K+ pero propició el ingreso de Ca2+. También, un aumento del Na+ se relacionó con una mayor absorción del Ca2+, lo que se observó en la presente investigación, por lo cual es probable que esta absorción tenga un efecto protector y/o osmótico. El Ca2+ dentro de la célula, por lo general, está unido a estructuras moleculares, estabiliza la membrana celular enlazando los grupos fosfatos y carboxilos de los fosfolípidos y proteínas a la superficie de la membrana, ayudando a disminuir la fluidez y permeabilidad de la misma (Lüttge 2004); mientras que el Ca2+ libre en el citosol es un importante regulador de numerosas funciones relacionadas con el crecimiento y el desarrollo (Marschner 1995). Estos roles del Ca2+ parecieran que operaron mejor en la sábila cuando la salinidad no era tan elevada, principalmente a 50 mol.m-3 NaCl, que fue donde se observaron los menores efectos de la sal (Figs. 1 a 3).
De igual manera, las concentraciones de Mg2+ fueron mayores (Fs = 17,88; p < 0,001) en los tratamientos salinos (Fig. 4e). Probablemente, en A. vera, la captación de este ion esencial sirva para el ajuste osmótico, teniendo un efecto protector como el del Ca2+, que ayuda a neutralizar altas concentraciones del ion sodio o quizás sea usado como contra ion para movilizar carbohidratos y remediar la posible alteración que el exceso de iones pudiera provocar (Marschner 1995, Kinraide 1999). El aumento en las concentraciones de Mg2+ se ha observado en plantas C3 (Cakmak et al. 1994, Pujos y Morard 1997) sometidas a distintos tratamientos salinos y en A. vera cultivada bajo deficiencia de K+ (Fuentes-Carvajal et al. 2006) e irrigada con agua de mar 60% (Jin et al. 2007); sin embargo, Murillo-Amador et al. (2014) encontraron que el contenido de este ion disminuyó en las hojas de esta planta con el aumento de la salinidad. Franco-Salazar et al. (2012), obtuvieron menores contenidos tanto de Ca2+ como Mg2+ en hojas de A. vera cosechadas de una parcela cercana al mar que en aquellas provenientes de una parcela alejada. Las plantas de A. vera sometidas a las distintas salinidades no sólo absorbieron más Ca2+ (Fig. 4d), sino que también absorbieron más Mg2+ (Fig. 4e) para compensar la disminución del K+ (Fig. 4a) provocada por las altas concentraciones de NaCl.
CONCLUSIONES
Aún cuando A. vera sobrevive a salinidades entre 50 y 300 mol.m-3 NaCl, muestra menor desarrollo y mayor deshidratación, necrosis foliar y radical conforme aumenta la concentración de NaCl, con respecto a plantas cultivadas hidropónicamente a 0 mol.m-3 NaCl. Bajo dichas salinidades (50-300 mol.m-3 NaCl), el número de hojas nuevas, volumen foliar, biomasa fresca y seca disminuyen; mientras que el número de hojas basales necrosadas aumenta. Por otro lado, la salinidad limita la acumulación de K+ y propicia la de Na+, Cl-, Mg2+ y Ca2+ en A. vera.
REFERENCIAS BIBLIOGRÁFICAS
1. Aguilar G, Peña C. 2006. Alteraciones fisiológicas provocadas por sequía en nopal (Opuntia ficusindica). Rev. Fitotec. Mex. 29(3):231-237. [ Links ]
2. Añez B, Vásquez J. 2005. Efecto de la densidad de población sobre el crecimiento y rendimiento de la zábila (Aloe barbadensis M.). Rev. Fac. Agron. (LUZ). 22(1):1-12.
3. Azcón-Bieto J, Talón M. 2000. Fundamentos de fisiología vegetal. McGraw Hill, Interamericana, Madrid, España, pp. 522.
4. Berry W, Nobel P. 1985. Influence of soil and mineral stresses on cacti. J. Plant Nutr. 8(8):679-696.
5. Brugnoli E, Lauteri M. 1991. Effects of salinity on stomatal conductance, photosynthetic capacity, and carbon isotope discrimination of salt-tolerant (Gossypium hirsutum L.) and salt-sensitive (Phaseolus vulgaris L.) C3 non-halophytes. Plant Phys. 95(2):628-634.
6. Cakmak I, Hengeler C, Marschner H. 1994. Partitioning of shoot and root dry matter and carbohydrates in bean plants suffering from phosphorus, potassium, and magnesium deficiency. J. Exp. Bot. 45(278):1245-1250.
7. Chapm an H, Pratt P. 1973. Métodos de análisis para suelos, plantas y aguas. Trillas, Ciudad de México, México, pp. 195.
8. Díaz M. 2001. Ecología experimental y ecofisiología: bases para el uso sostenible de los recursos naturales de las zonas áridas neo-tropicales. Interciencia. 26(10):472-478.
9. Dodd A, Borland A, Haslam R, Grifiths H, Maxwell K. 2002. Crassulacean acid metabolism: plastic, fantastic. J. Exp. Bot. 53(369):569-580.
10. Fernández-García N, Martínez V, Carvajal M. 2004. Effect of salinity on growth, mineral composition, and water relations of grafted tomato plants. J. Plant Nutr. Soil Sci. 167(5):616-622.
11. Franco-Salazar V, Véliz J. 2007. Respuestas de la tuna (Opuntia ficus-indica (L.) Mill.) al NaCl. Interciencia. 32(2):125-130.
12. Franco-Salazar V, Véliz J. 2008. Efectos de la salinidad sobre el crecimiento, acidez titulable y concentración de clorofila en Opuntia ficus-indica (L.) Mill. Saber. 20(1):12-17.
13. Franco-Salazar V, Véliz J, Rojas L. 2012. Ecofisiología de Aloe vera (L.) Burm. f. en Guayacán, Península de Araya, estado Sucre, Venezuela. Interciencia. 37(6):444-450.
14. Franco-Salazar V, Véliz J, Valerio R. 2014. Algunos parámetros fisiológicos de Aloe vera (L.) Burm. f. (sábila) en Guayacán, Península de Araya, estado Sucre, Venezuela. Saber. 26(1):18-24.
15. Fuentes-Carvajal A, Véliz J, Imery J. 2006. Efecto de la deficiencia de macronutrientes en el desarrollo vegetativo de Aloe vera. Interciencia. 31(2):116- 122.
16. Ghoulam C, Foursy A, Fares K. 2002. Effects of salt stress on growth, inorganic ions and proline accumulation in relation to osmotic adjustment in five sugar beet cultivars. Env. Exp. Bot. 47(1):39-50.
17. Girija C, Smith B, Swamy P. 2002. Interactive effects of sodium chloride and calcium chloride on the accumulation of proline and glycinebetaine in peanut (Arachis hypogaea L.). Env. Exp. Bot. 47(1):1-10.
18. Goldstein G, Ortega J, Nerd A, Nobel P. 1991. Diel patterns of water potential components for the crassulacean acid metabolism plant Opuntia ficusindica when well-watered or droughted. Plant Physiol. 95(1):274-288.
19. Greenway H, Munns R. 1980. Mechanisms of salt tolerance in nonhalophytes. Annu. Rev. Plant Physiol. 31(1):149-190.
20. Hernández-Cruz L, Rodríguez-García R, Jass o D, Angulo-Sánchez J. 2002. Aloe vera response to plastic munch and nitrogen. In: Janick J, Whipkey A. (Eds). Trends in new crops and new uses. ASHS Press, Alexandria, VA, pp. 570-574.
21. Herrera A, Fernández M, Taisma M. 2000. Effects of drought on CAM and water relations in plants of Peperomia carnevalii. Ann. Bot. 86(1):511-517.
22. Jin Z, Wang C, Liu Z, Gong W. 2007. Physiological and ecological characters studies on Aloe vera under soil salinity and seawater irrigation. Proc. Biochem. 42(4):710-714.
23. Kinraide T. 1999. Interactions among Ca2+, Na+ y K+ in salinity toxicity: quantitative resolution of multiple toxic and ameliorative effects. J. Exp. Bot. 50(338):1495-1505.
24. Liu Z, Zhao G, Lui L, Zheng Q. 2006. Nitrogen metabolism of Aloe vera under long-term diluted seawater irrigation. J. Appl. Hort. 8(1):33-36.
25. Lüttge U. 2004. Ecophysiology of Crassulacean Acid Metabolism (CAM). Ann. Bot. 93(3):629-652.
26. Marschner H. 1995. Mineral nutrition of higher plants. 2nd ed. Academia Press, London, UK. pp. 889.
27. Moghbeli E, Fathollahi S, Salari H, Ahmadi G, Saliqehdar F, Safari A, Hosseini M. 2012. Effects of salinity stress on growth and yield of Aloe vera L. J. Med. Plants Res. 6(16):3272-3277.
28. Murillo-Amador B, Cortés-Avila A, Troyo-Diéguez E, Nieto-Garibay A, Jones H. 2001. Effects of NaCl salinity on growth and production of young cladodes of Opuntia ficus-indica. J. Agron. Crop Sci. 187(4):269-279.
29. Murillo-Amador B, Córdoba-Matson M, Villegas- Esp inoza J, Hernández-Montiel L, Troyo-Diéguez E, García-Hernández J. 2014. Mineral content and biochemical variables of Aloe vera L. under salt stress. PLoS ONE. 9(4):1-9.
30. Naqvi S, Mumtaz S, Shereen A, Khan M. 1997. Role of abscisic acid in regulation of wheat, seedling growth under salinity stress. Biol. Plant. 39(3):453- 456.
31. Nobel P. 2006. Parenchyma-Chlorenchyma water movement during drought for the hemiepiphytic cactus Hylocereus undatus. Ann. Bot. 97(1):469- 474.
32. Nobel P, Lüttge U, Heuer S, Ball E. 1984. Influence of applied NaCl on crassulacean acid metabolism and ionic levels in a cactus, Cereus validus. Plant Physiol. 75(1):799-803.
33. Pimienta-Barrios E, González M, Nobel P. 2002. Ecophysilogy of a wild platyopuntia exposed to prolonged drought. Env. Exp. Bot. 47(1):77-86.
34. Pimienta-Barrios E, Zañudo-Hernández J, Rosas- Espinoza V, Valenzuela-Tapia A, Nobel P. 2005. Young daughter cladodes affect CO2 uptake by mother cladodes of Opuntia ficus-indica. Ann. Bot. 95(2):363-369.
35. Pujos A, Morard P. 1997. Effects of potassium deficiency on tomato growth and mineral nutrition at the early production stage. Plant Soil. 189(2):189-189.
36. Rodríguez-García R, Jasso D, Gil-Marín J, Angulo- Sánchez J, Lira-Saldivar R. 2007. Growth, stomatal resistance, and transpiration of Aloe vera under different soil water potentials. Ind. Crops Prod. 25(2):123-128.
37. Rodríguez-Navarro A, Rubio F. 2006. High-affinity potassium and sodium transport systems in plants. J. Exp. Bot. 57(5):1149-1160.
38. Silva H, Sagardia S, Seguel O, Torres C, Tapia C, Franck N, Cardemil L. 2010. Effect of water availability on growth and water use efficiency for biomass and gel production in Aloe vera (Aloe barbadensis M.). Ind. Crops Prod. 3(1)1:20-27.
39. Silveira J, Melo A, Viégas R, Oliveira J. 2001. Salinityinduced effects on nitrogen assimilation related to growth in cowpea plants. Env. Exp. Bot. 46(1):171- 179.
40. Silverman F, Young D, Nobel P. 1988. Effects of applied NaCl on Opuntia humifusa. Physiol. Plant. 72(1):343-348.
41. Sokal R, Rohlf J. 1979. Biometría. Principios y métodos estadísticos en la investigación biológica. H. Blume Ediciones, Madrid, España, pp. 832.
42. Sultana N, Ikeda T, Kashem M. 2001. Effect of foliar spray of nutrient solution on photosynthesis, dry matter accumulation and yield in seawater-stressed rice. Env. Exp. Bot. 46(1):129-140.
43. Sun S, Shen Q, Wan J, Liu Z. 2003. Induced expression of the gene for NADP-malic enzyme in leaves of Aloe vera L. under salt stress. Acta Biochim. Biophys. Sin. 35(5):423-429.
44. Taiz L, Zeiger E. 1998. Plant Physiology. 2th Edition. Sinauer Associates, Inc., Sunderland, Massachusetts, pp. 786. Ting I. 1985. Crassulacean acid metabolism. Ann. Rev. Plant Phys. 36(1):595-622.
45. Tüffers A, Martin C, Willert D. 1995. Possible water movement from older to younger leaves and photosynthesis during drought stress in two succulent species from South Africa, Delosperma tradescantioides Bgr. and Prenia sladeniana L. Bol. (Mesembryanthemaceae). J. Plant Phys. 146(1):177-182.
46. Van Schaik A, Struik P, Damian T. 1997. Effects of irrigation and N on the vegetative growth of Aloe barbadensis Mill. in Aruba. Trop. Agric. 74(2):104-109.
47. Velasco H. 1983. Uso y manejo del suelo. Limusa, S.A., México, Distrito Federal, México, pp. 191. Villafañe R. 1997. Efecto de la salinidad del suelo sobre el crecimiento de la batata. Agron. Trop. 47(2):135-138.
48. Yamaguchi I, Mega N, Sanada H. 1993. Components of Aloe vera (L.) Burm. f. Biosci. Biotech. Biochen. 57(8):1350-1352.
49. Yokoi S, Bress an R, Hasegawa M. 2002. Salt Stress Tolerance of Plants. JIRCAS Working Report. 1(1):25-33.
50. Wang N, Zhang H, Nobel P. 1998. Carbon flow and carbohydrate metabolism during sink-to-source transition for developing cladodes of Opuntia ficusindica. J. Exp. Bot. 49(328):1835-1843.












 uBio
uBio