Saber
versão impressa ISSN 1315-0162
Saber vol.27 no.1 Cumaná mar. 2015
Aceite esencial de Wedelia calycina (ASTERACEAE): composición química, actividad antibacteriana y antifúngica
Essential oil of Wedelia calycina (ASTERACEAE): chemical composition, antibacterial and antifugal activities
Hellen Yandri Bruzual Villarroel1, Willian Henríquez Guzmán1, Oscar Crescente1, José Gregorio Lanza2
1 Universidad de Oriente, Núcleo de Sucre, Escuela de Ciencias, Departamento de Química, Laboratorio de Productos Naturales, Cumaná, Venezuela,
2 Instituto Nacional de Nutrición, Laboratorio de Análisis Fisicoquímicos y Espectrométricos. Caracas, Venezuela E-mail: tuamorhelena@gmail.com / whenriquez66@gmail.com
RESUMEN
El aceite esencial de Wedelia calycina L.C. Rich fue extraído para evaluar su composición química, actividad antibacteriana y antifúngica. El aceite esencial fue obtenido por destilación de arrastre por vapor de las hojas y arrojó un rendimiento del 0,025%. Éste fue analizado por Cromatografía de Gases/Espectrometría de Masas (CG/EM), además de compararlo con los índices de retención de compuestos modelos. Fueron identificados 44 compuestos, entre los que están en mayor proporción: germacreno D (8,83%), 3,3,7,7-tetrametil-5-(2-metil- 1-propenil)-triciclo[4.1.0.0(2,4)] heptano (8,66%), β-sesquifelandreno (7,87%), óxido de cariofileno (5,10%) y (+)-octahidro-4,8,8,9-tetrametil-1,4-metanoazulen-7(1H)-ona (4,65%). Predominan los grupos de compuestos sesquiterpénicos hidrocarbonados (44,83%) y oxigenados (26,90%), seguido por monoterpenos (15,79%), y el 12,48% restante corresponde a compuestos alifáticos de baja masa molecular. El aceite esencial mostró actividad antibacteriana moderada contra Staphylococcus aureus, Bacillus subtilis, Micrococcus luteus y Klebsiella pneumoniae; se observó un efecto dosis-respuesta frente a Bacillus subtilis, y no ejerció actividad contra Escherichia coli ni Enterococcus faecalis. El aceite esencial no mostró actividad antifúngica sobre especies de hongos patógenos y fitopatógenos ensayados.
Palabras clave: Componentes volátiles, sesquiterpenos, germacreno D, actividad biológica.
ABSTRACT
Essential oil of Wedelia calycina L.C. Rich was investigated for its antibacterial and antifungal activities. The essential oil was obtained by drag through steam distillation of leaves with a yield of 0.025 %. It was analyzed by gas chromatography–mass spectrometry (GC-MS). Fourty four compounds were identified, the main ones being germacrene D (8.83%), 3,3,7,7-tetramethyl-5-(2-methyl-1-propenyl)-triciclo[4.1.0.0(2,4)] heptane (8.66%), β-sesquiphellandrene (7.87%), oxide of caryophyllene (5.10%) and 1,4-methaneazulen-7(1H)-ona,octahydro- 4,8,8,9-tetramethyl-, (+) (4.65). Sesquiterpenes hydrocarbons (44.83%) and oxygenated sesquiterpenes (26.90%) were the predominant groups of compounds. The dominant groups were sesquiterpene hydrocarbon (44.83%) and oxygenated (26.90%) compounds followed by monoterpenoid compounds (15.79%) and the remaining 12.41% were aliphatic low molecular mass compounds. Wedelia calycina essential oil exhibited moderate antibacterial activity against Staphylococcus aureus, Bacillus subtilis, Micrococcus luteus and Klebsiella pneumonia; showed a linear dose response against Bacillus subtilis, and no activity against Escherichia coli and Enterococcus faecalis. The essential oil showed no activity against the tested pathogenic or fito-pathogenic fungi.
Key words: Volatile components, sesquiterpenes, germacrene D, biological activity.
Recibido: junio 2014. Aprobado: diciembre 2014. Versión final: enero 2015.
INTRODUCCIÓN
Los aceites esenciales son sustancias odoríferas de naturaleza oleosa, muy numerosos y están ampliamente distribuidos en distintas partes del mismo vegetal (Cadby et al. 2002). Son componentes heterogéneos de terpenos, sesquiterpenos, ácidos, ésteres, fenoles olactonas; todos ellos fácilmente separables ya sean por métodos químicos o físicos, como la destilación, refrigeración, centrifugación, entre otros (Briga 1962). Suelen ser inocuos, mientras la dosis suministrada no supere los límites de toxicidad (Tripathi et al. 2009). Sufren degradación química en presencia de la luz solar, aire, calor o ácidos y álcalis fuertes, generando oligómeros de naturaleza indeterminada. Además son solubles en disolventes orgánicos comunes y casi inmiscibles en disolventes polares asociados (agua, amoniaco). Son aceptados como sustancias seguras (GRAS) por la Agencia de Drogas y Alimentos de los Estados Unidos de Norteamérica (FDA, por sus siglas en inglés) (CFR 2003).
Wedelia calycina L.C. Rich es una planta fanerógama perenne, de la familia de las Asteráceas, caracterizada por tener hojas con un olor distintivo. El género Wedelia posee 143 especies (Jiménez y Ruiz 1999), del cual, en Venezuela, se han aislado productos naturales de la especie Wedelia trilobata. Este género se caracteriza por biosintetizar kaurenos, compuestos diterpénicos que contienen un rígido esqueleto tetracíclico (Henríquez et al. 2002). De las hojas de W. trilobata, se aisló el ácido kaurénico (ent-kaur-16-en-19-oico), el cual ejerce actividad biológica contra Staphylococcus aureus, Bacillus cereus y Leishmania (V.) braziliensis (Campos-Bedolla et al. 1997, Tincual et al. 2002, Brito et al. 2006). La presencia de W. calycina sugiere que en el área donde habita pueden encontrarse los pájaros denominados como cardenalitos (Carduelis cucullata), especie de ave pequeña nativa de la zona norte de Venezuela, en peligro de desaparecer debido a que son capturados por los pobladores para mantenerlos como adorno en cautiverio (Rivero 2004).
Existen pocos estudios relacionados con los componentes volátiles del género Wedelia, uno de estos es el análisis del aceite esencial de W. paludosa contiene como componentes mayoritarios al α- y β-pineno, limoneno y γ-muuroleno (Craveiro et al. 1993). El aceite esencial de W. trilobata posee α-felandreno, germacreno D, limoneno, 1,5,5-trimetil-6-metilen-ciclohexeno y cariofileno (Donghai et al. 2012); asimismo, el aceite de W. calycina Rich. contiene mayoritariamente germacreno-D, β-cariofileno, cadina-1,4-dieno y fonenol (Buitrago et al. 2012). En este mismo sentido, el aceite esencial de la especie W. glauca presentó como compuestos mayoritarios al limoneno, sabineno, α-pineno (Bailac et al. 2005); y la especie W. chinensis α-pineno, espatulenol y limoneno (Garg et al. 2005). El objetivo de esta investigación fue determinar la composición química del aceite esencial de hojas de W. calycina L.C. Rich, recolectadas en la localidad de San Juan de Macarapana, Cumaná, estado Sucre, y evaluar su efecto antibacteriano y antifúngico.
MATERIALES Y MÉTODOS
Material vegetal
Hojas frescas de W. calycina L.C. Rich., se recolectaron en las zonas verdes de la localidad de San Juan de Macarapana, Cumaná, estado Sucre. Luego se trasladaron al Laboratorio de Productos Naturales del Departamento de Química, Núcleo de Sucre, de la Universidad de Oriente para su procesamiento. La identificación de la especie vegetal se realizó por comparación con especímenes depositados en el Herbario Isidro Ramón Bermúdez Romero del Departamento de Biología, Núcleo de Sucre, Universidad de Oriente, por el Prof. Luis J. Cumana.
Aislamiento del aceite esencial
Se siguió el procedimiento de destilación por arrastre con vapor sugerido por Pavia et al. (1988). Las hojas frescas (458 g) trituradas se colocaron en un balón de destilación, a las cuales se les hizo circular vapor de agua durante 4 horas, para obtener luego del condensado el agua enriquecida en el aceite esencial. El aceite obtenido después de extracción con n-hexano fue secado con sulfato de sodio anhidro y almacenado en la oscuridad bajo refrigeración a -20°C hasta su uso en los análisis de Cromatografía de Gases/ Espectrometría de Masas y ensayos biológicos.
Análisis de Cromatografía de Gases/Espectrometría de Masas
El análisis por cromatografía de gases fue realizado en un cromatógrafo de marca Agilent 7890 acoplado a un detector selectivo de masas Agilent 5975c (70eV). Se empleó una columna DB-5 de 30 metros de largo, 0,25 mm de diámetro y 0,25 μm de film. Se usó Helio como gas transportador con un flujo de 0,8 mL/min. Se inyectó 1μL de muestra disuelta en CHCl3. Se empleó como temperatura inicial 35°C (1 min) y luego se calentó a razón de 8°C/min hasta 280°C. El inyector se mantuvo a 200°C y el detector a 280°C. Se determinaron los índices de Kováts analizando conjuntamente la muestra con una mezcla de n-alcanos (C8 a C22) (Davies 1990, Adams 2001).
Análisis microbiológico
Cepas bacterianas
Escherichia coli (ATCC 25922), Staphylococcus aureus (IBE Doc-19), Enterococcus faecalis (WHO14), Bacillus subtilis (ICTA-07), Klebsiella pneumoniae (ATCC 10031), Micrococcus luteus (ATCC 4698).
Cepas fúngicas
Aspergillus niger, Rhizopus oryzae, Curvularia lunata, Penicillum hirsutum y P. expansus, como especies fitopatógenas y Candida albicans, como especie patógena, donados del Laboratorio de Micología del Departamento de Bioanálisis del Núcleo de Sucre, Universidad de Oriente, Cumaná, Venezuela.
Método antibacteriano
La actividad antibacteriana se evaluó mediante el ensayo de difusión en agar según la metodología de Erna (2002). Las cepas de las especies bacterianas se mantuvieron en cuñas de agar Müeller-Hinton a temperatura ambiente. Cada inóculo bacteriano se ajustó en solución salina fisiológica con un patrón Mac Farland de turbidez 0,5 (107 - 108 UFC/mL). La suspensión bacteriana fue inoculada en las placas de Petri contentivas de agar Müeller-Hinton, se impregnaron discos de papel de filtro Watman Nº 3 (6 mm) con 10 μL de una solución del aceite esencial en
h-hexano a la concentración deseada y se colocaron en las placas. Las placas se dejaron durante 12 horas a 5ºC en un refrigerador convencional, y luego incubadas a 37ºC durante 24 horas, la zona de inhibición alrededor del disco se determinó en mm. Las diluciones del aceite se prepararon en el rango de concentración entre 7-28 mg/mL (70 μg/ disco-280 μg/disco).Ensayo antifúngico
La actividad se valoró utilizando el método de difusión en agar. Las cepas de hongos se incubaron durante una semana a temperatura ambiente en tubos de vidrio con agar papa dextrosa (PDA por sus siglas en inglés) inclinado. Seguidamente, se le añadió a cada tubo 10 mL de agua destilada estéril, se agitó fuertemente y se filtró sobre gasa estéril. La suspensión esporangial obtenida de cada especie de hongo fue sembrada sobre cápsulas de Petri, previamente servidas con agar PDA. Finalmente, se colocaron sobre las placas con agar PDA los discos de papel de filtro, Whatman Nº 3, de 6 mm de diámetro previamente impregnados con la solución del aceite esencial, de concentración conocida (entre 7-28 mg/mL). Un control de crecimiento fue realizado por cada ensayo, colocando un disco impregnado con 10 μL de solvente en el cual se disolvió la muestra de aceite esencial. Finalmente, se incubó durante 48 horas a temperatura ambiente para permitir el normal crecimiento de las especies de hongos, luego, se midió la actividad antifúngica como el diámetro de halo de inhibición de la especie fúngica alrededor del disco (Erna 2002).
RESULTADOS Y DISCUSIÓN
El proceso de arrastre con vapor de agua de las hojas frescas de W. calycina genero 0,113 g de aceite esencial de color amarillo pálido a partir de 458 g de material vegetal, un rendimiento en masa del 0,025%. El rendimiento obtenido mediante destilación por arrastre con vapor de las partes aéreas de W. calycina fue menor en comparación con lo obtenido por Buitrago et al. (2012), quien reportó un rendimiento de 0,045% para el aceite esencial extraído mediante hidrodestilación con trampa de Clevenger; diferencia que debe estar relacionada con los métodos de extracción y el hábitat donde se recolectó la planta. Buitrago et al. (2012) recolectaron la muestra vegetal en la población de Calderas en el estado Barinas y la muestra empleada para esta investigación se recolectó en la localidad de San Juan de Macarapana, sector La Última, estado Sucre.
Análisis de CG/EM
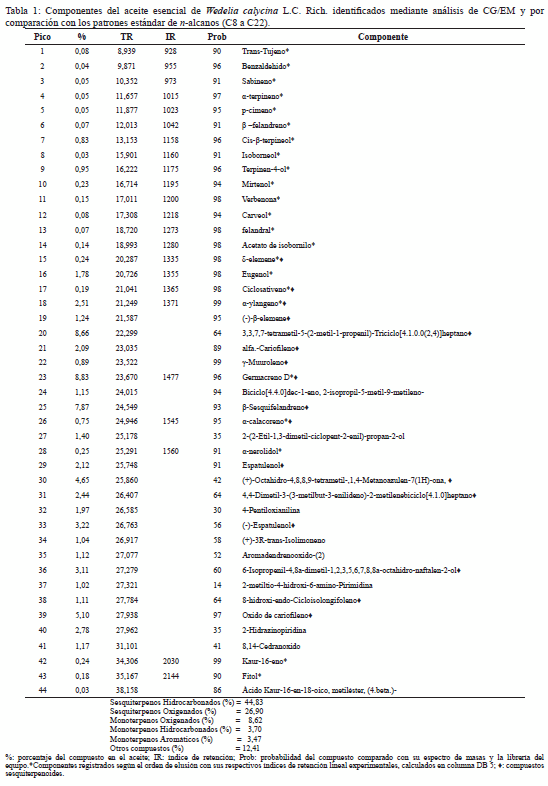
El análisis por CG/EM del aceite esencial permitió identificar mediante comparaciones de los índices de retención (IR) y tiempo de retención (TR) con los obtenidos de patrones certificados, además de comparaciones de los espectros de masas con los obtenidos de librerías de la base de datos de espectros NIST05a.L. En total se identificaron 44 componentes, por la base de datos NIST05a.L del equipo, 23 de estos fueron confirmados por sus índices de retención experimentales con los de un patrón certificado de una mezcla de n-alcanos (C8 a C22), dichos componentes se muestran en la Tabla 1.
De acuerdo a su consistencia y composición química el aceite esencial de las hojas de W. calycina, es una esencia fluida, abundante en componentes sesquiterpenoides (71,73%); entre estos predominan los sesquiterpenos hidrocarbonados (44,83%) y los sesquiterpenoides oxigenados (26,90%). En menor proporción están presentes los monoterpenoides (15,79%); distribuidos entre compuestos oxigenados (8,62%), hidrocarbonados (3,70%) y aromáticos (3,47%). El 12,48% restante lo componen compuestos alifáticos de baja masa molecular, algunos alcanos, alcoholes, aldehídos, cetonas, ésteres, ácidos y ciertas aminas (Tabla 1). Los sesquiterpenos más abundantes son germacreno D (8,83%); 3,3,7,7-tetrametil- 5-(2-metil-1-propeniltriciclo[4.1.0.0(2,4)]heptano, (8,66%); β-Sesquifelandreno, (7,87%) y óxido de cariofileno (5,10%). De los componentes monoterpénicos el (+)-trans-isolimoneno es el que se encuentra en mayor proporción (1,04%), seguido por el terpinel-4-ol (0,95%) y el cis-β-terpineol (0,83%).
En correlación con esta investigación, los resultados de la caracterización química obtenidos por Buitrago et al. (2012) para el aceite esencial de esta misma especie vegetal, recolectada en la población de Calderas, estado Barinas, muestra que está constituido mayoritariamente de compuestos sesquiterpénicos (95,88%); siendo germacreno-D (49,48%), β-cariofileno (23,94%), cadina-1,4-dieno (4,56%) y fonenol (3,94%), los principales componentes identificados. Al comparar los resultados de los especímenes recolectados en los llanos venezolanos con los obtenidos de los recolectados en el oriente venezolano (objeto de esta investigación), puede deducirse que ambos aceites están constituidos mayoritariamente por compuestos sesquiterpénicos, hidrocarbonados y oxigenados, siendo el germacreno D el componente más abundante en los dos aceites, aunque la diferencia en términos porcentuales es notable. Es conocido que el germacreno D juega un papel importante como precursor de muchos otros sesquiterpenos, de allí probablemente la existencia de sesquiterpenos tales como cadinenos y selinenos (Bülow y König 2000, Telascrea et al. 2007).
Es importante destacar que de la investigación realizada por Buitrago et al. (2012), se reporta una composición de 95,88% de sesquiterpenos en el aceite, mientras que para este estudio solo se obtuvo un rendimiento de 71,73% de esta familia de compuestos, esta diferencia puede deberse a que en el método empleado por Buitrago et al. (2012) la cantidad de compuestos químicos de baja masa molecular extraídos se ve disminuida debido a que el material vegetal se encuentra en contacto directo con la fuente de calor y estos compuestos son tan volátiles que no tienen oportunidad de condensarse en el sistema refrigerante sino que en su mayoría se pierden por evaporación. No obstante, mediante la técnica de arrastre con vapor de agua el material vegetal no se coloca directamente al calor, es el vapor de agua quién arrastra de alguna manera con los componentes presentes en la muestra vegetal; ya sean muy volátiles o medianamente volátiles, puesto que el calor aplicado no es tan excesivo.
Los compuestos terpénicos vegetales a menudo han sido reportados como defensas anti-herbívoros (Langenheim 1994). También, se ha sugerido que el germacreno D por sí mismo puede tener efectos disuasorios contra herbívoros, además de ejercer actividad insecticida contra mosquitos (Kiran y Devi 2007), así como efecto repelente contra áfidos (Bruce et al. 2005) y garrapatas (Birkett et al. 2008).
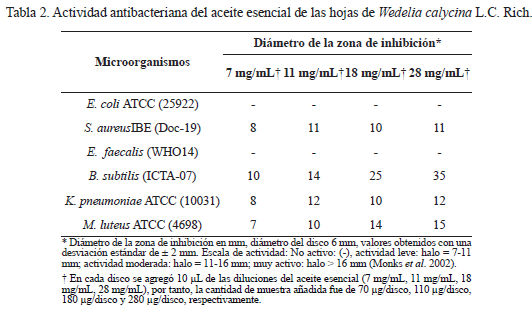
La actividad antibacteriana del aceite esencial fue evaluada contra bacterias Gram positivas y Gram negativas. Estos microorganismos son morfológica y fisiológicamente diferentes, por lo que los resultados obtenidos son representativos de la actividad antibacteriana del aceite y de las características estructurales de los microorganismos. Los resultados mostraron que el aceite esencial de las hojas de W. calycina es activo contra las bacterias Gram positivas, S. aureus, B. subtilis, M. luteus y sólo contra la Gram negativa K. pneumoniae. Contrariamente el aceite obtenido fue inactivo contra E. coli y E. faecalis (Tabla 2).
En este bioensayo antibacterial, el aceite esencial fue activo a concentraciones entre 7 y 28 mg/mL (70-280 μg/disco), para inhibir el crecimiento de las bacterias Gram positivas S. aureus, B. subtilis, M. luteus, y la Gram negativa K. pneumoniae. Contra la bacteria Gram positiva B. subtilis se observó una marcada relación entre la concentración del aceite y la inhibición del crecimiento de ésta: a una concentración de 7 mg/mL (70 μg/disco) tiene un halo de inhibición de 10 mm, a 11 mg/mL (110 μg/disco) el diámetro aumentó 14 mm, a 18 mg/mL (180 μg/disco) se observó un diámetro de inhibición de 25 mm y a 28 g/mL (280 μg/disco) el diámetro fue de 35 mm.
En alusión a la inhibición del crecimiento de las bacterias S. aureus y K. pneumoniae, el diámetro del halo generado se mantuvo prácticamente dentro de un rango de valores constante, es decir no fue posible apreciar una relación concentración/actividad significativa, halos de inhibición promedio de 10 mm. La inhibición del crecimiento de la bacteria M. luteus por acción del aceite esencial, a diferentes concentraciones, exhibió una relación relativamente significativa dependiente de la concentración, con diámetros de 7, 10, 14 y 15 mm a medida que la concentración aumentó de 7, 11, 18 y 25 mg/ mL, respectivamente. Contra E. coli y E. faecalis el aceite esencial fue inactivo. El efecto más notorio se evidenció sobre la especie B. subtilis (diámetros con valores de 10 a 35 mm), la relación entre la concentración del aceite esencial y la zona de inhibición del crecimiento de B. subtilis, permite inferir que las características adaptativas de esta bacteria para adecuarse a las condiciones de este ambiente no fue lo suficientemente resistente para sobreponerse a la acción ejercida por el aceite esencial obtenido de las hojas de W. calycina L.C. Rich, pues a mayor concentración de éste menor crecimiento de B. subtilis, observándose mayor halo de inhibición a las concentraciones más altas, en la tabla 2 se pueden detallar estos resultados.
La especie bacteriana B. subtilis está considerada como un saprófito y no patógeno para el humano, sin embargo es capaz de contaminar algunos alimentos, raramente causa intoxicación alimentaria, pero sus esporas tienen la capacidad de sobrevivir a altas temperaturas, complicando así su eliminación (Madigan 2005). Además, tiene facultad para formar endosporas de gran resistencia, que le proporcionan una gran ventaja para subsistir en condiciones extremas. Este carácter le confiere a estas células una clasificación entre las más resistentes del planeta (Fajardo y Nicolson 2006). Normalmente estas bacterias crecen a pH alrededor de 7-7,4, y entre 12-45ºC; pero tiene la capacidad de adaptarse a las condiciones que estén a su alrededor, reflejando la configuración correspondiente, ya sea en su forma vegetativa o latente (Madigan 2005). De allí la importancia de este aceite esencial, puesto que posee componentes capaces de ejercer un marcado efecto contra esta especie bacteriana.
Los resultados obtenidos de este bioensayo indicaron que el aceite esencial tiene propiedades antibacterianas, sugiriendo que uno o más de los componentes del aceite producen efecto contra las bacterias S. aureus, B. subtilis, M. luteus y K. pneumoniae. El aceite esencial evidenció una relación dosis/respuesta frente a B. subtilis, y no exhibió actividad contra E. coli y E. faecalis. El aceite esencial no mostró actividad frente a los hongos, patógenos y fitopatógenos ensayados.
CONCLUSIONES
El aceite esencial obtenido de las hojas frescas de W. calycina es una esencia fluida rica en compuestos sesquiterpenoides, de los cuales, el más abundante fue el germacreno D, siendo éste un constituyente frecuente en especies de Wedelia. Los resultados de la bioactividad indicaron que el aceite esencial tiene propiedades antibacterianas, contra las bacterias S. aureus, B. subtilis, M. luteus y K. pneumoniae. No exhibió actividad contra E. coli y E. faecalis. Tampoco mostró actividad frente a los hongos, patógenos y fitopatógenos ensayados.
REFERENCIAS BIBLIOGRÁFICAS
1. Adams RP. 2001. Identification of Essential Oils by Gas Chromatography/Quadrupole Mass Spectroscopy. Allured: Carol Stream, Illinois, USA, pp. 469. [ Links ]
2. Bailac PN, Dellacasa AD, Ponzi MI, Firpo NH. 2005. Essential oil composition of Wedelia glauca (Ort.) Hoffman ex Hicken from Argentina. J. Essent. Oil Res. 17(4):401-402. [ Links ]
3. Birkett MA, Al Abassi S, Krober T, Chamberlain K, Hooper AM, Guerin PM, Pettersson J, Pickett JA, Slade R, Wadhams LJ. 2008. Antiectoparasitic activity of the gum resin, gum haggar, from the East Africa plant, Commiphora holtziana. Phytochem. 69(8):1710-1715. [ Links ]
4. Briga J. 1962. Los aromáticos en la industria moderna. 2ª edición. Editorial Sintes, Barcelona, España, pp. 323.
5. Brito M, Crescente O, Fernández A, Coronado A, Rodríguez N. 2006. Eficacia de un ácido kaurénico extraido de la planta venezolana Wedelia trilobata (Asterácea) contra Leishmania (Viannia) braziliensis. Biomédica. 26(Supl. 1):180-187.
6. Bruce TJA, Birkett MA , Blande J, Hooper AM , Martin JL, Khambay B, Prosser I, Smart LE , Wadhams LJ. 2005. Response of economically important aphids to components of Hemizygiapetiolata essential oil. Pest Manag. Sci. 61(11):1115-1121.
7. Buitrago D, Morales A, Rojas L, Meléndez P. 2012. Estudio de los componentes volátiles de Wedelia calycina Rich. (Asteraceae). Rev. Fac. Farm. (ULA). 54(1):3-6.
8. Bülow N, König WA. 2000. The role of germacrene D as a precursor in sesquiterpene biosynthesis: Investigation of acid catalyzed, photochemically and thermally induced rearrangements. Phytochem. 55(2):141-168.
9. Cadby PA, Troy WR, Middleton JD, Matthias GH. 2002. Fragrances: are they safe? Flavour Fragr. J. 17(6):472-477.
10. Campos-Bedolla P, Campos M, Valencia-Sánchez A, Ponce Montero H, Uribe C, Osuna L, Calderón J. 1997. Inhibitory action of kaurenoic acid derivatives from Montana tormentosa (Asteracea) on acetylcholine, oxytocin and serotonin induced rat uterine contractions. Phytother. Res. 11(1):11- 16.
11. CLSI (Clinical and Laboratory Standars Institute). 2007. Performance standars for antimicrobial susceptibility testing; Sixteenth informational supplement. CLSI document M100-S17 [ISBN 1-56238-625-5]. Clinical and Laboratory Standars Institute, Wayne, Pennsylvania, USA.
12. CFR (Code of Federal Regulations). 2003. Code of Federal Regulations U.S. Government Printing Office. Title 21, Vol. 3, Chapter I, Part 182, Subpart A, 456-460.
13. Davies NW. 1990. Gas chromatographic retention indices of monoterpenes and sesquiterpenes on methyl silicon and Carbowax 20M phases. J. Chromatogr. A. 503:1-24.
14. Donghai L, Zhenyi L, Mofei G, Jing Z, Xiaobo Y, Jing X. 2012. Study on the chemical composition and extraction technology optimization of essential oil from Wedelia trilobata (L). Hitchc. Afr. J. Biotechnol. 11(20):4513-4517.
15. Erna CT. 2002. Condiciones para un buen estudio de susceptibilidad mediante test de difusión en agar. Rev. Chil. Infect. 19(Supl. 2):S77-81.
16. Craveiro A, Matos F, Alencar J, Machado M, Krush A, Silva M. 1993. Volatile constituents of two Wedelia Species. J. Essent. Oil Res. 5(4):439-441.
17. Fajardo CP, Nicolson W. 2006. Bacillus endospores isolated from granite: close molecular relationships to globally distributed Bacillus spp. from endolithic and extreme environments. Microbiol. Cell Sci. 72(4):2856-2863.
18. Garg S, Gupta D, Jain S. 2005. Volatile Constituents of the Aerial Parts of Wedelia chinensis Merrill., from the North Indian Plains. J. Essent. Oil Res. 17(4):364-365.
19. Henríquez W, Crescente O, Arrieche D, Marchan E. 2002. Biological activities of a kaurenic acid isolated from Wedelia trilobata. Nat. Prod. Ress. Mill. A. 2:38.
20. Jiménez S, Ruiz T. 1999. Las especies venezolanas del género Wedelia Jacq (Asteraceae). Maracay: Universidad Central de Venezuela, Facultad de Agronomía (Disertación Maestría), pp.130.
21. Kiran SR, Devi PS. 2007. Evaluation of mosquitocidal activity of essential oil and sesquiterpenes from leaves of Chloroxylons wietenia DC. Parasitol. Res. 101(2):413-418.
22. Langenheim JH. 1994. Higher plant terpenoids: A phytocentric overview of their ecological roles. J. Chem. Ecol. 20(6):1223-1280.
23. Madigan MMJ. 2005. Brock Biology of Microorganisms (11th ed.). Prentice Hall, USA, pp.1152.
24. Monks N, Lerner C, Henríques A, Farias F, Schapoval E, Suyenaga E, Da Rocha A, Schwartsmann G, Mothes B. 2002. Anticancer, antichemotactic and antimicrobial activities of marine sponges collected off the coast of Santa Catarina, southern Brazil. J. Exp. Mar. Biol. Ecol. 281:1-12.
25. Pavia DL, Lampman GM, Kriz GS. 1988. Introduction to Organic Laboratory Techniques. Saunders College Publishing, Fort Worth, USA.
26. Rivero A. 2004. El Cardenalito (Carduelis cucullata). Ecología y comportamiento en la Región Centro Occidental Barquisimeto-Venezuela. Segunda Edición. Vicerrectorado de Investigación y Postgrado UPEL. Barquisimeto, Venezuela, pp. 200.
27. Telascrea M, de Araújo CC, Marques MOM, Facanali R, de Moraes PLR , Cavalheiro AJ. 2007. Essential oil leaves of Cryptocarya mandioccana Meisner (Lauraceae): Composition and intraspecific chemical variability. Biochem. Syst. Ecol. 35(4):222-232.
28. Tincual BM, Jimenez IA, Bazzochi IL, Moujir LM, Mamani ZA, Barroso JP, et al. CITAR EL RESTO DE LOS AUTORES. 2002. Antimicrobial terpenoids from the oleoresin of the Peruvian medicinal plant Copaifera paupera. Plant Med. 68(9):808-812.
29. Tripathi A, Upadhy ay S, Bhuiyan M, Bhattacharya P. 2009. A review on prospectsof essential oils as biopesticide in insect-pest management. J. Pharmacognosy Phytother. 1(15):52-63.












 uBio
uBio