Saber
versión On-line ISSN 2343-6468
Saber vol.28 no.1 Cumaná abr. 2016
PREVALENCIA DEL COMPLEJO Entamoeba spp. EN NIÑOS Y ADOLESCENTES DE VARIOS MUNICIPIOS DEL ESTADO ZULIA, VENEZUELA
ZULBEY RIVERO-RODRÍGUEZ1, ANGELA BRACHO1, RICARDO ATENCIO2, ISMAEL URIBE1, RAFAEL VILLALOBOS3
Universidad del Zulia, Facultad de Medicina, 1 Escuela de Bioanálisis, Cátedra Práctica Profesional de Parasitología, 2 Ciencias Básicas y Aplicadas, 3 Escuela de Medicina, Maracaibo, Venezuela. E-mail: zulbeyrivero@gmail.com
RESUMEN
Actualmente, la forma correcta de informar con base al examen microscópico fecal la presencia de formas evolutivas compatibles con Entamoeba histolytica, es complejo Entamoeba spp., ya que morfológicamente no se puede distinguir entre sus integrantes (E. histolytica, E. dispar y E. moshkovskii). Para determinar la prevalencia de este complejo, se obtuvo una muestra fecal de 302 individuos, de uno u otro sexo, entre 0 y 19 años de edad de siete municipios del estado Zulia, Venezuela. Las muestras fecales se procesaron mediante examen coproparasitológico in situ, y posteriormente todas las muestras fueron sometidas al método de concentración de formol-éter (Ritchie). El 74,2% (224/302) de los individuos estaban parasitados, con predominio del poliparasitismo (85,8%), con predominio de las protozoosis/cromistas sobre las helmintiasis. Resultaron 69 individuos (22,8%) con formas evolutivas del complejo Entamoeba spp. Se observó predominio de eliminación de formas quísticas en las muestras estudiadas 50/69 (72,5%), 15 individuos presentaron tanto quistes como trofozoítos (21,7%). Solo se detectaron trofozoítos del complejo en cuatro individuos (5,8%); incluyendo trofozoítos hematófagos, típicos de E. histolytica, en uno de ellos. No se encontró diferencia significativa al evaluar la prevalencia del complejo Entamoeba con el sexo, ni con la edad (p > 0,05); aunque el mayor porcentaje de casos se detectó entre los 2 y 14 años. Entamoeba coli y Endolimax nana fueron los microorganismos asociados en forma significativa al complejo Entamoeba spp. Se concluye que la infección por los integrantes del complejo Entamoeba spp. es endémica en niños y adolescentes de diversas comunidades del estado Zulia.
PALABRAS CLAVE: Entamoeba histolytica, Entamoeba dispar, Entamoeba moshkovskii, parásitos intestinales.
PREVALENCE OF Entamoeba spp. COMPLEX IN CHILDREN AND TEENAGERS IN SEVERAL MUNICIPALITIES IN ZULIA STATE, VENEZUELA
ABSTRACT
Currently, the correct way to report the presence of evolutionary forms compatible with Entamoeba histolytica, based on faecal microscopic examination, is the complex Entamoeba spp., since it is not possible to distinguish morphologically among its members (E. histolytica, E. dispar and E. moshkovskii). To determine the prevalence of this complex, one faecal sample was obtained from 302 individuals, male or female, between 0 and 19 years of age in seven municipalities of Zulia state, Venezuela. Faecal samples were processed by in situ coproparasitological examination, and then all samples were subjected to the concentration method with formalin-ether (Ritchie). An estimate of 74.2% (224/302) of individuals examined were parasitized. Multiparasitism was prevalent (85.8%) but protozoan/chromistas infections predominate over helminths. Sixty nine individuals (22.8%) showed evolutionary forms compatible with the complex Entamoeba spp. A predominance of cystic forms in the studied samples was observed in 50/69 (72.5%) individuals, 15 of them had both cysts and trophozoites (21.7%). Trophozoites were only detected in four individuals (5.8%), including hematophagous trophozoites typical of E. histolytica in one individual. There were no statistically significant differences in the prevalence of Entamoeba complex based on sex or age (p > 0.05); although the highest percentage of cases was detected between 2 and 14 years. Endolimax nana and Entamoeba coli were the microorganisms significantly associated to Entamoeba spp. complex. We conclude that infection by members of the complex Entamoeba spp. is endemic in children and teenagers of diverse communities of Zulia state.
KEY WORDS: Entamoeba histolytica, Entamoeba dispar, Entamoeba moshkovskii, intestinal parasites.
Recibido: marzo 2015.Aprobado: septiembre 2015 Versión final: febrero 2016
INTRODUCCIÓN
Entamoeba histolytica es el protozoo causante de la amibiasis humana. Esta enfermedad afecta al 10% de la población mundial, es frecuente en países subdesarrollados con clima tropical y es responsable aproximadamente de 100 mil muertes por año en el mundo (WHO 1997). Las personas infectadas se dividen en dos grupos de acuerdo a sus manifestaciones clínicas: 90% son asintomáticos (portadores sanos) y 10% son sintomáticos. Pueden causar a nivel intestinal, disentería amibiana, rectocolitis aguda, colitis no disentérica crónica, ameboma; y a nivel extraintestinal absceso hepático, pulmonar, cerebral, esplénico, enfermedad pleuropulmonar, genitourinaria y cutánea (López et al. 2008).
Desde la primera descripción de la amibiasis, se desarrollaron una serie de eventos que provocaban dudas sobre la patogenicidad de E. histolytica y argumentaban la probable existencia de otra amiba intestinal morfológicamente idéntica a ella, pero biológicamente no patógena. Diamond y Clark (1993) con base en estudios genómicos, bioquímicos e inmunológicos, demostraron la existencia de dos especies, una patógena (E. histolytica) y una comensal (E. dispar). Más recientemente, varios trabajos publicados en los últimos años han indicado que E. moshkovskii puede causar infección en humanos. Esta especie se conocía anteriormente como E. histolytica variedad Laredo (Clark y Diamond 1991) y se consideraba como una amiba de vida libre, que raramente infectaba a humanos, mostrando como particularidad su capacidad para crecer a temperatura ambiente. Sin embargo, estudios actuales realizados en varios países, en los que se emplearon herramientas moleculares para el diagnóstico en humanos, revelan una prevalencia de E. moshkovskii que varía entre 2,2 y 61,8% (Fotedar et al. 2007, 2008, Beck et al. 2008, Hamzah et al. 2010, Nazemalhosseini et al. 2010, Ngui et al. 2012, Elbakri et al. 2013).
En la amibiasis intestinal, el diagnóstico habitual de laboratorio se fundamenta en el estudio microscópico de la materia fecal, el cual tiene la gran limitación de no diferenciar entre E. histolytica, E. dispar y E. moshkovskii. Ante esta dificultad técnica en el informe del examen microscópico fecal, se propone denominar la presencia de estructuras compatibles con E. histolytica, como complejo Entamoeba (Fotedar et al. 2008, Sard et al. 2011). De esta manera quedará a criterio del médico correlacionar con la clínica del paciente, para determinar si el mismo está infectado por una Entamoeba patógena (E. histolytica) o no patógena (E. dispar/E. moshkovskii) y aplicar el tratamiento terapéutico cuando corresponda.
Las técnicas diagnósticas de detección de ácidos nucleicos, en especial la reacción en cadena de la polimerasa (PCR), han mostrado una gran utilidad en la caracterización de diversas infecciones, y son de vital importancia para la diferenciación de estas tres especies de amibas (Fotedar et al. 2007, Hamzah et al. 2010, Elbakri et al. 2013). También se han propuesto métodos de ELISA para la detección de antígenos específicos de E. histolytica en muestras fecales (coproantígenos), con resultados aceptables para la detección de la amibiasis intestinal (Haque et al. 1995, 1998, Evangelopoulos et al. 2001). Sin embargo, todos estos procedimientos, por ser técnicas laboriosas y/o costosas, no se realizan de rutina en los laboratorios clínicos de la red hospitalaria pública del país.
Aunque la infección por las especies del complejo Entamoeba spp. puede estar presente en individuos de todas las edades, existen algunos grupos más susceptibles. Los niños y las comunidades indígenas en general forman parte de estos grupos. Mora et al. (2005) evaluaron la presencia del complejo en individuos de Cumaná, región nor-oriental de Venezuela y detectaron asociación estadísticamente significativa del complejo con la edad, ubicándose el mayor número de infectados entre los 10 y 19 años. Varias investigaciones efectuadas en comunidades indígenas del estado Zulia (región nor-occidental del país) también refieren cifras importantes del complejo Entamoeba en estos individuos (Díaz et al. 2006, Rivero et al. 2007, Bracho et al. 2014).
A nivel internacional se han señalado cifras variables del complejo Entamoeba, muchos de los cuales se han obtenido mediante examen microscópico de la muestra fecal; 2,9% en Australia (Fotedar et al. 2007), 7% en Tanzania (Beck et al. 2008), 17,6% en Malasia (Ngui et al. 2012), 19,2% en Emiratos Árabes (Elbakri et al. 2013). Particularmente en Latinoamérica, una investigación realizada en México refiere una prevalencia de 12,8% del complejo Entamoeba en individuos de comunidades rurales (Ramos et al. 2005); así mismo Gatti et al. (2002), refieren 27% de prevalencia en un área rural de Ecuador. En Venezuela, Mora et al. (2005), señalan una prevalencia del 16% en individuos del estado Sucre; mientras que en el estado Zulia se ha informado prevalencia del 20% o más de infección por el complejo Entamoeba spp., dependiendo de la comunidad objeto de estudio (Díaz et al. 2006, Rivero et al. 2009a, Bracho et al. 2013a).
Para contribuir con las estadísticas regionales sobre la prevalencia actual del complejo Entamoeba spp. a nivel del estado Zulia (occidente de Venezuela), se efectuó este estudio en niños y adolescentes de varios municipios, principalmente en comunidades de alto riesgo para la infección por estas amibas.
MATERIALES Y MÉTODOS
Área de estudio, universo y muestra
Se escogieron para el estudio comunidades consideradas de bajos recursos socioeconómicos y malas condiciones higiénicas dentro de cada municipio (zonas rurales y/o marginales), según referencias previas (Maldonado et al. 2008, Rivero et al. 2009b, Cabrera 2011). El muestreo fue realizado desde febrero 2012 a diciembre 2013, mediante jornadas médicas desarrolladas en cada comunidad de siete municipios del estado Zulia (9°50’N-72°15’O), Venezuela. El clima zuliano es cálido, con una temperatura promedio anual de 27,8°C en las tierras bajas y con temperaturas templadas y hasta frías en las vertientes occidentales de la Sierra de Perijá. Las precipitaciones oscilan entre los 300 mm. en La Guajira y los 4.500 mm anuales en la Misión de El Tokuko, al suroeste del estado, en la Sierra de Perijá (Anónimo 2015).
Utilizando técnica de muestreo no probabilístico y voluntario se incluyeron en el estudio, sin distinción de género, niños y adolescentes de las siguientes comunidades: Nazaret del municipio Mara (35), Isla Maraca de Almirante Padilla (23), Laguna de Sinamaica y Alitasía de Páez (49), Encontrados de Catatumbo (47), La Concepción de Jesús Enrique Lossada (14), Toromo de Machiques de Perijá (76) y Caja Seca de Sucre (58). Se obtuvieron 302 muestras fecales, los individuos fueron clasificados en diferentes grupos etarios, según Quintero (2001) y Cuminsky et al. (1994) de la siguiente manera: Lactantes menores y mayores (1-23 meses), Preescolares (2-6 años), Escolares (7-14 años) y Adolescentes (15-19 años).
Se obtuvo información clínico-epidemiológica de los individuos estudiados, solo en la comunidad yukpa de Toromo; donde un médico pudo realizar examen clínico y anamnesis orientada; así como el llenado de la encuesta epidemiológica.
Consideraciones bioéticas
Previo a la recolección de las muestras, se solicitó la colaboración voluntaria de la población y de las autoridades recalcándose la confidencialidad del estudio. Se realizó un plan de acción que incluyó actividades de promoción y prevención sobre parasitosis intestinales. En las comunidades indígenas se obtuvo la aprobación del cacique (comunidad Toromo, municipio Machiques y Alitasía, municipio Páez). Se siguieron las normas de bioética establecidas en la Declaración de Helsinski de la Asociación Médica Mundial en su versión adoptada en la LII Asamblea General de Edimburgo (WMA 2008). Se proporcionó un “Consentimiento Informado”, en el que quedó asentado por escrito el deseo de colaborar voluntariamente; en el caso de menores de edad lo firmaron sus representantes.
Diagnóstico parasitológico
De cada individuo se obtuvo mediante evacuación espontánea una muestra de heces, que fue recolectada por ellos mismos con un depresor de plástico desechable, y se colocó en un recipiente hermético ad hoc, previamente identificado. Una porción de cada muestra fecal se procesó parasitológicamente por el método coprológico directo con solución salina y lugol en el sitio de recolección. En caso de detectar trofozoítos de amibas, se sometieron a la coloración temporal de azul de metileno amortiguado a los fines de identificar género/especie con base en sus características nucleares. Posteriormente, al resto de la muestra se le agregó formol-salino para ser transportadas en cavas de anime al Laboratorio de Parasitología de la Escuela de Bioanálisis de la Universidad del Zulia (LUZ), donde se sometieron a la técnica de concentración de formol-éter (Botero y Restrepo 2003). Los trofozoítos y quistes fueron identificados como formas evolutivas del complejo Entamoeba spp. (E. histolytica/dispar/moshkovskii) con base en su forma, tamaño, número y características nucleares, según los criterios descritos por Alger (1998).
Análisis estadístico
Se utilizó el Ji cuadrado (χ 2) con corrección de Fisher, para el análisis de la significancia entre la prevalencia del complejo Entamoeba spp., género y grupos etarios. Para establecer la afinidad entre pares de especies parasitarias dentro de un mismo hospedador (complejo Entamoeba y otros taxones) se calculó el Indice de Fager (IAB) y posteriormente una prueba de t para determinar significancia (Morales y Pino 1987). Para efectuar los cálculos se utilizó el programa SPSS versión 10. Se tomó el 95% como índice de confiabilidad estadística y se consideró significativa toda p ≤ 0,05.
RESULTADOS
Se estudiaron 302 individuos, siendo el más joven de 6 meses y el mayor de 19 años, la mediana de la edad fue de 6 ± 4,2 años. Con relación al género participaron en el estudio, 165 hembras (54,6%) y 137 varones (45,4%). Los análisis coproscópicos revelaron una prevalencia global de parásitos intestinales de 74,2% (224/302). Se diagnosticaron 13 enteroparásitos, donde los más frecuentes fueron los protozoarios/cromistas (Tabla 1). El cromista Blastocystis spp. fue el taxón más frecuentemente observado en 42,7% de los casos; mientras que Ascaris lumbricoides (38,7%) fue el helminto que presentó la mayor prevalencia.
Del total estudiado, resultaron 69 individuos con presencia del complejo Entamoeba spp. en sus muestras fecales (22,8%). Al evaluar las formas evolutivas presentes, predominó la eliminación de formas quísticas en las muestras (50/69 = 72,5%), 15 individuos presentaron tanto quistes como trofozoítos en sus heces (15/69 = 21,7%). Solo se detectaron trofozoítos del complejo en cuatro individuos (4/69 = 5,8%); incluyendo trofozoítos hematófagos, típicos de E. histolytica, en uno de ellos (1/69 = 1,4%).
El monoparasitismo se presentó en 14% de los individuos estudiados, con predominio de Blastocystis spp. como único microorganismo presente. En el caso de las infecciones múltiples (89%), se detectaron personas hasta con 11 taxones parasitarios distintos, siendo el biparasitismo la asociación predominante con un 18%.
En la Tabla 2 se presenta la prevalencia del complejo Entamoeba spp. según género y grupos etarios estudiados, donde se aprecia que no se determinó diferencia estadísticamente significativa en la presencia del complejo para ambas variables (para sexo χ 2 = 1,037; p = 0,390 y para edad χ2 = 6,116; p =0,106).
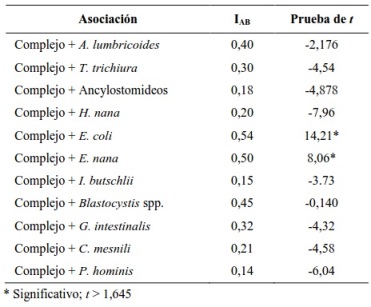
Al evaluar los taxones parasitarios asociados al complejo Entamoeba spp. (Tabla 3), se detectó una asociación estadísticamente significativa (t >1,64) con Entamoeba coli y Endolimax nana, más no con el resto de los helmintos y protozoarios identificados.
Tabla 1. Prevalencia de parásitos/cromistas intestinales en niños y adolescentes de varios municipios del estado Zulia, Venezuela.
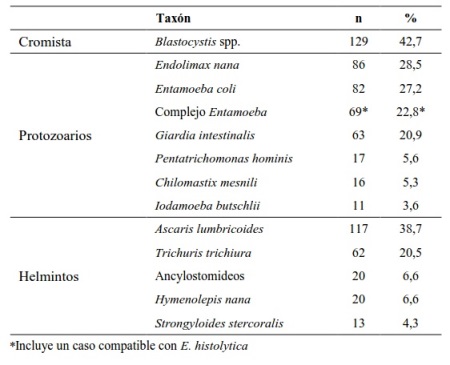
Tabla 2. Presencia del complejo Entamoeba spp. por género y grupo etario, en niños y adolescentes de varias comunidades del estado Zulia, Venezuela. 

DISCUSIÓN
La prevalencia total del complejo Entamoeba spp. obtenida en este estudio fue del 22,8%, este valor es ligeramente mayor al señalado con anterioridad por otros investigadores en niños y jóvenes del estado Zulia: Rivero et al. 2001 (15,7%), Rivero et al. 2009b (18,81%), Acurero et al. 2013 (9%). Probablemente nuestra cifra obedece a que los individuos evaluados, vivían en peores condiciones que los incluidos en los referidos estudios, además de que se incluyeron dos comunidades indígenas remotas. En las comunidades indígenas zulianas la prevalencia del complejo tiende a ser mayor, Bracho et al. (2014) refieren 21,98% y 23,68% de prevalencia en yukpas, al comparar los años 2002 y 2012 respectivamente. De igual forma Maldonado et al. (2008), estudiaron indígenas Japrería y Añus, detectando 34,52% y 26,85% de prevalencia del complejo Entamoeba.
Esto claramente indica que el complejo es bastante frecuente en diversas comunidades del estado Zulia. En otras latitudes también se han encontrado valores altos del complejo; Hooshyar et al. (2012), refieren una prevalencia de 1 a 30% de E. histolytica/dispar en diferentes partes de Irán. Sin embargo, a nivel nacional existen datos de cifras más bajas del complejo Entamoeba. Mora et al. (2005) señalan 16% al estudiar individuos con síntomas gastrointestinales en Cumaná, estado Sucre; así mismo Devera et al. (2014) refieren cifras bajas de este parásito en comunidades rurales del estado Anzoategui (0,6%).
Es difícil analizar los resultados emitidos por los organismos gubernamentales. El Ministerio del Poder Popular para la Salud (MPPS) notificó 110.015 casos de amibiasis durante el año 2010, de los cuales el estado Zulia aportó 28.352 casos (MPPS 2011). Estos registros oficiales quizá no reflejen la realidad, pues el diagnóstico de la parasitosis en estos casos es eminentemente clínico y en muchas ocasiones no se corrobora la sospecha clínica con algún examen de laboratorio. Además para agravar la situación, mientras se siga utilizando únicamente el examen microscópico como técnica diagnóstica, la discriminación adecuada del agente causal (E. histolytica) será sumamente difícil, pues solo podrá identificarse como complejo Entamoeba spp. a nivel microscópico.
Por otro lado, el desconocimiento a nivel gubernamental de la existencia del complejo Entamoeba, no permite que se realicen las estadísticas de laboratorio de forma tal, que un renglón reúna los casos que se reportan como complejo Entamoeba spp. (quistes y trofozoítos no hematófagos) y en otro se coloquen aquellos casos reales de E. histolytica (trofozoítos hematófagos); por lo menos mientras se continúe trabajando con examen microscópico. Por tal motivo, actualmente todos los hallazgos se incluyen en la estadística como casos de E. histolytica, lo que realmente colabora en el sobrediagnóstico de la amibiasis.
En la investigación efectuada solo se detectó un caso de amibiasis intestinal invasiva, ya que el paciente eliminó exclusivamente trofozoítos hematófagos en su muestra fecal. Se trató de un niño yukpa de la comunidad de Toromo de 4 años de edad, que presentó diarrea con sangre sin moco y pérdida del apetito. Este diagnóstico fue confirmado inmunológicamente, al resultar positivo a la detección en suero de anticuerpos IgG contra E. histolytica (datos no mostrados aquí). Esta situación pareciera corroborar la premisa de que solo un bajo porcentaje de individuos parasitados por E. histolytica (10%) presentan síntomas clínicos intestinales y que aproximadamente el 2% al 20% revela manifestaciones extraintestinales (Urdaneta et al. 1998); el resto de los infectados por el parásito es generalmente asintomático.
Si comparamos el número de individuos infectados por el complejo Entamoeba en la comunidad de Toromo (18/76) y entre todos los individuos estudiados (69/302), donde solo un paciente demostró microscópicamente amibiasis invasiva (Chacín-Bonilla y Dikdan 1981); se evidencia la baja tendencia a producir cuadros sintomáticos invasivos en pacientes infectados por E. histolytica; mención aparte de que existe la posibilidad de que muchos de ellos sean portadores de E. dispar y/o E moshkovskii y no realmente de E. histolytica. Chacín-Bonilla et al. (1984), refieren solo dos casos de individuos con trofozoítos hematófagos al evaluar 258 personas en el municipio Urdaneta del estado Zulia; así mismo, solo dos casos de amibiasis invasiva al estudiar 327 individuos del municipio Mara, del mismo estado (Chacín-Bonilla et al. 1990).
La mayoría de los individuos parasitados con el complejo Entamoeba eliminó quistes, lo cual sugiere que en el caso de que realmente sean portadores de E. histolytica, probablemente se trate de portadores asintomáticos, ya que éstos eliminan principalmente quistes (más que trofozoítos) en su materia fecal; esto ha sido referido por otros autores (Gatti et al. 2002, López et al. 2008). Los eliminadores de quistes son importantes desde el punto de vista epidemiológico, debido a que son los responsables del mantenimiento del ciclo biológico del parásito en el lugar.
Se plantea cada vez con mayor énfasis que el sexo, por lo general, no influye en el comportamiento de los parásitos intestinales dentro de las poblaciones humanas. Las deficiencias en los hábitos higiénicos, carencia de saneamiento ambiental y la escasez de recursos económicos determinan primordialmente que toda la población esté igualmente expuesta a ambientes contaminados por enteroparásitos, lo que permite la posibilidad de hospedar un amplio espectro de especies de parásitos intestinales, los cuales suelen compartir similar mecanismo de transmisión (Devera et al. 2009). Esto ocurre sin importar el sexo de los habitantes, por lo que se pudiera inferir con base en lo anteriormente planteado y a nuestros resultados, que esta variable no es determinante en la prevalencia del complejo Entamoeba.
En cuanto a la edad, las mayores prevalencias del complejo Entamoeba se detectaron entre los 2 y 14 años (preescolares y escolares). Rivera et al. 1998, refieren que el grupo etario de 5 a 14 años fue el más afectado en las infecciones por E. histolytica/E. dispar en Filipinas. Mora et al. (2005) señalan una prevalencia estadísticamente significativa del complejo en individuos entre 10 y 19 años de edad de Cumaná (cifras que incluyen escolares y adolescentes). Este aspecto es importante, pues aunque en nuestros resultados no se determinó diferencia significativa entre los grupos etarios estudiados, se evidenció un escaso número de parasitados entre los lactantes (3/36); para quienes existe el mito de que la infección por E. histolytica es sumamente común como productor de disentería (Beltramino et al. 2009). Se ha descrito un probable efecto protector contra E. histolytica en los niños más pequeños, que reciben alimentación eminentemente láctea (sobre todo de leche materna). La saliva y la leche materna contienen un sistema de lactoperoxidasa con actividad antimicrobiana. La leche humana también posee lipasa, con capacidad destructora sobre los trofozoitos de Giardia lamblia y E. histolytica (Castellanos et al. 2000). Además, los niños pequeños (lactantes menores y mayores) generalmente reciben cuidados maternos relacionados con medidas higiénicas más estrictas, que impiden la infección por parásitos intestinales, particularmente protozoarios como E. histolytica (Haque et al. 2003, Bracho et al. 2013b).
Para probar lo anterior es necesario efectuar técnicas específicas, como el diagnóstico mediante PCR y así poder llegar a conclusiones definitivas. Al respecto Bracho et al. (2013b) estudiaron 50 niños menores de 5 años con diarrea del Hospital Universitario de Maracaibo en el estado Zulia; mediante PCR detectaron que 6 muestras (12%) presentaron ADN de E. dispar y 2 (4%) ADN de E. histolytica. Ningún niño presentó asociación de ambas amibas. Los dos niños que presentaron E. histolytica tenían 1 año de edad. E. dispar si fue detectada en niños de menor edad. Estos resultaron destacan el hecho de que E. histolytica no es frecuente en menores de 1 año.
Entamoeba coli y Endolimax nana, se observaron asociadas en forma significativa al complejo Entamoeba, estas combinaciones parasitarias también fueron observadas por Ramos et al. (2005), al estudiar una población rural mexicana; donde E. coli y E. nana estaban asociados al complejo en 75,7% y 56,8% respectivamente. Rivera et al. (1998) señalan que la infección por E. histolytica/E. dispar estaba fuertemente asociada a E. coli, en una investigación realizada en Filipinas. Kaminsky (2011) refiere una situación similar al estudiar personas infectadas por el complejo Entamoeba en Honduras, las asociaciones más frecuentes fueron con B. hominis (15,3%), con Entamoeba coli (17%), con Endolimax nana (11%), con Entamoeba hartmanni (4%) y con Giardia lamblia (2,5%). En nuestra investigación las especies que presentaron valores significativos de asociación parasitaria con el complejo Entamoeba fueron dos protozoarios, situación que se explica porque estos microorganismos tienen un mecanismo común de transmisión fecal-oral, a través de alimentos y aguas contaminadas.
Se observó una alta frecuencia de parasitismo intestinal entre los participantes; más de la mitad estaba infectado con más de una especie de protozoo relacionado al fecalismo, con helmintos o ambos, lo cual es indicación clara de un ambiente insalubre, íntima convivencia con animales domésticos, poca higiene personal y agua no segura para el consumo; condiciones que se apreciaron en la mayoría de las comunidades estudiadas. Según el estudio epidemiológico en Toromo, relacionado con la disponibilidad del agua y disposición de excretas, la mayoría de los individuos recolectaban el agua en pipas, no hierven ni filtran el agua de consumo y acostumbran defecar a campo abierto. Esta situación se reproducía en gran parte en el resto de las comunidades estudiadas, a pesar que algunas de ellas si tenían red de cloacas o letrinas en sus hogares.
Se concluye que la infección por los integrantes del complejo Entamoeba spp. es endémica en niños y adolescentes de diversas comunidades del estado Zulia. Así mismo, se confirma la necesidad de disponer de pruebas sencillas y confiables en los laboratorios de salud pública (probablemente un ELISA para detectar coproantígenos), para determinar la distribución real de E. histolytica en nuestra población.
REFERENCIAS BIBLIOGRÁFICAS
1.ACURERO E, ÁVILA A, RANGEL L, CALCHI M, GRIMALDOS R, COTIZ M. 2013. Protozoarios intestinales en escolares adscritos a instituciones públicas y privadas del municipio Maracaiboestado Zulia. Kasmera. 41(1):50-58.
[ Links ]
2.ALGER J. 1998. Entamoeba histolytica/Entamoeba dispar, interpretación del diagnóstico parasitológico. Rev. Med. Hondur. 66(3):113114.
3. [ Links ]ANÓNIMO. 2015. Zulia. Wikipedia. Disponible en línea en: https://es.wikipedia.org/wiki/Zulia. (Acceso 08.09.2015) [ Links ]
4.BECK D, DODAN N, MARO V, SAM N, SHAO J, HOUPT E. 2008. High prevalence of Entamoeba moshkovskii in a Tanzanian HIV population. Acta. Trop. 107(1):40-49. [ Links ]
5.BELTRAMINO J, SOSA H, GAMBA N, BUSQUETS N, NAVARRO L, VIRGOLINI S, RICARDO O. 2009. Sobrediagnóstico de amibiasis en niños con disentería. Arch. Argent. Pediatr. 107(6):510514.
6. [ Links ]BOTERO D, RESTREPO M. 2003. Parasitosis Humanas. Corporación para Investigaciones Biológicas, Medellín, Colombia, pp. 506. [ Links ]
7.BRACHO A, RIVERO-RODRÍGUEZ Z, CORDERO ME, CHIRINOS R, GONZÁLEZ Y, URIBE I, ATENCIO R, VILLALOBOS R. 2013a. Prevalencia de enteroparásitos y anticuerpos IgG antiEntamoeba histolytica en indígenas de la comunidad de Toromo, estado Zulia, Venezuela. Rev. Soc. Ven. Microbiol. 33(2):151-156. [ Links ]
8.BRACHO A, RIVERO Z, ARRAIZ N, VILLALOBOS R, URDANETA H. 2013b. Detección de Entamoeba histolytica y Entamoeba dispar mediante PCR, en niños menores de cinco años con diarrea en Maracaibo, Venezuela. Estudio Preliminar. Invest. Clin. 54(4):373-381.
[ Links ]
9.BRACHO A, RIVERO-RODRÍGUEZ Z, RÍOS M, ATENCIO R, VILLALOBOS R, RODRÍGUEZ L. 2014. Parasitosis intestinales en niños y adolescentes de la etnia yukpa de Toromo, estado Zulia, Venezuela. Comparación de los años 2002 y 2012. Kasmera. 42(1):41-51.
[ Links ]
10.CABRERA L. 2011. Implicaciones sociales y económicas del fenómeno de las parasitosis en el estado Zulia. Maracaibo: Universidad del Zulia, División de Estudios para Graduados de la Facultad de Humanidades y Educación [Disertación Grado Doctora en Ciencias Humanas], pp. 145.
[ Links ]
11.CASTELLANOS R, GUEVARA M, ROBINSON R, VÁZQUEZ L. 2000. Respuestas inmunes innatas y adaptativa. MEDISAN. 4(2): 64-74.
[ Links ]
12.CHACÍN-BONILLA L, DIKDAN Y. 1981. Prevalencia de Entamoeba histolytica y otros parásitos intestinales en una comunidad suburbana de Maracaibo. Invest. Clin. 22(4):185-203. [ Links ]
13.CHACÍN-BONILLA L, RUBIO F, CUAMO Y, AÑEZ S. 1984. Prevalencia de Entamoeba histolytica y otros parásitos intestinales en una comunidad del distrito Urdaneta, estado Zulia. Invest. Clin. 25(1):11-24. [ Links ]
14.CHACÍN-BONILLA L, DIKDAN Y, GUANIPA N, VILLALOBOS R. 1990. Prevalencia de Entamoeba histolytica y otros parásitos intestinales en un barrio del municipio Mara, estado Zulia, Venezuela. Invest. Clin. 31(1):315. [ Links ]
15.CLARK CG, DIAMOND LS. 1991. The Laredo strain and other 'Entamoeba histolytica like' amoebae are Entamoeba moshkovskii. Mol. Biochem. Parasitol. 46(1):11-18. [ Links ]
16.CUMINSKY M, LEJARRAGA H, MERCER R, MARRELL M, FESCINA R. 1994. Manual de crecimiento y desarrollo del niño. SenelPal Tex, Buenos Aires, Argentina, pp. 3-137. [ Links ]
17.DEVERA R, AMAYA I, BLANCO I, MONTES A, MUÑOZ M. 2009. Prevalencia de Blastocystis hominis en estudiantes de la Unidad Educativa Bolivariana Alejandro Otero “Los Alacranes”, San Félix, estado Bolívar. Vitae. 39:1-9.
18.DEVERA R, BLANCO Y, AMAYA I, NASTASI M, ROJAS G, VARGAS B. 2014. Parásitos intestinales en habitantes de la comunidad rural “La Canoa”, estado Anzoátegui, Venezuela. Rev. Ven. Salud Pública. 2(1):15-21.
19.DIAMOND LS, CLARK CG. 1993. A redescription of Entamoeba histolytica Schaudinn, 1903 (Emended Walker, 1911) separating it from Entamoeba dispar Brumpt, 1925. J. Eukaryot. Microbiol. 40(3):340-344. [ Links ]
20.DÍAZ I, RIVERO Z, BRACHO A, CASTELLANOS M, CALCHI M, ACURERO E, ATENCIO R. 2006. Prevalencia de enteroparásitos en niños de la etnia yukpa de Toromo, Edo. Zulia, Venezuela. Rev. Méd. Chile. 134(1):72-78. [ Links ]
21.ELBAKRI A, SAMIE A, EZZEDINE S, ODEH R. 2013. Differential detection of Entamoeba histolytica, Entamoeba dispar and Entamoeba moshkovskii in fecal samples by nested PCR in the United Arab Emirates (UAE). Acta Parasitol. 58(2):185-190. [ Links ]
22.EVANGELOPOULOS A, LEGAKIS N, VAKALIS N. 2001. Microscopy, PCR and ELISA applied to the epidemiology of amoebiasis in Greece. Parasitol Int. 50(3):185-189. [ Links ]
23.FOTEDAR R, STARK D, BEEBE N, MARRIOT D, ELLIS J, HARKNESS J. 2007. PCR detection of Entamoeba histolytica, Entamoeba dispar and Entamoeba moshkovskii in stool samples from Sydney, Australia. J. Clin. Microbiol. 45(3):1035-1037.
[ Links ]
24.FOTEDAR R, STARK D, MARRIOT D, ELLIS J, HAKNESS J. 2008. Entamoeba moshkovskii infections in Sydney, Australia. Eur. J. Clin. Microbiol. Infect. Dis. 27(2):133-137. [ Links ]
25.GATTI S, SWIERCZYNSKI G, ROBINSON F, ANSELMI M, CORRALES J, MOREIRA J, MONTALVO G, BRUNO A, MASERATI R, BISOFFI Z, SCAGLIA M. 2002. Amebic infections due to the Entamoeba histolytica-Entamoeba dispar complex: a study of the incidence in a remote rural area of Ecuador. Am. J. Trop. Med. Hyg. 67(1):123127. [ Links ]
26.HAMZAH Z, PETMITR S, MUNGTHIN M, LEEYAYOOVA S, CHAVALITSHEWINKOON-PETMITR P. 2010. Development of multiplex real-time polymerase chain reaction for detection of Entamoeba histolytica, Entamoeba dispar, and Entamoeba moshkovskii in clinical specimen. Am. J. Trop. Med. Hyg. 83(4):909-913. [ Links ]
27.HAQUE R, NEVILLE L, HAHN P, PETRI W. 1995. Rapid diagnosis of Entamoeba infection by using Entamoeba and Entamoeba histolytica stool antigen detection kits. J Clin Microbiol. 33(10):2558-2561. [ Links ]
28.HAQUE R, ALI I.K.M, AKTHER S, PETRI W. 1998. Comparison of PCR, Isoenzyme analisis and antigen detection for diagnosis of Entamoeba histolytica infection. J. Clin. Microbiol. 36(2):449-452. [ Links ]
29.HAQUE R, MONDAI D, KIRKPATRICK B, AKTER S, FARR B, SACK B, PETRI W. 2003. Epidemiologic and clinical characteristics of acute diarrhea with emphasis on Entamoeba histolytica infections in preschool children in a urban slum of Dhaka, Bangladesh. Am J Trop Med Hyg. 69(4):398-405. [ Links ]
30.HOOSHYAR H, ROSTAMKHANI P, REZAIAN M. 2012. Molecular epidemiology of human intestinal amoebas in Iran. Iranian. J. Publ. Health. 41(9):10-17.
[ Links ]
31.KAMINSKY R. 2011. Infección por Entamoeba histolytica/E. dispar determinada por dos métodos en vendedores de mercados, Honduras. Rev. Med. Hondur. 79(1):7-11. [ Links ]
32.LÓPEZ M, QUIROZ D, PINILLA A. 2008. Diagnóstico de amebiasis intestinal y extraintestinal. Acta Med. Colomb. 33(2):75-83. [ Links ]
33.MALDONADO A, RIVERO Z, CHOURIO G, DÍAZ I, CALCHI M, ACURERO E, BRACHO A, BÁRCENAS J 2008. Prevalencia de enteroparasitos y factores ambientales asociados en dos comunidades del estado Zulia. Kasmera. 36 (1):53-66. [ Links ]
34.MORA L, GARCÍA A, DE DONATO M. 2005. Prevalencia del complejo Entamoeba histolytica/Entamoeba dispar en pacientes con síntomas gastrointestinales de diarrea procedentes de Cumaná, estado Sucre. Kasmera. 33(1):36-45. [ Links ]
35.MORALES G, PINO L. 1987. Parasitología cuantitativa. Fundación Fondo Editorial Acta Científica Venezolana, Caracas, Venezuela, pp. 132. [ Links ]
MPPS (MINISTERIO DEL PODER POPULAR PARA LA SALUD). 2011. Anuario de morbilidad 2011. Gobierno Bolivariano de Venezuela. Disponible en línea en: http://www.mpps.gob.ve/index.php?option=com _phocadownload&view=category&id=15:anuari os-de-morbilidad&Itemid=915 (Acceso 10.02.2015).
36.NAZEMALHOSSEINI E, NOCHI Z, SAHEBEKHTIARI N, ROSTAMI M, DABIRI H, REZA M, KAZEMI B, HAGHIGHI A. 2010. Discrimination of Entamoeba moshkovskii in patients with gastrointestinal disorders by single-round PCR. Jpn. J. Infect. Dis. 63(2):136-138.
37.NGUI R, ANGAL L, FAKHRURRAZI S, AI Y, LING L, IBRAHIM J, MAHMUD R. 2012. Differentiating Entamoeba histolytica, Entamoeba dispar and Entamoeba moshkovskii using nested polymerase chain reaction (PCR) in rural communities in Malaysia. Parasit. Vectors. 5:187.
38.QUINTERO R. 2001. Crecimiento y desarrollo psicológico al niño venezolano. Puericultura Atención Primaria en Salud Infanto-Juvenil. Ediciones Psicopediátricas. Ediluz, Maracaibo, Venezuela, pp. 7-10.
39.RAMOS F, MORÁN P, GONZÁLEZ E, GARCÍA G, RAMIRO M, GÓMEZ A, GARCÍA M, MELENDRO E, VALADEZ A, XIMENEZ C. 2005. High prevalence rate of Entamoeba histolytica asymptomatic infection in a rural mexican community. Am. J. Trop. Med. Hyg. 73(1): 8791.
40.RIVERA W, TACHIBANA H, KANBARA H. 1998. Field study on the distribution of Entamoeba histolytica and Entamoeba dispar in the northern Philippines as detected by the polymerase chain reaction. Am J Trop Med Hyg. 59(6): 916-921.
41RIVERO Z, DIAZ I, ACURERO E, CAMACHO MC, MEDINA M, RIOS L. 2001. Prevalencia de parásitos intestinales en escolares de 5 a 10 años de un instituto del municipio Maracaibo, Edo. Zulia, Venezuela. Kasmera. 29(2):153-170.
42.RIVERO Z, MALDONADO A, BRACHO A, GOTERA J, ATENCIO R, LEAL M, SANCHEZ R, SILVA C. 2007. Enteroparasitosis en indígenas de la comunidad Japrería estado Zulia, Venezuela. Interciencia. 32(4):270-273.
43.RIVERO Z, BRACHO A, CHOURIO G, DÍAZ I, CALCHI M, ACURERO E, MALDONADO A, ARRAIZ N, CORZO G. 2009a. Detección y diferenciación de Entamoeba histolytica y Entamoeba dispar mediante Reacción en Cadena de la Polimerasa (PCR) en individuos de una comunidad del estado Zulia, Venezuela. Cad. Saúde Pública. 25(1):151-159.
44.RIVERO Z, MALDONADO A, BRACHO A, CASTELLANOS M, TORRES J, COSTA L, MÉNDEZ A, MÁRQUEZ L. 2009b. Prevalencia de enteroparásitos, rotavirus y adenovirus en niños aparentemente sanos. Kasmera. 37(1):62-73.
45.SARD B, NAVARRO R, SANCHIS G. 2011. Amebas intestinales no patógenas; una visión clínico analitica. Enferm. Infecc. Microbiol. Clin. 29(3):20-28.
46.URDANETA H, COVA J, MOLINA S, AGUIRRE A, HERNANDEZ M. 1998. Evaluación inmunoquímica de cepas de Entamoeba histolytica venezolanas. Kasmera. 26(1):35-49.
47.WHO (WORLD HEALTH ORGANIZATION). 1997. Amoebiasis. Weekly Epidemiologic Record. 72(14):97-100.
48.WMA (WORLD MEDICAL ASSOCIATION). 2008. Ethical principles for medical research involving human subjects. Declaration of Helsinki. Disponible en línea en: http://www.wma.net/es/30publications/10polici es/b3/index.html.pdf?print-media-type&footerright=[page]/[toPage] (Acceso 16.09.2015).












 uBio
uBio 
