Saber
versión On-line ISSN 2343-6468
Saber vol.28 no.1 Cumaná abr. 2016
SEROPREVALENCIA Y FACTORES DE RIESGOS ASOCIADOS CON LA INFECCIÓN POR Toxocara canis EN LA POBLACIÓN DE LA LAGUNA, ESTADO ANZOÁTEGUI, VENEZUELA
JULMAN CERMEÑO1, SAMER HOUDA1, NICOLA SALVADOR1, CARLOS SALAVERRIA2
Universidad de Oriente, 1 Núcleo de Bolívar, Escuela de Ciencias de la Salud Dr. Francisco Battistini Casalta, Departamento de Parasitología y Microbiología, Ciudad Bolívar, Venezuela, 2 Núcleo de Anzoátegui, Escuela de Ciencias de la Salud, Departamento de Parasitología y Microbiología, Barcelona, Venezuela. E-mail: jcerme30@gmail.com
RESUMEN
Para determinar la seroprevalencia de la infección por Toxocara canis en la población de La Laguna, estado Anzoátegui, se realizó un estudio prospectivo. Previo consentimiento informado, se aplicó una encuesta para la recolección de datos clínicos, epidemiológicos y socioeconómicos. Se tomaron muestras de sangre para realizar análisis hematológico, detectar anticuerpos específicos IgG anti-T. canis mediante ELISA y niveles séricos de IgE. Se evaluó una muestra de 146 personas. El 29,5% presentó anticuerpos IgG anti-T. canis, con predominio entre los 0-5 años (13,7%); no hubo diferencias por género ni edad (p > 0,05). Las familias con ingresos más bajos fueron las más afectadas (72,1%) y en su mayoría las viviendas no tenían aceras (21,0%; p = 0,018). Sólo la desparasitación de los perros estuvo asociada con infección por T. canis (p = 0,034). Los títulos de IgE se acompañaron de una discreta eosinofilia, lo que sugiere una posible infección parasitaria. Se demuestra que existe una elevada seroprevalencia de infección por T. canis en la población evaluada, por lo cual la infección debe ser considerada en niños con riesgo, como aquellos en contacto con perros, que viven en casas que carezcan de aceras, que están en contacto con el suelo y con déficit de higiene personal. Se destaca la importancia que las autoridades sanitarias deben asignar a esta infección, que habitualmente no se reconoce como un problema de salud pública.
PALABRAS CLAVE: Desparasitación, inmunoglobulina E, niños, toxocariasis, zoonosis.
SEROPREVALENCE AND RISK FACTORS ASSOCIATED WITH Toxocara canis INFECTION IN LA LAGUNA TOWN, ANZOÁTEGUI STATE, VENEZUELA
ABSTRACT
To determine the seroprevalence of Toxocara canis infection in the town La Laguna, Anzoátegui state, a prospective study was performed. After informed written consent was obtained from participants, the subjects were surveyed to collect clinical, epidemiological and socioeconomic data. Blood samples were obtained for hematological analysis, in order to detect specific anti-T. canis IgG antibodies by ELISA and serum IgE levels. A sample of 142 persons was evaluated. An estimate of 29.5% had IgG antibodies against T. canis predominantly between 0-5 years (13.7%); there were no differences either by gender or age (p > 0.05). Families with lowest income were mostly affected (72.1%) and most of their houses lacked sidewalks (21.0%; p = 0.018). Only deworming of dogs was associated with T. canis infection (p = 0.034). IgG titers are accompanied by slight eosinophilia, suggesting a possible parasitic infection. A high seroprevalence of T. canis infection was found in the population evaluated, hence the infection should be considered in children at risk, such as those in contact with dogs, living in houses that lack sidewalks, those in contact with soil and have poor personal hygiene. The importance that health authorities should allocate to this infection in underlined, which usually is not recognized as a public health concern.
KEY WORDS: Children, deworming, immunoglobulin E, toxocariasis, zoonoses.
Recibido: junio 2015. Aprobado: noviembre 2015 Versión final: febrero 2016
INTRODUCCIÓN
La toxocariasis humana es una zoonosis cuyo agente etiológico es la larva de segundo estadio (L2) del ascarídeo Toxocara, siendo T. canis y T. cati los más frecuentes; la infección se adquiere por la ingestión accidental de huevos embrionados (Moreira et al. 2014). Es una enfermedad que afecta al hombre de diferentes edades, especialmente a la población infantil (Flórez 2002, MacPherson 2013). Ha sido asociada frecuentemente a la disminución de hábitos higiénicos, debido a la fácil diseminación del parásito en el medio ambiente, su resistencia a factores climáticos adversos, las condiciones socioeconómicas y culturales, el crecimiento de la población canina y la alta prevalencia en perros, especialmente cachorros, facilita la infestación humana (Campos Júnior et al. 2003, García-Pedrique et al. 2004, Manini et al. 2012). Se manifiesta clínicamente como toxocariasis ocular (migración de larvas en los ojos, coriorretinitis, uveítis, estrabismo e incluso pérdida de la visión en el ojo lesionado), visceral (tos, disnea e infiltrados pulmonares, hepatomegalia, esplenomegalia, anemia, astenia, fiebre, pérdida de peso, entre otras), encubierta (eosinofilia, hiperglobulinemia y niveles elevados de IgE, falta de concentración) y el síndrome de larva migrante (migración de larvas única o múltiples a diferentes órganos). En muchos casos se ignora su frecuencia, a pesar que se le atribuye como responsable de numerosos problemas oculares (Maguiña et al. 2004, Figueiredo et al. 2005).
La toxocariasis tiene una distribución cosmopolita considerándosele endémica en la mayor parte de los países de América, África y Asia (Overgaauw 1997, MacPherson 2013). En América Latina, la seroprevalencia ha sido variable. Se señala en países como Argentina un 23% (Chiodo et al. 2006), Bolivia 6% (Lozano et al. 2011), Brasil 28,8% (Paludo et al. 2007), Chile 75% (Noemi et al. 1997), Colombia 42,1% (Mendoza et al. 2010), México 30,8% (MuñozGuzmán et al. 2010), Perú entre 22,5% a 32,4% (Espinoza et al. 2010), Uruguay 18,1% (Durán et al. 1993) y en Venezuela 9,7% (García-Pedrique et al. 2004).
En Venezuela los estudios sobre infección por T. canis han sido escasos, por lo que se conoce poco sobre la seroprevalencia en la población, señalándose un porcentaje entre 1,8% a 66,6% (Lynch et al. 1988, Pifano et al. 1988, García-Pedrique et al. 2004, Martínez et al. 2015). Los trabajos publicados muestran la poca importancia que se le ha atribuido a esta entidad y su impacto en la población, considerada por algunos investigadores como una enfermedad desatendida (Delgado y Rodríguez-Morales 2009). Además, esta patología no es de notificación obligatoria y no es considerada ni diagnosticada de rutina en los diferentes centros de salud del estado; por lo que en algunas poblaciones de riesgo las cifras reales de prevalencia no son bien conocidas. Por tal motivo y debido a que un estudio preliminar se demostró una prevalencia del 80% de perros infectados con T. canis en la población de La Laguna, municipio Guanta, estado Anzoátegui (datos no publicados); se planteó la presente investigación con la finalidad de determinar la prevalencia de infección humana por T. canis en dicha localidad y su asociación con factores de riesgo epidemiológico.
MATERIAL Y MÉTODOS
Se trata de un estudio descriptivo y transversal, realizado entre los meses de julio a diciembre de 2007. Previa aprobación del proyecto por los líderes de la comunidad y conjuntamente con ellos, se realizaron visitas, casa por casa, donde se explicó a cada familia la importancia, objetivos, finalidad y la metodología del estudio. Se incluyeron a todos los niños y adolescentes (n = 146; 100%) con o sin sintomatología de toxocariasis que vivían en la población de La Laguna, municipio Guanta, estado Anzoátegui, cuyos padres y/o representantes dieron su consentimiento informado para participar en el estudio. Se respetaron los principios éticos para la investigación médica en seres humanos, en concordancia con los lineamientos de la Declaración de Helsinki de la Asamblea Médica Mundial (CIOMS 2002).
Se realizó una encuesta a los padres o representantes de los niños menores de edad. Los datos de identificación personal, epidemiológicos (género, edad, factores de riesgo, entre otros) y manifestaciones clínicas, fueron recolectados de manera independiente en una ficha individual diseñada para tal fin. Asimismo, se recogieron datos socioeconómicos, de cada una de las familias, según el método de Graffar modificado por Méndez-Castellanos et al. (1986).
Área de estudio
El sector de La Laguna pertenece a la parroquia Chorrerón, municipio Guanta, estado Anzoátegui; se encuentra delimitado geográficamente por el mar Caribe al Norte, el estado Sucre al Sur y al Este, y el municipio Sotillo al Oeste. Posee clima de pie de montaña, con temperaturas que oscilan entre los 28 y 35ºC. . Toma de muestra Previa asepsia y antisepsia, se obtuvieron dos muestras sanguíneas de la vena cubital, una recogida en tubos estériles al vacío (Vacutainer®) sin anticuogulante y la otra contenía sal de EDTA (ácido etilenodiaminotetracético). El tubo sin anticoagulante, media hora después de su obtención, fue centrifugada a 3.500 g x 10 minutos, obtenido el suero fue fraccionado en alícuotas de 1 mL, conservados a -20°C hasta su procesamiento.
Pruebas serológicas y evaluación hematológica
Para la determinación de anticuerpos específicos anti-T. canis se empleó la prueba comercial Bordier-ELISA (Bordier Affinity Products Commercial®), la cual emplea antígeno excretor- secretor (E/S) de larvas de Toxocara canis. La sensibilidad diagnóstica de la prueba es superior al 90% y la especificidad de un 90%. Las absorbancias se midieron a una densidad óptica (DO) de 405 nm mediante un lector de placas de ELISA. Se consideraron como positivas aquellas muestras que presentaron absorbancia > 1,200 unidades de DO. Los resultados fueron interpretados siguiendo las recomendaciones del fabricante.
Para la determinación de inmunoglobulina IgE cuantitativa se utilizó la prueba comercial ELISA, DRG® IgE (Immunoglobulin E) (EIA– 1788), la cual utiliza anticuerpos anti– inmunoglobulina E monoclonal, para valorar reacciones alérgicas y de hipersensibilidad. Se se midió la DO a 450 nm. Los valores de referencias considerados fueron niveles de IgE < 10 UI/mL en menores de 3 años de edad; < 25 UI/mL de 3 a 4 años; < 50 UI/mL entre 4 a 7 años; < 100 UI/mL entre 4 a 14 años y < de 150 UI/mL en > 15 años. Los resultados de cada una de las pruebas ensayadas fueron interpretados siguiendo los criterios del fabricante.
Para la lecturas de las pruebas de ELISA se empleó un lector Statfax Modelo 303/Plus, de Awareness Technology, Inc (Florida, USA). La muestra de sangre con anticoagulante etilenodiaminotetracético (EDTA), se utilizó para realizar los análisis hematológicos. Para este análisis se requirió alrededor de 10 μL de sangre total introducida directamente en el equipo de Coulter Counter® serie T. Los resultados del estudio fueron entregados a cada uno de los pacientes de manera oportuna.
Condiciones sanitarias
Las condiciones sanitarias fueron definidas en tres grupos: buenas, regulares y malas. Buenas: procedencia del agua por tuberías, hierve el agua, conservación del agua en nevera, uso de poceta para la disposición de excretas, recolección de basura por el aseo urbano, lavarse las manos antes de comer. Regulares: procedencia del agua por camiones cisterna, no hierven el agua, conservación del agua en pipotes con tapa, disposición de las excretas en pozo séptico, quema de basura, algunas veces se lavan las manos antes de comer. Malas: procedencia del agua por lluvia u otras fuentes, no hierven el agua, conservan el agua en pipotes sin tapa, disposición de las excretas al aire libre/letrinas, entierran/queman la basura y no se lavan las manos antes de comer (Chiodo et al.2006).
Análisis estadístico
El análisis estadístico se realizó utilizando el programa SPSS/PC (Statistical Package for Social Sciences) para Windows versión 15.0. Se realizó estadística descriptiva. Se elaboraron tablas de contingencia y las variables cualitativas se compararon mediante la prueba de ji al cuadrado (Ji2) y la prueba exacta de Fisher. Se aplicó el análisis de correlación de Pearson para variables cuantitativas. En las comparaciones de más de dos medias se aplicó el análisis de varianza con la corrección de Tukey para comparaciones múltiples, considerando una p < 0,05 como significativa.
RESULTADOS
Se procesaron 146 muestras de sueros y sangre de niños, niñas y adolescentes de la población de La Laguna, estado Anzoátegui. Las características epidemiológicas generales de la población en estudio y su relación con la presencia de anticuerpos IgG anti-Toxocara canis se muestran en la Tabla 1. La edad estuvo comprendida entre los 3 meses y 16 años con una media de 6,8 años (DE ± 4,3), donde el 50% de la población fueron masculinos (n = 73). La mayoría de los individuos evaluados se encontraron en el grupo etario entre 0 y 5 años.
Se demostró que 43 individuos (29,45%; 43/146) de la población evaluada tenían anticuerpos IgG anti-T. canis y la mayor seropositividad fue evidenciada en el grupo de 05 años (13,69%; 20/146); de ellos, 22 eran femeninos (15,06%) y 21 masculinos (14,38%). Cabe destacar, que no se evidenciaron anticuerpos contra Toxocara en los niños menores de 24 meses. No hubo diferencias en la prevalencia de anticuerpos anti-T. canis por género ni edad (p > 0,05).
Se encuestaron 67 familias en sus respectivas viviendas y en sólo 43 de ellas (64,17%) se encontraron sujetos con anticuerpos anti-T. canis. Se encontró un promedio de 2,2 niñas, niños o adolescentes por familia. Cada familia ocupaba una vivienda. La mayoría de las casas donde vivían los individuos seropositivos a T. canis tenían techo de zinc (93,02%; 40/43); piso de cemento (79,06%; 34/43) y paredes de bloque (69,76%; 30/43). El 74,41% de los seropositivos (32/43) no tenían aceras frente a su vivienda. Hubo asociación entre la infección por T. canis y la ausencia de aceras (p = 0,018).
Con relación a las características socioeconómicas de las familias con individuos seropositivos, se encontró que la educación del padre y madre, en su mayoría, era de primaria completa (62,79% y 65,11%, respectivamente). El 51,16% (22/43) de los padres eran albañiles y el 86,04% (37/43) de las madres trabajan en los oficios del hogar. El 72,09% (31/43) de las familias con individuos seropositivos a T. canis vivían en pobreza crítica (estrato V) y el 23,25% (10/43) en pobreza relativa (estrato IV) (Tabla 2).
Las principales manifestaciones clínicas generales de la población evaluada se describen en la Tabla 3. Se evidenció que el 19,86% (29/146) de los seropositivos eran asintomáticos. De los sujetos seropositivos sintomáticos (14/146), cuatro tenían asma y alergia y tres dolor abdominal; sin embargo, no hubo asociación entre la presencia de anticuerpos IgG anti-T. canis y la presencia de los síntomas encontrados (p > 0,05).
Los valores hematimétricos demuestran 70% de sujetos con anemia microcítica hipocrómica y eosinofilia discreta. El valor medio del hematocrito fue 36,9% (DE + 3,5; IC 95%: 36,33 a 37,47), hemoglobina 11,9 g/dL (DE + 1,1; IC 95%: 11,72 a 12,08), hemoglobina corpuscular media 24,7 pg (DE + 2,5; IC: 95% 24,29 a 25,11), volumen corpuscular medio 76,6 fL (DE+7,0; IC 95%: 75,46 a 77,74) y eosinófilos 4,15% (DE + 6,7; IC 95%: 3,06 a 5,24). El resto de los valores se encontraba dentro de límites normales.
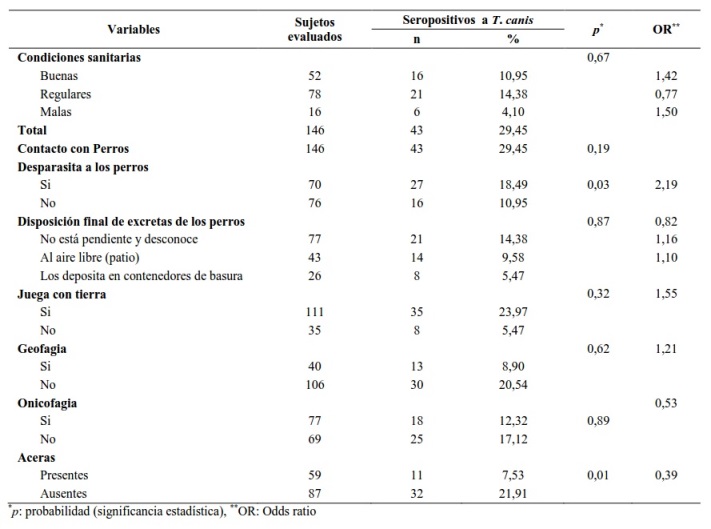
En la Tabla 4 se muestran los factores de riesgos según seroprevalencia de infección por T. canis. Hubo asociación estadísticamente significativa entre la desparasitación de los perros (p = 0,034), ausencia de aceras (p = 0,01) y la seropositividad a T. canis.
Se observó que el 24,65% de los sujetos seropositivos (36/146) tenían niveles de IgE > 100 UI/mL y presentaron un evento alérgico muy probable (p = 0,0001), posiblemente atribuido a infección por T. canis (IC 95%: 600,54-639,46). Estos individuos tenían eosinofilia asociada. El 4,10% (6/146) tenían niveles de IgE entre 20-100 UI/mL (IC 95%: 71,76 a 78,24) y 0,68% (n=1) tuvo valores < 20 UI/mL (IC 95%: 5,88 a 9,12).
Se entregaron los resultados en sobres cerrados a la dirección de salud del municipio Guanta, donde se especificaron las medidas de tratamiento humano y canino a aplicarse en la población seropositiva a T. canis.
Tabla 1. Aspectos epidemiológicos según hallazgos de anticuerpos IgG anti-Toxocara canis de la población de La Laguna, estado Anzoátegui, Venezuela.
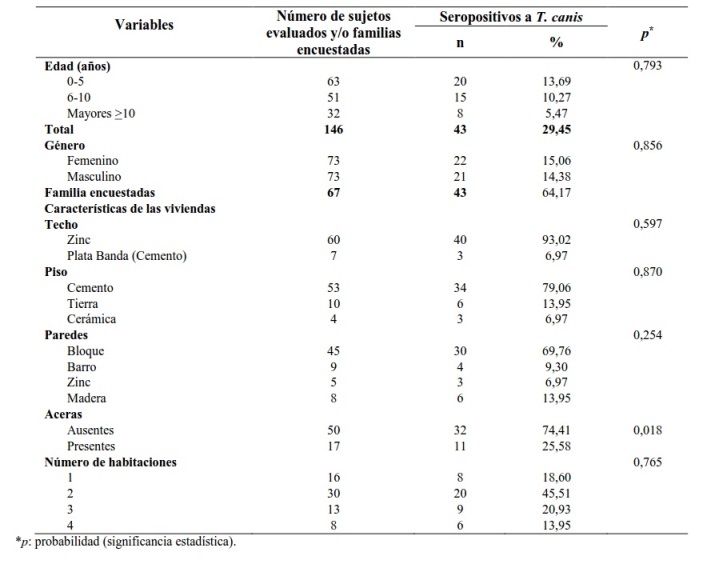
Tabla 2. Características socioeconómicas de las familias con individuos seropositivos a Toxocara canis de la población de La Laguna, estado Anzoátegui, Venezuela.
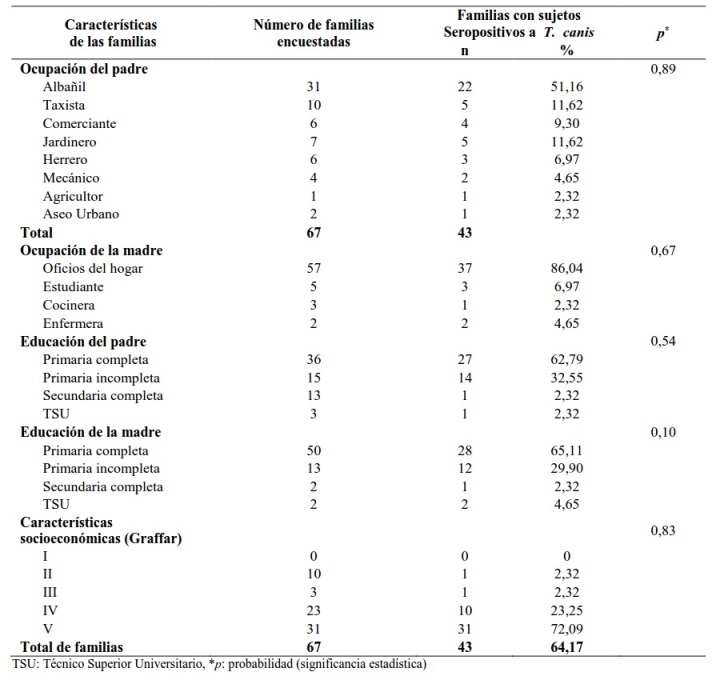
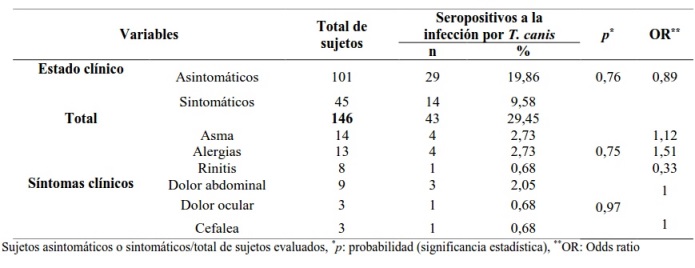
Tabla 4. Factores de riesgos según la presencia de anticuerpos IgG anti-Toxocara canis de la población de La Laguna, estado Anzoátegui, Venezuela.
DISCUSIÓN
Los resultados obtenidos demuestran que la seroprevalencia de anticuerpos contra T. canis fue elevada (29,45%) en los niños, niñas y adolescentes de la población de La Laguna del estado Anzoátegui; lo cual coincide con varios estudios internacionales (Magnaval et al. 2001, Campos et al. 2003, Espinoza et al. 2003, Fan et al. 2004a,b, Coelho et al. 2004, 2005, López et al. 2005), y es mayor que en otras investigaciones (Teixeira et al. 2006, Cassenote et al. 2014, Cong et al. 2015) e incluso en Venezuela (García-Pedrique et al. 2004, DíazSuárez et al. 2010, Gallardo y Camacho 2012); y es menor, a la señalada por Pifano et al. (1988) en Caracas y Lynch et al. (1988) en indígenas del Amazonas. La prevalencia demostrada en este estudio coincide con la señalada en niños preescolares del estado Aragua, Venezuela (Martínez et al. 2015).
Varios trabajos han señalado una mayor prevalencia en varones (Glickman et al. 1981, Chieffi et al. 1990, Kayes 1997, Overgaauw 1997, Alonso et al. 2000, García-Pedrique et al. 2004). Sin embargo, en este estudio no hubo diferencias significativas con respecto al género,
lo que coincide con lo descrito por otros autores (Flórez 2002, Coelho et al. 2004, Figueiredo et al. 2005, Teixeira et al. 2006), lo que indica que ambos géneros están expuestos al riesgo de infección.
En este estudio no hubo diferencias estadísticamente significativas con relación a la edad y la presencia de anticuerpos anti T. canis, lo cual puede atribuirse a que se estudió un grupo de riesgo, similar a lo señalado por otros autores (Alonso et al. 2000, Anaruma et al. 2002, Fan et al. 2004a,b, Figueiredo et al. 2005, Fu et al. 2014) y, en contraste, a lo observado en otros estudios que evidencian diferencias significativas con respecto a la edad (Radman et al. 2000, Flórez 2002, García-Pedrique et al. 2004), quizás sea atribuido al hecho, de que estos últimos consideraron a toda la población. Se evidenció que el grupo etario con mayor seropositividad fue de 0-5 años, (13,69%), similar a lo descrito por otros investigadores (Flórez 2002, GarcíaPedrique et al. 2004); lo cual puede explicarse por los hábitos lúdicos propios de la edad, inadecuadas costumbres higiénicas que implican un gran contacto con el suelo y su comportamiento, lo que origina mayor posibilidad de transmisión de la infección (Radman et al. 2000).
El hecho de no evidenciar anticuerpos anti T. canis en los niños menores de 24 meses, puede ser atribuido a que estos niños están más vigilados por sus padres y es menos probable que estén en contacto con los perros y que estos queden solos en los alrededores de las casas y en las calles.
La asociación entre la ausencia de aceras y la presencia de anticuerpos IgG anti-T. canis, coincide con lo señalado por Figueiredo et al. (2005), quizás, porque los huevos de Toxocara spp. requieren suelos de tierra o arena con humedad y temperatura adecuadas para transformarse en las formas infectivas (huevos larvados) facilitando la infección (Despommier et al. 2003).
La asociación significativa demostrada entre la desparasitación de los perros y la seropositividad a T. canis, podría ser atribuida a que cuando se desparasitan los perros y no se eliminan adecuadamente sus heces, o se desinfecta el lugar donde el perro tiene permanencia o defeca; los huevos que son eliminados por el animal, puedan embrionarse en el medio ambiente en condiciones adecuadas y diseminarse fácilmente (CDC 2004, Overgaauw y van Knapen 2013, Nijsse et al. 2015); existiendo alta probabilidad que los niños y adolescentes que no tengan una buena higiene personal se pueden infectar, al igual que otros animales, con huevos embrionados o larvas. Además, los huevos son resistentes a los factores adversos (Campos Júnior et al. 2003, GarcíaPedrique et al. 2004, Manini et al. 2012) y la costumbre de los habitantes del sector, de no estar pendiente de la disposición final de los excrementos de los perros, de que sus menores jueguen con tierra y algunos tengan geofagia; los predispone más a la infección.
Se ha demostrado que la presencia de perros en el hogar, el contacto con ellos, la exposición con el suelo, la geofagia y el hábito de no lavarse las manos antes de comer está asociado con la infección por Toxocara canis (Cassenote et al. 2014, Cong et al. 2015).
Similar a otros investigadores, no se encontraron diferencias con relación al nivel de educación de los padres y la presencia o ausencia de anticuerpos IgG anti-T. canis (Figueiredo et al. 2005, Cassenote et al. 2014). Se puede asumir que todos los habitantes, sin importar el nivel educativo alcanzado, se encuentran en un área rural con las mismas deficiencias sanitarias y factores de riesgos ambientales.
La influencia de los factores socioeconómicos sobre la ocurrencia de la infección humana por Toxocara spp. ha sido evaluada por diferentes autores (Alonso et al. 2000, Anaruma et al. 2002), señalándose que las poblaciones de menor nivel socioeconómico presentan altas prevalencias por una mayor contaminación de los suelos, por las características de sus viviendas y por los hábitos higiénicos y socio-culturales de sus habitantes.
La población evaluada en este estudio posee un nivel socioeconómico mayoritariamente bajo, estrato IV y V, según el Graffar modificado, calles sin pavimentar y por ende sin limpieza diaria, lo que significa una vasta extensión de terreno expuesto a depósitos de heces caninas. Así mismo, la población de La Laguna tiene un clima subtropical húmedo y sus habitantes tienen malos hábitos de saneamiento ambiental lo que favorece la contaminación de los suelos con huevos de T. canis.
Se ha descrito que la presentación clínica predominante de la toxocariasis humana en niños es la asintomática (Alderete et al. 2003, Altcheh et al. 2003), siendo ésta la forma más frecuentemente encontrada en este estudio y en los casos sintomáticos el compromiso de vías respiratorias fue más frecuente. Esto obedece a que las manifestaciones clínicas de la toxocariasis humana puede presentarse mucho tiempo después de la ingesta de huevos infectivos de T. canis, ya que las larvas tienden a permanecer en reposo para luego invadir o reinvadir tejidos (Minvielle et al.1999). Sin embargo, otros autores encuentran que en la población sintomática, los síntomas respiratorios son los más frecuentemente observados, tanto en adultos como en niños, lo cual coincide con lo encontrado en este estudio (Radman et al. 2000); a pesar de no existir una asociación estadística entre las manifestaciones clínicas y presencia de anticuerpos IgG anti-T. canis (p > 0,05).
Se ha descrito, en un porcentaje importante, anemia y eosinofilia en la infección por Toxocara spp. (Figueiredo et al. 2005, Teixeira et al. 2006), lo cual coincide con lo evidenciado en la presente investigación. Sin embargo, se ha señalado, que la ausencia de esos signos no descarta la infección (Altcheh et al. 2003).
Con respecto a los niveles de IgE y su relación con la presencia de anticuerpos IgG antiT. canis, se pudo evidenciar títulos elevados acompañados de discreta eosinofilia, lo que sugiere que estos individuos pudieran tener toxocariasis. La presencia de antígenos producidos por este parásito, son capaces de inducir la activación de células β policlonales, las cuales a su vez son las responsables de concentraciones de IgE elevadas en el suero, provocando una reacción de hipersensibilidad en los seropositivos, coincidiendo con lo descrito en otros estudios (Buij et al. 1997, Minvielle et al. 1999, Cobzaru et al. 2012, Mazur-Melewska et al. 2012). La eosinofilia parece ser un buen marcador de la infección en los niños que tienen un curso más sintomático de la enfermedad y la hiperinmunoglobulinemia IgE, puede ser un elemento importante que distingue entre la infección actual o pasada por Toxocara (MazurMelewska et al. 2012).
La seroprevalencia de infección por T. canis fue elevada (29,5%) en los niños y adolescentes de la población de La Laguna, estado Anzoátegui, fundamentalmente en el grupo etario entre los 2-5 años, sin diferencias entre géneros. Los títulos elevados de IgE son compatibles con un evento alérgico probable y sugiere la importancia de descartar la infección por T. canis.
Se demuestra una elevada seroprevalencia de infección por T. canis en la población evaluada y la infección debe ser considerada en niños con riesgos, como aquellos en contacto con perros, que han tenido contacto con el suelo y con déficit de higiene personal. Se destaca la importancia que las autoridades sanitarias deben asignar a esta infección, que habitualmente no se reconoce como un problema de salud pública.
REFERENCIAS BIBLIOGRÁFICAS
1.ALDERETE J, JACOB C, PASTOTINO A, ELEFANT G, CASTRO A, FOMIN A, CHIEFFI P. 2003. Prevalence of Toxocara infection in Schoolchildren from the Butantã region, São Paulo, Brazil. Mem. Inst. Oswaldo Cruz. 98(5):593-597.
2. [ Links ]ALONSO J, BOJANICH M, CHAMORRO M, GORODNER J. 2000. Toxocara Seroprevalence in children from a subtropical city in Argentina. Rev. Inst. Med. Trop. São Paulo. 42(4):235-237.
3. [ Links ]ALTCHEH J, NALLAR M, CONCA M, BIANCARDI M, FREILIJ H. 2003. Toxocariasis: aspectos clínicos y de laboratorio en 54 pacientes. An. Pediatr. 58(5):425-431. [ Links ]
4.ANARUMA F, CHIEFFI P, SILVEIRA C, CAMARGO E, SILVEIRA E, ARANHA J, RIBEIRO MC. 2002. Human toxocariasis: a seroepidemiological survey in the municipality of Campinas, Brazil. Rev. Inst. Med. Trop. São. Paulo. 44(6): 303307. [ Links ]
5.BUIJ J, BORSBOOM G, RENTING M, HILGERSOM W, VAN WIERINGEN J, JANSEN G, NEIJENS J. 1997. Relationship between allergic manifestations and Toxocara seropositivity: A cross- sectional study among elementary school children. Eur. Respir. J. 10:14671475. [ Links ]
6.CAMPOS JÚNIOR D, ELEFANT G, DE MELO E SILVA E, GANDOLFI L, JACOB C, TOFETI, A, PRATESI R. 2003. Frequency of seropisitivity to Toxocara canis in children of different socioeconomic strata. Rev. Soc. Bra. Méd. Trop. 36(4):509-513.
7. [ Links ]CASSENOTE AJ, LIMA AR, PINTO NETO JM, RUBINSKY-ELEFANT G. 2014. Seroprevalence and modifiable risk factors or Toxocara spp. in Brazilian schoolchildren. PLoS Negl. Trop. Dis. 29:8(5):e2830. [ Links ]
8.CDC (CENTERS FOR DISEASE CONTROL AND PREVENTION). 2004. Toxocara infection (toxocariasis) and animals. Disponible en línea en: http://www.cdc. gov/healthypets/diseases/toxocariasis.htm. (Acceso 05.11.2015). [ Links ]
9.CHIEFFI P, UEDA E, CAMARGO A, DE SOUZA M, GUEDES L, GERBI M., SPIR M, MOREIRA AS. 1990. Visceral larva migrans: a seroepidemiological survey in five municipalities of São Paulo state, Brazil. Rev. Inst. Med. Trop. São Paulo. 32(3):204- 210. [ Links ]
10.CHIODO P, BASUALDO J, CIARMELA L, PEZZANI B, APEZTEGUÍA M, MINVIELLE M. 2006. Related factors to human toxocariasis in a rural community of Argentina. Mem. Inst. Oswaldo Cruz. 101(4):397-400. [ Links ]
11.CIOMS (CONSEJO DE ORGANIZACIONES INTERNACIONALES DE LAS CIENCIAS MÉDICAS). 2002. Pautas éticas internacionales para la investigación Biomédica en seres humanos. Ginebra. Disponible en línea en: http://www.cioms.ch/publications/guideline s/pautas_eticas_internacionales.htm (Acceso 21.11.2006). [ Links ]
12.COBZARU RG, RÎPĂ C, LEON MM, LUCA MC, IVAN A, LUCA M. 2012. Correlation between asthma and Toxocara canis infection. Rev. Med. Chir. Soc. Med. Nat. Iasi. 116 (3):727-730. [ Links ]
13.COELHO L, SILVA M, DINI C, GIANCON A, NOVO N, SILVEIRA E. 2004. Human toxocariasis: a seroepidemiological survey in Schoolchildren of Sorocaba, Brazil. Mem. Inst. Oswaldo Cruz. 99(6):533-557. [ Links ]
14.COELHO L, BEZERRA L, PESSOA E, ARAKI K, TAKEUCHI T, ITO A, AOKI T, YAMASAKI H. 2005. Prevalence of toxocariasis in northeastern Brazil based on serology using recombinant Toxocara canis antigen. Am. J. Trop. Med. Hyg. 72(1):103-107.
15.CONG W, MENG QF, YOU HL, ZHOU N, DONG XY, DONG W, WANG XY, QIAN AD, ZHU XQ. 2015. Seroprevalence and risk factors of Toxocara infection among children in Shandong and Jilin provinces, China. Acta Trop.152:215-219. [ Links ]
16.DELGADO O, RODRÍGUEZ-MORALES A. 2009. Aspectos clínico-epidemiológicos de la toxocariasis: una enfermedad desatendida en Venezuela y América Latina. Bol. Mal. Salud Amb. 49(1):1-33. [ Links ]
17.DESPOMMIER D. 2003. Toxocariasis: clinical aspects, epidemiology, medical ecology, and molecular aspects. Clín. Microbiol. Rev. 16(2):265-272. [ Links ]
18.DÍAZ-SUÁREZ O, GARCÍA ME, MELÉNDEZ F, ESTÉVEZ J. 2010. Seroepidemiología de la toxocariasis en una comunidad indígena yucpa de la Sierra de Perijá al occidente de Venezuela. Kasmera. 38(2):138-146. [ Links ]
19.DURÁN E, BONIFACINO R, ZANETTA E, PIERI D. 1993. Toxocariasis humana en el Uruguay. Parasitolol. Dia 17(2):30-34.
[ Links ]
20.ESPINOZA Y, HUAPAYA P, SEBILLA C, HUIZA A, JIMÉNEZ S, NÁQUIRA C. 2003. Toxocariosis humana: seroprevalencia en población de Lima mediante la técnica de ELISA. An. Fac. Med. 64(4):228-232. [ Links ]
21.ESPINOZA YA, HUAPAYA PE, ROLDÁN WH, JIMÉNEZ S, ABANTO EP, ROJAS CA, CAVERO YA, GUTIÉRREZ CA. 2010. Seroprevalence of human toxocariasis in Andean communities from the Northeast of Lima, Peru. Rev. Inst. Med .Trop. São Paulo. 52(1):31-36. [ Links ]
22.FAN CK, HUNG C, DU W, LIAO C, SU K. 2004a. Seroepidemiology of Toxocara canis infection among mountain aboriginal schoolchildren living in contaminated districts in eastern Taiwan. Trop. Med. Int. Health. 9(12):1312-1318.
[ Links ]
23.FAN CK, LAN C, HUNG C, CHUNG W, LIAO C, DU W, SU KE. 2004b. Seroepidemiology of Toxocara canis infection among mountain aboriginal adults in Taiwan. Am. J. Trop. Med. Hyg. 71(2):216-221.
24. [ Links ]FIGUEIREDO S, TADDEI J, MENEZES J, NOVO N, SILVA E, CRISTÓVÃO H, CURY MC. 2005. Clinical epidemiological study of toxocariasis in a pediatric population. J. Pediatr. (Río Janeiro). 81(2):126-132. [ Links ]
25.FLÓREZ AC. 2002. Situación de la toxocariasis en Colombia, enero de 1996 enero de 2002. Inf. Quinc. Epidemiol. Nac. 7(20):361-388.
26. [ Links ]FU CJ, CHUANG TW, LIN HS, WU CH, LIU YC, LANGINLUR MK, LU MY, HSIAO WW, FAN CK. 2014. Seroepidemiology of Toxocara canis infection among primary schoolchildren in the capital area of the Republic of the Marshall Islands. BMC. Infect. Dis. 14:261-267. [ Links ]
27.GALLARDO J, CAMACHO S. 2012. Infección por Toxocara canis y factores de riesgo en niños de la comunidad Agua Azul, estado Yaracuy. Salud, Arte y Cuidado. 5(1):2127. [ Links ]
28.GARCÍA-PEDRIQUE ME, DIÁZ-SUÁREZ O, ESTÉVEZ J, CHENG-NG R, ARAUJOFERNÁNDEZ M, CASTELLANO J, ARAUJO J, CABRERA L. 2004. Prevalencia de infección por Toxocara en pre-escolares de una comunidad educativa de El Moján, estado Zulia, Venezuela. Resultados preliminares. Invest. Clín. 45(4):347-354.
29. [ Links ]GLICKMAN LT, CHAUDRY IU, CONSTANTINO J, CLACK FB, CYPESS RH, WINSLOW L. 1981. Pica patterns, Toxocariasis and elevated blood lead in children. Am. J. Trop. Med. Hyg. 30(1):77-80.
30. [ Links ]KAYES SG. 1997. Human toxocariasis and the visceral larva migrans syndrome: correlative inmunopatology. Chem. Immunol. 66:99-124. [ Links ]
LÓPEZ M, MARTIN G, CHAMORRO M, ALONSO J. 2005. Toxocariosis en niños de una región subtropical. Medicina (Buenos Aires). 65(3):226-230.
31.LOZANO D, SUAREZ E, ORTUÑO E, TORRICO MC, CORDOVA M, GELAZ G, GELAZ L. 2011. Relación entre asma y toxocariasis en pacientes pediátricos en Cochabamba, Bolivia. Gac. Med. Bol. 31(2):76-79.
32.LYNCH NR, WILKES LK, HODGEN AN, LOPEZ RI, TURNER KJ. 1988. Seroprevalence of Toxocara canis infection in tropical Venezuela. Trans. R. Soc. Trop. Med. Hyg. 82(2):275-281.
33.MACPHERSON CN. 2013. The epidemiology and public health importance of toxocariasis: a zoonosis of global importance. Int. J. Parasitol. 43(12-13):999-1008.
34.MAGNAVAL JF, GLICKMAN L, DORCHIES P, MORASSIN B. 2001. Highlights of human toxocariasis. Kor. J. Parasitol. 39(1):1-11.
MAGUIÑA C, SOTO L, EGOAVIL M, BREÑA P. 2004. Enfermedades de mascotas en humanos. Revisión actualizada. Rev. Soc. Per. Med. Inter. 17(1):17-26.
35.MANINI MP, MARCHIORO AA, COLLI CM, NISHI L, FALAVIGNA-GUILHERME AL. 2012. Association between contamination of public squares and seropositivity for Toxocara spp. in children. Vet. Parasitol. 188(1-2):48-52.
36.MARTÍNEZ M, GARCÍA H, FIGUERA L, GONZÁLEZ V, LAMAS F, LÓPEZ K, MIJARES V, CORRALES Y, LARES M, FERRER E. 2015. Seroprevalence and risk factors of toxocariasis in preschool children in Aragua state,Venezuela. Trans. R. Soc. Trop. Med. Hyg. 109(9):579-88.
37.MAZUR-MELEWSKA K, MANIA A, FIGLEROWICZ M, KEMNITZ P, SŁUŻEWSKI W, MICHALAK M. 2012. The influence of age on a clinical presentation of Toxocara spp. infection in children. Ann. Agric. Environ. Med. 19(2):233-236.
38.MÉNDEZ-CASTELLANOS H, LÓPEZ M, LANDAETA M, GONZÁLEZ A. 1986. Estudio transversal de Caracas. Arch. Venez. Pueric. Pediat. 49:111-115.
39.MENDOZA DL, LOZANO S, JAIMES MB. 2010. Exposición al parásito Toxocara canis en una población escolar de la Comuna 7 del Distrito de Santa Marta, Colombia. Rev. Fac. Cienc. Salud. 7(2):183-190.
40.MINVIELLE M, NIEDFELD G, CIARMELA ML, FALCO A, GHIANI H, BASUALDO J. 1999. Asma y Toxocariosis Encubierta. Medicina. 59(3):243-248.
41.MOREIRA GM, TELMO L, MENDONÇA M, MOREIRA AN, MCBRIDE AJ, SCAINI CJ, CONCEIÇÃO FR. 2014. Human toxocariasis: current advances in diagnostics, treatment, and interventions. Trends Parasitol. 30(9):456-64.
42.MUÑOZ-GUZMÁN MA, DEL RÍO-NAVARRO BE, VALDIVIA-ANDA G, ALBA-HURTADO F. 2010. The increase in seroprevalence to Toxocara canis in asthmatic children is related to cross-reaction with Ascaris suum antigens. Allergol. Immunopathol. (Madrid). 38(3):115-21.
43.NIJSSE R, PLOEGER HW, WAGENAAR JA, MUGHINI-GRAS L. 2015. Toxocara canis in household dogs: prevalence, risk factors and owners' attitude towards deworming. Parasitol. Res. 114(2):561-569.
44.NOEMI I, RUGIERO E, VIOVY A, CORTES P, CERVA J, GONZALEZ M, BACK S, GOTTLIEB B, HERRERA M, CORDOVEZ J. 1997. Seroepidemiologia familiar de la toxocariasis. Bol. Chil. Parasitol. 49:52-59.
45.OVERGAAUW PA. 1997. Aspects of Toxocara epidemiology: human Toxocariasis. Crit. Rev. Microbiol. 23(3):215-231.
46.OVERGAAUW PA, VAN KNAPEN F. 2013. Veterinary and public health aspects of Toxocara spp. Vet. Parasitol. 193(4):398403.
47.PALUDO ML, FALAVIGNA DL, ELEFANT GR, GOMES ML, BAGGIO ML, AMADEI LB, FALAVIGNA-GUILHERME AL. 2007. Frecuency of Toxocara infection in children attended by the health public service of Maringá, south Brazil. Rev. Inst. Med. Trop. São Paulo. 49 (6):343-348.
48.PIFANO F, ORIHUELA R, DELGADO O, CORTEZ R, ABDUL-HADI S, DALE M, GARMENDIA J. 1988. La Toxocariasis humana en Venezuela, especialmente en el Valle de Caracas. Gac. Med. Caracas. 96:31-42.
49.RADMAN N, ARCHELLI S, FONROUGE R, GUARDIS M, LINZITTO O. 2000. Human toxocariosis. Its seroprevalence in the City of La Plata. Mem. Inst. Oswaldo Cruz. 95(3):281-285.
50.TEIXEIRA C, CHIEFFI P, LESCANO S, SILVA E, FUX B, CURY M. 2006. Frequency and risk factors for toxocariasis in children from a pediatric outpatient center in southeastern Brazil. Rev. Inst. Med. Trop. São Paulo. 48(5):251-255.












 uBio
uBio 
