Saber
versión impresa ISSN 1315-0162
Saber vol.28 no.4 Cumaná dic. 2016
PREVALENCIA DEL EDEMA MACULAR CISTOIDEO EN PACIENTES ADULTOS INTERVENIDOS DE CATARATA POR LA TÉCNICA DE FACOEMULSIFICACIÓN
DANIEL ERNESTO GUARACHE1,2, FERNANDO ELÍAS GUARACHE1,2, FERNANDO LEÓN GUARACHE1,2
DANIEL ERNESTO GUARACHE1,2, FERNANDO ELÍAS GUARACHE1,2, FERNANDO LEÓN GUARACHE1,2
1 Hospital Universitario Dr. Antonio Patricio de Alcalá, Servicio de Oftalmología,
2 Grupo Oftalmológico Guarache, Cumaná, Venezuela. E-mail: danielguarache@gmail.com
RESUMEN
El objetivo del presente trabajo fue establecer la prevalencia del edema macular cistoideo, en pacientes intervenidos quirúrgicamente por la técnica de facoemulsificación con implantación de lente intraocular. Los pacientes fueron atendidos en el servicio de oftalmología del Hospital Universitario de Caracas, durante un periodo consecutivo de 3 meses en el año 2014. Las variables estudiadas fueron: agudeza visual corregida y medición del grosor foveal mediante tomografía de coherencia óptica (OCT) a las 4 semanas de haber sido intervenidos quirúrgicamente. La muestra estuvo formada por 50 ojos de pacientes intervenidos quirúrgicamente de catarata por la técnica evaluada. Los pacientes se dividieron según su agudeza visual corregida en cuatro grupos: grupo I: entre 20/20 y 20/40, grupo II: entre 20/50 y 20/70, grupo III: entre 20/80 y 20/200 y el grupo IV: 20/400 o menos. El 90% de los ojos estudiados se ubicó en el grupo I. El grosor foveal promedio encontrado fue de 172 ± 13 µm. Hubo dos pacientes (4%) complicados con ruptura de la cápsula posterior, uno de los cuáles presentó disminución de la agudeza visual corregida de 20/40 (2%), además de implantación del lente intraocular en el sulcus ciliar (2%) y grosor foveal de 198 µm. Por otra parte, el segundo paciente complicado por implantación del lente intraocular en el sulcus ciliar (2%) tampoco tuvo incidencia en la agudeza visual. La prevalencia de edema macular cistoideo fue de 2%. Las complicaciones identificadas en el paciente que desarrolló edema macular cistoideo pseudofáquico fueron: ruptura capsular posterior durante la cirugía de cataratas, e implante del lente intraocular en el sulcus ciliar. La OCT resultó ser una técnica diagnóstica no invasiva, precisa y confiable en el diagnóstico del EMC pseudofáquico.
PALABRAS CLAVE: Pseudofáquico, lente intraocular, agudeza visual, tomografía, coherencia óptica.
CYSTOID MACULAR EDEMA PREVALENCE IN PATIENTS UNDERGOING CATARACT SURGERY BY PHACOEMULSIFICATION
ABSTRACT The objective of the present study was to establish the prevalence of cystoid macular edema (CME), in patients operated by the technique of phacoemulsification with implantation of intraocular lens. Patients were attended in the Ophthalmology Service at the University Hospital of Caracas for a consecutive period of 3 months in the year 2014. The variables studied were: corrected visual acuity and measurement of the foveal thickness by optical coherence tomography (OCT), 4 weeks after surgery. The sample was composed of 50 patients operated of cataract by the evaluated technique, and divided according to their corrected visual acuity into four groups: Group I: between 20/20 and 20/40, group II: 20/50 to 20/70, group III: between 80/20 and 20/200 and the Group IV: 20/400 or less. Ninety per cent of the eyes studied were ranked in Group I. Average foveal thickness was 172 ± 13 µm. There were two (4%) patients complicated with rupture of the posterior capsule, one of which showed decrease of corrected visual acuity 20/40 (2%), as well as implantation of the intraocular lens in the ciliary sulcus (2%) and 198 µm foveal thickness; the other patient, with posterior capsule rupture, did not have impact on the visual acuity. On the other hand, the second patient complicated by implantation of the intraocular lens in the ciliary sulcus (2%) did not have impact on visual acuity. The prevalence of CME was 2%. The complications identified in the patient that developed pseudofaquic CME were: posterior capsular rupture during surgery of cataract, and implant of the intraocular lens in the ciliary sulcus. OCT demonstrated to be a non-invasive diagnostic technique, accurate and reliable in the diagnosis of pseudofaquic CME.
KEY WORDS: Pseudophaquic, intraocular lens, visual acuity, tomography, optical coherence.
Recibido: marzo 2016. Aprobado: julio 2016. Versión final: septiembre 2016.
INTRODUCCIÓN
La presencia de catarata es la principal causa de pérdida progresiva de la agudeza visual (AV) en la población adulta. La tasa anual de cirugía de catarata se ha elevado de 1,2 a 7,2 por cada 1.000 habitantes en los últimos años, lo cual se explica por el aumento de procedimientos quirúrgicos de forma más precoz (Brizzi et al. 2006). Las técnicas utilizadas y los resultados de la cirugía de catarata han cambiado durante las últimas décadas, en donde se estima que la facoemulsificación es el procedimiento quirúrgico más usado por los oftalmólogos, representando una técnica segura y confiable hoy día (Dholakia y Vasavada 2004).
La facoemulsificación e implante de lente intraocular (LIO) plegable es la técnica preferida en la actualidad (Lobo 2012), ya que mejora la calidad de vida del paciente, más que cualquier otro método utilizado. Uno de los factores claves para aumentar la tasa de éxito en esta cirugía es decidir el procedimiento de forma precoz, debido a que con el tiempo las fibras cristalinianas van cambiando su configuración hasta transformarse en una catarata brunescente de núcleo duro. La facoemulsificación está indicada cuando la calidad de vida del paciente es afectada por el impedimento visual y la evaluación preoperatoria revela que el potencial de recuperación visual es bueno (Boyd 2002). La recuperación visual temprana es de suma importancia para que el paciente pueda retomar de forma precoz sus actividades de rutina. Diferir la cirugía puede significar operar cataratas nucleares densas, lo cual aumenta el riesgo de desgarros, tanto de la cápsula anterior como posterior, aunque se realice extracción extracapsular programada o facoemulsificación. Esta situación puede llevar a una serie de complicaciones como: luxación del cristalino, afaquia, pérdida vítrea, queratopatía bulosa y edema macular cistoideo (EMC), que aumentan la morbilidad y comprometen aún más la AV definitiva del paciente (Boyd 2002). A pesar que el EMC pseudofáquico se presenta con frecuencia, casi siempre es autolimitado y subclínico, y se desarrolla típicamente de 4 a 6 semanas posteriores a la cirugía de catarata, y fue inicialmente reportado por Irvine en el año 1953, siendo conocido como síndrome de Irvine-Gass (Ryan 2001). Representa una respuesta patológica inespecífica debida a la disrupción de la permeabilidad normal selectiva de la barrera que protege la retina (hematorretiniana) e impide el libre movimiento de los elementos constituyentes del plasma hacia la retina y, en combinación con sistemas activos y pasivos de transporte, juega un papel importante en el mantenimiento y la homeostasis de la retina neurosensorial (Pulido 2001, Ryan 2001, Brar et al. 2010).
Cuando hay disrupción de la barrera hematorretiniana se produce expansión significativa del espacio extracelular de la retina, debido a la entrada de agua y elementos constituyentes del plasma sin ningún tipo de restricción. Esta expansión del espacio extracelular conlleva a la acumulación de fluidos en la región macular con un incremento correspondiente del grosor de la retina parafoveal. La acumulación progresiva de fluidos en forma de espacios quísticos, localizados entre las capas plexiforme externa y nuclear interna de la retina, se denomina EMC (Ryan 2001).
El EMC puede presentarse en múltiples condiciones patológicas oculares que incluyen la afaquia, oclusión venosa retiniana, retinosis pigmentaria y en patologías sistémicas con afectación ocular, en especial la diabetes mellitus (Catier et al. 2005).
El EMC se diagnostica por clínica, a través de oftalmoscopía indirecta y se confirma a través de múltiples métodos de diagnóstico por imágenes, entre los que destacan: (a) Angiografía fluoresceínica (AGF), que es clínicamente el examen disponible más usado. Permite el estudio de la circulación retiniana y coroidea en condiciones normales y patológicas. Este examen permite detectar alteraciones en la barrera hematorretiniana. Tiene como desventaja el de ser un método invasivo que puede ocasionar complicaciones severas y no siempre hay correlación entre el grado de hiperfluorescencia y la pérdida visual (Tranos et al. 2004, Torrón et al. 2006). La AGF demuestra la fuga de fluido a partir de los capilares perifoveales, y en algunos casos en el nervio óptico (Gulkilik et al. 2006). El EMC angiográfico puede presentarse con hallazgos patológicos en la AGF, sin afectación de la AV, el cual ha sido reportado hasta en un 50% de los pacientes intervenidos de catarata, complicada o no. Así mismo, el EMC clínico además de los cambios angiográficos puede asociarse con disminución de la AV con una incidencia que oscila entre el 0,2 y el 13% (Gulkilik et al. 2006, Torrón et al. 2006) y (b) Tomografía de coherencia óptica (OCT), resulta un procedimiento no invasivo, por lo cual es el más usado, que se basa en la interferometría de baja coherencia y obtiene imágenes de los cortes del tejido retiniano en alta resolución, permitiendo cuantificar el grosor retiniano. Debido a que la OCT opera con rayos de longitud de onda próximos a la luz infrarroja es mínima la molestia del paciente al realizar el examen. Este estudio está indicado para la detección temprana y seguimiento de pacientes con EMC. Se ha demostrado que la OCT obtiene mediciones altamente reproducibles y es más efectivo en la detección del EMC que la AGF, ya que puede demostrar la distribución axial del fluido en la mácula (Tranos et al. 2004, Brizzi et al. 2006). El EMC pseudofáquico puede ser diagnosticado usando únicamente métodos no invasivos, accesibles y rápidos como la OCT, obteniendo además detalles de la microestructura retiniana y otros datos específicos como el grosor exacto de la fóvea (Torrón et al. 2006).
Los pacientes intervenidos de cataratas, tanto por la técnica de extracción extracapsular o de facoemulsificación, son susceptibles de desarrollar un EMC como consecuencia de los cambios de presión a nivel de la cámara anterior del globo ocular y del proceso inflamatorio postquirúrgico.Actualmente, la facoemulsificación es el procedimiento de extracción de cataratas más usado en todo el mundo. Esta técnica permite mejores resultados visuales mientras menor es la dureza de la catarata, lo que conlleva a la realización de procedimientos quirúrgicos cada vez más precoces y, como consecuencia, a un mayor número de extracciones de cataratas al año. El EMC es conocido como la causa más frecuente de disminución de la AV después de una cirugía de catarata no complicada (Catier et al. 2005, Vajpayee et al. 2005, Gulkilik et al. 2006, Centurión et al. 2007). Algunos trabajos de investigación reportan que el EMC se presenta en el 50% de los casos operados de cataratas por la técnica de facoemulsificación no complicada (Gulkilik et al. 2006, Torrón et al. 2006).
El estudio del EMC en todo paciente operado de catarata en el servicio de oftalmología del Hospital Universitario de Caracas, usando la OCT, permitiría conocer la prevalencia de esta patología, así como los factores de riesgo para desarrollar EMC pseudofáquico (ruptura capsular posterior durante la cirugía, tiempo quirúrgico prolongado, diabetes mellitus, entre otros). De esta forma se podría iniciar tratamiento profiláctico en pacientes con EMC en estadío subclínico (portadores de factores de riesgo) y evitar la afectación de la AV y, en el caso del EMC clínico, aplicar tratamiento oportuno adecuado.
Considerando lo expuesto anteriormente, se planteó la evaluación oftalmológica, con medición de la AV, tonometría, oftalmoscopía, así como la realización de OCT macular a todos los pacientes intervenidos de catarata por la técnica de facoemulsificación con el objetivo de determinar la prevalencia del EMC pseudofáquico, en el servicio de oftalmología del Hospital Universitario de Caracas, con el propósito de iniciar tratamiento oportuno y evitar la cronicidad del edema para mejorar la calidad visual en estos pacientes.
MATERIALES Y MÉTODOS
Estudio descriptivo y prospectivo, de corte transversal. La muestra intencional fue de 50 ojos de pacientes intervenidos quirúrgicamente de catarata por la técnica de facoemulsificación, con implante de lente LIO en la cámara posterior, complicada o no, realizados por el personal médico del servicio de oftalmología del Hospital Universitario de Caracas, en el lapso comprendido entre agosto y octubre de 2014, que se encontraban en la cuarta semana de postoperatorio. A cada paciente se realizó la historia oftalmológica completa que incluyó los antecedentes personales, prestando especial atención a los pacientes diabéticos e hipertensos, debido su mayor riesgo de desarrollar EMC.
Normas de bioética
Los pacientes involucrados en el presente estudio, fueron informados sobre los procedimientos, objetivos y métodos utilizados en la investigación, siguiendo las normas de bioética, establecidas por la Organización Mundial de la Salud (OMS 1993), para trabajos de investigación en humanos, y bajo las normas éticas de la Declaración de Helsinki, que señalan que todo trabajo de investigación deberá estar a cargo de personas con la debida preparación científica y bajo la vigilancia de profesionales de la salud, respetando el derecho de cada individuo participante en la investigación a salvaguardar su integridad personal (OMS 1993, WMADH 2001).
Criterios de inclusión
Pacientes intervenidos de catarata por la técnica de facoemulsificación, con implante de LIO en la cámara posterior, complicados o no, mayores de 16 años, que se encontraban en la cuarta semana de postoperatorio.
Criterios de exclusión
Pacientes afáquicos, pacientes diabéticos o no, con EMC demostrado por oftalmoscopia indirecta usando lente de 78D y 20D en la evaluación oftalmológica preoperatoria, pacientes con alteraciones retinianas demostradas en la evaluación pre o postoperatoria, pacientes con opacidades corneales o vítreas que interfieran con la AV final y pacientes con trastornos refractivos elevados (mayores a 6 dioptrías esféricas y/o 3 dioptrías de cilindro).
Procedimientos
Todos los pacientes intervenidos de catarata, durante el período señalado, por la técnica de facoemulsificación con implante de LIO, complicados o no, fueron tratados en el postoperatorio con antibióticos y antiinflamatorios esteroideos tópicos, moxifloxacina (Vigamox®) y prednisolona (Prednefrin forte® al 1%) respectivamente, durante un mes, usando un esquema decreciente. Los pacientes pseudofáquicos, seleccionados para el estudio, fueron organizados en cuatro grupos, según la AV corregida (AVC): Grupo I: 20/20 a 20/40, Grupo II: 20/50 a 20/70, Grupo III: 20/80 a 20/200 y Grupo IV: 20/400 o menos. En cada paciente se realizó evaluación oftalmológica completa que incluyó medición de la AV con la mejor corrección, biomicroscopía con lámpara de hendidura, toma de la presión intraocular (PIO) con tonómetro de Goldman y oftalmoscopia indirecta con lente de 78D y 20D.
A la cuarta semana del postoperatorio se realizó OCT macular, en la sede de la Asociación para el Avance de la Oftalmología, utilizando un tomógrafo de coherencia óptica Stratus versión III, Carl Zeiss, el cual emplea un programa de mapeo macular que mide el espesor de la fóvea con un barrido de 6 líneas radiales con fijación foveal, usando una longitud de escaneo de 0,6 mm, tomando como grosor normal promedio 185 ± 15 µm (rango de 156 a 208 µm) (Brizzi et al. 2006, Tian et al. 2006). Los pacientes con grosor foveal por encima de este rango fueron considerados portadores de EMC, con o sin afectación de la agudeza visual.
Análisis estadístico
Se calculó el promedio y la desviación estándar de las variables continúas; en el caso de las variables nominales, se calculó su frecuencia y porcentaje. La relación de la variación de la fóvea respecto a la AVC se determinó a través del análisis de varianza de una vía, la prueba a posteriori de Dunnett, tomando como referencia la agudeza visual 20/20. Se consideró un valor estadístico significativo si p < 0,05 (Sokal y Rohlf 1979). Los datos fueron analizados con JMP-SAS versión 11. El cálculo de la prevalencia se realizó a través de la siguiente fórmula: Prevalencia = (CT/Nt) x 100, en donde CT = número de casos con la enfermedad en un momento determinado, para la muestra estudiada y Nt = número total de individuos en la muestra (Tapia 1995).
RESULTADOS
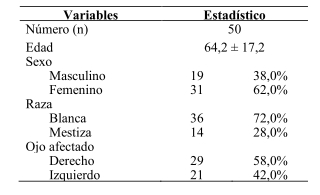
La Tabla 1 muestra las características de la población estudiada, en cuanto a promedio de edad, sexo, raza y ojo afectado, en pacientes post-operados de catarata por la técnica de facoemulsificación (pseudofáquicos), en el servicio de oftalmología del Hospital Universitario de Caracas. La edad promedio de la población fue de 64,2 ± 17,2 años. Predominó el sexo femenino con 62%, la raza blanca con 72% y el ojo derecho el más afectado con 58%.
Tabla 1. Características epidemiológicas, según edad, sexo, raza y ojo afectado en la población estudiada.

En la Tabla 2 se muestra el grosor foveal expresado en micrómetros (μm), agudeza visual corregida, ruptura capsular, posición del lente intraocular y la refracción post operatoria, en los pacientes que integran el grupo en estudio. El grosor foveal promedio fue de 172 ± 13 μm. Todos los pacientes se ubicaron en el grupo I (AVC 20/20 a 20/40). La agudeza visual corregida 20/20 representó el 48% de la población, 20/25 el 28%, el 20/30 el 10% y 20/40 el 4%. La posición predominante en la implantación del lente intraocular fue en el saco capsular, representando el 96% de los casos y solo en dos casos se colocó en el sulcus ciliar debido a una ruptura amplia de la cápsula posterior con mal soporte para el implante del LIO en el saco capsular, representando 4%. La refracción post operatoria promedio para la esfera fue de -0,84 dioptrías (D) ± 0,90, y para el cilindro -0,97D ± 0,49.
Tabla 2. Agudeza visual, grosor foveal, lugar de implantación del lente intraocular y complicaciones en el trans y postoperatorio en pacientes intervenidos de cataratas.

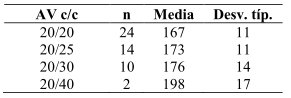
En la Tabla 3 se presenta la relación entre la AVC y el grosor foveal. Los pacientes con AVC 20/20 el grosor foveal promedio fue de 167 ± 11 μm, mientras aquellos con AVC 20/25 presentaron un promedio de 173 ± 11 μm y los pacientes con AVC 20/30 el promedio fue de 176 ± 14 μm. En tanto que los pacientes con AVC 20/40 presentaron un promedio de 198 ± 17 μm. La prueba ANOVA (análisis de varianza) compara la AVC con la media del grosor foveal, observándose que a medida que disminuyó la AVC aumentó el grosor foveal, siendo esta relación inversa estadísticamente significativa (p = 0,003).
Tabla 3. Relación entre agudeza visual corregida y grosor foveal determinado por OCT, en pacientes intervenidos de cataratas.
DISCUSIÓN 
La cirugía moderna de cataratas con facoemulsificación, incisión corneal autosellante e implante de LIO plegable en el saco capsular, parece haber disminuido considerablemente la incidencia del EMC tanto clínico como angiográfico (Torrón et al. 2006, Lobo 2012). Aproximadamente el 20% de los pacientes que son intervenidos de catarata, ya sea por la técnica de extracción extracapsular o por la de facoemulsificación, sin complicaciones, desarrollan EMC angiográfico (Tranos et al. 2004, Nicholas et al. 2006). El EMC pseudofáquico es conocido como la causa más frecuente de disminución de la AV después de una cirugía de catarata no complicada, aunque es relativamente más factible que se presente cuando el procedimiento quirúrgico se complica, entre otras cosas: con ruptura de la cápsula posterior y pérdida de humor vítreo, trauma severo del iris y presencia de vítreo en la herida quirúrgica, elevando su incidencia por encima de 20% (Ho et al. 2006, Jong-Hyun et al. 2014).
El EMC clínico usualmente se presenta de 3 a 12 semanas posteriores a la cirugía, aunque puede hacerlo luego de varios meses o años después. La resolución espontánea del EMC con mejoría de la AV ocurre en el 80% de los casos entre los 3 y 12 meses postquirúrgicos (Tranos et al. 2004). El diagnóstico de EMC se establece desde el punto de vista clínico midiendo la AVC, practicando oftalmoscopia indirecta, que puede ser realizada usando lámpara de hendidura con lente de contacto o no contacto, que permite en muchos casos detectar el engrosamiento de la retina, ya sea localizado o extendido al polo posterior, y que se confirman a través del diagnóstico por imágenes (Flach 1998, Torrón et al. 2006).
Por más de 30 años, la fotografía del fondo de ojo y la AGF han sido de extremo valor para la expansión del conocimiento en anatomía, patología y fisiopatología de la retina y coroides, permitiendo el diagnóstico, monitoreo y tratamiento de diversas enfermedades maculares y coroideas (Ryan 2001).
El advenimiento de nuevas técnicas de exploración imagenológica ha constituido uno de los elementos de mayor importancia en el diagnóstico médico en los últimos años. Técnicas como resonancia nuclear magnética, tomografía axial computarizada, la ultrasonografía, entre otras, han constituido herramientas muy útiles al permitir la visualización (in vivo y de forma no cruenta) de estructuras que escapan a los medios diagnósticos tradicionales e incluso a la imaginación de los propios médicos (Mendoza et al. 2005).
En la actualidad OCT es un método de diagnóstico imagenológico ampliamente usado para diagnóstico y seguimiento de muchas enfermedades de la retina y del nervio óptico como es el caso del EMC, por ser rápido, inocuo, accesible, y por brindar imágenes de alta definición de las distintas capas de la retina, comparables a un corte histológico de la misma (Ferguson et al. 2014).
A pesar que ésta patología ha sido descrita desde hace más de 40 años, su etiología aun no ha sido esclarecida por completo. Se han sugerido muchos factores que contribuyen en su patogénesis, tal es el caso de la pseudofaquia, oclusión de vena retiniana, retinosis pigmentaria, fototoxicidad,
tracción vítreo macular, mediadores inflamatorios, edad, color del iris, pérdida de vítreo, lesión de la cápsula posterior, y enfermedades sistémicas como hipertensión arterial y la diabetes mellitus (Catier et al. 2005, Gulkilik et al. 2006, Jong-Hyun et al. 2014). La incidencia del EMC angiográfico sin afectación de la agudeza visual ha sido estimada en 50% de los casos. El EMC clínico produce una pérdida visual variable, en un porcentaje que oscila entre 0,2 y 13% de pacientes intervenidos de catarata, complicadas o no (Torrón et al. 2006).
Con relación en los resultados mostrados en la Tabla 2, dos pacientes complicados con ruptura de cápsula posterior, uno presentó agudeza visual corregida (AVC) de 20/40, mientras que el otro presentó AVC de 20/30, este último, pese a tener un grosor foveal estudiado por OCT dentro de parámetros normales y sin criterios diagnóstico de edema macular, no se logró establecer la causa de ella. Por otra parte, hubo un tercer caso con AVC 20/40, en una cirugía sin complicación, que presentó grosor foveal de 186 μm, por lo que se estima que el mal resultado visual pudiera estar relacionado a edema macular diabético preexistente, no visible en la oftalmoscopia indirecta preoperatoria.
Numerosos trabajos describen como factor de riesgo para el desarrollo del EMC, la ruptura capsular, la pérdida de humor vítreo a través de la incisión, incarceración vítrea en la incisión, toxicidad luminosa del microscopio quirúrgico, afaquia, LIO fijado en el sulcus o en cámara anterior, luxación de fragmentos de cristalino al polo posterior, e incluso la capsulotomía posterior con YAG láser (Dholakia y Vasavada 2004, Lobo 2012).
Con respecto a los resultados mostrados en la Tabla 3, y tomando como criterio por OCT para el diagnóstico de EMC un grosor foveal de 185 ± 15 μm, con y sin la disminución de la AVC, se pudo evidenciar la presencia de un solo caso de EMC, el cual representa el 2% de la población estudiada (Brizzi et al. 2006, Tian et al. 2006). En vista que el OCT puede arrojar resultados con variaciones del grosor entre 10 a 15 μm, solo por el grosor no debe plantearse la presencia del EMC (Brizzi et al. 2006). No obstante, en éste caso en particular, la cual fue una cirugía complicada, con ruptura capsular e implante de LIO en el sulcus ciliar, presencia de AVC de 20/40 y grosor foveal de 210 μm, se estableció el diagnóstico de EMC pseudofáquico.
La prevalencia del EMC en este estudio fue de 2%, y obviamente su etiología se corresponde con complicaciones quirúrgicas (ruptura de cápsula posterior y como consecuencia de ello implante de LIO en el sulcus ciliar). Este resultado es similar a los obtenidos por Gulkilik et al. (2006), quienes reportaron prevalencia de EMC entre 0,2 y 12%. Ursell et al. (1999) reportaron una prevalencia de EMC angiográfico del 13% posterior a cirugía de catarata no complicada. Contrario a nuestros resultados, Dholakia y Vasavada (2004) en su estudio de 165 ojos sometidos a cirugía de catarata sin complicaciones, ninguno presentó EMC.
La predisposición de la mácula a desarrollar EMC no ha sido completamente entendida. En determinadas situaciones el EMC, incluyendo pseudofáquico, está asociado a fugas localizadas a partir de los capilares parafoveales (Ryan 2001). Numerosos estudios histopatológicos han evaluado los cambios retinianos asociados al EMC. La microscopía de luz revela la acumulación de material eosinofílico en las capas plexiforme externa y nuclear interna de la retina, con formación de múltiples quistes, los cuales generalmente se agrupan alrededor de uno central foveal. En los casos severos y de larga duración del EMC, los quistes pueden aumentar de tamaño y extenderse a las capas más internas de la retina, produciendo finalmente alteraciones parciales o totales del grosor retiniano macular (Ryan 2001, Bringmann et al. 2004). Algunos estudios histopatológicos han demostrado que los espacios quísticos se corresponden con áreas donde las células retinianas se encuentran desplazadas. Antclif et al. (2004) evaluaron la conductividad hidráulica de la retina, posterior a la ablación progresiva de las células retinianas realizada con láser excimer, y concluyeron que las capas plexiforme interna y externa constituyen una barrera de gran resistencia al flujo de líquido a través de la retina (Tranos et al. 2004).
Los estudios histopatológicos que tratan de establecer alguna relación con la etiología del EMC no son concluyentes. Algunos trabajos publicados sugieren la idea de que los primeros cambios, previos al desarrollo del EMC, van asociados al aumento del líquido en el espacio extracelular en la retina. Sin embargo, otras investigaciones plantean como hipótesis el papel determinante de los cambios intracelulares (edema y degeneración) en las células de Müller. Se especula que los espacios en el EMC pueden representar células de Müller edematosas, sin expansión del espacio extracelular.
En concordancia con esta teoría se encuentra el hecho que la isquemia, y otros factores que produzcan disrupción de la función de las células de Müller, están asociados con el desarrollo del EMC. Otros estudios han evidenciado la pérdida localizada de los fotorreceptores en ojos con EMC, y plantean la posibilidad que la degeneración del epitelio pigmentado de la retina esté también involucrada en la génesis del EMC (Ryan 2001, Bringmann et al. 2004).
La causa de EMC pseudofáquico sigue siendo controversial; el principal mecanismo fisiopatológico sugerido, como se ha comentado anteriormente, involucra las fuerzas resultantes de la tracción vítrea sobre la mácula. La incarceración del vítreo en la herida quirúrgica, que produce tracción de la pupila y de las áreas de unión firme de la retina con el vítreo que incluye la mácula y el nervio óptico, se han asociado con un riesgo incrementado de EMC pseudofáquico crónico (Lobo 2012). Sin embargo, esta teoría no explica la aparición del EMC después de la cirugía de cataratas sin complicaciones, o en ausencia de tracción vitreomacular. En los casos en los que se demostró tracción vítrea, también se identificó la presencia de inflamación ocular como un hallazgo concomitante.
La hiperemia periquerática, celularidad y flare en humor acuoso y vítreo, incluso edema del disco óptico y periflebitis, se asoció al EMC pseudofáquico. Actualmente el flare es considerado un marcador inflamatorio y de disrupción de la barrera hematorretiniana en pacientes con EMC pseudofáquico (Ersoy et al. 2013).
Los mediadores químicos de la inflamación, incluyendo las prostaglandinas (liberadas en el postoperatorio), aparentemente juegan un papel activo en el desarrollo del EMC, al incrementar la permeabilidad vascular. La fuga de líquido por angiografía en pacientes con EMC se reduce al administrar inhibidores de la ciclooxigenasa, que a su vez disminuye la síntesis de prostaglandinas, pudiendo explicar el origen inflamatorio del EMC (Ryan 2001). En la actualidad se describen múltiples opciones terapéuticas para el EMC. Se usan anti-inflamatorios no esteroideos (AINE) como nepafenac, cuyo mecanismo de acción es a través de la inhibición en la síntesis de prostaglandinas, incluso a nivel de retina y coroides. Este fármaco también inhibe la extravasación de proteínas en el
vítreo y ha demostrado ser una terapia efectiva para el tratamiento del EMC (Lindstrom y Kim 2006). En casos más severos se recomienda la combinación de un AINE con esteroides. Si no hay mejoría visual, administrar esteroides intravítreo. En los casos refractarios a los esteroides intravítreo se debe plantear la aplicación de un inhibidor del factor de crecimiento vascular endotelial (anti VEGF) como bevacizumab (Falavarjani et al. 2012). En algunos países está disponible el implante intravítreo de dexametasona, lo que representa una buena opción terapéutica debido a su liberación prolongada en el vítreo (Vito et al. 2014). Se ha descrito tratamiento exitoso con el uso de interferón alfa a2 subcutáneo (Deuter et al. 2011).
Los pacientes con edema macular diabético deben ser evaluados por el especialista en retina para determinar la posibilidad de aplicar tratamiento previo a la cirugía de cataratas debido al alto riesgo de exacerbación del edema. El tratamiento va a depender del estado de la retinopatía y del edema macular diabético (Aroca 2013).
CONCLUSIONES
La prevalencia del edema macular cistoideo en los pacientes intervenidos de catarata por la técnica de facoemulsificación complicadas o no, intervenidos quirúrgicamente, por el personal médico del servicio de oftalmología del Hospital Universitario de Caracas, en el lapso agosto-octubre de 2014, fue de 2%. La totalidad de los pacientes se ubicaron en el grupo I (agudezas visuales corregidas de 20/20 a 20/40). Distribuidas de la siguiente manera, AVC 20/20: 48%, AVC 20/25: 28%, AVC 20/30: 20% y AVC 20/40: 4%. El grosor foveal promedio de los pacientes intervenidos de catarata con la técnica de facoemulsificación, medido por tomografía de coherencia óptica (OCT) fue de 172 ± 13 μm. Las complicaciones identificadas en el paciente que desarrolló edema macular cistoideo pseudofáquico fueron la ruptura capsular posterior durante la cirugía de cataratas con implante del lente intraocular en el sulcus ciliar. La tomografía de coherencia óptica es una técnica diagnóstica no invasiva, precisa y confiable en el diagnóstico del edema macular cistoideo pseudofáquico.
REFERENCIAS BIBLIOGRÁFICAS
1.AROCA P. 2013. Current status in diabetic macular edema treatments. World J. Diabetes. 4(5)165-169. [ Links ]
2.BOYD B. 2002. Atlas de cirugía ocular. Cirugía de cataratas y lentes intraoculares. Cirugía oculoplástica funcional y cosmética. Volumen II. Editorial Highlight
of Ophthalmology International. Ciudad de Panamá, Panamá, pp. 125-130. [ Links ]
3.BRAR M, YUSON R, KOZAC I, MOJANA F, CHENG L, BARTSCH D, OSTER S, FREEMAN W. 2010. Correlation between morphological features on spectral domain optical coherence tomography and angiographic leakage patterns in macular edema. Retina. 30(3):383-389.
[ Links ]
4.BRINGMANN A, REICHENBACH A, WIEDEMANN P. 2004. Pathomechanisms of cystoid macular edema. Ophthalmic Res. 36(5):241-249.
[ Links ]
5.BRIZZI M, BOMBANA A, CARRIACONDO P, BUZALAI F, NEWTON-KARA J. 2006. Retinal thickness assesed by optical coherente tomography (OCT) in pseudophakic macular edema. Arq. Bras. Oftalmol. 69(4):539-544.
[ Links ]
6.CATIER A, TADAYONI R, PAQUES M, ERGINAY A, HAOUCHINE B. 2005. Characterization of macular edema from various etiologies by optical coherence tomography. Am. J. Ophthalmol. 140(2):200e1-200e9.
[ Links ]
7.CENTURIÓN V, NICOLI C, VILLAR-KURI J. 2007. El libro del cristalino de las américas. Livraria Santos Editora. Brasil, pp. 320-331. [ Links ]
8.DEUTER C, GELISKEN F, STÜBIGER N, ZIERHUT M, DOYCHEVA D. 2011. Successful treatment of chronic pseudofakic macular edema (Irvine Gass syndrome) with interferon alpha: a report of three cases. Ocul. Inmunol. Inflamm. 19(3):216-218.
9. [ Links ]DHOLAKIA S, VASAVADA A. 2004. Intraoerative performance and longterm outcome of phacoemulsification in age-related cataract. Indian J. Ophthalmol. 52(4):311-317. [ Links ]
10.ERSOY L, CARAMOY A, RISTAU T, KICRHHOF B, FAUSER S. 2013. Aqueous flare is increased in patients with clinically significant cystoid macular edema after cataract surgery. Br. J. Ophtalmol. 97(7)862-865. [ Links ]
11.FALAVARJANI K, PARVARESH M, MODARRES M. HASHEMI M. SAMIY N. 2012. Intravitreal bevacizumab for pseudofakic cystoid edema; a systematic review. J. Ophtalmic. Vis. Res. 7(3):235-239.
[ Links ]
12.FERGUSON L, SANDEEP G, DOMINGUEZ J, BALAIYA S, CHALAM K. 2014. Retinal measument obtained with spectral domain coherence optic tomography assisted optical biopsy accurately correlates with ex vivo histology. PloS One. 9(10):1-8.
13. [ Links ]FLACH A. 1998. The incidence, pathogenesis and treatment of cystoid macular edema following cataract surgery. Trans. Am. Ophthalmol. Soc. 96:557-633.
[ Links ]
14.GULKILIK G, KOCABORA S, TASKAPILI M, ENGIN, G. 2006. Cystoid macular edema after phacoemulsification: risk factors and effect on visual acuity. Can. J. Ophthalmol. 41(6):699-703.
15. [ Links ]HO T, KAISER R, BENSON W. 2006. Retinal complications of cataract surgery. Compr. Ophthalmol. Update. 7(1):1-10. [ Links ]
16.JONG-HYUN O, ROY C, JAE D, CHOUL Y. 2014. Vitreous hyper-reflective dots in optical coherence tomography and cystoid macular edema after uneventful phacoemulsification surgery. PloS One. 9(4):1-8.
[ Links ]
17.LINDSTROM R, KIM T. 2006. Ocular permeation and inhibition of retinal inflammation: an examination of data and expert opinion on the clinical utility of nepafenac. Curr. Med. Res. Opin. 22(2):397-404.
[ Links ]
18.LOBO C. 2012. Pseudofakic cystoid macular edema. Ophtalmologica. 227(2):61-67. [ Links ]
19.MENDOZA C, SANTIESTEBAN R, GONZALEZ A, GONZALEZ L, PERDOMO Y. 2005. La tomografía de coherencia óptica en el diagnóstico de enfermedades de la retina y el nervio óptico. Rev. Cub. Oftalmol. 18(2):0-0. [ Links ]
20.NICHOLAS S, RILEY A, NEVELDSON B, PUERDIE G. 2006. Correlations between optical coherence tomography measurement of macular thickness and visual acuity after cataract extraction. Clin. Exp. Ophthalmol. 43(2):124-129.
[ Links ]
21.OMS (ORGANIZACIÓN MUNDIAL DE LA SALUD). 1993. Pautas éticas internacionales para la investigación y experimentación biomedical en seres humanos. Disponible en línea en: http://www.uchile.cl/portal/investigacion/centro-interdisciplinario-de-estudios-en-bioeti ca/documentos/76194/pautas-eticas-internacionales-para-la-investigacion-y-experimentacion (Acceso 01.10.2013).
[ Links ]
22.PULIDO J. 2001. Retina, coroides y vítreo. Los requisitos en oftalmología. Editorial Elsevier, España, pp. 45-51.
23. [ Links ]RYAN J. 2001. Retina. 3 Edition. Mosby, St. Louis, USA, pp. 56-58. [ Links ]
24.SOKAL R, ROHLF J. 1979. Biometría: principios y métodos estadísticos en la investigación de la biología. Edición Blume. Madrid, España, pp. 832. [ Links ]
25.TAPIA J. 1995. Medidas de prevalencia y relación incidencia-prevalencia. Med. Clin. 105:216-218.
[ Links ]
26.TIAN B, LI X, ZHAO M, LU Y, WANG S. 2006. A comparative study of various diagnostic procedures in macular edema. Zhonghua Yan. Za. Zhi. 42(8):724-727. [ Links ]
27.TORRÓN B, RUIZ O, FERRER E, SANCHEZ A, HONRUBIA F. 2006. Edema macular quístico pseudofáquico. Detección mediante tomografía de coherencia óptica Arch. Soc. Esp. Oftalmol. 81:147-154.
[ Links ]
28.TRANOS PG, WICKREMASINGHE SS, STANGOS N, TOPOUZIS F, TSINOPOULOS I. 2004. Macular edema. Surv. Ophthalmol. 49(5):470-490.
[ Links ]
29.URSELL P, SPARTAN D, WHITECAP S, NUSSENBLATT R. 1999. Cystoid macular edema after phacoemulification: relationship to blood-aqueous barrier damage and visual acuity. J. Cataract. Refract. Surg. 25(11):1492-1497.
[ Links ]
30.VAJPAYEE R, NAMRATA S, SURESH P, JEEWAN, T. 2005. Phacoemulsification surgery. Jaypee Brothers Medical Publishers (P) Ltd, pp. 240-248.
31. [ Links ]VITO F, BALESTRIERI M, PERDICCHI A, ENRICI M, DELLEFAVE M, RECUPERO S. 2014. Intravitreal injection of dexamethasone implant and ranibizumab in cystoid macular edema in the course of Irving Gass Syndrome. Case. Rep. Ophthalmol. 5(2):243-248. [ Links ]
32.WMADH (WORLD MEDICAL ASSOCIATION DECLARATION OF HELSINKI). 2001. Ethical principles for Medical Research Involving Human Subjects. Bull. WHO. 79(4):151-183. [ Links ]












 uBio
uBio 
