Saber
versión impresa ISSN 1315-0162
Saber vol.28 no.4 Cumaná dic. 2016
CARACTERÍSTICAS CLÍNICAS Y EPIDEMIOLÓGICAS DE ENTEROBIASIS EN NIÑOS ESCOLARIZADOS DE UNA ZONA RURAL DEL ESTADO FALCÓN, VENEZUELA
DALMIRO CAZORLA-PERFETTI,MARÍA ACOSTA-QUINTERO ,PEDRO MORALES-MORENO
Universidad Nacional Experimental Francisco de Miranda (UNEFM), Decanato de Investigaciones, Centro de Investigaciones Biomédicas (CIB), Laboratorio de Entomología, Parasitología y Medicina Tropical (LEPAMET), Coro, Venezuela.E-mail: lutzomyia@hotmail.com / cdalmiro@gmail.com DALMIRO CAZORLA-PERFETTI,MARÍA ACOSTA-QUINTERO ,PEDRO MORALES-MORENO
RESUMEN
El entero-helminto Enterobius vermicularis es el agente causal de la enterobiasis u oxiuriasis, la cual se encuentra con mayor prevalencia en niños. Se realizó un estudio para determinar la prevalencia y los parámetros clínicos y epidemiológicos de la enterobiasis en niños escolarizados de la población rural El Paso Acurigua, estado Falcón, Venezuela. El estudio de tipo descriptivo, prospectivo y transversal, se llevó a cabo entre noviembre 2006 y abril de 2007, en un total de 82 niños. Para la identificación de los probables factores de riesgo asociados a la enterobiasis se usó una ficha encuesta-epidemiológica. El diagnóstico parasitológico se realizó con el método de la cinta adhesiva. Los síntomas asociados a oxiuriasis se determinaron mediante evaluación clínica. La prevalencia global de enterobiasis fue 40,2% (33/82), con porcentajes de infección significativamente mayores en varones (p = 0,001). Los síntomas significativamente asociados a enterobiasis fueron el prurito anal (p = 0,001), la intranquilidad (p = 0,002), el bruxismo (p = 0,000) y el dolor abdominal (p = 0,02). Con la aplicación del análisis de regresión logística múltiple (ARLM) se determinó como potenciales factores de riesgo independientes significativamente involucrados en la transmisión de la enterohelmintiasis: el prurito anal [Odds Ratio (OR) = 3,6], la onicofagia (OR = 2,8), tener uñas sucias (OR = 6,3), jugar con mascotas (OR = 2,0), defecar en pozo séptico (OR = 2,3) y el hacinamiento (≥ 6 personas/casa: OR = 19,8; ≥ 3 personas/habitación: OR = 1,8). En conclusión se determinó una elevada prevalencia de enterobiasis (40,2%) en niños escolarizados de la comunidad rural El Paso Acurigua, estado Falcón, Venezuela. Por ello, se recomienda mejorar las condiciones socio-sanitarias del sector, y mantener campañas de promoción y educación para salud.
PALABRAS CLAVE: Oxiuriasis, epidemiología, manifestaciones clínicas, niños.
CLINICAL AND EPIDEMIOLOGICAL CHARACTERISTICS OF ENTEROBIASIS IN RURAL SCHOLAR CHILDREN FROM FALCON STATE, VENEZUELA
ABSTRACT
The enteric helminth Enterobius vermicularis is the causal agent of enterobiasis or oxyuriasis, which is most prevalent in children. A study was designed to determine the prevalence and clinical and epidemiological profiles of enterobiasis in preschool and elementary school children of El Paso Acurigua, Falcon state, Venezuela. The descriptive, prospective and cross-sectional survey was performed from November 2006 to April 2007, in a total of 82 children. Probable risk factors for enterobiasis were identified by using epidemiological questionnaires. Symptoms associated to enterobiasis were determined by means of clinical examination. The diagnosis of pinworm infection was made by adhesive cellulose tape. The overall prevalence of enterobiasis was 40.24% (33/82), with significantly higher percentages of infection in boys (p = 0.001). Anal pruritus (p = 0.001), restlessness (p = 0.002), bruxism (p < 0.000) and abdominal pain (p = 0.02) were the symptoms significantly associated with enterobiasis. Multiple logistic regression analysis allowed the determination of independent potential risk factors for transmission of this enterohelminthiasis: anal pruritus [Odds Ratio (OR) = 3.6], onycophagy (OR = 2.8), dirty fingernails (OR = 6.3), pet playing (OR = 2.0), defecation on septic tank (OR = 2.3) and overcrowding (≥ 6 persons/household: OR = 19.8; ≥ 3 persons/room: OR = 1.8). Enterobiasis remains highly prevalent among school children from “El Paso Acurigua”. Thus, improving standards of living and personal-community hygiene as well as education campaigns, are advised.
KEY WORDS: Oxyuriasis, epidemiology, clinical manifestations, children.
Recibido: mayo 2016. Aprobado: julio 2016. Versión final: septiembre 2016.
INTRODUCCIÓN
La enterobiasis u oxiuriasis es ocasionada por el entero-helminto Enterobius vermicularis (Nematoda-Chromadorea, Plectia-Rhabditida, Oxyuridae, sensu Ruggiero et al. 2015), comúnmente conocido como oxiuro (Botero y Restrepo 2012). A pesar de que existen numerosas drogas antihelmínticas ampliamente disponibles, la oxiuriasis aún continúa afectando a millones de seres humanos en todo el globo terráqueo, especialmente niños en edad preescolar y escolar (Cook 1994, Kucik et al. 2004, Botero y Restrepo 2012, Kim y Yu 2014). Estas elevadas tasas de prevalencia e incidencia se explican por varias causas (e.g., biológicas, conductuales, eco-epidemiológicas), incluyendo la facilidad con que E. vermicularis se adquiere individuo a individuo, ya que el parásito posee hasta cuatro posibles mecanismos de transmisión; además, se debe tener presente el uso inadecuado de las drogas antihelmínticas (Hugot et al. 1999, Botero y Restrepo 2012).
Como se ha venido insistiendo (Cazorla-Perfetti 2014), en Venezuela a la oxiuriasis se le considera como una patología de poco interés, probablemente por el hecho de que por lo general la entero-helmintiasis no es fatal, además de que no es de reporte obligatorio (Cazorla et al. 2006a, Maniscalchi et al. 2010). Sin embargo, aunque con muy poca frecuencia, las migraciones ectópicas de E. vermicularis pueden producir eventos patológicos de consideración (Botero y Restrepo 2012, Cazorla-Perfetti 2014), e inclusive el deceso del individuo (Serpytis y Seinin 2012, Mizia-Stec et al. 2014); y de forma indirecta, principalmente en niños, insomnio, cansancio e irritabilidad, lo que posiblemente lleve a la disminución en el rendimiento escolar por el déficit de atención (Cook 1994, Kucik et al. 2004, Botero y Restrepo 2012). A pesar de que usualmente no se le atribuía a este entero-helminto efectos deletéreos sobre el estado nutricional de los niños, en la actualidad se ha demostrado que E. vermicularis disminuye los niveles de macro y microelementos (cobre, hierro, zinc y magnesio), cuyas deficiencias por lo común se encuentran asociadas estrechamente al deterioro del crecimiento y desarrollo pondoestatural, la respuesta inmune y de la capacidad intelectual (Koltas et al. 1997, Stephenson et al. 2000, Benítez y Amorós 2011, Cazorla-Perfetti 2014).
La enterobiasis es altamente frecuente en los escolares tanto rurales como de áreas urbanas de Venezuela, dándose prevalencias en algunas regiones de > 50% (Cazorla-Perfetti 2014). Similar situación se observa en el estado Falcón, región nor-occidental, especialmente en áreas rurales de la región semiárida (Monte Espinoso Tropical) donde se han registrado cifras de hasta más del 50% (Acosta et al. 2002, Cazorla et al. 2006a,b, Humbría-Heyliger et al. 2012); sin embargo, en las otras áreas biogeográficas de la entidad federal como el sistema montañoso coriano (sierra falconiana), existen pocos registros o estudios de la parasitosis intestinal aplicando el método de la cinta adhesiva en la región perianal.
Los inconvenientes planteados acerca de la enterobiasis como problema de salud pública en Venezuela, y particularmente en la región falconiana, ha motivado al equipo de investigación multidisciplinario del Laboratorio de Entomología, Parasitología y Medicina Tropical (LEPAMET), Área Ciencias de la Salud,
Coro, estado Falcón, Venezuela, a realizar un estudio para determinar la prevalencia y los parámetros clínicos y epidemiológicos de la infección por oxiuros en niños escolarizados de la población rural de El Paso Acurigua, enclavada en el pie de monte de la serranía del estado Falcón (sistema montañoso coriano), en la región Nor-Occidental de Venezuela.
MATERIALES Y MÉTODOS
Área de estudio
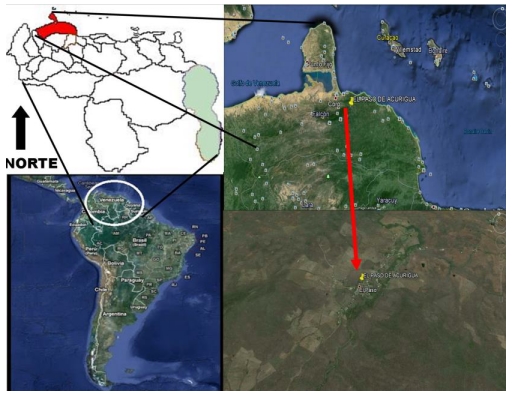
El estudio de tipo descriptivo, prospectivo y transversal, se llevó a cabo entre noviembre 2006 y abril de 2007, en la población de El Paso Acurigua (11º19´48´´ de latitud norte y 69º26´55´´ de longitud oeste), Municipio Colina del estado Falcón, Venezuela (Fig. 1). La región posee una zona bioclimática del tipo Bosque Seco Tropical (BST), con precipitación y temperatura promedio anual entre 1.000-1.800 mm y 22-29ºC, respectivamente (Ewel et al. 1976).
Muestra
De acuerdo a censo realizado, la población de El Paso de Acurigua estaba integrada por 493 habitantes. La muestra estuvo conformada por todos los 82 alumnos, 35 (42,7%) del sexo femenino, y 47 (57,3%) varones, que representaron la matrícula de la Escuela Bolivariana de El Paso de Acarigua en el periodo escolar 2006-2007, con edades comprendidas entre 3 y 14 años ( ± D.S = 7,3 ± 2,7).
Consideraciones bioéticas
A los habitantes, y a las autoridades sanitarias y educativas, se les notificó acerca de los objetivos del estudio antes de su inclusión, y los padres y representantes de los niños firmaron su consentimiento de participar. Se siguieron las normas de bioética establecidas en la Declaración Helsinki de la Asociación Médica Mundial en su versión adoptada en la LII Asamblea General de Edimburgo del año 2000. Todos los resultados de los exámenes realizados fueron entregados a cada participante. Adicionalmente, se envió un informe a las autoridades sanitarias competentes para que aplicaran el tratamiento adecuado.
Determinación de factores de riesgo
A la comunidad en general, se les dictaron charlas informativas y educativas sobre todo lo relacionado con la enterobiasis y su prevención. En la identificación de los probables factores de riesgos asociados a enterobiasis se usó una ficha encuesta-epidemiológica, aplicada a los representantes de cada niño participante. Se indagaron datos epidemiológicos de interés, que fueron anotados en ficha ad hoc. Dicha ficha epidemiológica estuvo estructurada de la siguiente manera: datos de identificación, hábitos de higiene personal y familiar, estratificación social; tenencia de mascotas, consentimiento informado. El estado socio-económico de los núcleos familiares se estableció por el método de Graffar modificado (Méndez-Castellano 1994).
Se consideró que existía hacinamiento cuando habitaban más de seis personas por casa, más de tres personas por habitación y más de dos personas
por cama (Acosta et al. 2002).
Figura 1. Ubicación geográfica de la población de El Paso de Acurigua (11º19´48´´ de latitud norte y 69º26´55´´ de longitud oeste), municipio Colina, estado Falcón, Venezuela.
Evaluación clínica
La evaluación clínica se realizó con especial énfasis en la búsqueda de síntomas generalmente asociados con la infección por E. vermicularis, incluyendo, entre otros, prurito anal, enuresis, lesiones perianales, bruxismo, vulvovaginitis, intranquilidad (Botero y Restrepo 2012). Es importante señalar que tanto la evaluación clínica y parasitológica fue realizada bajo la supervisión y ejecución de la médico especialista del grupo (MAQ).
Examen parasitológico oviscópico
Se aplicó, una vez a primeras horas de la mañana (alrededor 6-7 am) antes del aseo personal y defecación, la técnica oviscópica de la cinta adhesiva transparente de Graham (Graham 1941, Botero y Restrepo 2012), como se ha descrito en trabajos previos (Acosta et al. 2002, Cazorla et al. 2006a,b, Humbría-Heyliger et al. 2012).
Análisis estadístico
La asociación univariante entre las manifestaciones clínicas y los posibles factores de riesgo con la presencia de los oxiuros, se hizo mediante las pruebas estadísticas de Ji cuadrado (χ2) y χ2 de Mantel-Haenczel y la de χ2 de la razón de verosimilitud, respectivamente. Se consideró p ≤ 0,05 como nivel de significación. En aquellos casos donde se encontró una asociación significativa en el análisis univariado, la fuerza se determinó mediante los Odds Ratio (OR) o productos de la razón cruzada o de momios. Mientras mayor sea un OR indicará un riesgo elevado (≥ 1). En lo referente a las manifestaciones clínicas, los OR se obtuvieron por las tablas de contingencia (análisis bivariante simple), y para los factores de riesgo por análisis de regresión logística múltiple (ARLM) utilizándose como método de estimación de parámetros el de Máxima Verosimilitud, y calculándose su bondad de ajuste con la prueba de Hosmer-Lemeshow, a fin de poder controlar las variables de confusión (confounding variables). Los datos se analizaron mediante paquete estadístico SIGMAPLOT versión 12.5 (Systat Software Inc.), y página Web para cálculos estadísticos Simple Interactive Statistical Analysis (SISA).
RESULTADOS
Del total de 82 niños examinados, se encontraron parasitados con E. vermicularis 33 (Fig. 2) para una prevalencia de la infección de 40,2%; de éstos, 7 (21,2%) correspondieron al sexo femenino y 26 (78,8%) al masculino, para una diferencia significativa en relación con el género [χ2 = 10,2; p = 0,001], resultados éstos que se muestran en la Tabla 1. En lo referente a los grupos etarios, los niños en edad escolar presentaron los mayores porcentajes de infección por E. vermicularis (72,7 vs. 27,3%), sin embargo estas diferencias no fueron estadísticamente significativas (χ2 = 14,8; p = 0,19) (Tabla 1).
En la Tabla 2, se muestran los signos y síntomas. El prurito anal se presentó en 22 (66,67%) de los niños parasitados y 15 (30, 61%) de los no parasitados (χ2 = 10,32; OR = 3,6; p = 0,001); la intranquilidad se detectó en 15 (45,46%) de los niños parasitados y 7 (14,29%) de los no parasitados (χ2 = 9,6; OR = 5; p = 0,001); mientras que el bruxismo se presentó en 20 (60,61%) de los niños parasitados y 10 (20,41%) de los no parasitados (χ2 = 13,6; OR = 6; p = 0,001), y el dolor abdominal en 8 (24,24%) de los niños parasitados y 3 (6,12%) delos no parasitados (χ2 = 5,5; OR = 4,9; p = 0,001) (Tabla 2). Dentro de los hábitos de higiene personal y familiar (Tablas 3 y 4) se encontraron significativamente asociados a oxiuriasis, la onicofagia (χ2 = 4,6; p = 0,03), uñas sucias (χ2 = 16,8; p = 0,001), jugar con mascotas (χ2 = 5,2; p = 0,02), no lavar las manos antes (χ2 = 22,0; p = 0,000) y después (χ2 = 5,5; p = 0,02) de comer y al defecar (χ2 = 10,4; p = 0,001), colgar la ropas juntas (χ2 = 6,8; p = 0,01), defecar en pozo séptico (χ2 = 5,6; p = 0,02),recolectar la basura en bolsas plásticas (χ2 = 13,9; p = 0,000), el hacinamiento (≥ 6 personas/casa: χ2 = 30,4; p = 0,000); ≥ 3personas/habitación: χ2 = 5,2; p = 0,02); y en lo referente a las condiciones socio-económicas (Graffar), pertenecer a un núcleo familiar con un bajo nivel de pobreza relativa o crítica (χ2 = 12,0; p = 0,001) (Tabla 4).
Los Odds Ratio (OR; 95% intervalo de confianza) de los factores de riesgo significativamente asociados con la infección por E. vermicularis, tal como lo sugieren sus OR ≥1, fueron: padecer de prurito anal (OR = 3,6), practicar la onicofagia (OR = 2,8), poseer las uñas sucias (OR = 6,3), jugar con mascotas (OR = 2,0), defecar en pozo séptico (OR = 2,3) y vivir en hacinamiento (≥ 6 personas/casa: OR = 19,8; ≥ 3 personas/habitación: OR = 1,8) (Tabla 5).
De acuerdo a la prueba de Hosmer y Lemeshow, se obtuvieron valores no significativos (χ2 = 3,03, p = 0,8917), con lo cual se considera que el modelo cuenta con buen ajuste.
Tabla 1. Prevalencia de enterobiasis por grupos de edades y sexo, en niños de El Paso de Acurigua, estado Falcón,Venezuela.
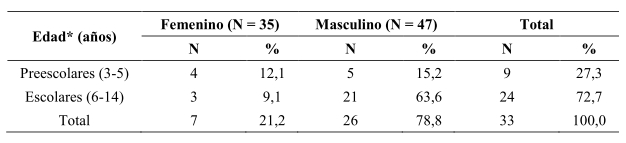
Tabla 2. Manifestaciones clínicas asociadas con enterobiasis en niños de El Paso de Acurigua, estado Falcón, Venezuela.
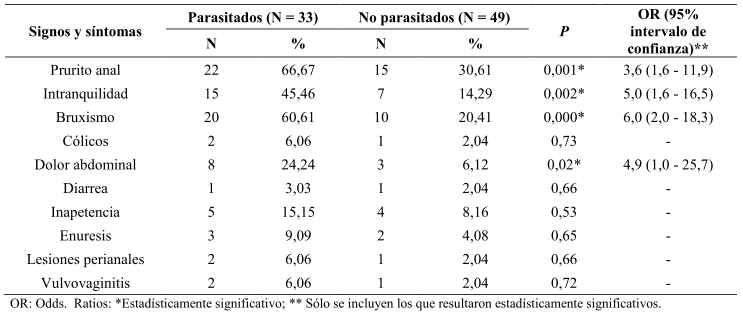
Tabla 3. Hábitos de higiene personal y familiar y su asociación con enterobiasis en niños de El Paso de Acurigua, estado Falcón, Venezuela.
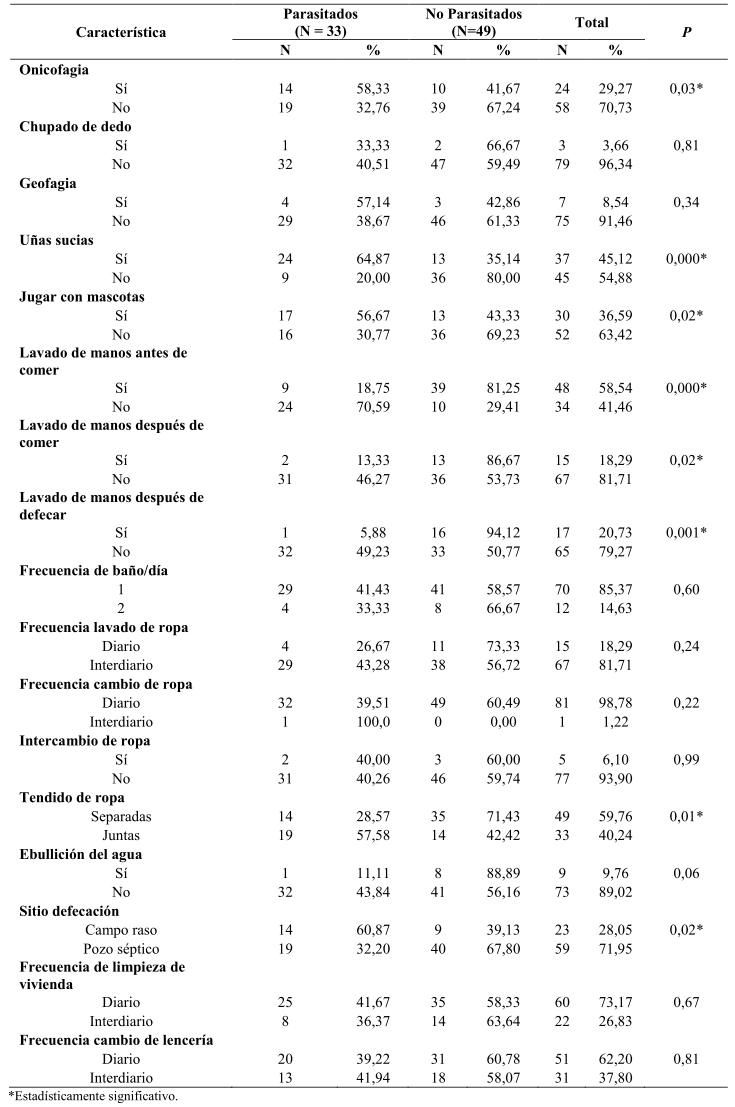

Tabla 2. Manifestaciones clínicas asociadas con enterobiasis en niños de El Paso de Acurigua, estado Falcón, Venezuela.

Tabla 3. Hábitos de higiene personal y familiar y su asociación con enterobiasis en niños de El Paso de Acurigua, estado Falcón, Venezuela.

Tabla 4. Hábitos de higiene personal y familiar y condición socio-económica (Graffar) y su asociación con enterobiasis en niños de El Paso de Acurigua, estado Falcón, Venezuela.
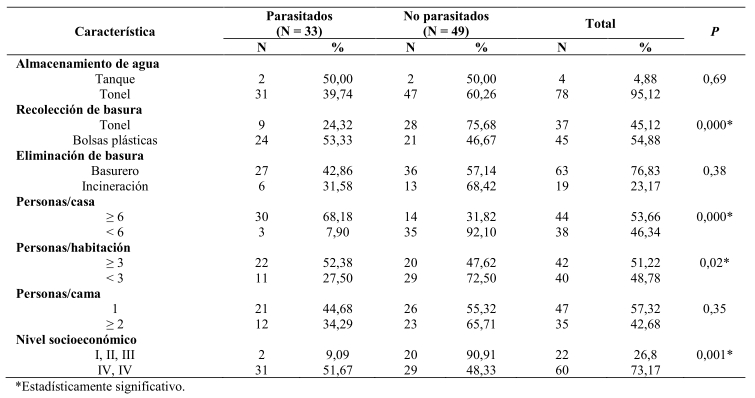
Tabla 5. Odds Ratios (OR) obtenidos del análisis de regresión logística múltiple (ARLM) para factores de riesgo potencialmente asociados a enterobiasis en niños de El Paso de Acurigua, estado Falcón, Venezuela.
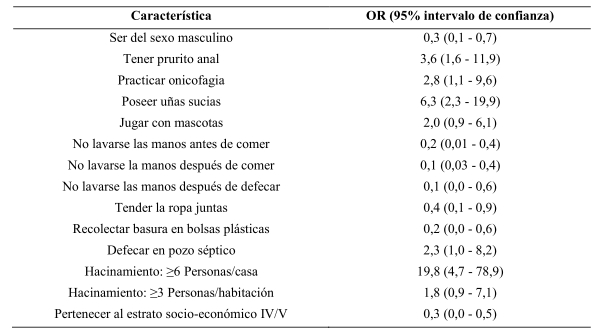
Figura 2. Huevos de Enterobius vermicularis sobre la superficie de cinta adhesiva. A: 50X; B: 100X; C: 400X.
DISCUSIÓN 
A pesar de su ubicuidad, las tasas de infección por E. vermicularis pueden variar de región en región y dentro de un mismo país, dependiendo de varios factores como los de tipo climático, socio-económicos, demográficos, culturales e inclusive del método de diagnóstico (Deĝerli et al. 2009 Maniscalchi et al. 2010, Botero y Restrepo 2012). En este sentido, la prevalencia de 40,2% encontrada en niños matriculados en la Escuela Bolivariana de El Paso de Acarigua, estado Falcón, Venezuela, es comparativamente mayor o menor que las detectadas en estudios realizados en otros estados del país, incluyendo Trujillo (46,5%) (Oropesa et al. 2010); Mérida (4,8 y 24,7%) (Scorza et al. 1974); Zulia (8,6 y 55%) (Romero de Olaria 1979, Páez de Mourad y Calchi 1994, Simoes et al. 2000, Rivero et al. 2001); Bolívar (4,7-45,8%) (Devera et al. 1998, Requena-Certad et al. 2002, Requena et al. 2007, Cañas et al. 2013); Anzoátegui (11,2-49%) (Greatty et al. 1994, González et al. 1995, Maniscalchi et al. 2010, Martínez y Batista 2011); Lara (17,7-39,1%) (Pérez et al. 2011, Cervantes et al. 2012); Miranda (19,2%) (Arencibia et al. 2013). Esta cifra de 40,2% se encuentra dentro del rango encontrado en la región falconiana (23-57,8%) (Acosta et al. 2002, Cazorla et al. 2006a,b, Humbría-Heyliger et al. 2012), confirmando una vez más que esta entero-helmintiasis es altamente prevalente en preescolares y escolares de la entidad, especialmente en su área rural.
A diferencia de los hallazgos hechos en otras áreas de Venezuela (e.g., Devera et al. 1998, Maniscalchi et al. 2010, Requena-Certad et al. 2002, Requena et al. 2007) y particularmente de la zona semiárida del estado Falcón (Acosta et al. 2002, Cazorla et al. 2006a,b, Humbría-Heyliger et al. 2012), en los preescolares y escolares del presente estudio, se determinó que los varones exhibieron prevalencias de oxiuriasis significativamente mayores que las de sus contrapartes del sexo femenino. Como posible explicación a estas diferencias, se ha indicado que las niñas adquieren hábitos de higiene más temprano, además de que los varones son más hiperactivos (Requena-Certad et al. 2002, Lee et al. 2011). En relación con los grupos de edades, no se encontró una asociación estadísticamente significativa entre esta variable y la infección por E. vermicularis, lo que sugiere que todos los individuos se encuentran expuestos en similares condiciones de riesgo; esto coincide con varios estudios hechos en otras regiones de Venezuela (e.g., Devera et al. 1998, Requena-Certad et al. 2002, Requena et al. 2007, Maniscalchi et al. 2010,), y el estado Falcón (Acosta et al. 2002, Cazorla et al. 2006a,b, Humbría-Heyliger et al. 2012). Sin embargo, es necesario acotar que otros investigadores han observado tasas de infección significativamente mayores en niños en edad escolar, considerando que los preescolares reciben cuidados especiales de sus cuidadores, y se encuentran confinados en las aulas de clase durante las actividades de recreo y merienda (Norhayati et al. 1994, Song et al. 2003).
La mayoría de los investigadores concuerdan en que el prurito anal es el síntoma más comúnmente relacionado con la presencia de los oxiuros (Gilman et al. 1991, Botero y Restrepo 2012, Zhao et al. 2013, Cazorla-Perfetti 2014), tal como se detectó en los niños estudiados (OR = 3,6), así como también en estudios similares hechos en la región falconiana (Acosta et al. 2002, Cazorla et al. 2006a,b, Humbría-Heyliger et al. 2012). Éste se origina, especialmente en horas nocturnas, cuando la hembra del entero-helminto sale por el ano y al arrastrarse libera una sustancia pegajosa que ocasiona la alergia local (Cook 1994, Gilman et al. 1991, Botero y Restrepo 2012). Este rascado durante las horas de pernocta, perjudica las actividades de aprendizaje de los niños en la escuela, debido a que el insomnio con intranquilidad los estresan y les disminuye su capacidad de atención (Botero y Restrepo 2012), como en los preescolares y escolares del presente estudio (OR = 5). Además, debe tenerse en cuenta de que la “vergüenza de tener gusanos” puede influir en la salud mental de los niños (Chang et al. 2009). Contrastando con otros trabajos realizados en la zona semiárida falconiana (Cazorla et al. 2006a,b, Humbría-Heyliger et al. 2012), el bruxismo (OR = 6) fue otro de los síntomas de la alteración del comportamiento significativamente asociado con la infección por E. vermicularis en los niños de El Paso de Acurigua, estado Falcón, Venezuela. Tal como se observó en el presente trabajo (OR = 4,9), los oxiuros se encuentran entre otro de los posibles agentes de origen parasitario que ocasionan dolor abdominal en los humanos (Botero y Restrepo 2012, Giorgio et al. 2012, Thomassen et al. 2012, Yazgan et al. 2015). No obstante lo discutido, es necesario que se realicen estudio clínicos más controlados y aleatorizados, especialmente los de tipo caso-control, para determinar más fehacientemente la relación causa-efecto entre los oxiuros y las manifestaciones clínicas que potencialmente ocasionan (Gilman et al. 1991, Rodríguez-Morales 2009); esto debido a que no se analizó la presencia de otros parásitos intestinales y de que muchas de estas manifestaciones clínicas no son patognomónicas de las infecciones por E. vermicularis.
El éxito de E. vermicularis para diseminarse dentro de las poblaciones humanas, depende en gran medida de su capacidad de poseer hasta cuatro mecanismos de transmisión, siendo el más común y ampliamente reconocido el de “mano-ano-boca” (Cook 1994, Hugot et al. 1999, Botero y Restrepo 2012). El hecho de haberse encontrado que el prurito anal (OR = 3,6) y la onicofagia (OR = 2,8) con uñas sucias (OR = 6,3) se presentaron en los niños de El Paso de Acurigua, estado Falcón, Venezuela, significativamente asociados a la presencia de E. vermicularis y en una elevada frecuencia, conduce a sugerir que la vía oral “mano-ano-boca” debe estar jugando un papel importante en la diseminación de los huevos del entero-helminto en la zona. La denominada “diseminación aerosol” también se encuentra dentro de los mecanismos que utilizan los oxiuros
para trasmitirse, la cual consiste en aprovechar la facilidad de flotación de los huevos cuando son esparcidos por el viento, pudiendo contaminar todo tipo de superficies (fomites) (e.g., enseres, alimentos, agua) (Hugot et al. 1999). Esta característica ayuda a explicar la asociación entre la presencia de oxiuros y el “jugar con mascotas” (OR = 2), pudiendo de esta manera entrar por vía oral los huevos del parásito, que potencialmente se encuentran en el pelo de sus mascotas (e.g., perros, gatos) (Hugot et al. 1999, Tavassoli et al. 2012), cuando los niños se llevan de una manera deliberada o no las manos a la boca.
El hacinamiento se encuentra dentro de los factores más importantes que contribuyen en la diseminación intradomiciliar persona-persona de los oxiuros, cuyos huevos no necesitan, a diferencia de la mayoría de los geohelmintos, de las condiciones microambientales para su desarrollo (Requena et al. 2002, Wang et al. 2009, Botero y Restrepo 2012, Cazorla-Perfetti 2014). Esta afirmación se ha demostrado fehacientemente en los estudios hechos en el semiárido falconiano (Acosta et al. 2002, Cazorla et al. 2006a,b, Humbría-Heyliger et al. 2012), y se reafirma una vez más en los niños escolarizados del presente trabajo, en donde se encontró porcentajes de infección de oxiuriasis significativamente mayores en niños provenientes de núcleos familiares con un elevado grado de hacinamiento (≥ 6 personas/casa, OR = 19,8; ≥ 3 personas/habitación, OR = 1,8).
El hecho de que exista en la comunidad la costumbre de colgar la vestimenta juntas en la familia, habla a favor que esta sea otra de las vías de diseminación intradomiciliar persona-persona (Botero y Restrepo 2012, Cazorla-Perfetti et al. 2015), aunque su asociación con el helminto intestinal fue débil (OR = 0,4).
En algunas regiones a E. vermicularis se le denomina comúnmente como “gusano de los asientos” (thread worm), esto debido a que a través de los inodoros contaminados cuando los individuos se sientan pueden servir vía fómite para la transmisión (Botero y Restrepo 2012). Esto ayudaría a explicar el hallazgo de mayores porcentajes de infección por oxiuros en los niños de El Paso de Acurigua, estado Falcón, Venezuela, que defecaban en pozo séptico (OR = 2,3), en comparación con aquellos que lo hacían a campo raso.
Varios autores han encontrado una asociación significativa entre el estrato socio-económico familiar y la infección por oxiuros (Changsap et al. 2002, Chang et al. 2009, Keskin y Ay Bektaş 2014). En los estudios realizados en la región falconiana, se ha detectado una relación directa entre el entero-nematodo y el bajo grado de instrucción de las madres, como variable socio-económica (Cazorla et al. 2006a), las cuales necesitan de un conocimiento básico de educación para la salud en parasitosis intestinales y particularmente en enterobiasis, para reducir las tasas de infección (Kang et al. 2012, Kim y Yu 2014). La mayoría de los preescolares y escolares de El Paso de Acurigua, estado Falcón, Venezuela, provenían de hogares con grado alto de pobreza relativa y crítica; sin embargo, esta característica no se encontró fuertemente asociada a la presencia de los oxiuros (OR = 0,3). Sin embargo, el hecho de presentarse en la comunidad tasas de prevalencia de enterobiasis > 40%, es por sí solo un indicativo de serios problemas de higiene comunitaria y familiar, insalubridad y los de tipo socio-económico (Botero y Retrepo 2012).
CONCLUSIONES
La enterobiasis es altamente prevalente (40,2%) en los niños escolarizados de El Paso de Acurigua de la sierra falconiana. Los deficientes hábitos de higiene personal y condiciones socio-económicos limitadas contribuyen con la transmisión y mantenimiento endémico de E. vermicularis.
AGRADECIMIENTOS
Comunidad y Autoridades educativas y sanitarias de El Paso Acurigua, estado Falcón, Venezuela.
REFERENCIAS BIBLIOGRÁFICAS
1.ACOSTA M, CAZORLA D, GARVETT M. 2002. Enterobiasis en escolares de una población rural del estado Falcón, Venezuela y su relación con el nivel socio-económico. Invest. Clín. 43(3):173-181.
[ Links ]
2.ARENCIBIA H, LOBAINA J, TERÁN C, LEGRÁ R, ARENCIBIA A. 2013. Parasitismo intestinal en una población infantil venezolana. Medisan. 17(5):742-748. [ Links ]
3.BENÍTEZ M, AMORÓS C. 2011. Vitaminas y oligoelementos. Pediatr. Integral. 15(5):427-445.
4. [ Links ]BOTERO D, RESTREPO M. 2012. Oxiuriasis. En: Parasitosis Humanas. 5a ed. Corporación para Investigaciones Biológicas, Medellín, Colombia, pp. 177-186. [ Links ]
5.CAÑAS N, FARIÑAS A, RICO T, SUÁREZ S, BENÍTEZ M. 2013. Parasitismo intestinal en escolares, Parroquia Pozo Verde, Estado Bolívar, Venezuela. Septiembre-Octubre 2006. Hig. Sanid. Ambient. 13(2):975-979.
[ Links ]
6.CAZORLA D, ACOSTA M, ZÁRRAGA A, MORALES P. 2006a. Estudio clínico-epidemiológico de enterobiasis en preescolares y escolares de Taratara, estado
Falcón, Venezuela. Parasitol. Latinoam. 61(1/2):43-53.
[ Links ]
7.CAZORLA D, ACOSTA M, GARCÍA E, GARVETT M, RUIZ A. 2006b. Enterobius vermicularis infection in preschool and schoolchildren of six rural communities from a semiarid region of Venezuela: A clinical and epidemiological study. Helminthologia. 43(2):81-85.
[ Links ]
8.CAZORLA-PERFETTI D. 2014. Aspectos relevantes de la enterobiosis humana: revisión crítica. Saber. 26(3):221-242.
[ Links ]
9.CAZORLA-PERFETTI D, LEHMANN S, CARRERO C, BRAVO F, ACOSTA-QUINTERO M, MORALES-MORENO P. 2015. Perfiles clínicos y epidemiológicos de la infección por coccidios intestinales en Mirimire, estado Falcón, Venezuela. Saber. 27(1):46-60.
[ Links ]
10.CERVANTES J, OTAZO G, ROJAS M, VIVAS F, YOUSSEPH Y, ZECHINI V, D´APOLLO R, CÁRDENAS E, TRAVIEZO L. 2012. Enteroparásitos, enterobiasis y factores de riesgo en niños preescolares. Salud, Arte y Cuidado. 5(1):47-54. [ Links ]
11.CHANG J, HUANG W, CHEN E, HU S. 1990. Survey of Enterobius vermicularis infection among school children in Tainan City. Kaohsiung J. Med. Sci. 6(11):587-593. [ Links ]
12.CHANG T, LIAO C, HUANG Y, CHANG C, CHOU C, TSAY H, HUANG A, GUU S, KAO T, FAN C. 2009. Prevalence of Enterobius vermicularis infection among preschool children in kindergartens of Taipei City, Taiwan in 2008. Korean J. Parasitol. 47(2):185-187. [ Links ]
13.CHANGSAP B, NITHIKATHKUL C, BOONTAN P, WANNAPINYOSHEEP S, VONGVANICH N, POISTER C. 2002. Enterobiasis in primary schools in Bang Khun Thian District, Bangkok, Thailand. Southeast Asian J. Trop. Med. Public Health. 33(Suppl. 3):72-75. [ Links ]
14.COOK G. 1994. Enterobius vermicularis. Gut. 35(9):1159-1162. [ Links ]
15.DEĜERLI S, MALATYALI E, ÖZÇELIK S, ÇELIKSÖZ A. 2009. Enterobiosis in Sivas, Turkey from past to present, effects on primary school children and potential risk factors. Türkiye Parazitol. Derg. 33(1):95-100. [ Links ]
16.DEVERA R, PÉREZ C, RAMOS Y. 1998. Enterobiasis en escolares de Ciudad Bolívar, estado Bolívar, Venezuela. Bol. Chil. Parasitol. 53(1-2):14-18. [ Links ]
17.EWEL J, MADRIZ, TOSI JR J. 1976. Bosque seco tropical. En: Zonas de Vida de Venezuela. Memoria explicativa sobre el mapa ecológico. 2a edición. Editorial Sucre, Caracas, Venezuela, pp. 76-88. [ Links ]
18.GILMAN R, MARQUIS G, MIRANDA E. 1991. Prevalence and symptoms of Enterobius vermicularis infections in a Peruvian shanty town. Trans. R. Soc. Trop. Med. Hyg. 85(6):761-764. [ Links ]
19.GIORGIO V, MONACO S, ONESIMO R, FUNDARÒ C. 2012. Don't forget 'simple' causes of abdominal pain. BMJ Case Rep. 2012. pii:bcr2012006502. [ Links ]
20.GONZÁLEZ C, GREATTY O, SÁNCHEZ J. 1995. Estudio comparativo del régimen de dosificación única entre albendazol y pamoato de pirantel para tratamiento de enterobiasis en población infantil del barrio "José A. Anzoátegui" de la ciudad de Puerto La Cruz. 1993. Actual. Infect. 11(1/3):2-6. [ Links ]
21.GRAHAM C. 1941. A device for the diagnosis of Enterobius infection. Am. J. Trop. Med. 21(2):159-161.
22. [ Links ]GREATTY O, GONZÁLEZ C, SÁNCHEZ M, MOROCOIMA A. 1994. Incidencia de enterobiasis de una población del estado Anzoátegui: obtenido a través del método de Graham. Acta Cient. Venez. 43(Suppl. 1):263. [ Links ]
23.HUGOT J, REINHARD K, GARDNER S, MORAND S. 1999. Human enterobiasis in evolution: origin, specificity and transmission. Parasite. 6(3):201-208.
[ Links ]
24.HUMBRÍA-HEYLIGER L, TOYO M, CAZORLA D, MORALES P. 2012. Estudio clínico-epidemiológico de enterobiasis en niños de una comunidad rural del estado Falcón-Venezuela. Bol. Mal. Salud Amb. 52(2):211-222. [ Links ]
25.KANG I, KIM D, AN H, SON H, CHO M, PARK M,KANG S, KIM B, YU H. 2012. Impact of health education on the prevalence of enterobiasis in Korean preschool students. Acta Trop. 122(1):59-63. [ Links ]
26.KESKIN N, AY BEKTAŞ A. 2014. The prevalence of Enterobius vermicularis in primary school which have different socioecomic level in Ankara. Turkiye Parazitol. Derg. 38(3):159-165. [ Links ]
27.KIM D, YU H. 2014. Effect of a one-off educational session about enterobiasis on knowledge, preventative practices, and infection rates among schoolchildren in South Korea. PLoS One. 9(11):e112149.
28. [ Links ]KOLTAS I, OZCAN K, TAMER L, AKSUNGUR P. 1997. Serum copper, zinc and magnesium levels in patients with enterobiosis. J. Trace Elem. Med. Biol. 11(1):49-52. [ Links ]
29.KUCIK C, MARTIN G, SORTOR B. 2004. Common intestinal parasites. Am. Fam. Physician. 69(5):1161-1168. [ Links ]
30.LEE S, LEE J, JU J, LEE W, CHO S. 2011. Prevalence of Enterobius vermicularis among preschool children in Gimhae-si, Gyeongsangnam-do, Korea. Korean J. Parasitol. 49(2):183-185. [ Links ]
31.MANISCALCHI M, LEMUS-ESPINOZA D, KIRIAKOS D, PACHECO F, APONTE C, VILLARROEL O, HARB P. 2010. Enterobius vermicularis en niños del área rural del estado Anzoátegui, Venezuela. Rev. Soc. Venez. Microbiol. 30(2):128-133. [ Links ]
32.MARTÍNEZ R, BATISTA O. 2011. Parasitismo intestinal y factores asociados en la población infantil de la comunidad Santa Bárbara, Venezuela. Rev. Panam. Infectol. 13(2):38-45.
[ Links ]
33.MÉNDEZ-CASTELLANO H. 1994. Fundacredesa: Proyecto Venezuela 1993. Arch. Venez. Puer. Ped. 57(1):34-35.
[ Links ]
34.MIZIA-STEC K, WYBRANIEC M, BOCHENEK T, GIERLASZYŃSKA K, GĄSIOR M, WOJNICZ R. 2014. Fulminant variant of Loeffler disease imicking arrhythmogenic right ventricular cardiomyopathy in the course of enterobiasis. Eur. Heart J. 35(46):3266.
[ Links ]
35.NORHAYATI M, HAYASCTI M, OOTHUMAN P, AZIZI O, FATMAH M, ISMAIL Y, MINUDIN Y. 1994. Enterobius vermicularis infection mong children aged 1-8 years in a rural area of Malaysia. Southeast Asian J. Trop. Med. Public Health. 25(3):494-497.
[ Links ]
36.OROPESA O, QUEVEDO G, LEYVA L, FERRA B, FERRER I, RODRÍGUEZ N. 2010. Intervención educativa sobre parasitismo intestinal en niños de la Escuela Primaria Salvano Velazco, Boconó. Correo Científico Médico de Holguín. 2010:14(1). Disponible en línea: http://www.cocmed.sld.cu/no141/no141ori04.htm (Acceso: 25.05.2016).
[ Links ]
37.PÁEZ DE MOURAD B, CALCHI M. 1994. Prevalencia de parasitosis intestinales en alumnos del preescolar INSP José Celestino Azuaje, el Policita, municipio Maracaibo, estado Zulia. Kasmela. 22(1/4):51-69. [ Links ]
38.PÉREZ J, SUAREZ M, TORRES C, VÁSQUEZ M, VIELMA Y, VOGEL M, CÁRDENAS E, HERRERA E, SÁNCHEZ J. 2011. Parasitosis intestinales y características epidemiológicas en niños de 1 a 12 años de edad: ambulatorio urbano II Laura Labellarte, Barquisimeto, Venezuela. Arch. Venez. Pueric. Pediatr. 74(1):16-22.
[ Links ]
39.REQUENA I, JIMÉNEZ Y, RODRÍGUEZ N, SANDOVAL M, ALCALA F, BLANCO Y, DEVERA R. 2007. Enterobius vermicularis en preescolares de un área suburbana en San Félix, estado Bolívar, Venezuela. Invest. Clin. 48(3):277-286.
[ Links ]
40.REQUENA-CERTAD I, LIZARDI V, MEJÍA L, CASTILLO H, DEVERA R. 2002. Infección por Enterobius vermicularis en niños pre escolares de Ciudad Bolívar, Venezuela. Rev. Biomed. 13(4):231-240.
[ Links ]
41.RIVERO Z, DÍAZ I, ACURERO E, CAMACHO M, MEDINA M, RÍOS L. 2001. Prevalencia de parásitos intestinales en escolares de 5 a 10 años de un instituto del municipio Maracaibo, Edo. Zulia-Venezuela. Kasmera. 29(2):153-170.
42. [ Links ]RODRÍGUEZ-MORALES A. 2009. Parasitología basada en evidencias: una nueva filosofía en el estudio y manejo de las enfermedades parasitarias. Rev. Cient. Cienc. Med. 12(2):38-41. [ Links ]
43.ROMERO DE OLARIA T. 1979. Estudios sobre la incidencia de enterobiasis en niños del Hospital Universitario de Maracaibo, utilizando el método de Graham modificado por Jacobs. Kasmera. 7(1/4):95-115.
[ Links ]
44.RUGGIERO M, GORDON D, ORRELL T, BAILLY N,BOURGOIN T, BRUSCA R, CAVALIER-SMITH T, GUIRY M, KIRK P. 2015. A higher level classification of all living organisms. PLoS One. 10(4):e0119248.
[ Links ]
45.SCORZA J, AÑEZ N, LÓPEZ N, PÉREZ M, ROSSELL O, RODRÍGUEZ A, ARAGORT R, GOTTBERG C. 1974. Postgrado de Parasitología. Helmintiasis. Talleres Gráficos de la Universidad de Los Andes, Mérida, Venezuela, pp. 137. [ Links ]
46.SERPYTIS M, SEININ D. 2012. Fatal case of ectopic enterobiasis: Enterobius vermicularis in the kidneys. Scand. J. Urol. Nephrol. 46(1):70-72.
[ Links ]
47.SIMOES M, RIVERO Z, CARREÑO G, LUGO M, MALDONADO A, CHACÍN I, PARRA M, MÉNDEZ Y, MARQUINA M. 2000. Prevalencia de enteroparasitosis en una
escuela urbana en el municipio San Francisco, estado Zulia, Venezuela. Kasmera. 28(1):27-43.
[ Links ]
48.SONG H, CHO C, KIM J, CHOI M, HONG S. 2003. Prevalence and risk factors for enterobiasis among school children in a metropolitan city in Korea. Parasitol. Res. 91(1):46-50.
[ Links ]
49.STEPHENSON I, LATHAN M, OTTESEN E. 2000. Malnutrition and parasitic helminth infections. Parasitology. 12 (Suppl.):23-38.
50. [ Links ]THOMASSEN I, KLINKHAMER P, VAN DE POLL M. 13-Year old boy with abdominal pain. Ned. Tijdschr. Geneeskd. 156(18):A3566.
[ Links ]
51.TAVASSOLI M, JAVADI S, FIROZI R, REZAEI F, KHEZRI A, HADIAN M. 2012. Hair contamination of sheepdog and pet dogs with Toxocara canis eggs. Iranian J. Parasitol. 7(4):110-115. [ Links ]
52.WANG C, LEE Y, CHANG C, LEE N, CHEN P, HUANG F, LIOU N. 2009. Current status of Enterobius vermicularis infection in primary schoolchildren in Miaoli County and Taichung County, Taiwan. J. Microbiol. Immunol. Infect. 42(5):420-426.
[ Links ]
53.YAZGAN S, ÇETINKAYA Ü, ŞAHIN I. 2015. The investigation of prevalence of Enterobius vermicularis (L. 1758) in primary school age children and its relation to various symptoms. Turkiye Parazitol. Derg. 39(2):98-102.
[ Links ]
54.ZHAO L, AN R, SHI X, WANG L, LI Y. 2013. Investigation on pinworm infection and relative factors on prevalence among urban and rural preschool children in Xianyang City. Zhongguo Ji Sheng Chong Xue Yu Ji Sheng Chong Bing Za Zhi. 31(4):262-263. [ Links ]












 uBio
uBio 
