Revista de la Sociedad Venezolana de Microbiología
versión impresa ISSN 1315-2556
Rev. Soc. Ven. Microbiol. v.21 n.2 Caracas jul. 2001
Resistencia de Klebsiella pneumoniae a los antimicrobianos en Venezuela.
Análisis de una década
De la Parte-Pérez, M. A.1; Brito, A.2; Guzmán, M.3; Carmona, O.3 y GVRB3.
1. Escuela de Enfermería, Universidad Central de Venezuela (UCV).
2. Escuela de Medicina "J. M. Vargas", UCV.
3. Grupo Venezolano de Vigilancia de la Resistencia Bacteriana.
Resumen
Describimos y analizamos la evolución de la resistencia de Klebsiella pneumoniae a los antimicrobianos durante el período 1989-1998, en Venezuela. Estudiamos 14.970 aislados de K. pneumoniae procedentes de los centros de salud que conforman el GVRB, realizando antibiograma según normas del NCCLS, con los siguientes resultados: para betalactámicos clásicos, ampicilina progresa del 94% en 1989 al 97% en 1998; ampicilina-sulbactam y amoxicilina-clavulánico se mantienen entre el 30-40%; carbenicilina reporta hasta el 98%; piperacilina 40-50%; y piperacilina-tazobactam entre el 8 y el 16%. Su comportamiento frente a cefalosporinas: cefotaxima ha tenido un ascenso rápido, ubicándose cerca del 70%; ceftriaxona reportó hasta el 59%; ceftazidima llegó hasta el 53%; cefoperazona cercano al 30%; y cefoperazona-sulbactam <5%. Para aminoglucósidos, la resistencia está entre el 20 y el 40%, sin cambios notables durante el período estudiado. Las quinolonas se mantienen con valores menores al 10%, excepto para lomefloxacina, que alcanza el 18%. Los carbapenemos reportan resistencia menor al 1%.
Palabras-clave: Klebsiella pneumoniae, vigilancia de la resistencia bacteriana, antimicrobianos.
Resistance of Klebsiella pneumoniae to antimicrobial agents in Venezuela.
Analysis of a decade
Abstract
Klebsiella pneumoniae's antibiotic resistance was analyzed to follow-up changes during 1989 to 1998, according to the data-base of the Vigilance Program of Bacterial Resistance to Antibiotics in Venezuela (GVRB). Resistance has been measured by the disc diffusion test, adopting the NCCLS breakpoints in 14.970 isolates recuperated from hospital and community infections from fifteen bacteriology laboratories reporting to GVRB. Results: for classic ß-lactam: resistance to ampicillin rises from 94% in 1989 to 97% in 1998, ampicillin-sulbactam and amoxicillin-clavulanic acid levels are between 30 and 40%; carbenicillin reports up to 98%; piperacillin between 40 and 50%; piperacillin-tazobactam around 15%. Results for cephalosporins are: cefotaxime has risen rapidly from 6% to 69%. Ceftriaxone reports resistance of 59%, ceftazidime up to 53% and cefoperazone values are near 30%; cefoperazone-sulbactam with resistance <5%. Aminoglucosides, show little changes in resistance values being between 20 and 40% for the period analyzed. Quinolones keep low values (less than 10%), excepting lomefloxacine which reports up to 18%. Carbapenems resistance is below 1%.
Introducción
Las bacterias agrupadas en el género Klebsiella son enterobacterias Gram-negativas de morfología bacilar inmóviles, capsuladas de 0,3 a 1,5 x 0,6 a 6,µm, agrupadas en pares o cadenas cortas, y pueden ser consideradas bacterias oportunistas. La especie tipo es K. pneumoniae, la cual se halla en las vías respiratorias y en las heces de aproximadamente el 5-10% de los individuos sanos, y es responsable de un pequeño porcentaje de neumonías bacterianas.
El género Klebsiella comprende las siguientes especies:
1. K. pneumoniae o bacilo de Friedlaender, que es la especie más importante. Puede producir necrosis pulmonar complicada, con hemorragia extensa del pulmón. También, ocasionalmente, produce infecciones urinarias y bacteriemia, que puede sembrar focos a distancia en pacientes debilitados.
2. K. oxytoca, variante indol-positiva de K. pneumoniae. Produce las mismas manifestaciones clínicas.
3. K. ozaenae, agente causal de la ocena, caracterizada por atrofia progresiva y fétida de la mucosa nasal y faríngea.
4. K. rhinoescleromatis, agente productor del rinoescleroma, un granuloma destructivo de la nariz y faringe.
5. K. pneumoniae y K. oxytoca producen infecciones hospitalarias o nosocomiales.
Carmona y cols., reportan siete especies de Klebsiella, y cinco de ellas de importancia en clínica, siendo la quinta K. planticola. Estas especies son diferenciables mediante las pruebas bioquímicas de indol, malonato, Voges-Proskauer y ONPG, y pueden ser comensales del aparato respiratorio, genitourinario e intestinal.
Posee 5 antígenos somáticos "O" y hasta 80 antígenos capsulares "K" diferentes, constituidos por polisacáridos. La clasificación con los antisueros anti-K es útil desde el punto de vista epidemiológico, especialmente en el diagnóstico de las infecciones adquiridas en el hospital. La identificación del serotipo K se hace mediante el fenómeno de hinchamiento de la cápsula o por contrainmunoelectroforesis.
El género Klebsiella da positiva la prueba del citrato, es decir: es capaz de utilizar el citrato como única fuente de carbono, y K. pneumoniae y K. oxytoca son ureasa positivas. K. pneumoniae experimentalmente es muy patógeno para el ratón y menos para el conejo. En el humano es productor de un pequeño porcentaje de neumonías bacterianas agudas, (el 3% de todas las neumonías bacterianas, aproximadamente). En un estudio realizado en un hospital de Venezuela, se reporta una incidencia del 0,77%, dando origen a neumonías lobares graves y de alta letalidad. Su poder invasor depende, como en la infecciones por neumococo, del efecto antifagocitario de la cápsula, siendo avirulentas las cepas acapsuladas. La neumonía por K. pneumoniae se caracteriza por una extensa consolidación pulmonar, por la presencia de abundantes bacilos en las zonas edematosas del pulmón y por la producción de un esputo denso, gelatinoso y hemorrágico. Con frecuencia se forman abscesos pulmonares, que hay que intervenir quirúrgicamente. Cuando este tipo de neumonía se adquiere en la comunidad afecta fundamentalmente a individuos con diabetes mellitus, alcohólicos o personas con infección pulmonar obstructiva crónica. Se asocia con infecciones de las vías urinarias, heridas, bacteriemia, infecciones del oído y meningitis.
El género Klebsiella se aísla en un 9% de las infecciones del tracto urinario y en un 14% de las bacteriemias de origen nosocomial.
En los últimos años se ha comprobado que K. pneumoniae se encuentra con relativa frecuencia entre los agentes bacterianos de gastroenteritis. En trabajos sobre la etiología de las diarreas agudas en Venezuela, Pérez-Schael y colaboradores llaman la atención sobre el alto porcentaje (11,6%) de aislamientos en casos de diarrea aguda en niños, y hacen notar que, en la mitad de los coprocultivos que resultan positivos, esta especie bacteriana se encuentra en cultivo puro o fuertemente predominante. Se conoce la capacidad de Klebsiella para adquirir de E. coli el plásmido que codifica para las toxinas termolábil (TL) y termoestable (TE), así que no sorprende su relación con epidemias de diarrea en casas-cuna. K. pneumoniae y K. oxytoca han sido asociadas con casos de diarrea secretoria en niños.
La fuente de infección está constituida por pacientes y portadores del microorganismo, y el vehículo de contagio son las gotillas expelidas por nariz y boca.
No existe inmunidad natural en el humano, y la infección va seguida de la aparición de anticuerpos específicos.
La diseminación de patógenos resistentes a fármacos es una de las principales amenazas al éxito del tratamiento de las enfermedades infecciosas.
Históricamente, la resistencia bacteriana a los antimicrobianos se definía como la infección bacteriana persistente, a pesar de la administración de una dosis adecuada del antimicrobiano específico. Más tarde se modificó esta definición, al relacionar la resistencia con la concentración del antimicrobiano en el sitio de acción; así la resistencia podría ser parcial o relativa.
Actualmente, una bacteria se considera resistente cuando las concentraciones de un antimicrobiano necesarias para inhibir el crecimiento de una bacteria in vitro, concentración inhibitoria mínima (CIM), es mayor que las concentraciones alcanzadas en suero o en tejidos.
Los siguientes mecanismos de resistencia están bien comprobados:
1. Los microorganismos producen enzimas que destruyen el medicamento activo. Ejemplos son las betalactamasas de Gram-positivos y de Gram-negativos, enzimas adenilantes, fosforilantes o acetilantes. Las betalactamasas fueron apareciendo gradualmente, para luego aumentar en forma alarmante. En la actualidad se describen cientos de betalactamasas, entre las cuales, algunas son de espectro expandido (ß-LEE), capaces de inactivar los nuevos grupos de antibióticos betalactámicos. En una revisión realizada de 966 aislados de Klebsiella, provenientes de 35 unidades de terapia intensiva en el sureste y suroeste de Europa, incluyendo Turquía, 220 (23%) eran productores de ß-LEE.
2. Los microorganismos cambian su permeabilidad al medicamento. Por ejemplo, la resistencia a la amikacina y a algunos otros aminoglucósidos puede depender de la falta de permeabilidad a los antimicrobianos, al parecer, debido a un cambio en la membrana externa que altera el transporte activo al interior de la célula.
3. Los microorganismos desarrollan un blanco estructural alterado para el medicamento. Por ejemplo, la resistencia cromosómica a los aminoglucósidos se relaciona con la pérdida o alteración de alguna proteína específica sobre la subunidad 30S del ribosoma bacteriano, el cual sirve como sitio de unión en microorganismos sensibles. Los microorganismos resistentes a la eritromicina tienen un receptor alterado sobre la subunidad 50S del ribosoma resultante de la metilación de un ARNr 23S. La resistencia a algunas penicilinas y cefalosporinas puede depender de la pérdida o alteración de las proteínas fijadoras de penicilina (PFP, o PBP en inglés).
4. Los microorganismos desarrollan una vía metabólica alterada que funciona como un atajo o derivación de la reacción, la cual es inhibida por el medicamento. Este mecanismo se manifiesta en las bacterias resistentes a las sulfonamidas que no requieren ácido para-amino-benzoico (PABA) extracelular, sino que, a semejanza de los mamíferos, pueden utilizar el ácido fólico preformado.
5. Los microorganismos desarrollan una enzima alterada, la cual todavía puede ejecutar su función metabólica, pero que es afectada mucho menos por el medicamento que la misma enzima en una bacteria sensible. Se puede ejemplificar con el caso de bacterias resistentes al trimetoprim, donde la ácido dihidrofólico reductasa es inhibida con una eficacia mucho menor que en las bacterias sensibles al trimetoprim.
Otra forma de volverse resistentes a un antimicrobiano es cuando las bacterias pierden la estructura que actúa como blanco específico. Ejemplo típico de este evento es cuando los microorganismos sensibles a penicilina pierden parte de su pared celular, tomando la configuración de formas L durante la administración de antibióticos inhibidores de la formación de la pared celular, como las penicilinas y cefalosporinas, y pueden permanecer así durante varias generaciones. Cuando nuevas progenies de estos organismos regresan a su forma bacteriana original, reanudando la producción de su pared celular, se tornan de nuevo sensibles a los antibióticosAsí, las bacterias se pueden hacer resistentes a un antimicrobiano, no permitiendo su entrada en la célula, bombeándolo al exterior, alterándolo enzimáticamente, modificando la enzima u orgánulo diana, para hacerlos menos sensibles al fármaco, etc. Los genes de la resistencia a los antimicrobianos se pueden encontrar en el cromosoma bacteriano o en un plásmido denominado plásmido R. Se describen dos tipos de plásmidos: plásmido-® es aquél con capacidad de transferencia de resistencia de una bacteria a otra, y facilitan la diseminación de la resistencia a uno o más antimicrobianos, y plásmido-r, aquéllos que sólo codifican la resistencia, más no poseen el factor de transferencia.
K. pneumoniae presenta aumento de la resistencia a los antimicrobianos mediante la producción de betalactamasas de espectro expandido (ESBL).
Materiales y Métodos
Se trata de un estudio descriptivo, epidemiológico de campo y longitudinal, donde se presentan los valores de resistencia para cada antibiótico probado, comparando los porcentajes de resistencia interanuales y sus coeficientes de auto-correlación.
A partir de 14.970 cepas de K. pneumoniae registradas en el sistema informático del Proyecto de Vigilancia de la Resistencia Bacteriana a los Antimicrobianos en Venezuela, del Grupo Venezolano de Resistencia Bacteriana (GVRB), desde 1989 hasta 1998, se determinaron los porcentajes de resistencia a los antimicrobianos más frecuentemente utilizados en la terapia para las infecciones, donde se identifica K. pneumoniae como agente etiológico.
Para la determinación de la resistencia bacteriana a los diferentes antimicrobianos, se emplearon los procedimientos recomendados por el Comité Nacional de Estándares para Laboratorios Clínicos de EE.UU. (National Committee for Clinical Laboratory Standards-NCCLS), utilizando la técnica del disco de difusión en agar, con discos de antibiótico de reconocida calidad.
Análisis y Discusión de Resultados
Resistencia frente a las penicilinas (véanse datos en cuadro 1 y gráfico 1):
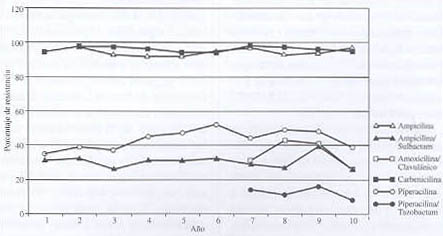
La resistencia a ampicilina y carbenicilina se ha mantenido a lo largo de la década en cifras superiores al 90% (entre el 90 y el 98%, con coeficientes de correlación cercanos a 1 y p< 0,001).
Estos resultados demuestran la ineficacia de estos antibióticos para el tratamiento de infecciones por K. pneumoniae, y consideramos que deberían ser eliminados del antibiograma para este patógeno. Conclusiones similares fueron descritas en publicaciones anteriores del Grupo Venezolano de Vigilancia de la Resistencia Bacteriana (GVRB), cuando ya fue evidente que el 90% de los aislados de K. pneumoniae eran resistentes a la ampicilina y carbenicilina.
Ampicilina-sulbactam y amoxicilina-ácido clavulánico se mantienen con cifras de resistencia cercanas al 30% (entre el 26 y el 41%, con coeficientes de auto-correlación no significativos), por lo que estos antibióticos no son recomendables para el tratamiento de infecciones graves por K. pneumoniae. En un estudio realizado en un hospital privado de Buenos Aires, Argentina, reportan resistencia creciente durante el período estudiado (1989-1994), desde el 25 hasta el 68%, y el GVRB, desde 1992, reporta cifras de resistencia similares para este patógeno.
Piperacilina presenta cifras de resistencia, durante el período, entre el 35% y el 52%, con un coeficiente de auto-correlación significativo (p<0,05). En 1994, el GVRB reporta valores de resistencia de K. pneumoniae frente a la piperacilina cercanos al 40%.
Entre las penicilinas, solamente piperacilina-tazobactam presenta porcentajes de resistencia por debajo del 20% (entre 8 y 16%), con un coeficiente de auto-correlación significativo (p<0,05).
Resistencia frente a cefalosporinas (véanse datos en cuadro 2 y gráfico 2):
Cuadro 1. Evolución de la resistencia de Klebsiella pneumoniae frente a las penicilinas.
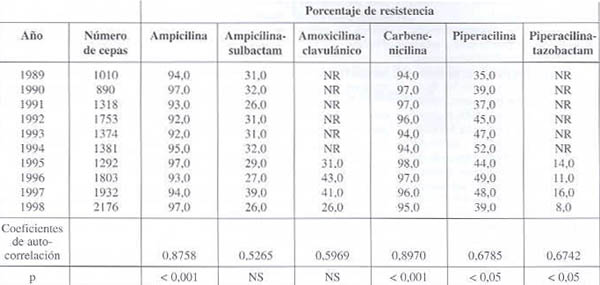
NS: No Significativa; No reportado; Fuente GVRB
Gráfico 1. Evolución de la resistencia de Klebsiella pneumoniae frente a las penicilinas.
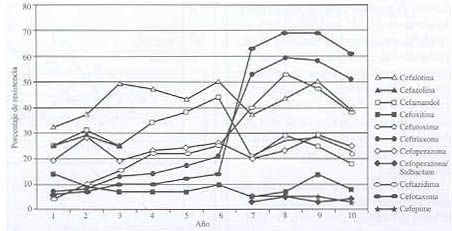
En nuestro estudio, las cefalosporinas de primera generación mantienen altos niveles de resistencia, con altos coeficientes de auto-correlación (p< 0,05). Bianchini y cols. reportan un aumento de la resistencia de K. pneumoniae a la cefalotina, de un 38% en 1986 hasta un 68% en 1994.
Las cefalosporinas de segunda generación muestran porcentajes de resistencia crecientes, con coeficientes de auto-correlación significativos: p< 0,05 para cefamandol y p< 0,0001 para cefuroxima. Cefoxitina mantiene cifras por debajo del 20%, y su coeficiente de auto-correlación es significativo (p< 0,05). Dentro del grupo de cefalosporinas de segunda generación, cefoxitina podría considerarse para el tratamiento de infecciones no graves por este patógeno.
Dentro de las cefalosporinas de tercera generación, cefotaxima presenta un ascenso progresivo de los valores de resistencia, desde el 6% al inicio de la década hasta 69% a partir de 1996, con coeficiente de auto-correlación significativo (p< 0,05). Ceftazidima y ceftriaxona presentan valores de resistencia altos, con coeficiente de auto-correlación no significativo. En el estudio de Bianchini y col., ceftazidima reporta valores de resistencia crecientes para K. pneumoniae, del 1% en 1986 hasta el 62% en 1994. Cefoperazona mantiene valores de resistencia cercanos al 30% y un coeficiente de auto-correlación significativo (p< 0,03). En el estudio argentino ya mencionado, la evolución de la resistencia para este antibiótico durante el período (1986-1994) reporta un aumento del 1% en 1986 al 62% en 1994. De este grupo de cefalosporinas, cefoperazona-sulbactam es el único antibiótico con cifras bajas de resistencia y un coeficiente de auto-correlación cercano a 1 (p< 0,0001), por lo que sería la única cefalosporina de tercera generación recomendable para el tratamiento de infecciones graves por K. pneumoniae.
En relación con la cefalosporina de cuarta generación cefepime, ésta presenta bajos porcentajes de resistencia (<5%) y un coeficiente de auto-correlación cercano a 1 (p< 0,0001), por lo que puede considerarse como antibiótico de primera línea para el tratamiento de las infecciones graves por este patógeno.
Cuadro 2. Evolución de la resistencia de Klebsiella pneumoniae frente a las cefalosporinas.
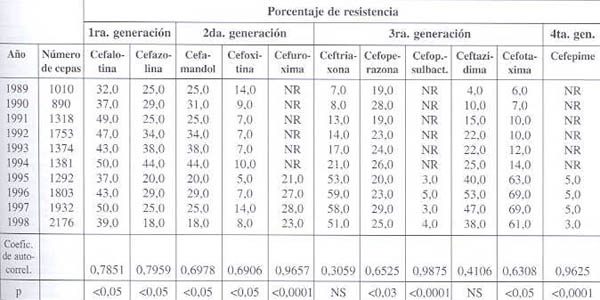
NS: No Significativa; No reportado; Fuente GVRB
Gráfico 2. Evolución de la resistencia de Klebsiella pneumoniae frente a las cefalosporinas.
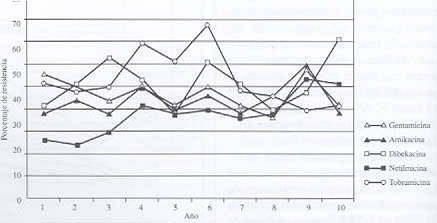
Resistencia frente a aminoglucósidos (véase datos en cuadro 3 y gráfico 3):
Los valores de resistencia para todos los aminoglucósidos se mantienen alrededor del 30%, p<0,01 para gentamicina, p<0,05 para amikacina y tobramicina, y no significativo para netilmicina. Para este grupo de antibióticos, Bianchini y cols. reportan valores superiores a los nuestros (gentamicina del 29 al 67% y amikacina del 27 al 49%). El uso de este grupo de antibióticos para el tratamiento de infecciones graves por K. pneumoniae no es recomendable sin el antibiograma correspondiente, pero podría utilizarse asociado a una cefalosporina de primera línea para este patógeno.
Cuadro 3. Evolución de la resistencia de Klebsiella pneumoniae frente a los aminoglucósidos.
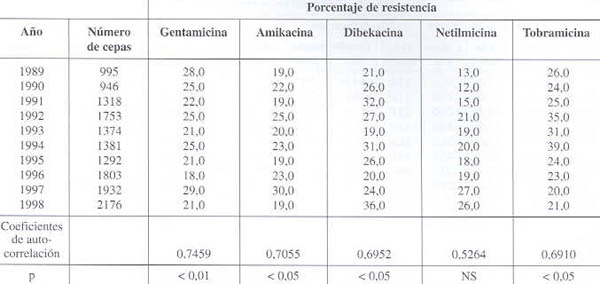
NS: No Significativa; No reportado; Fuente GVRB
Gráfico 3. Evolución de la resistencia de Klebsiella pneumoniae frente a los aminoglucósidos.
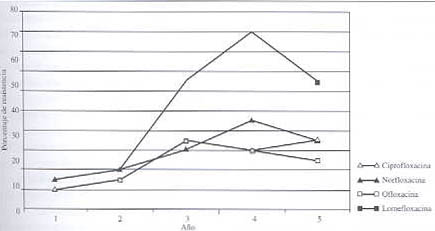
Resistencia frente a quinolonas (véanse datos en cuadro 4 y gráfico 4):
Nuestro estudio en relación a este grupo de antibióticos abarca el período 1994-1998. Tres (3) de las quinolonas evaluadas reportan valores de resistencia menores al 10%, con coeficientes de auto-correlación cercanos a 1 y p<0,0001 para ciprofloxacina y ofloxacina y p< 0,001 para norfloxacina. En el estudio de Bianchini y cols., norfloxacina reporta resistencia creciente (6% al inicio del estudio hasta el 42% en 1994). Trovafloxacina presenta 100% de sensibilidad, por lo que se incluye entre los antibióticos de primera línea para las infecciones graves por este patógeno en pacientes adultos.
Cuadro 4. Evolución de la resistencia de Klebsiella pneumoniae frente a las quinolonas.

NS: No Significativa; No reportado; Fuente GVRB
Gráfico 4. Evolución de la resistencia de Klebsiella pneumoniae frente a las quinolonas.
Resistencia frente a carbapenemos (véanse datos en cuadro 5):
Nuestro estudio frente a los carbapenemos abarca desde 1995 hasta 1998. Imipenem y meropenem reportan resistencia máxima del 2% p< 0,0001, por lo que son considerados antibióticos de primera línea para el tratamiento de las infecciones graves por K. pneumoniae. Otras referencias reportan desde 1989 hasta 1994 el 100% de sensibilidad para imipenem.
Cuadro 5. Evolución de la resistencia de Klebsiella pneumoniae frente a las carbapenemos.
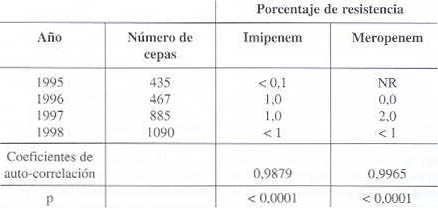
NS: No Significativa; No reportado; Fuente GVRB
Resistencia frente a aztreonam (véanse datos en cuadro 6):
En nuestro estudio, el seguimiento para este antibiótico abarca desde 1995 hasta 1998, con altas cifras de resistencia desde su inicio frente al patógeno en estudio. El coeficiente de auto-correlación, es significativo (p<0,05). Se sugiere no incluir este antibiótico en el antibiograma para esta bacteria.
La mayoría de las cepas de K. pneumoniae, al igual que otros Gram-negativos, patógenos nosocomiales, son con frecuencia resistentes a múltiples antimicrobianos. La resistencia natural a la carbenicilina y ampicilina mediada por producción de betalactamasas y la resistencia adquirida a través de plásmidos ha llevado a la aparición de resistencia a otros antibióticos, que incluyen aminoglucósidos y cefalosporinas. Es de hacer notar el rápido incremento de la resistencia a los antimicrobianos de amplio espectro, incluyendo en este grupo a ceftazidima, aztreonam, cefotaxima, ceftriaxona y otros, a causa de la adquisición de plásmidos codificadores de ß-LEE, las cuales fueron reportadas por primera vez en Europa en 1983; desde entonces, se han extendido por todo el mundo y se han insertado en una variedad de patógenos Gram-negativos, especialmente K. pneumoniae .
Cuadro 6. Evolución de la resistencia de Klebsiella pneumoniae frente al aztreonam.
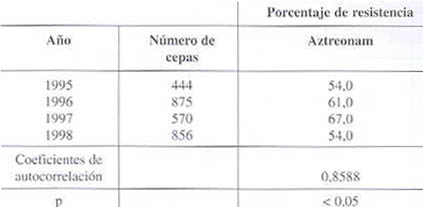
NS: No Significativa; No reportado; Fuente GVRB
Las ß-LEE son una causa frecuente de resistencia de las enterobacterias, especialmente Klebsiella, a las cefalosporinas de tercera generación. La mayoría son mutantes de los tipos clásicos TEM y SHV, con una o más sustituciones de aminoácidos cercanos al sitio activo. Estos cambios permiten la hidrólisis de las oximino-aminotiazolil-cefalosporinas y monobactanos, los cuales son estables a las enzimas clásicas TEM y SHV.
La epidemiología de las Klebsiellas productoras de ß-LEE varía entre hospitales. Muchas instituciones han experimentado grandes brotes por una cepa única, y algunos aislados productores de ß-LEE se han extendido entre hospitales.
Las Klebsiellas son protegidas de la desecación por su cápsula, y así sobreviven mejor que otras enterobacterias sobre la piel y fomites, lo que facilita la transmisión horizontal o infección cruzada (Casewell). Otros autores, sin embargo, enfatizan la importancia de la transferencia de plásmidos, más que la de aislados.
La diversidad de las betalactamasas SHV y TEM sigue en aumento. Recientemente, en el norte de Taiwan, se han caracterizado las SHV-25 y SHV-26 durante el estudio de 113 aislados de K. pneumoniae de igual número de hemocultivos, procedentes de pacientes de 10 hospitales del norte de Taiwan. Resistencia mediada por enzimas tipo TEM-1 correspondió a 32 aislados; la resistencia mediada por enzimas del tipo SHV correspondió a SHV-1,-2,-5,-11 y 12, además de las dos nuevas caracterizadas.
Recomendaciones
Hacer uso racional de los antimicrobianos, para evitar que los microorganismos produzcan nuevos mecanismos de resistencia que destruyan la eficacia de los mismos.
La industria farmacéutica deberá elaborar nuevos antimicrobianos que evadan los mecanismos de resistencia bacteriana conocidos.
Se recomienda a los institutos de salud incorporarse al Proyecto del GVRB, para que conozcan el patrón de resistencia de las bacterias a los antimicrobianos en su centro y en el resto del país.
Recomendaciones para limitar la aparición de la resistencia bacteriana a los antimicrobianos:
La emergencia de resistencia a fármacos en las infecciones puede llevarse al mínimo de la manera siguiente:
1. Manteniendo concentraciones tisulares del antimicrobiano suficientemente altas, para inhibir tanto la población bacteriana original como los mutantes de primer paso.
2. Administrando de modo simultáneo dos antimicrobianos que no tengan resistencia cruzada, cada uno de los cuales demora la aparición de mutantes resistentes al otro medicamento. Ejemplo son: rifampicina e isoniacida, en el tratamiento de la tuberculosis.
3. Evitando la exposición de los microorganismos a un fármaco en particular valioso mediante el control y limitación de su uso, en especial en hospitales y en la fabricación de alimentos para animales.
En el 50% de las oportunidades el antibiótico indicado no es el apropiado, debido a:
a) no está indicado;
b) es el antibiótico incorrecto;
c) la dosis es inadecuada;
d) la duración del tratamiento no es la apropiada;
e) y que... ¡para cubrir al paciente!
Así, el empleo incorrecto de quimioterápicos promueve el aumento y la diseminación de la resistencia bacteriana a los antimicrobianos, y puede contribuir con la aparición de sobreinfecciones.
Son errores comunes en la práctica:
1. uso sin un mínimo procedimiento tendiente al diagnóstico, como la coloración de Gram y el cultivo;
2. uso de más de 2 antibióticos;
3. uso de más de 5 antibióticos durante la misma hospitalización;
4. uso continuo durante más de 21 días;
5. uso parenteral cuando existe posibilidad de indicación oral;
6. profilaxis quirúrgica mayor de 48 horas (la primera dosis debe administrarse con la inducción de la anestesia)
7. profilaxis inadecuada;
8. uso de aminoglicósidos sin estimar la función renal del paciente.
Debido a la gran cantidad de antibióticos que se elaboran y distribuyen de manera indiscriminada, un número creciente de bacterias resultan resistentes a estos fármacos. La resistencia a los antimicrobianos constituye un problema de Salud Pública extremadamente grave. Muchas de las dificultades son consecuencia del empleo incorrecto de estos medicamentos. Se calcula que más del 50% de las prescripciones de antibióticos en los hospitales se realizan sin pruebas claras de infección o indicación médica comprobada. Muchos médicos han administrado antibacterianos a pacientes con catarros, gripe, neumonía viral y otras infecciones virales. Un estudio reciente demostró que más del 50% de los pacientes diagnosticados de resfriados e infecciones de vías respiratorias superiores y el 66% con catarros de vías respiratorias inferiores reciben antibióticos, aunque es ampliamente conocido que más del 90% de estos casos es de etiología viral. A menudo se prescriben antibióticos sin cultivar e identificar el patógeno, o sin determinar la sensibilidad de la bacteria al fármaco. Frecuentemente se administran antibióticos tóxicos de amplio espectro, en lugar de otros de espectro reducido, para obviar la realización de cultivos y pruebas de sensibilidad, con el consiguiente riesgo de efectos secundarios peligrosos, sobreinfecciones y selección de mutantes resistentes a fármacos. La situación empeora en los pacientes que no completan su tratamiento. Cuando se interrumpe demasiado pronto un tratamiento antibiótico, pueden sobrevenir los mutantes resistentes a antibióticos. Además, en nuestro país los antibióticos se expenden libremente al público, y este hecho contribuye a aumentar la prevalencia de cepas resistentes.
Otro factor que sin duda contribuye al aumento de la resistencia a fármacos es el empleo de antibióticos en los alimentos para animales. La adición de niveles bajos de antibióticos al alimento del ganado aumenta la eficiencia y la tasa de ganancia de peso en el ganado bovino, porcino y en los pollos, en parte por el control de las infecciones en poblaciones animales hacinadas. Sin embargo, esto aumenta también la cantidad de bacterias resistentes a los antibióticos en el tubo digestivo de los animales. La eliminación de los suplementos de antibióticos en los alimentos de animales podría contribuir con la disminución de la resistencia bacteriana a los antibióticos.
Para concluir, recomendamos seguir los lineamientos de la reciente Declaración de Guadalajara (ver Anexo), Jalisco, México, 1º Mayo 2001 auspiciada por APUA, OPS, API y AMIMC .
El Señor creó las medicinas de la tierra, y el juicioso no las despreciará.
Eclesiastés, 38.4
Anexo:
Declaración de Guadalajara para combatir la resistencia a los antimicrobianos en América Latina:
Se reconoce que:
1. Los antibióticos son medicamentos de primera línea para el tratamiento de numerosas enfermedades infecciosas causadas por bacterias; sin embargo, si se permite su uso inadecuado serán cada vez menos potentes. Los antibióticos deben ser manejados como recursos no renovables.
2. La resistencia bacteriana a los antibióticos es un problema creciente en América Latina, así como en otras regiones del mundo, perjudicando tanto el tratamiento de infecciones comunes de origen comunitario como de aquellas intra-hospitalarias. Los hallazgos de resistencia a los antibióticos mediante pruebas de laboratorio se correlacionan claramente con fracasos terapéuticos en el paciente.
3. En este contexto, los antibióticos deben considerarse como un bien común y ser manejados en beneficio del individuo y de toda la sociedad, sin discriminación alguna.
4. Asimismo, su indicación inadecuada por parte del médico, el uso excesivo y sin fundamentos claros, así como la posibilidad de auto-prescripción por el público, son factores que promueven el desarrollo y la diseminación de la resistencia microbiana.
5. Por otra parte, el uso de antibióticos en la industria agropecuaria contribuye de manera importante a la selección ambiental de microorganismos resistentes.
Se deben promover las siguientes acciones:
1. La vigilancia y monitoreo de la resistencia bacteriana a los antibióticos, de manera sistemática, tanto en los hospitales como en la comunidad.
2. El uso racional de antibióticos como un factor clave, que reduzca la resistencia a los mismos.
3. La notificación clara, a la población en general, sobre los riesgos de la automedicación, los efectos secundarios y el desarrollo perjudicial de una resistencia microbiana consecutiva.
4. La promoción de un sistema de educación médica continua, según las peculiaridades de cada país y en forma permanente.
5. La emisión de regulaciones estrictas para la prescripción y dispensación de antibióticos.
6. El establecimiento de Comités de Vigilancia Farmacológica referida a Antibióticos en aquellas instituciones públicas y privadas donde se prescriben los mismos, bajo regulaciones gubernamentales concordantes con el uso racional de estos medicamentos.
7. El instructivo de los Ministerios de Salud de cada país, a todos los hospitales públicos y privados, para la implementación de Guías de Tratamiento Estandarizado de las infecciones más comunes; para ello se solicitará la participación de las agrupaciones médicas pertinentes, como las Asociaciones de: Infectología, Microbiología, etc.
8. La venta de antibióticos exclusivamente con receta médica, que especifique dosis y duración adecuadas, según la infección tratada.
9. El compromiso de la industria farmacéutica para desarrollar nuevos antibióticos, la promoción de su uso adecuado y la suspensión de la producción de combinaciones de los mismos, con mayores riesgos de interacciones perjudiciales.
10. La prohibición del uso de antibióticos para promover el crecimiento de animales.
11. El cumplimiento de estándares para el control de calidad de los antibióticos genéricos producidos, a cargo de un organismo independiente, que garantice la ejecución de las normas en términos de eficacia, absorción, biodisponibilidad, bioseguridad, etc.
12. La provisión de la infraestructura y equipamiento necesarios, así como la capacitación de recursos humanos en los laboratorios de Microbiología clínica, para la identificación precisa de organismos causantes de infecciones y el desarrollo de pruebas modernas de susceptibilidad y/o resistencia.
13. La creación de Comités de Control de Infecciones en cada hospital público o privado.
Sugerimos:
1. Que las autoridades de salud de cada país latinoamericano respalden los diferentes puntos de esta Declaración, en beneficio de la población en general y del uso racional de antibióticos en particular.
2. Que las agencias reguladoras requieran información documentada sobre el desarrollo y evolución de la resistencia microbiana en cada país, como parte del programa de registro y aprobación de nuevos antibióticos.
3. Que se revise la duración y dosis de antibióticos para cada infección, basados en perfiles de susceptibilidad y resistencia locales.
4. Que se conduzcan estudios de vigilancia, para determinar los antibióticos más eficaces contra determinado patógeno bacteriano, ante el informe de cepas multirresistentes.
5. Que se haga efectiva la prohibición del uso de antibióticos como medio coadyuvante de mayor crecimiento de animales.
6. Que se desarrollen antibióticos potencialmente biodegradables.
7. Que se desarrollen antimicrobianos específicos contra el sitio celular de ataque del patógeno y órgano del sistema.
8. Que se favorezca el uso cíclico o rotativo de los antibióticos, principalmente en áreas críticas de los hospitales, como las Unidades de Cuidado Intensivo.
Referencias Bibliográficas:
1. Prescott, M. L.; Harley, J. P. y Klein, D. A.: Microbiología, 4ª. Ed. McGraw-Hill Interamericana, Madrid, 1999. [ Links ]
2. Pelczar Jr., M. J.; Reid, R. D. y Chan, E. C. S.: Microbiología, 2ª. Ed. McGraw-Hill, México, 1982. [ Links ]
3. Núñez, M. J.; Gómez, M. J. y Carmona, O.: Microbiología Médica. Tomo I, 1ª. Ed. Ediciones de la Biblioteca de la UCV, Caracas, 1991. [ Links ]
4. Carmona, O.; Gómez, M. J.; Montes, T.; Marcano, C. y Mariño, F.: Microbiología Médica de Divo. McGraw-Hill Interamericana, 5ª Ed. México, 1997. [ Links ]
5. Delgado-Iribarren, A.; Amich, S.; Prieto, S. y Salve, M. A.: Microbiología (Laboratorio Clínico) Interamericana. Mc Graw-Hill, 1ª. Ed., Madrid, 1994. [ Links ]
6. Volk, W. A.: Microbiología Básica. Harla, 7ª Ed., México, 1996. [ Links ]
7. Castro, E.; Portillo, S. y Joya, M.: Estudio Clínico Epidemiológico de las neumonías en un hospital del estado Carabobo, Venezuela, 1989-1993. Bol. Soc. Ven. Microbiol.;17(1): 36-41, 1997. [ Links ]
8. Risso, C.; Martucci, A.; Martínez, F. y Rodríguez, L.: Producción de toxinas (TE, TL) en cepas de K. pneumoniae y K. oxytoca aisladas en casos de diarrea secretoria en niños. Resúmenes XXII Jornadas Venezolanas de Microbiología, Mérida, 1994. [ Links ]
9. Smith, A. L.: Resistencia antibiótica de los patógenos pediátricos. En: Clín. de Infect. de N. A. Infecciones Pediátricas, fascículo 4. Laboratorios Allen & Hanburys, 1998. [ Links ]
10. González Saldaña, N.: Mecanismos de resistencia a los antibióticos. Laboratorios C.V. Pfizer S.A. de C.V. Publicada por Organización en Trabajos de Comunicación S. A. de México, 1989. [ Links ]
11. Neu, H. C.: The biochemical basis of antimicrobial and bacterial resistance. Bull NY Acad Med; 63: 295-317, 1987. [ Links ]
12. Bush, K.: Classification of ß-lactamases: groups 2c, 2d, 2e, 3 and 4. Antimicrob Agents Chemother; 33: 271-6, 1989. [ Links ]
13. Bush, K.: Classification of ß-lactamases: groups 1, 2a, 2b, 2e and 2b'. Antimicrob Agents Chemother; 33: 264-70, 1989. [ Links ]
14. Bush, K.; Jacoby, G. and Medeiros, A.: A functional classification scheme for ß-lactamases and correlation with molecular structure. Antimicrob Agents Chemother; 39: 1211-33, 1995. [ Links ]
15. Nordmann, P.: Trends in b-Lactam Resistance Among Enterobacteriaceae. Clinic Infect Dis; 27(S): 100-6, 1998. [ Links ]
16. Yuan, M.; Aucken, H.; Hall, L. M. C.; Pitt, T. L. and Levermore, D. M.: Epidemiological typing of klebsiellae with extended-sprectrum ß-lactamases from European intensive care units. JAC; 41: 527-39, 1998. [ Links ]
17. Donowitz, G. R. and Mandel, G. L.: Beta-Lactam antibiotics. N Engl J Med; 3(18):419-426, 1988. [ Links ]
18. Knothe, H.; Shah, P.; Kizmery, V. and Mitsuhatshi, S.: Transferable resistance to cefotaxime, cefamandol, cefoxitin in clinical isolates of Klebsiella pneumoniae and Serratia marcescens. Infection; 11:315-17, 1983. [ Links ]
19. Drusano, George L.: Infection in the Intensive Care Unit: ß-Lactamase-Mediated Resistance Among Enterobacteriaceae and Optimal Antimicrobial Dosing. Clin Infec Dis; 27(S): 111-6, 1998. [ Links ]
20. Guzman, M.; Casellas, J. M. and Silva, H. S.: Bacterial Resistance to Antimicrobial Agents in Latin America. Infect Dis Clinics of NA; 14: 67-81, 2000. [ Links ]
21. Bauer, A.; Kirby, W.; Sherris, J. C. and Turk, M.: Antibiotic Susceptibility Testing by a Standardized Single Disk Method. Am J Clin Pathol; 45: 493-496, 1966. [ Links ]
22. Inciarte, L.; Sanz, L.; Contreras, R.; Texeira, G.; Carmona, O. y GVRB.: Resistencia de Klebsiella pneumoniae a los antimicrobianos en Venezuela. Bol. Soc. Ven. Microbiol.; 15(1):7-10, 1995. [ Links ]
23. Carmona, O.; Guzmán, M. y GVRB.: Resistencia bacteriana a los antimicrobianos en Venezuela. Bol. Soc. Ven. Microbiol.; 14(1): 15-25, 1994. [ Links ]
24. Bianchini, H.: Evolución de la Resistencia Bacteriana durante 9 años en un hospital privado de Buenos Aires. Memorias Año Louis Pasteur. Sociedad Venezolana de Microbiología, Caracas, 1995. [ Links ]
25. Jenkins, S. G.: Mechanisms of Bacterial Antibiotic Resistance. New Horizon; 4(3): 321-32, 1996. [ Links ]
26. Kleibe, C.; Nies, B. A.; Meyer, J. F. et al.: Evolution of plasmid-coded resistance to broad-spectrum cephalosporins. Antimicrob Agents Chemother; 28: 302-7, 1985. [ Links ]
27. French, G. L.; Shannon, K. P. and Simmons, N.: Hospital outbreak of Klebsiella pneumoniae isolates recovered at the Cleveland Department of Veterans Affairs Medical Center. Clinical Infectious Diseases; 23: 118-24, 1996. [ Links ]
28. Hobson, R. P.; Mackenzie, F. M. and Gould, I. M.: An outbreak of multiply-resistant Klebsiella pneumoniae in the Grampian region of Scotland. Journal of Hospital Infection; 33: 249-62, 1996. [ Links ]
29. Arlet, G.; Rouveau, M.; Casin, I.; Bouvet, P. J.; Lagrange, P. H. and Philippon, A.: Molecular epidemiology of Klebsiella pneumoniae strains that produce SHV-4 ß-lactamase and which were isolated in 14 French hospitals. Journal of Clinical Microbiology; 32: 2553-8, 1994. [ Links ]
30. Chang, F.-Y.; Siu, L. K.; Fung, C.-P.; Huang, M.-H. and Ho, M.: Diversity of SHV and TEM ß-Lactamases in Klebsiella pneumoniae: Gene Evolution in Northen Taiwan and Two Novel ß-Lactamases, SHV-25 and SHV-26. Antimicrob Agents Chemother; 45(9): 2407-13, 2001. [ Links ]
31. Declaración de Guadalajara para Combatir la Resistencia a los Antimicrobianos en América Latina. Xº Congreso Panamericano de Infectología. Jalisco, México, 2001. [ Links ]












 uBio
uBio 
