Revista de la Sociedad Venezolana de Microbiología
versión impresa ISSN 1315-2556
Rev. Soc. Ven. Microbiol. v.23 n.2 Caracas jul. 2003
Biogeografía de Nocardia: Estudio de la población edáfica de Nocardia en diversas zonas climáticas del estado Lara, Venezuela.
Biogeography of Nocardia: Study of edafic population of Nocardia in different climatic areas of Lara state, Venezuela.
Ramírez A1, Blanco M2, García E3.
1. Profesor Instructor. Departamento de Microbiología y Parasitología Clínicas, Facultad de Medicina, Universidad de Los Andes, Mérida, Venezuela.
2. Profesor Instructor. Departamento de Microbiología y Parasitología Clínicas, Facultad de Farmacia, Universidad de Los Andes, Mérida, Venezuela.
3. Profesor Agregado. Departamento de Microbiología y Parasitología Clínicas, Facultad de Farmacia, Universidad de Los Andes, Mérida, Venezuela.
Este trabajo fue financiado por el Fondo Nacional de Ciencia y Tecnología, a través del Proyecto S1-2001001177.
RESUMEN
Se estudiaron nueve muestras de suelos provenientes de diferentes zonas climáticas del estado Lara, Venezuela, para determinar la distribución de Nocardia, estimar su población, si existe alguna correlación entre las características edafológicas y la población de este microorganismo en el suelo. Para el aislamiento se utilizó la técnica del señuelo de parafina y la cuantificación se realizó por el método del Número Más Probable (NMP). La población de Nocardia sp., aisladas en seis de las muestras estudiadas osciló entre 0,9-17,5 organismos/g de suelo, y sólo se encontró correlación entre el pH del suelo y la población de este microorganismo en algunas de las muestras estudiadas. Las especies de Nocardia más frecuentemente aisladas en el suelo son especies del complejo N. asteroides, aunque el método del señuelo en parafina ha sido ampliamente utilizado para el aislamiento del género Nocardia, éste no resultó selectivo, y su utilidad para cuantificar estos microorganismos del suelo es limitada.
Palabras-clave: Nocardia, aislamiento, ecología, suelo, MPN.
ABSTRACT
Nine soil samples from different climatic areas of Lara state, Venezuela, were studied to determine the population and distribution of Nocardia and the soil factors influencing their distribution. For this purpose, the paraffin bait technique and the Most Probable method were applied. In six of the studied samples, the population of Nocardia sp., oscillated between 0.9-17.5 organisms g-1 dry soil. We find out correlation only between the soil pH and the population of this microorganisms in some of the studied samples. The more frequently isolated species belong to the Nocardia asteroides complex. Although the paraffin bait method has been broadly used for the isolation of the Nocardia gender, it was not selective and its utility to quantify this microorganisms is limited.
INTRODUCCIÓN
Uno de los géneros más abundantes de la biota actinomicótica del suelo es Nocardia. Estos microorganismos se caracterizan por ser Gram-positivos, parcialmente ácido-alcohol-resistentes, filamentosos y por fragmentar a formas cocoides y bacilares (1-3). Además, se caracterizan por ser aerobios estrictos; sin embargo, algunos autores reportan que el crecimiento puede ser estimulado por la incubación con 10% CO2. Poseen un metabolismo oxidativo, son quimioorganotrofos, catalasa-positivos y no esporulan (2,4).
Aunque el suelo es su hábitat natural, en donde lleva vida saprófita, ocasionalmente puede producir infecciones cutáneas severas, como el micetoma, que se inician con heridas localizadas, causadas frecuentemente por espinas o astillas (5-7). Este género puede producir otras enfermedades en los humanos, tales como: a) nocardiasis pulmonar; b) nocardiasis sistémica o diseminada; c) nocardiasis del sistema nervioso central; d) nocardiasis extrapulmonar; e) nocardiasis cutánea, subcutánea y linfocutánea. De estas afecciones, las que tienen mayor impacto tanto clínico como epidemiológico son la nocardiasis pulmonar y el actinomicetoma (8).
En Venezuela, el primer caso reportado de actinomicetoma fue descrito por Rafael Rangel en 1909, y hasta 1997 se habían registrado 62 casos de actinomicetomas, 28 de los cuales fueron producidos por especies de Nocardia. La mayor prevalencia de esta enfermedad se localiza en los estados Lara (51,7%), Falcón (17,7%), Distrito Capital (8,1%) y Miranda (8,1%) (6,9).
El 64% de los pacientes provienen de zonas con vegetación xerófita de estos estados, y afecta principalmente a individuos de áreas rurales. Actinomadura madurae es el agente etiológico productor de micetoma más frecuentemente encontrado (40,3%), seguido de N. brasiliensis (27,4%) (6,9). Sin embargo, es importante destacar que el 45,1 % de los actinomicetomas son producidos por alguna especie de Nocardia, lo cual supera la prevalencia de A. madurae.
El aislamiento de Nocardia a partir del suelo tiene interés ecológico y epidemiológico; para ello se han diseñado diferentes técnicas, como el método selectivo de antibióticos y la técnica del señuelo de parafina ("paraffin bait"), que es una de las más utilizadas, y que se fundamenta en la capacidad que tiene el género Nocardia de utilizar la parafina como única fuente de carbono. Esta técnica ha sufrido diversas modificaciones, con la finalidad de incrementar su poder selectivo, y ha sido utilizada para el aislamiento de especies de este género a partir de suelos de diferentes regiones del mundo: Argentina, Kuwait, México, EE.UU., Brasil, India, Sudan, España y Venezuela (10-16).
La presencia y abundancia de estos microorganismos en el suelo varían, de acuerdo a diversos factores ecológicos tales como condiciones climáticas de la región, así como las características del suelo, entre las que se encuentran: contenido de materia orgánica, pH, humedad, textura, biota asociada, etc.; además, estas condiciones también influyen en su distribución geográfica (10,16). Poco se conoce acerca de la distribución de Nocardia en el suelo, pero algunos datos sugieren que en Venezuela puede ser endémica de ecosistemas con vegetación xerófita (17, 18). Sin embargo, también existen reportes que indican que Nocardia presenta una distribución más amplia, incluyendo ecosistemas húmedos, debido a que existen diferentes autores que han logrado aislar especies de Nocardia en los estados Mérida y Amazonas (19,20).
De acuerdo a estos antecedentes, nuestro interés está centrado en estudiar la distribución de Nocardia sp. en suelos de diferentes zonas climáticas del estado Lara, estimar su población en el suelo por el método del Número Más Probable (estudio cuantitativo) y determinar si existe alguna correlación entre las características edafológicas y climáticas con la población de estos microorganismos.
METODOLOGÍA
Sectores de muestreo:
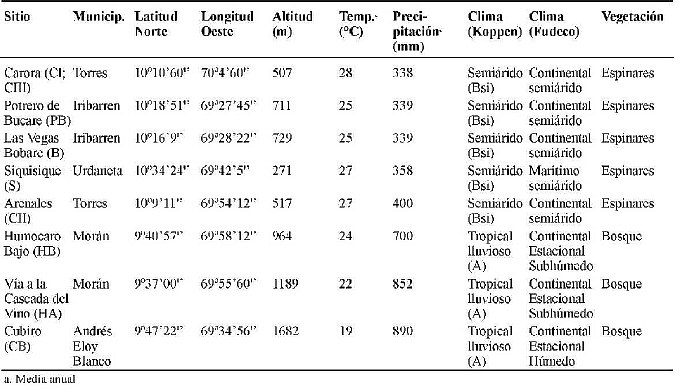
Se recolectaron un total de 9 muestras de suelos de los siguientes sitios: Carora (se recolectaron tres muestras identificadas como CI, CII y CIII), Bobare-Potrero de Bucare (PB), Las Vegas-Bobare (B), Siquisique-Baragua (S), Humocaro Bajo-El Tocuyo (HB), Vía a la Cascada del Vino (HA) y Cubiro (CB), cuyas características climáticas se muestran en la tabla 1.
Tabla 1. Características de los sitios de muestreo.
De cada sitio se tomaron 10 muestras de suelo de 300 g cada una. Las muestras se recolectaron en forma no aleatoria, en un área de muestreo de 100 m2 y se mezclaron para hacer una muestra compuesta de 3 Kg de peso. El muestreo se realizó hasta una profundidad de 10 cm, después de retirar los restos orgánicos superficiales. Las muestras se colocaron en bolsas plásticas y se mantuvieron a 4°C hasta el momento de su procesamiento.
Las muestras de suelo se pasaron por un tamiz (Endecotts LTD, London, England) de 10 mesh (2 mm) y se homogeneizaron manualmente por 15 minutos. Se determinó el contenido de humedad a cada una de las muestras, secando a 105ºC durante 3 días.
Preparación de las suspensiones de suelo tamizado:
Se pesó el equivalente a 50 g de suelo seco y se agregaron a 450 ml de caldo libre de carbono (CFB) estéril. Esta suspensión se agitó por 20 minutos con un agitador magnético y se dejó en reposo por 10 minutos. Esta suspensión constituye la dilución 10-1.
Determinación de la población total de microorganismos viables:
La población total de microorganismos viables fue estimada siguiendo el método del Número Más Probable, y se determinó en las siguientes muestras de suelos: Siquisique-Baragua, Humocaro Bajo, Bobare, Potrero de Bucare y Humocaro Alto. Se prepararon las suspensiones de suelo como se indicó anteriormente. Luego, se realizaron diluciones seriadas hasta 10-10 en agua peptonada. De cada dilución se tomaron 5 alícuotas de 1 ml cada una y se inocularon en 5 tubos de ensayo que contenían 9 ml de caldo nutriente. Los tubos se incubaron a 34ºC por 6 días. Cada muestra se procesó por duplicado.
Determinación de la población de parafinolíticos totales, nocardioformes y Nocardia:
Para el aislamiento de Nocardia a partir de suelos se utilizó la técnica del señuelo de parafina, la cual se combinó con el método del Número Más Probable, que permite estimar la densidad de la población microbiana mediante la determinación de la presencia o ausencia de microorganismos en varias alícuotas individuales de cada una de las diluciones consecutivas del suelo (21).
El procedimiento realizado se describe a continuación: A partir de la suspensión del suelo, se realizaron diluciones seriadas hasta 10-8. De cada dilución se tomaron 5 alícuotas de 1 ml cada una y se inocularon en 5 tubos que contenían 9 ml de CFB y la varilla con parafina. Los tubos se incubaron a 34ºC por 5 semanas. Cada muestra se procesó por duplicado. Las colonias que crecieron sobre la varilla de parafina se subcultivaron sobre agar nutriente.
Identificación:
Se realizó mediante:
Análisis de las características macro y microscópicas de las cepas, propiedades tintoriales (Gram); grado de fragmentación de las hifas (microcultivo).
Resistencia a la lisozima: Se realizó en placas de microtitulación (Microtiter System). A cada pozo se le agregó 150 µl de caldo glicerol con lisozima (Sigma, concentración final 0,05 mg/ml) y se le adicionaron 50 µL de la suspensión bacteriana. Se incubó a 34ºC por 14 días. Además, se inoculó una microplaca con caldo glicerol sin lisozima. Las suspensiones fueron procesadas por duplicado. Se utilizó como control positivo N. asteroides (ATCC 10905) y como control negativo Streptomyces sp. (T77).
Se realizó la determinación de la presencia de los ésteres metílicos de ácidos micólicos mediante cromatografía en capa fina de silica gel (5).
Se realizaron las pruebas de hidrólisis o descomposición de caseína, xantina, hipoxantina, tirosina y urea. (22)
Estudio edafológico:
Las muestras fueron enviadas al Laboratorio de Suelos de la Escuela de Geografía de la Universidad de Los Andes, para obtener los datos correspondientes a textura por el método de Bouyucos (contenido de arena, arcilla y limo), pH en H2O (2:1), relación C/N, carbono orgánico (Método de Walkley-Black), nitrógeno (Método de Kjeldahl), fósforo (método de Olsen) y magnesio, sodio, potasio y calcio (por extracción en acetato de amonio y medición por espectroscopía de absorción atómica).
Análisis estadístico:
Los valores del NMP fueron normalizados mediante el log en base 10 de n+1. A los resultados obtenidos se les realizó un análisis de correlación de Pearson y ANOVA de Kruskal-Wallis, utilizando el paquete estadístico para Windows, STATISTICA 4.5.
RESULTADOS
Características de los suelos estudiados:
Las características edafológicas de las muestras estudiadas se presentan en la tabla 2. Los suelos estudiados se caracterizaron por ser francos (CI, CII y B), franco arenosos (CIII, PB y HA) y franco arcilloso (HB y CB). No se encontraron diferencias significativas entre el contenido de arena, limo, arcilla, fósforo, sodio, magnesio y calcio. El pH y el carbono orgánico de los suelos varió entre 6,05-7,45 y 0,80-4,15%, respectivamente.
Tabla 2. Características edafológicas de las muestras de suelo estudiadas.
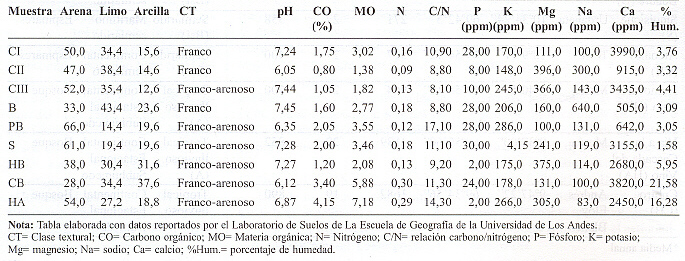
Las muestras de Cubiro y Humocaro Alto presentaron el mayor porcentaje de humedad, 21,58 y 16,28%, respectivamente; así como también mostraron el mayor contenido de materia orgánica, 5,88 y 7,18, respectivamente, observándose diferencias significativas con respecto al resto de los suelos, cuyo porcentaje de humedad varió entre 1,58-5,95%.
Estimación de la población total:
La población de bacterias viables totales osciló entre 1,19 x 106-1,75 x 107 organismos/g de suelo seco. La muestra de Bobare fue la que presentó la menor población (1,19 x 106 organismos/g de suelo seco). Mientras que Humocaro Alto mostró la mayor población de bacterias viables totales , 1,75 x 107 organismos/g de suelo seco.
Caracterización morfológica, citoquímica y fisiológica de las cepas aisladas:
Se aislaron un total de sesenta y cuatro cepas sugestivas de actinomicetos, a partir de las 9 muestras de suelos procesadas, de las cuales treinta y seis fueron sugestivas de Nocardia sp. Todas estas cepas fueron Gram-positivas, en forma de filamentos, cocos y/o bacilos. Entre las características coloniales se destaca que el micelio aéreo de las cepas varió de blanco a salmón, las colonias fueron pequeñas o puntiformes, con bordes regulares, de aspecto seco y de consistencia dura. Al microcultivo se observaron filamentos finos, ramificados con fragmentación a bacilos y/o cocos a partir del quinto día.
El 100% de estas cepas presentaron ácidos micólicos y fueron resistentes a la lisozima. Las características fisiológicas permitió identificar treinta cepas como pertenecientes al complejo Nocardia asteroides, tres N. transvalensis, una N. otitidiscaviarum y dos cepas a las que no se logró ubicar en especie (ver tabla 3).
Tabla 3. Especies de Nocardia aisladas de cada uno de los sitios de muestreo.

Veintidós cepas se ubicaron como "otros actinomicetos", debido a que no fragmentaban el micelio, no presentaron ácidos micólicos y eran sensibles a la lisozima, mientras que seis cepas se identificaron como Rhodococcus sp. debido a que al Gram se observaron sólo cocos y bacilos Gram-positivos, presentaron ésteres metílicos de ácidos micólicos y fueron sensibles a la lisozima.
Estimación de la población de parafinolíticos totales y nocardiformes:
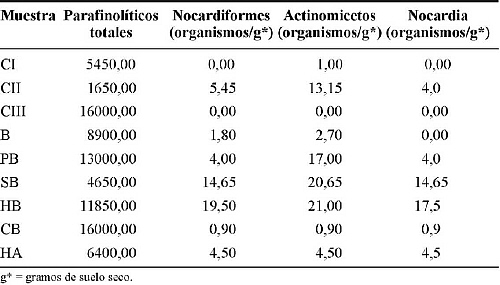
Las poblaciones de los parafinolíticos totales y los nocardiformes difieren significativamente (ver tabla 4), ya que la población de parafinolíticos totales varió desde 1.650-16.000 organismos/g de suelo seco, mientras que la población de nocardiformes osciló entre 0,9-19,5 organismos/g de suelo seco.
Las muestras de Potrero de Bucare, Carora II, Siquisique y Humocaro Bajo fueron las que presentaron la mayor población de actinomicetos (17,0; 13,75; 20,65 y 21,0 organismos/g de suelo seco, respectivamente). Es importante destacar que en las muestras de Potrero de Bucare y Carora II fue donde se observó la mayor diferencia entre la población de actinomicetos y la de los nocardioformes.
Estimación de la población de Nocardia:
En las muestras de Bobare, Carora I y III no se aislaron Nocardia sp., mientras que en los suelos de Siquisique y Humocaro Bajo se logró aislar la mayor población de estos microorganismos, 14,65 y 17,5 organismos/g de suelo seco, respectivamente (Ver tabla 4). En las muestras restantes (Cubiro, Carora II Potrero de Bucare y Humocaro Alto) la población osciló entre 0,9-4,5 organismos/g de suelo seco.
Tabla 4. Estimación de la población de parafinolíticos totales y nocardiformes.
DISCUSIÓN
Estimación de la población total de bacterias viables:
No se observaron diferencias significativas en la población total de los suelos de Bobare, Potrero de Bucare, Siquisique, Humocaro Alto y Bajo. Tampoco se observó una marcada correlación de la población total de bacterias viables con los parámetros edafológicos estudiados; por lo tanto, la población de bacterias viable en estos suelos no es afectada por factores del ambiente, tales como condiciones climatológicas de la región ni por las características del suelo, entre estas, materia orgánica, pH, humedad, textura, etc.
Aislamiento:
Del total de cepas de actinomicetos aisladas en el presente estudio, el 56,25% correspondió a especies de Nocardia, de las cuales el 77,78% fueron identificadas como pertenecientes al complejo N. asteroides. Resultados similares han sido reportados por otros autores (23,24), quienes lograron aislar con la técnica del señuelo de parafina cepas de N. asteroides, entre el 71 y el 79%. Otros autores (20, 25, 26) recuperaron sólo N. asteroides (100 %) de muestras provenientes de suelos. Estos resultados nos indican que la distribución de especies de Nocardia está limitada a determinadas regiones, y posiblemente esto pueda estar influenciado por características climáticas o del suelo que aún no se han logrado determinar.
En el presente estudio se logró aislar tres cepas de N. transvalensis (dos de Humocaro Bajo y una de Carora II); éstas representaron el 8,3% de las cepas de Nocardia aisladas. Hasta ahora otros autores no han reportado el aislamiento de esta especie en otras regiones del mundo y Venezuela, por lo que estos resultados sugieren la vida saprofítica de esta especie en el suelo.
Además, se logró aislar una N. otitidiscaviarum de la muestra de Humocaro Bajo (2,78% del total de cepas de Nocardia aisladas), y no se logró aislar N. brasiliensis. Estos resultados difieren de los reportados por otros autores (12, 27) y por Malik et al., 1982 y Unaogu et al., 1993 citados por Khan et. al. (26), quienes lograron aislar N. otitidiscaviarum y N. brasiliensis en mayor proporción a la obtenida en nuestro estudio.
Otro estudio (15) señala sólo el aislamiento de N. asteroides por el método en agar suplementado con antibióticos a partir de muestras de suelos de España, mientras que en un estudio realizado en México (16), utilizando un método similar, aislaron un 23,62% de N. asteroides, un 59,05% de N. brasiliensis y un 17,32% de N. otitidiscaviarum. Todos estos resultados sugieren que, independientemente del método utilizado para el aislamiento de Nocardia, existe una distribución de este microorganismo que difieren en las regiones del mundo; sin embargo, en la mayoría de las regiones donde se ha logrado aislar nocardias, la especie más frecuente es N. asteroides.
Estimación de la población de Nocardia sp.:
Al comparar el porcentaje de recuperación de Nocardia sp. respecto a los parafinolíticos totales, se encontró que éste varió en un rango de 0,0056-0,34% en las diferentes muestras estudiadas, lo cual indicó que la técnica del señuelo de parafina no es selectiva para el aislamiento de nocardias del suelo, ya que permite el crecimiento de otros microorganismos capaces de utilizar la parafina como única fuente de carbono. Estos resultados nos permiten explicar el hecho de no aislar N. brasiliensis, ya que probablemente esto sea debido a que la población de parafinoliticos totales enmascaró el crecimiento de este microorganismo y no necesariamente al hecho de que no estén presentes en el suelo. Esta misma razón podría explicar que la población de Nocardia haya sido muy baja.
Al comparar la población de Nocardia sp. con la población de actinomicetos no se encontraron diferencias significativas.
En nuestro estudio la población de Nocardia osciló entre 0,9-17,5 organismos/g de suelo seco, resultados que difieren a los reportado en otro estudio (15), en el cual la población de N. asteroides, aislada de suelos de España, osciló entre 5,1x102 y 1,21x104 UFC/gr de suelo seco. Llama la atención que suelos con alto contenido de carbono y humedad (CB y HA) muestren una población tan baja de Nocardia.
Estudio edafológico:
Al comparar el contenido de carbono y materia orgánica, nitrógeno y porcentaje de humedad de las muestras de las zonas con vegetación tipo espinares con las muestras de la zona que presentaron vegetación tipo bosque se encontró diferencia significativa (p< 0,05).
A pesar de que otros autores (10,16) han reportado que el tipo de suelo y la vegetación son parámetros ecológicos importantes que influyen en la distribución y número de nocardias en el suelo, en nuestro estudio no se observó diferencia significativa al comparar la población de Nocardia presente en el suelo con el tipo de vegetación, ni con otro de los parámetros edafológicos estudiados, excepto con el pH, ya que en las muestras de suelo de donde se logró aislar Nocardia su densidad de población muestra una fuerte correlación positiva con el pH (r=0,87, p< 0,05).
Estos resultados difieren a los reportados por otros autores (15), quienes sí encontraron que existe una correlación estadísticamente significativa entre la población de Nocardia y el contenido de carbono presente en el suelo, pero no encontraron diferencias con el contenido de nitrógeno, relación C/N y contenido de humedad. Sin embargo, otros autores (16) no encuentran variaciones importantes en las características edafológicas de los suelos en dos zonas estudiadas (zona endémica y no endémica de micetomas), y atribuyen la abundancia de actinomicetos en los suelos de la zona endémica a tres factores: 1) clima prevaleciente; 2) el tipo de vegetación y 3) al cultivo predominante.
CONCLUSIONES
1. La especie de Nocardia más frecuentemente aislada del suelo de las zonas estudiadas fue N. asteroides, seguida de N. transvalensis. y N. otitidis-caviarum.
2. La mayor densidad de población de Nocardia se obtuvo de suelos ligeramente alcalinos, con bajo contenido de humedad y de materia orgánica.
3. La mayor densidad de población y diversidad de especies de Nocardia se encontró en los suelos de Humocaro Bajo-El Tocuyo
4. La técnica del señuelo de parafina no es suficientemente selectivo para aislar Nocardia, pues buena parte de la microbiota del suelo puede crecer con parafina como única fuente de carbono.
BIBLIOGRAFÍA:
1. Sandoval AH, Serrano JA. Identificación y Diagnóstico de Actinomicetos Patógenos. Xochimilco (México): Universidad Autónoma Metropolitana; 1996. [ Links ]
2. Serrano JA. Infecciones producidas por Nocardia. Rev Soc Ven Microbiol. 1996; 16 (1): 6-14. [ Links ]
3. Boiron P, Provost F, Dupont B. Methods de Laboratoire pour Le Diagnostic de la Nocardiosis. Paris: Instituto Pasteur; 1993. [ Links ]
4. Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. Diagnóstico Microbiológico. Texto y Atlas a Color. 5ta. ed. Argentina: Editorial Médica Panamericana; 1999. [ Links ]
5. Schaal K, Beaman B. Clinical significance of actinomycetes. En: Goodfellow M, Mordarski M and Williams S, editores. The Biology of the Actinomycetes. London: Academic Press. 1984. [ Links ]
6. Serrano J, Mejías M, Zamora R, García E. and Boiron P. Streptomyces somaliensis as an Etiologic Agent of Actinomycetoma in Lara State, Venezuela. An epidemiological, clinical, microbiological, molecular and hitological. Study of five case. J Mycol Med. 1998; 8: 97-104. [ Links ]
7. Lavalle P. Micetomas en México. En: Barroeta S, editor. Micetomas. Memorias del Primer Simposio Internacional. Barquisimeto, Edo. Lara, Venezuela. Editorial Venezolana. 1978. [ Links ]
8. Beaman B, Beaman L. Nocardia Species: Host-Parasite Relationships. Clin Microbiol Rev 1994; 7 (2): 231-264. [ Links ]
9. Pérez M, Hernández R, Fernández G, Yegres F. Micetoma: Reporte de tres casos en el estado Falcón, Venezuela. Invest. Clin. 1996; 37 (1): 61-73. [ Links ]
10. McNeil M, Brown J. The Medically Important Aerobic Actinomycetes. Clin Microbiol Rev 1994; 7: 357- 417. [ Links ]
11. Van Gelderen A, Duran E. The efficiency of 1M NH4Cl and 2M NaCl for the isolation of pathogenic Nocardia from soil. Mycopathologia 1989; 108: 117-123. [ Links ]
12. Van Gelderen A, Runco R, Salin R. Natural occurrence of Nocardia in soil of Tucumán: Physiological characteristics. Mycopathologia 1987; 99: 15-19. [ Links ]
13. Kurup P, Schmitt JA. Isolation of Nocardia form soil by a Modified Paraffin Bait Method. Mycologia 1971; 63 (1): 175-177. [ Links ]
14. Groth I, Vettermann R, Schuetze B, Schumann P, Saiz-Jiménez C. Actinomycetes in Karstic caves of northern Spain (Altamira and Tito Bustillo). J. Microbiological Methods 1999; 36 (1-2): 115-122. [ Links ]
15. Valero P, Martín F. Nocardia in soil of southeasterns Spain: abundance, distribution, and chemical characterization. Can. J. Microbiol. 1984; 30: 1088-1092. [ Links ]
16. Castañón-Olivares L, Manzanno-Gayosso P, Hernández-Hernández F, Romero-Martínez R, López-Martínez R. Aislamiento de Actinomicetos Patógenos en una Zona endémica de Micetoma en México. Rev. Mex. Mic. 1992; 8: 111-120. [ Links ]
17. Albornoz M. Distribución Geográfica de los Micetomas en Venezuela. En: Barroeta S, editor. Micetomas. Memorias del Primer Simposio Internacional. Barquisimeto, Edo. Lara. Venezuela. Editorial Venezolana; 1978. [ Links ]
18. Serrano J, Novoa D, Mejia M, García E. Mycetoma in Venezuela- Series of cases of State of Lara (1976-1994). Multidisciplinary Family- case. Comparison Epidemiologic Study (1994-1996). En: The Biology of the Actinomycetes´94. Procceding of the Ninth International Symposium on the Biology of the Actinomycetes. V; 1995. [ Links ]
19. Tablante R. Aislamiento de Nocardia a partir de Suelos en el Estado Mérida Trabajo de ascenso no publicado. Universidad de Los Andes, Facultad de Farmacia. Mérida, Venezuela; 1986. [ Links ]
20. Uzcátegui M, Serrano J, Rojas K, García E, Díaz F, Couble A y col. Aislamiento de Nocardia asteroides de muestras de suelo de cinco estados de Venezuela. Rev. Soc. Ven. Microbiol. 2001; 21 (1): 17-23. [ Links ]
21. Alexander M. Most Probable-number method for Microbial Population. En: Black C.A., Evans D.D. et al, editores. Methods of Soil Analysis. Part 2, 1965. [ Links ]
22. Gondon R. Some strains in search of a genus- Corynebacterium, Mycobacterium, Nocardia or What?. J. General Microbiol. 1966; 43: 329. [ Links ]
23. McClung N. Isolation of Nocardia asteroides from soils. Mycology 1960; 52: 154-156. [ Links ]
24. Ajello G, Brown J, Mahgoub ES, Ajello L. A Note on the Isolation of Pathogenic Aerobic Actinomycetes from Sudanese Soils. Curr. Microbiol. 1979; 2: 25-26. [ Links ]
25. Goel S, Kanta S. Prevalence of Nocardia species in soil of Patiala area. Indian J. Pathol. Microbiol. 1993; 36 (1): 53-60. [ Links ]
26. Khan Z, Neil R, Chandy T, Chung, H, Al-Sayer, Provost F et al. Nocardia asteroides in the soil of Kuwait. Mycophatologia 1997; 137: 159-163. [ Links ]
27. Atias M, Farid A and Zaki M. Isolation of Pathogenic Fungi and Actimomycetes from Soil in Egypt. Sabouraudia 1981; 19: 217-221. [ Links ]












 uBio
uBio 
