Revista de la Sociedad Venezolana de Microbiología
versión impresa ISSN 1315-2556
Rev. Soc. Ven. Microbiol. v.23 n.2 Caracas jul. 2003
Cambios en la resistencia de Staphylococcus aureus a los antimicrobianos en centros clínicos del Area Metropolitana de Caracas, Venezuela. Período 1995-2002.
Changes in the resistance of Staphylococcus aureus to antimicrobials in clinical centers of Metropolitan Area of Caracas, Venezuela. Period 1995-2002.
De La Parte-Pérez MA1, Brito A2, Hurtado P1, Landaeta JM2, Guzmán M3, Carmona O3.
1. Cátedra de Microbiología, Escuela de Enfermería, UCV, Caracas.
2. Cátedra de Microbiología de la Escuela "J. M. Vargas", UCV, Caracas.
3. Grupo Venezolano de Vigilancia de la Resistencia Bacteriana a los Antimicrobianos.
RESUMEN
El objetivo de este trabajo fue estudiar los cambios en la resistencia a los antimicrobianos de aislados de Staphylococcus aureus (SA) provenientes de muestras clínicas recuperadas en tres centros de salud del área metropolitana de Caracas durante el período 1995-2002.
Los datos se obtuvieron de los Servicios de Bacteriología del Hospital Vargas (HV), Hospital Clínico Universitario (HCU) y Centro Médico (CM), participantes del Grupo Venezolano de Vigilancia de la Resistencia Bacteriana a los Antimicrobianos (GVRB). Analizamos 6.291 cepas de S. aureus mediante pruebas de sensibilidad a los antimicrobianos por el método de difusión en agar. Los rangos de resistencia registrados fueron: HV: oxacilina (Ox) 9 a 33%, vancomicina (Van) 0 a 1%, gentamicina (Gen) 2 a 16%, ciprofloxacina (Cip) 1 a 13%, eritromicina (E)10 a 25% y trimetoprim-sulfametoxazol (SXT) 2 a 13%. HUC: Ox 3 a 18%, Van 0 a 2%, Gen 5 a 33%, Cip 3 a 14%, E 10 a 30% y SXT 1 a 10%. CM: Ox 4 a 20%, Van 0%, Gen 5 a 10, Cip 2 a 14%, E 16 a 29% y SXT 1 a 6%. Los porcentajes de resistencia de este patógeno en estos centros, en general, reflejan una tendencia al aumento, especialmente ciprofloxacina, eritromicina y trimetoprim-sulfametoxazol. Sin embargo, los valores reportados para oxacilina son inferiores a los hallados en países asiáticos, Europa, EE UU y otros países de América Latina.
Palabras-clave: Staphylococcus aureus, resistencia a los antimicrobianos.
ABSTRACT
We studied the changes in antimicrobial resistance of Staphylococcus aureus (SA) isolates from three Health Institutions from the metropolitan area of Caracas during the period between 1995-2002. SA isolates were recuperated from the Bacteriology Services from Hospital Vargas (HV), Hospital Clínico Universitario (HCU) and Centro Médico (CM) participants of the venezuelan group for the surveillance of bacterial antimicrobial resistance (GVRB). The sensibility to antimicrobials of 6,291 isolates of SA was analyzed by the agar diffusion method. Percentages of resistance found were as follows: HV: oxacillin (Ox) reported values between 9 and 33%, vancomycin (Van) 0 to 1%, gentamicin (Gen) 2 to 16%, ciprofloxacin (Cip) 1 to 13%, erytromycin (E) 10 to 25% and trimethoprim-sulfamethoxazole (SXT) 2 to 13%. HUC: Ox 3 to 18%, Van 0 to 2%, Gen 5 to 33%, Cip 3 to 14%, E 10 to 30% and SXT 1 to 10%, and in CM: Ox 4 to 20%, Van 0%, Gen 5 to 10, Cip 2 to 14%, E 16 to 29% and SXT 1 to 6%.
The percentages of antimicrobial resistance for these isolates, in general, show tendency to increase, specially for Cip, E and SXT. Notwithstanding, the values found are lower than those reported in countries of Asia, Europe, USA and other Latinamerican countries.
INTRODUCCIÓN
Staphylococcus aureus es un microorganismo resistente, pudiendo sobrevivir a condiciones ambientales adversas. Son relativamente tolerantes al calor, a la desecación y a los medios con elevadas concentraciones de sal (1).
Desde el punto de vista microscópico, se caracterizan por ser cocos Gram-positivos, inmóviles, con un diámetro de 0,8 a 1 µm y una fuerte tendencia a agruparse en forma irregular, semejante a racimos de uvas, de donde deriva su nombre.
S. aureus crece rápidamente en medios de cultivo líquidos y sólidos, en condiciones aeróbicas o anaeróbicas. En el agar las colonias son lisas, convexas, con un diámetro de 1 a 4 mm, de color beige a dorado.
La mayoría de las cepas producen un halo de betahemólisis entre las 18 y 36 horas de cultivo en medios de agar-sangre. Se identifica en el laboratorio por resultar positivo a las pruebas de: coagulasa, catalasa, desoxirribonucleasa y fermentación de manitol, entre otras. Poseen ácido teicoico en su pared celular y un ADN con contenido bajo en guanina+citosina (G+C 30-39%) (1, 2).
Desde las primeras horas de vida, el ser humano es colonizado por S. aureus, localizándose éste en la región umbilical, perineal, la piel y aparato digestivo. En la edad escolar y adulta se convierte en portador, siendo el sitio de reservorio con mayor frecuencia el vestíbulo nasal anterior, donde la adherencia de los microorganismos parece estar mediada por su contenido en ácido teicoico (3).
Se estima que un 20-40% de las personas adultas portan S. aureus en sus fosas nasales, según factores estacionales y epidemiológicos (4). Se describe que el 30% de la población puede ser portadora permanente, el 50% portador intermitente y el 20% nunca es colonizado (5).
El estado de portador asintomático en la vagina de mujeres premenopáusicas es de aproximadamente el 10%, con aumento en el índice de portador y recuentos bacterianos durante las menstruaciones (6).
Hay personas que son mas propensas a la colonización por S. aureus, como el personal de salud (médicos, enfermeros, entre otros), siendo portadores naso-faríngeos en un porcentaje mayor de casos (50, 70 y 90%) que en la población general (7, 8).
Los pacientes diabéticos que reciben insulina, los consumidores de drogas parenterales y los pacientes con hemodiálisis tienen un índice de colonización mayor que la población general (9, 10). También el estado de portador es clínicamente importante en el caso de pacientes sometidos a cirugía o con trastornos cutáneos exudativos, los cuales experimentan un mayor número de infecciones que los no portadores, y éstas, habitualmente, son producidas por la misma cepa que coloniza al paciente (5).
S. aureus produce una diversidad de procesos clínicos, siendo la lesión anatómica característica el absceso piógeno o un exudado purulento. Además, las toxinas extracelulares en ciertas circunstancias dominan este cuadro clínico (intoxicación alimenticia, síndrome de choque tóxico). Por último, cualquier infección localizada puede convertirse en el punto de siembra de una bacteremia potencialmente fatal, con focos metastásicos.
La resistencia de S. aureus a los antimicrobianos ß-lactámicos es un problema clínico importante. En la actualidad se efectúa la distinción entre tres diferentes tipos de resistencia (11): a) resistencia mediada por ß-lactamasas; b) resistencia intrínseca; y c) tolerancia a la destrucción por los antibióticos ß-lactámicos.
En 1929, Fleming aisló la penicilina de Penicillium notatum, y en 1941 Florey, Chain y colaboradores hicieron posible la producción comercial de la penicilina G, iniciando su uso clínico.
A partir del año 1945 se reporta la primera cepa de S. aureus resistente, que producía una proteasa de la serina (penicilinasa) capaz de hidrolizar el anillo ß-lactámico que inactiva al antibiótico (12 ).
La mayoría de las cepas de S. aureus resistentes a la penicilina contienen plásmidos que les permiten producir una ß-lactamasa extracelular que hidroliza e inactiva a la penicilina G (13). Actualmente sólo un porcentaje limitado de aislados intrahospitalarios (5%) y un 20-30% de cepas extrahospitalarias no producen ß-lactamasas, permaneciendo sensibles a la penicilina G (5).
Entre 1960 y 1964, se produjeron varios antibióticos semisintéticos resistentes a la penicilinasa: metilcilina y oxacilina, entre otros. En 1961 se aislaron cepas resistentes a metilcilina en Europa, y actualmente se han identificado en el resto del mundo (14).
La resistencia a meticilina indica también resistencia a todas las penicilinas-penicilinasa-resistentes y a las cefalosporinas, siendo responsable de esta resistencia el gen mec, el cual codifica la proteína fijadora de penicilina (15).
La expresión de la resistencia a la meticilina, es con frecuencia heterogénea, y el porcentaje de la población bacteriana que expresa el fenotipo de resistencia varía de acuerdo a las condiciones ambientales (16).
El mecanismo de la resistencia a meticilina y oxacilina está mediado por la mutación de un gen que lleva a la síntesis de una nueva proteína fijadora de penicilina (PFP, o PBP en inglés). Debe producirse además otra mutación. El segundo gen afectado regularía la expresión del nuevo gen codificador de la PFP, y su actividad es variable (17). Este hecho conduce al fenómeno de heterorresistencia, lo que significa que una de cada diez mil células de la bacteria aislada es resistente a oxacilina, y el resto, nueve mil novecientas noventa y nueve, son sensibles. El gen modulador se manifiesta cuando las bacterias se cultivan a 30ºC en solución de cloruro de sodio (NaCl) al 2% y en presencia de cationes divalentes. Si no se realiza el antibiograma en estas condiciones obtenemos un resultado de falsa sensibilidad a oxacilina (18).
Algunos Staphylococcus aureus resistentes a oxacilina contienen un plásmido que codifica la ß-lactamasa y la aminoglucósido adenil transferasa. Estas cepas, además de ser resistentes a la penicilina G y a la oxacilina, también lo son a los aminoglucósidos como la gentamicina y la tobramicina (19).
Todos los Staphylococcus aureus resistentes a oxacilina lo son también a las cefalosporinas y a la clindamicina y, generalmente, son sensibles a la vancomicina, la rifampicina y la combinación de trimetoprim-sulfametoxazol, la teicoplanina, el ácido fusídico y las quinolonas como enoxacina y ciprofloxacina (20, 21).
Las cefalosporinas de primera generación son las más activas contra los cocos Gram-positivos, incluyendo S. aureus y Streptococcus (22). Además, son los agentes de elección para la profilaxis de la mayoría de los procedimientos quirúrgicos, que incluyen operaciones ortopédicas y cardiovasculares (23, 24).
Se produce sinergismo cuando se combinan penicilinas resistentes a la penicilinasa, como oxacilina y nafcilina, con gentamicina contra este microorganismo (25).
Hasta el momento no existen datos que demuestren la ventaja del uso de combinaciones de antimicrobianos en el tratamiento de infecciones humanas causadas por S. aureus con respecto a la terapia con penicilina o cefalosporinas solas (26).
La combinación de ß-lactámicos y aminoglucósidos incrementa la capacidad de muerte bacteriana in vitro (27) y en el modelo animal con endocarditis (28). En un ensayo clínico comparando tratamiento con una sola droga y la combinación para el tratamiento de endocarditis, la terapia combinada resultó ser más rápida en la resolución de la bacteremia, pero el resultado clínico fue el mismo con las dos terapias (29). Muchos clínicos, cuando es posible, utilizan un aminoglucósido durante los primeros días de tratamiento.
La vancomicina, antibiótico bactericida de pequeño espectro, es la droga de elección para el tratamiento de las infecciones causadas por S. aureus resistente a los ß-lactámicos (oxacilina y cefalotina).
Los múltiples mecanismos de acción de la vancomicina (inhibición de la síntesis y el ensamblado de la 2da. etapa del peptidoglicano de la pared celular y alteración de la permeabilidad de la membrana citoplasmática), contribuyen a la baja frecuencia de desarrollo de resistencia (30).
Desde la descripción de enterococos resistentes a vancomicina, en 1988, se anticipaba la emergencia de Staphylococcus aureus resistentes a vancomicina (SARV - concentración inhibitoria mínima [CIM] >32 µg/mL) (31), mediante la transferencia a Staphylococcus aureus del elemento genético contentivo del gen de la resistencia denominado vanA procedente de Enterococcus faecalis. Este evento fue demostrado in vitro en 1992 (32), y posteriormente en 1996 fue reportado en Japón el primer aislado clínico de Staphylococcus aureus con susceptibilidad disminuida a la vancomicina (VISA) (33), según los criterios de la NCCLS (34) y, hasta junio de 2002 se habían identificado ocho (8) pacientes con infecciones por este microorganismo con sensibilidad intermedia a vancomicina (VISA) en EE UU (35, 36).
En julio de 2002 se reporta la primera infección clínica por Staphylococcus aureus resistente a vancomicina (VRSA) (37) y en el boletín semanal del CDC de Atlanta, de fecha 11 de octubre de 2002, en Pennsylvania, se reporta el segundo caso de VRSA procedente de una muestra de un paciente hospitalizado por úlcera crónica del pie y probable osteomielitis (38). El aislado fue sometido a antibiograma por el método de difusión con disco en agar y sembrado en placa de agar cerebro-corazón adicionado con vancomicina (Van) a una concentración de 6 µg/mL. El crecimiento de las colonias en la placa y una zona de 12 mm. de diámetro de inhibición del crecimiento de las colonias alrededor del disco de Van, sugerían que la cepa tenía susceptibilidad reducida a Van. Seguidamente, mediante Etest® se confirmó que se trataba de una cepa resistente a Van (CIM = 64 µg/mL). Luego se notificó al Departamento de Salud de Pennsylvania (PDH) y se remitió el aislado al CDC, donde fue confirmado mediante el método de microdilución en caldo como VRSA (CMI de vancomicina = 32 µg/mL). Esta capa contenía ambos genes de resistencia mecA y vanA, los cuales, son responsables de la resistencia a oxacilina y vancomicina, respectivamente. El aislado resultó sensible a cloranfenicol, linezolid, minociclina, quinupristin-dalfopristin, rifampicina y trimetoprim-sulfametoxazol (38).
La presencia del gen vanA en este aislado sugiere que el determinante de resistencia fue adquirido de un enterococo resistente a vancomicina; asimismo, este aislado parece no estar relacionado con el primer VRSA identificado en la muestra del paciente en Michigan (37).
El objetivo de este trabajo fue revisar los cambios en la resistencia a los antimicrobianos de cepas de Staphylococcus aureus provenientes de muestras de centros clínicos del área metropolitana de Caracas, Venezuela, durante el período 1995 - 2002.
MATERIALES Y METODOS
Se analizaron 6.291 cepas de S. aureus (SA), aisladas de diversas muestras clínicas (hemocultivos, secreción ótica, líquido cefalorraquídeo (LCR), líquido pleural, secreción nasal, esputo, orina, heces, huesos, piel heridas, abscesos, entre otras), provenientes de 3 centros hospitalarios del área metropolitana de Caracas, durante los años 1995-2002.
La determinación de la sensibilidad a los antimicrobianos de S. aureus (oxacilina (Oxa), vancomicina (Van), gentamicina (Gen), ciprofloxacina (Cip), eritromicina (E) y trimetoprim-sulfametoxazol (SXT), se realizó mediante el método de difusión en agar con discos impregnados de antibióticos, según recomendaciones de Bauer-Kirb (39) y siguiendo las normas de eficiencia de la NCCLS (Comité Nacional de Estándares para los Laboratorios Clínicos) (40). Se midieron los halos de inhibición frente a cada antimicrobiano, los cuales fueron registrados en un formato, que además recoge información sobre: nombre de la institución, identificación del paciente, edad, sexo y procedencia de la muestra. Estos datos fueron remitidos a la Unidad de Microbiología e Infectología del Hospital "J.M. Vargas" de Caracas, sede del Grupo de Vigilancia de la Resistencia Bacteriana a los Antimicrobianos en Venezuela (GVRB), y transcritos a un sistema computarizado adaptado al programa Whonet, que incorpora a Venezuela a la red internacional coordinada por la OMS.
RESULTADOS Y DISCUSIÓN
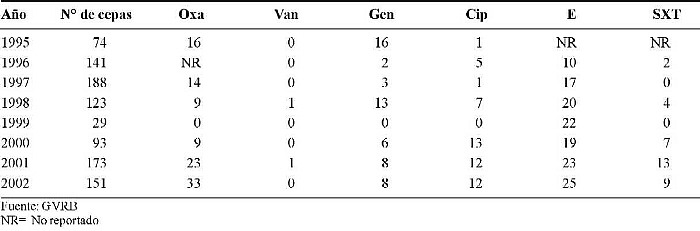
En el Hospital "J. M. Vargas" de Caracas (HV) se recuperaron 972 cepas de S. aureus, y la resistencia a la oxacilina (Oxa) reportó valores entre 9 y 33%, vancomicina (Van) entre 0 y 1%, gentamicina (Gen) entre 2 y 16%, ciprofloxacina (Cip) entre 1 y 13%, eritromicina (E) entre 10 y 25%) y trimetoprim-sulfametoxazol (SXT) entre 2 y 13% (Cuadro 1).
Cuadro 1. Comportamiento de la resistencia a los antimicrobianos de los aislados de S. aureus en el Hospital Vargas de Caracas, Venezuela. Período 1995-2002.
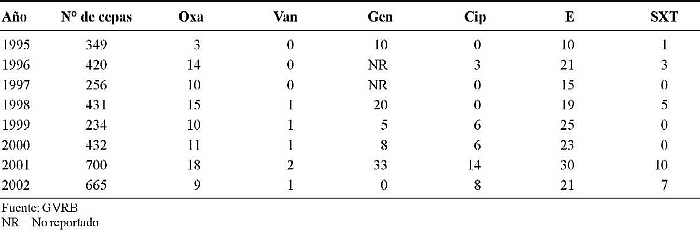
En el Hospital Universitario de Caracas (HUC), donde los aislados de S. aureus fueron 3.487, los resultados de la resistencia fueron: Oxa entre 3 y 18%, Van 0 a 2%, Gen 5 a 33%, Cip 3 a 14%, E 10 a 30% y SXT 1 a 10% (Cuadro 2).
Cuadro 2. Comportamiento de la resistencia a los antimicrobianos de los aislados de S. aureus en el Hospital Universitario de Caracas, Venezuela. Período 1995-2002.
En el Centro Médico de Caracas (CM), de los 1.832 aislados los hallazgos fueron como sigue: Oxa 4 a 20%, Van 0%, Gen 5 a 10%, Cip 2 a 14%, E 17 a 29% y SXT 1 a 6% (Cuadro 3).
Cuadro 3. Comportamiento de la resistencia a los antimicrobianos de los aislados de S. aureus en el Centro Médico, Caracas, Venezuela. Período 1995-2002.
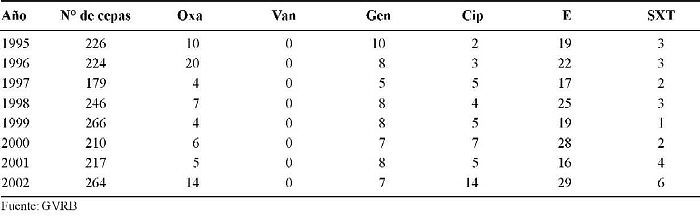
Los valores de resistencia de S. aureus a la Oxa se mantienen estables cuando se comparan con los reportados para otros períodos (41), siendo el rango de éstos relativamente amplio (entre 3 y 33%). El aumento reflejado se limita al Hospital Vargas de Caracas (Cuadro 1).
El primer informe del GRVB, en 1989, reporta para S. aureus 25% de resistencia a Oxa. Posteriormente, en el segundo informe, que abarca los años 1988, 1989 y 1990, los valores se mantienen hasta 1990, cuando se reporta un descenso (17%), y para el año 2002 el total nacional es de 15% (42-45).
Al comparar nuestros resultados con los de otros países, observamos que los valores de resistencia para Oxa en Europa, para el período 1999-2003, son como sigue: Alemania 8,5 a 18,2%, España 23,2 a 28,1% y Reino Unido 33,2 a 44,4% (46).
El Grupo Colombiano para la Vigilancia de la Resistencia Bacteriana a los Antimicrobianos (RESCOL), en un estudio realizado durante el período 2001 - 2002 reporta para S. aureus resistencia a Oxa del 52% (47).
Una investigación realizada por Seal y cols. en un hospital docente de Chicago, EE UU, durante el período 1986-2000, reporta resistencia de S. aureus a Oxa de 13 al 28%, respectivamente (48).
Pan y colaboradores reportan en aislados clínicos de S. aureus (SA) obtenidos de pacientes de una cárcel del Condado de California, durante el período 1997-2002, resistencia a Oxa del 29 al 74% (49).
El 91% de estos aislados meticilino-resistentes eran portadores del "cassette" genético mec (SCC mec) tipo IV. Mediante electroforesis pulsada en gel y tipeaje secuencial multilocus, demostró dos grupos mayores de clones. Uno de estos grupos es genéticamente indistinguible del responsable del brote producido por un S. aureus meticilino-resistente en el sistema carcelario del Condado de los Ángeles, EE UU, en 2002 (40).
Edmond y colaboradores, en un análisis de más de 10.000 bacteremias hospitalarias provenientes de 49 hospitales durante un período de tres años, encontraron que los agentes causales se distribuían como sigue: 64% Gram-positivos, 27% Gram-negativos y 8% levaduras. El agente más frecuente fue el estafilococo coagulasa-negativo, en un 32% de los aislados, S. aureus 16%, enterococos 11%, siendo la resistencia a meticilina para los aislados de SA en este grupo del 29% (50).
Para Van, nuestros datos reportan valores de 0 a 2%. Cabe indicar que estos resultados llamaron mucho la atención en su momento, pero no se hizo el seguimiento adecuado a los aislados para confirmar esta resistencia. En estos momentos existe una mayor vigilancia sobre el control de la calidad de los discos de antibiótico, y mejor dominio de los procedimientos para la realización del antibiograma por el personal participante en el GVRB. Actualmente pareciera que hay ausencia de resistencia del SA a vancomicina en América del Sur (45, 47).
Gentamicina reportó valores de resistencia de entre 2 y 33%. Este antibiótico es de utilidad cuando se usa en combinación con oxacilina y otros ß-lactámicos, donde presenta sinergismo y es utilizado con éxito en el tratamiento de las bacteriemias por S. aureus (26-28).
Del grupo de las quinolonas, la ciprofloxacina es el antimicrobiano más utilizado en el tratamiento de las infecciones por este microorganismo, y aquí se reportan valores de resistencia de entre 1 y 14%.
Para eritromicina, los valores oscilan entre el 10 y el 29%, probablemente debido al uso indiscriminado y mediante automedicación de dicho antibiótico a nivel de la comunidad.
En relación con trimetoprim-sulfametoxazol, se mantienen valores de resistencia entre el 1 y el 13%, por lo que este antimicrobiano permanece como de segunda elección ante infecciones no graves por este microorganismo (38).
CONCLUSIONES
La resistencia de S. aureus a oxacilina en Venezuela es menor que la reportada en otros países de América y Europa. No hay evidencia de resistencia a vancomicina y trimetoprim-sulfametoxazol pudiera considerarse como droga alternativa para las infecciones no graves por S. aureus resistente a las penicilinas. Es de hacer notar que el aislado del paciente de Pennsylvania VRSA, resultó ser sensible a este antimicrobiano entre otros.
REFERENCIAS BIBLIOGRÁFICAS:
1. Joklin W, Willet H , Amos D B, Wilfert C. Zinsser. Microbiología. 20ed. Buenos Aires: Médica Panamericana; 1999. p. 554-75. [ Links ]
2. Prescott LM, Harley JP, Klein D. Microbiología. 4 ed. Madrid: Mc Graw Hill Interamericana; 1999. p. 505-23. [ Links ]
3. Aly R, Shinefield HR, Litz C, Maibach HI. Role of teichoic acid in the binding of Staphylococcus aureus to nasal epithelial cells. J Infect Dis 1980; 141: 463. [ Links ]
4. Fekety FR Jr. The epidemiology and Prevention of Staphylococcal infection. Medicine 1964; 43:593. [ Links ]
5. Mandell GL, Bennett JE, Dolin R. Enfermedades Infecciosas Principios y Prácticas. 4 ed. New York: Churchill Livingstone; 1997. p. 1754-77. [ Links ]
6. Martin RR, Buttram V, Besch P et al. Nasal and vaginal Staphylococcus aureus in young women: quantitative studies. Ann Inten Med 1982; 96 (2): 951. [ Links ]
7. Godffrey ME, Smith IM. Hospital hazards of Staphylococcal sepsis. JAMA 1958; 166:1197 [ Links ]
8. Walker TS. Microbiología. 1ed. México: Mc Graw Hill Interamericana; 2000. p.112-40. [ Links ]
9. Tuazon CV, Perez A, Kishoba T et al. Staphylococcus aureus among insulin-injecting diabetic patients. An increased carriage rate JAMA 1975; 231. p. 1272. [ Links ]
10. Kirmani N, Tuazon CV, Murray HW et al. Staphylococcus aureus carriage rate of patients receiving long-term, hemodialysis. Arch Intern Med 1978; 138: 1657. [ Links ]
11. Sabath JA. Mechanism of resistance of beta-lactam antiobiotic in strains of Staphylococcus aureus. An Inter Med 1982; 97: 339. [ Links ]
12. Spink W, Ferris V. Quantitative Action of penicillin inhibitor from penicillin-resistant strains of Staphylococci. Science.1945;102:221. [ Links ]
13. Murray BE, Moellering RC Jr. Patterns and mechanisms of antibiotic resistance. Med Clin North Am.1978; 62: 899. [ Links ]
14. Barber M. Methicillin-resistant Staphylococci. J Clin Pathol. 1961; 14: 385. [ Links ]
15. Chambers HF. Methicillin resistance in staphylococci: molecular and biochemical basis and clinical implications. Clin Microbiol Rev 1997; 10: 781-91. [ Links ]
16. Lowy FD. Staphylococcus aureus infections.N Engl J Med 1998; 339(8): 520-532. [ Links ]
17. Hartman BJ, Tomasz A. Expression of methicillin resistance in heterogenous strains of Staphylococcus aureus. Antimicrob Agents Chemother 1986; 29(85). [ Links ]
18. Boyce JM, White RL, Bonver MC, et al. Reliability of the MS2 system in detecting methicillin-resistant Staphylococcus aureus. J Clin Microbiol 1982; 15: 220. [ Links ]
19. Weinstein RA, Kabins SA, Nathan C et al. Gentamicin-resistant staphylococci as hospital flora: Epidemiology and resistance plasmids. J Infect Dis 1982; 145: 374. [ Links ]
20. Dixson S, Brumfitt W, Hamilton-Miller JMT. In vitro activity of combinations of antibiotics against Staphylococcus aureus resistant to gentamicin and methicillin. Infection 1985; 13: 43. [ Links ]
21. Walsh TJ, Hansen SL, Tatem BA et al. Activity of novobiocin against methicillin-resistant Staphylococcus aureus. J Antimicrob Chemother 1985; 15: 435. [ Links ]
22. Moellering RC Jr, Swartz MN. The newer cephalosporins. N Engl J Med 1976; 294:24. [ Links ]
23. Cartwright PS, Pittaway DE, Jones HW III et al. The use of prophylactic antibiotics in obstetrics and gynecology: a review Obstet Gynecol Surv 1984; 39: 537 [ Links ]
24. Norden CW. A critical review of antibiotic prophylaxis in orthopedic Surgery Rev Infect Dis 1983;5: 928. [ Links ]
25. Watanakunakorn C, Glotzbecker C. Enhancement of the effects of antistaphylococcal antibiotics by aminoglycosides. Antimicrob Agents Chemother 1974; 6:802. [ Links ]
26. Korzeniowski O, Sarde MA. The National Collaborative Endocarditis Study Group: Combination antimicrobial therapy for Staphylococcus aureus endocarditis in patients addicted to parenteral drugs and in nonaddicts. Ann Intern Med 1982 97: 496. [ Links ]
27. Houlihan HH, Mercier RC, Rybak MJ. Pharmacodynamics of vancomycin alone and in combination with gentamicin at various dosing intervals against methicillin-resistant Staphylococcus aureus-infected fibrin-platelets clots in an in vitro infection model. Antimicrob Agents Chemother 1997; 41: 2497-2501. [ Links ]
28. Miller M, Wexler MA, Steigbigel NH. Single and combination antibiotic therapy of Staphylococcus aureus experimental endocarditis: emergence of gentamcin resistant mutans. Antimicrob Agents Chemother. 1978; 14: 336-43. [ Links ]
29. Korzeniowski O, Sande MA. National Collaborative Study Group. Combination antimicrobial therapy for Staphylococcus aureus endocarditis in patients addict to parenteral drugs and in non addicts: a prospective study. Ann Intern Med 1987; 97: 496-503. [ Links ]
30. Fekety R. Vancomicina y Teicoplanina. En: Mandell GL, Douglas RG y Bennett J. Enfermedades Infecciosas, Principios y Prácticas 3 ed. Buenos Aires: Edit Med Panam; 1991. p.330-6. [ Links ]
31. National Committee for Clinical Laboratory Standards. Methods for dilution antimicrobial susceptibility tests for bacteria that grow aerobically. 4th ed. Approved standard, M7-A4. Villanova, Pa: National Committee for Clinical Laboratory Standards, 1997. [ Links ]
32. Noble WC, Virani Z, Cree RGA. Co-transfer of vancomycin and other resistance genes from Enterococcus faecalis NCTC 12201 to Staphylococcus aureus. FEMS Microbiol Lett 1992; 93: 195-8 [ Links ]
33. Hiramatsu K, Hanaki H, Ino T, Yabuta K, Oguri T, Tenover FC. Methicillin- resistant Staphylococcus aureus clinical strain with reduced vancomycin susceptibility. J Antimicrob Chemother 1997; 40: 135-6. [ Links ]
34. National Committee for Clinical Laboratory Standards. Methods for dilution antimicrobial susceptibility tests for bacteria that grow aerobically. 5th ed. Approved standard, M7-A5. Wayne, Pennsylvania: National Committee for Clinical Laboratory Standards, 2000. [ Links ]
35. Smith TL, Pearson ML, Wilcox KR et al. Emergence of vancomycin resistance in Staphylococcus aureus. N Engl J Med 1999; 340: 493-501. [ Links ]
36. Fridkin SK. Vancomycin-intermediate and resistant Staphylococcus aureus: what the infectious disease specialist needs to know. Clin Infect Dis 2001; 32: 108-15. [ Links ]
37. CDC. Staphylococcus aureus resistant to vancomycin. United States, 2002. MMWR 2002; 51: 565-7 [ Links ]
38. CDC. Public Health Dispatch: Vancomycin-Resistant Staphylococcus aureus Pennsylvania, 2002. MMWR 2002; 51(40): 902. [ Links ]
39. Bauer W, Kirby WH, Shenis JC et al. Antibiotic susceptibility testing by standardized single disk meted. Am J Clin Pathol 1986; 45: 493. [ Links ]
40. National Cummitee for Clinical Laboratory Standars. Performance standars for antimicrobial disk susceptibility test. Aproved standars M2.A4. NCCLS, Villanova, Pa ,1990. [ Links ]
41. Laima Sanz, Rubén Contreras, Gilda Teixeira, Livia Inciarte, Oswaldo Carmona y Grupo Venezolano de Vigilancia de la Resistencia Bacteriana en Venezuela. Resistencia de Staphylococcus aureus a los antimicrobianos en Venezuela. Bol Soc Ven Microbiol 1994; 14(2): 19-23 [ Links ]
42. Carmona O, Guzmán M y GVRB. Vigilancia de la Resistencia Bacteriana a los antimicrobianos en 13 hospitales de Venezuela. Tercer Informe: Años 1988, 1989, 1990. Bol Soc Ven Microbiol. 1991; 11(1): 16-22. [ Links ]
43. Carmona O, Guzmán M y GVRB. Vigilancia de la Vigilancia de la Resistencia Bacteriana a los antimicrobianos en Venezuela. Cuarto Informe: Años 1988-1991. Bol Soc Ven Microbiol. 1992; 12(1): 11-22. [ Links ]
44. Comegna M, Guzmán M, Carmona O, Molina M y GVRB. Resistencia Bacteriana en Venezuela. Nuevos hallazgos. Bol Soc Ven Microbiol. 2000; 20(1): 58-63. [ Links ]
45. Grupo Venezolano de Vigilancia de la Resistencia Bacteriana (GVRB). Actualización de los datos de Resistencia bacteriana a los antimicrobianos en Venezuela. Período Julio 2001-Diciembre 2002. Bol Soc Ven Microbiol. 2003; 23(1): 89-97. [ Links ]
46. Stef L.A.M. Bronzwaer, Otto Cars, Udo Buchholz, Sigvard Mölstad, Wim Goettsch, Irene K, Veldhuijzen, Jacob L. Kool, Marc J.W. Sprenger, John E. Degener, and participans in the European Antimicrobial Resistance Surveillance System. A European Study on the Relationship between Antimicrobial Use and Antimicrobial Resistance. Emerging Infect Dis Journal; 2002; 8:3. (Europ Antimicrobial Resistance Surveillance System) Disponible en: URL:http://www.cdc.gov/ncidod/EARSS.htm. [ Links ]
47. Arias CA, Reyes J, Zúñiga M, Cortés L, Cruz C, Rico CL, Panesso D. And on behalf of the Colombian Antimicrobial Resistance Group (RESCOL) Multicentre surveillance of antimicrobial resistance in enterococci and staphylococci from Colombian hospitals, 2001-2002. Journal of Antimicrobial Chemotherapy; 2003: 51, 59-68. [ Links ]
48. Seal JB, Moreira B, Bethel CD, Daum RS. Antimicrobial resistance in Staphylococcus aureus at the University of Chicago Hospitals: a 15-year longitudinal assessment in a large university-based hospital. Infect Control Hosp Epidemiol. 2003 Jun; 24(6): 403-8. [ Links ]
49. Pan ES, Diep BA, Carleton HA, Charlebois ED, Sensabaugh GF, Haller BL, Perdreau-Remington F. Increasing prevalence of methicillin-resistant Staphylococcus aureus infection in California jails. Clin Infect Dis. 2003; 37(10): 1384-8. [ Links ]
50. Edmond MB, Wallace SE, McClish DK, Pfaller MA, Jones RN, Wenzel RP. Nosocomial bloodstream infections in United States hospitals: a three-year analysis. Clin Infect Dis. 1999; 29(2): 239-44. [ Links ]












 uBio
uBio 
