Revista de la Sociedad Venezolana de Microbiología
versão impressa ISSN 1315-2556
Rev. Soc. Ven. Microbiol. v.28 n.2 Caracas dez. 2008
Serotipos y resistencia antimicrobiana de cepas de Shigella flexneri aisladas de niños con diarrea aguda. Relación entre el serotipo y la severidad del episodio
Iraiz Bellorína, Gidalia Urbinaa, Fabiola Gonzálezb, Belén Salinasb, María Tomatc, Rosabel Gonzálezd,*
aEscuela de Bioanálisis-UCV ,
bCiudad Hospitalaria Dr. Enrique Tejera-INSALUD,
cEscuela de Medicina- Universidad de Carabobo,
dSección de Enfermedades Entéricas- Instituto de Biomedicina, Venezuela.
*Correspondencia: E-mail: rosagoma@hotmail.com
Resumen: Se determinó el serotipo, susceptibilidad a los antimicrobianos y la relación de severidad de la infección con el serotipo, a un grupo de 50 cepas de S. flexneri aisladas de niños menores de 5 años con diarrea: 25 niños deshidratados y 25 no deshidratados. Para la tipificación se utilizaron antisueros comerciales y la susceptibilidad a los antimicrobianos se realizó por el método de difusión en disco. Características epidemiológicas y clínicas de los episodios: media de edad 13,32 meses ± 12, clase obrera y marginal 94% (P< 0,05), eutróficos 80% (P<0,05), sangre macroscópica en heces 82% (P< 0,05), vómitos 60% (P> 0,05). El serotipo con mayor frecuencia fue el 2a (40%), seguido por el 3a (24%), 2b (18%), 1a (6%), 6 (4%), 3b (2%), 4a (2%), variante X (2%) y variante Y (2%). El mayor porcentaje de resistencia se observó a tetraciclina (96%), seguido por ampicilina (94%), cloranfenicol (90%), amoxicilina ácido clavulánico (84%) y trimetoprin-sulfametoxazol (72%). La desnutrición (36%, P< 0,05) y el serotipo 2a (56%, P< 0,05) se observaron con mayor frecuencia en los niños deshidratados, mientras que el serotipo 2b predominó en los no deshidratados (32%, P< 0,05). La prevalencia del serotipo 2a, su asociación con la severidad del episodio y la elevada resistencia a los antibióticos alertan sobre la problemática de la infección por Shigella en el país y refuerza la necesidad de estudios para ajustar pautas en el tratamiento.
Palabras clave: shigelosis, serotipo, diarrea, resistencia a los antibióticos
Serotype and antimicrobial resistance of Shigella flexneri strains isolated from children with acute diarrhea. Relationship between serotype and severity of the episode
Abstract: Serotype, antimicrobial susceptibility, and severity of the infection according to serotype, were determined in a group of 50 Shigella flexneri strains isolated from children less than 5 years old with diarrhea: 25 children dehydrated and 25 non dehydrated. Commercial antisera were used for serotyping and antimicrobial susceptibility was determined by the disc diffusion method. Clinical and epidemiological characteristics of the episodes: mean age 13.22 ± 12 months; 94% belonged to laborer and marginal classes (P<0.05); 80% eutrophic (P<0.05); 82% macroscopic blood in feces (P<0.05); 60% vomits (P>0.05). The most frequent serotype was 2a (40%), followed by 3a (24%), 2b (18%), 1a (6%), 6 (4%), 3b (2%), 4a (2%), variant X (2%) and variant Y (2%). The highest resistance percent was found for tetracycline (96%), followed by ampicylline (94%), chloramphenicol (90%), amoxicylline clavulonic acid (84%) and trimetoprim-sulfametoxazol (72%). Malnourishment (32%, P<0.05) and serotype 2a (56%, P<0.05) were seen more frequently in dehydrated children, while serotype 2b predominated in non dehydrated children (32%, P<0.05). Prevalence of serotype 2a and its association with the severity of the episode and high antibiotic resistance alert regarding the problem of Shigella infections in our country and reinforce the need of further studies to adjust treatment norms.
Keywords: shigellosis, serotype, diarrhea, antibiotic resistance
Recibido 30 de julio de 2008; aceptado 29 de octubre de 2008
Introducción
La shigelosis también conocida como disentería bacilar, es una enfermedad infecciosa aguda de las vías gastrointestinales inferiores causada por microorganismos del género Shigella. Las cuatro especies del género: S dysenteriae, S. flexneri, S. boydii y S. sonnei causan un gran espectro de infecciones que van desde una diarrea acuosa a la disentería fulminante. La infección se caracteriza por diarrea acompañada de fiebre, dolor abdominal agudo, tenesmo, vómitos y nauseas [1,2]. La patogénesis de Shigella es compleja, implica la interacción inicial del microorganismo con la célula huésped, invasión, multiplicación celular, lisis de la célula infectada, producción de enterotoxinas y diseminación de célula a célula [3]. Estos procesos dependen de la acción de múltiples genes que se encuentran en elementos cromosomales y plasmídicos [2,4,5].
Shigella causa anualmente en los países en desarrollo 163 millones de episodios de diarrea, y un millón de defunciones [6]. Se considera que el 70% de los casos reportados y 60% de las muertes ocurren en los niños menores de 5 años [6]. El alto porcentaje de defunciones esta relacionado con las precarias condiciones de vida, hacinamiento, baja higiene personal, falta de servicios básicos y poco acceso a programas de educación sanitaria y atención médica [7]. Además, se ha descrito que la distribución mundial de los serogrupos de Shigella no es igual en las distintas regiones; S. flexneri es mas frecuente en los países en desarrollo, mientras que en los países desarrollados predomina S. sonnei [6]. En Venezuela conocemos poco sobre la morbilidad y mortalidad de la infección por este microorganismo. Los trabajos publicados reportan una prevalencia que oscila entre 4 y 7% [8- 10] siendo más frecuente en los niños mayores de un año [10]. La shigellosis es una importante causa de muerte en los niños venezolanos. En un estudio de mortalidad por diarrea aguda en niños menores de 5 años realizado en la Ciudad Hospitalaria Dr. Enrique Tejera de la Ciudad de Valencia estado Carabobo, se aisló Shigella en el 19% de los niños fallecidos por diarrea, resultando además S. flexneri el serogrupo más frecuente [11].
A toda esta problemática, se une el creciente desarrollo de multirresistencia a los antibióticos que presenta Shigella [10,12-14] lo que reduce considerablemente las opciones de tratamiento y enfoca la lucha contra la enfermedad hacia otro horizonte como es el desarrollo de vacunas [15,16]. Algunas de estas vacunas se orientan a estimular la respuesta inmune contra los determinantes antigénicos serotipos específicos del polisacárido O [17,18] del lipopolisacarido (LPS) de la pared celular bacteriana. Pero el desarrollo de estos programas de vacunas solo tendrá éxito si se establecen en las regiones sistemas de vigilancia, que permitan conocer la prevalencia de la enfermedad y la distribución de los distintos serogrupos y serotipos de la bacteria.
El objetivo del estudio fue conocer el serotipo y el patrón de susceptibilidad a los antimicrobianos de un grupo de cepas de S. flexneri aisladas de niños menores de cinco años con diarrea, pertenecientes al sistema de vigilancia de la diarrea aguda de la Ciudad Hospitalaria Dr. Enrique Tejera de la Ciudad de Valencia, Edo. Carabobo en los años 1998 - 2005 [19]. Además se estudió la relación existente entre la severidad de las manifestaciones clínicas de la diarrea con los serotipos aislados.
Materiales y Métodos
Lugar del estudio y población
Las cepas de Shigella y datos de este estudio fueron obtenidos de pacientes que ingresaron al Sistema de Vigilancia de la Diarrea Aguda en niños menores de 5 años implementado en la Ciudad Hospitalaria Dr. Enrique Tejera (CHET) de la ciudad de Valencia, Estado Carabobo- Venezuela entre los años 1998 y 2005 [19]. El Sistema de Vigilancia fue aprobado por los Comités de Ética del Instituto de Biomedicina y de la Ciudad Hospitalaria Dr. Enrique Tejera.
Luego de haber obtenido el consentimiento informado del representante, los niños fueron evaluados clínicamente. Los datos (edad, género, estatus socioeconómico, tipo de alimentación, estado nutricional, fiebre, vómitos, grado de deshidratación, presencia de sangre macroscópica en las heces) se recolectaron y tabularon sistemáticamente. El estatus socioeconómico se determinó por la metodología de Graffar modificado [20] y el grado de deshidratación se estableció de acuerdo con los criterios de la Organización Mundial de la Salud [21]. Se definió un episodio de diarrea aguda como la presencia de tres o más evacuaciones en 24 horas, con alteración de la consistencia (líquida o semilíquida), con o sin sangre macroscópica en las heces y con una duración no mayor de 14 días [21].
De la población de niños con S. flexneri seleccionamos de forma aleatoria 50 casos: 25 niños deshidratados y 25 no deshidratados. La presencia de deshidratación se tomó como un indicador de la severidad de la infección.
Recolección y procesamiento de las muestras
Las muestras fueron recolectadas en envases adecuados, se evaluaron macroscópicamente y se tomó una porción representativa mediante dos hisopos estériles que posteriormente fueron colocados en el medio de transporte Cary- Blair (BBL, USA). En los casos en donde el paciente no evacuó, se tomaron las muestras mediante hisopado rectal. Las muestras se enviaron inmediatamente al laboratorio donde se sembraron en agar MacConkey (BBL, USA), agar Salmonella-Shigella (MERCK, Alemania), agar xilosa-lisina-dexosicolato (BBL, USA), caldo selenito (OXOID, Inglaterra) y se incubaron a 35°C por 18-24 horas. Las colonias lactosa negativas identificadas preliminarmente por métodos estandarizados [22] como Shigella fueron sembradas en placas de agar nutritivo (Difco, USA) para la determinación de los serogrupos, utilizando la metodología de aglutinación en lámina y los antisueros de la marca FUVESIN Productos Biológicos (Caracas, Venezuela). Las cepas se tipificaron utilizado los antisueros monovalentes DENKA-SEIKEN (Tokio, Japón). Se buscaron los tipos: 1a, 1b, 2a, 2b, 3a, 3b, 4a, 4b, 5a, 5b, 6, variante X y variante Y.
Prueba de susceptibilidad a los antimicrobianos
Los patrones de susceptibilidad se determinaron mediante el método de difusión de disco en agar siguiendo los lineamientos del Clinical and Laboratory Standards Institute (CLSI 2006) [23]. Se probaron los siguientes antibióticos: ampicilina (AMP) 10ug, amoxicilina/ácido clavulánico (AMC) 20ug/10ug, trimethoprim-sulfametoxazol (SXT) 1,25ug/23,75ug, ácido nalidíxico (NA) 30ug, ciprofloxacina (CIP) 5ug, tetraciclina (Te) 30ug, cloranfenicol (C) 30ug, ceftriazona (CRO) 30ug, cefotaxime (CTX) 30ug, aztreonam (ATM) 30ug e imipenem (IPM) 10ug, (Oxoid, Basingtoke, Hampshire, England). Como control se usaron las cepas E.coli ATCC 25922 y E.coli ATCC 35218.
Análisis de los datos
Los datos se registraron y procesaron en Microsoft Access y EXCEL en ambiente Windows, fueron analizados por estadística descriptiva y las proporciones se compararon mediante tablas de contingencia utilizando la prueba exacta de Fisher (2 colas y un intervalo de confianza (IC) de 95%). Las medias de las variables numéricas (edad), se compararon mediante la prueba t de Student (2 colas, 95% IC). Al comparar las características de los casos deshidratados y no deshidratados estimamos además los valores de Odds ratio (OR).
Resultados
Durante el período 2004-2005 en el Sistema de Vigilancia de la diarrea aguda implementado en la CHET se procesaron 1.442 coprocultivos, resultando el 27% (396/1442) positivos para Shigella. La frecuencia de los distintos serogrupos de Shigella fue: S. flexneri 21% (308/1442), S. sonnei 5% (75/1442), S. boydii 0.6% (9/1442), S. disenteriae 0,1% (2/1442). El 0.1% (2/1442) de las cepas no seroagruparon y fueron reportadas como Shigella spp.
La media de edad de los niños seleccionados para el estudio fue de 13,32 meses ± DS 11,9 meses. El 94% (46/49, P< 0,05) pertenece a la clase obrera y marginal (estratos sociales 4 y 5 por Graffar), el 80% (37/46, P<0,05) presentó peso y talla adecuados para la edad (eutróficos) y el 61% (11/18, P> 0,05) de la población menor de 6 meses no lacta leche materna. Observamos en el 82% (41/50, P< 0,05) sangre macroscópica en las heces y el 60% (30/50, P > 0.05) presentó vómitos.
El serotipo predominante fue el 2a (40%; 20/50), seguido del 3a (24%; 12/50), 2b (18%; 9/50), 1a (6%; 3/50), 6 (4%; 2/50), 3b (2%; 1/50 cepa), 4a (2%; 1/50), variante X (2%; 1/50 cepa) y variante Y (2%; 1/50).
Las cepas mostraron un alto porcentaje de resistencia a Te (96%, 48/50), AMP (94%, 47/50), C (90%, 45/50), AMC (84%, 42/50) y SXT (72%, 36/50). No se observó resistencia a NA, CIP, ATM, IPM, CRO y CTX. El 64% de las cepas presento resistencia simultánea a cinco antibióticos (AMP, AMC, SXT, C, Te), 22% fue resistente a cuatro antibióticos (AMP, AMC, C, Te), 6% a tres (AMP, AMC, Te) y 4% a dos (SXT, Te) (Tabla 1). En total el 92% presentó resistencia a más de tres antibióticos.
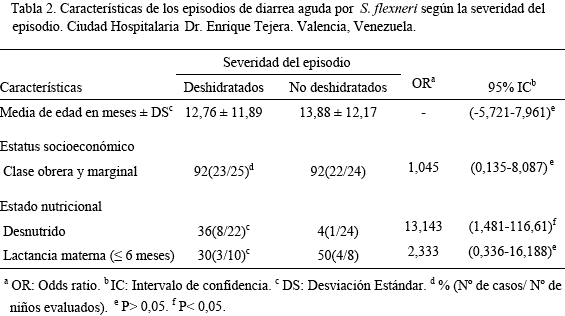
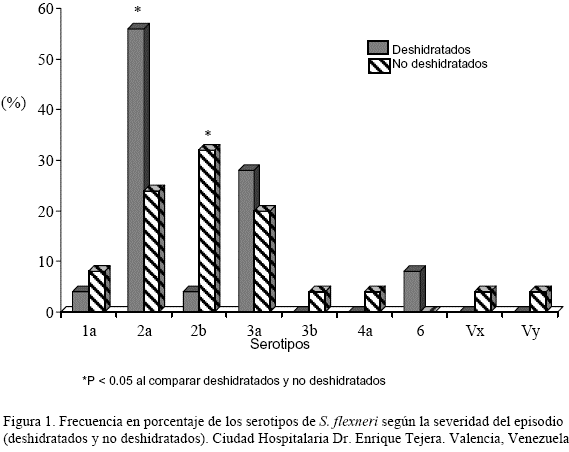
Las características de los casos deshidratados y no deshidratados se muestran y comparan en la Tabla 2. No observamos diferencias significativas entre los dos grupos respecto a la media de edad, estatus socioeconómico y tipo de alimentación. Sin embargo la desnutrición fue significativamente mas frecuente (P < 0,05) en los niños deshidratados (36%, 8/22) respecto a los no deshidratados (4%, 1/24). El único caso desnutrido en el grupo de los no deshidratados fue de tipo leve, mientras que en el grupo deshidratado 6 de los 8 niños desnutridos presentaron desnutrición severa. La frecuencia de los serotipos en los dos grupos se muestra en la Figura 1. El serotipo 2a fue significativamente más frecuente (P<0,05) en los niños deshidratados que en los no deshidratados (56% vs 24%, OR 4,030; 95% IC: 1,201-13,530). Mientras que el serotipo 2b predominó significativamente (P< 0,05) en los no deshidratados (32% vs 4%, OR 11,294; 95% IC: 1,289-98,942). Encontramos en los 14 casos deshidratados serotipo 2a, una mayor frecuencia de eutróficos (62%) que de desnutridos (38%), pero la diferencia no fue significativa (P>0,05; OR 0,3906; 95% IC 0,080- 1,898). Es de notar que fue mayor la variedad de serotipos en la población no deshidratada.
Discusión
Shigella es una importante causa de diarrea aguda en la población menor de 5 años de la Ciudad Hospitalaria Dr. Enrique Tejera de Valencia. Durante el período del estudio (2004-2005) ocupó el segundo lugar con una prevalencia del 27%. Al igual que en las regiones pobres del mundo la especie predominante fue S. flexneri y en los 50 casos estudiados observamos un alto porcentaje (94%) asociado a estratos sociales bajos. Se ha descrito la regionalización de los distintos serogrupos de Shigella pero no son claras las causas del predominio de S.flexneri en los países pobres y de S. sonnei en los desarrollados [6,7,24].
En el estudio predominaron los niños mayores de un año. Esta característica se ha reportado en estudios que demuestran un mayor riesgo de adquirir infección por Shigella luego del primer año de vida, cuando el niño es destetado [6-8]. Se ha demostrado que la protección que confiere la lactancia materna frente a las diarreas se ejerce a través de varios mecanismos, como la presencia de inmunoglobulinas, que evitan la adherencia de las bacterias a la mucosa intestinal y de moléculas como la lactoferrina que tiene efectos bacteriostáticos [25].
En la actualidad se han descrito 47 serotipos del género Shigella, lo que hace poco práctico construir y utilizar una vacuna multivalente que los contenga a todos. Por esta razón el desarrollo exitoso de las vacunas depende del conocimiento en las regiones de la distribución de los distintos serotipos [25]. En el presente estudio predominó el serotipo 2a de S. flexneri, hallazgo que coincide con estudios realizados en otras regiones del mundo [6,7,27]. Pero tenemos diferencias importantes respecto a la frecuencia de otros serotipos: El serotipo 3a ocupó el segundo lugar en nuestro estudio con una frecuencia del 24%, mientras que en un estudio multicéntrico realizado en seis países Asiáticos este serotipo presentó una prevalencia del 16% en Indonesia, 0% en China, 5% en Thailandia y 9% en Pakistan. [7]. Sin embargo se requieren estudios con un mayor número de muestras para concluir firmemente que el serotipo 2a de S.flexneri es el más frecuente en nuestro medio.
De acuerdo a la severidad del episodio, la población fue dividida en 2 grupos para su análisis: 25 niños deshidratados y 25 no deshidratados. El porcentaje de niños desnutridos y el serotipo 2a fueron significativamente mayores en el grupo deshidratado. Se ha demostrado que la desnutrición afecta la capacidad de recuperación y prolonga la duración del episodio diarreico acentuándose el grado de deshidratación [29] y por otro lado se ha identificado exclusivamente en S. flexneri 2a una enterotoxina llamada SHET-1 que es mediada por elementos cromosomales [29- 31]. Esta toxina produce diarrea acuosa y severa por alteración del transporte de electrolitos y secreción de líquido en el intestino delgado, además se ha descrito que posee efecto citopático [30]. No podemos concluir en este estudio cual de los dos factores, desnutrición y presencia del serotipo 2a, es el causante de la deshidratación. Sin embargo observamos en los 14 serotipos 2ª, en deshidratados, una mayor frecuencia de niños eutróficos. Sin dejar de considerar el peso de la desnutrición en la severidad del cuadro diarreico, el serotipo 2a de S. flexneri parece estar asociado a deshidratación por las características patógenas de la cepa. Sin embargo son necesarios estudios epidemiológicos y moleculares con mayor número casos para comprobar esta asociación.
El patrón de resistencia a los antibióticos fue similar al reportado en otros estudios [32,33]. Se observó una alta resistencia frente a antibióticos como AMP, AMC, SXT, C y Te, además de una considerable multirresistencia, siendo el antibiotipo más frecuente la combinación AMP, AMC, SXT C, Te. La problemática de la multirresistencia es mundial y se ha vinculado con la utilización indiscriminada de antibióticos y a la presencia de componentes genéticos extracromosomales como plásmidos, integrones y transposones que llevan los genes determinantes de resistencia [33-36 ]. Esto tiene una gran relevancia epidemiológica debido a que los patrones de resistencia encontrados en las cepas estudiadas reflejan los tipos de antibióticos más frecuentemente usados, lo cual limita el empleo de los mismos en el tratamiento de la diarrea aguda producida por S. flexneri y también expresa la existencia de mecanismos de transferencia plasmídica entre las cepas de la población.
Este es el primer estudio realizado en el país que determina la frecuencia de los distintos serotipos de S. flexneri aislados de niños con diarrea y los asocia con la severidad del episodio. A pesar de que se analizó un pequeño número de muestras, el predominio del serotipo 2a, su asociación con la severidad del episodio y la elevada resistencia a los antibióticos de las cepas, alertan sobre la problemática de la infección por Shigella en el país. Por esta razón es primordial crear sistemas de vigilancia sólidos para la generación de datos completos y sistemáticos que permitan conocer la morbilidad y mortalidad por Shigella, así como la frecuencia de los serotipos y los distintos patrones de resistencia. Esto ayudará en la elección del tratamiento adecuado y a la creación de programas de intervención y prevención oportunos.
Agradecimiento
Este trabajo fue financiado por CDCH-UCV Proyecto Nº 09-005654-2004 y por FONACIT: Proyecto Nº IBG200500031.
Referencias
1. Faruque AS, Teka T, Fuchs GJ. Shigellosis in children: a clinico-epidemiological comparison between Shigella dysenteriae type 1 and Shigella flexneri. Ann Trop Paediatr. 1998; 18: 197-201. [ Links ]
2. Keusch GT, Acheson DW. Shigelosis. En: Gómez F, editores. Enfermedades diarreicas en el niño. 10 ed. México, DF: Interamericana-McGraw-Hill; 1995.p.127-40. [ Links ]
3. Zurawski DV, Mitsuhata C, Mumy KL, McCormick BA, Maurelli AT. OspF and OspC1 are Shigella flexneri type III secretion system effectors that are required for postinvasion aspects of virulence. Infect Immun. 2006; 74:5964-76. [ Links ]
4. Sansonetti PJ, Kopecko DJ, Formal SB. Involvement of a plasmid in the invasive ability of Shigella flexneri. Infect Immun. 1982; 35:852-60. [ Links ]
5. Vargas M, Gascon J, Jimenez De Anta MT, Vila J. Prevalence of Shigella enterotoxins 1 and 2 among Shigella strains isolated from patients with traveler's diarrhea. J Clin Microbiol. 1999; 37:3608-11. [ Links ]
6. Kotloff KL, Winickoff JP, Ivanoff B, Clements JD, Swerdlow DL, Sansonetti PJ, et al. Carga mundial de infecciones por Shigella: implicaciones para el desarrollo de vacunas y la aplicación de estrategias de control. Bulletin of the World Health Oraganization. 1999; 77:651-66. [ Links ]
7. Von Seidlein L, Ryun D, Mohammad A, Hyejon L, Wang X, Thiem V, et al. A multicentre study of Shigella diarrhea in six Asian countries: disease burden, clinical manifestations, and microbiology. Plos Medicine. 2006; 3: 1556-69. [ Links ]
8. Inaty D, Cavazza ME, Mariño M, Fernández R, Gintiñas M, Pequenese DM, y col. Uso de antibioticoterapia y evolución de diarreas infantiles producidas por Shigella. GEN. 1998; 52: 1-9. [ Links ]
9. Urrestarazu MI, Liprandi F, Pérez de Suárez E, González R, Pérez-Schael I. Características etiológicas, clínicas y sociodemográficas de la diarrea aguda en Venezuela. Pan Am J Public Health. 1999; 6:149-56. [ Links ]
10. Hernández de Cuesta I, Godoy G.A. Shigella sp. Aisladas en Ciudad Bolivar. Prevalencia y su sensibilidad a los antimicrobianos. Rev Soc Ven Microbiol. 2002; 22-6. [ Links ]
11. Pérez-Schael I, Salinas B, González R, Salas H, Ludert JE, Escalona M, et al. Rotavirus mortality confirmed by etiologic identification in venezuelan children with diarrea. Pediatr Infect Dis J. 2007; 26: 393-7. [ Links ]
12. Sack RB, Rahman M, Yunus M, Khan EH. Antimicrobial resistance in organisms causing diarrheal disease. Clin Infect Dis. 1997; 1: S102- 5. [ Links ]
13. Bhattacharya S, Khanal B, Bhattarai NR, Das ML. Prevalence of Shigella species and their antimicrobial resistance patterns in Eastern Nepal. J Health Popul Nutr. 2005; 4:339- 42. [ Links ]
14. Seol SY, Kim YT, Jeong YS, Oh JY, Kang HY, Moon DC, et al. Molecular characterization of antimicrobial resistance in Shigella sonnei isolate in Korea. J Med Microbiol. 2006: 7:871-7. [ Links ]
15. Cohen D, Ashkenazi S, Green MS, Gdalevich M, Robin G, Slepon R, et al. Double-blind vaccine-controlled randomised efficacy trial of an investigational Shigella sonnei conjugate vaccine in young adults. Lancet. 1997; 18: 155-9. [ Links ]
16. Coster TS, Hoge CW, VanDeVerg LL, Hartman AB, Oaks EV, Venkatesan MM, et al. Vaccination against Shigellosis with attenuated Shigella flexneri 2a strain SC602. Infect Immun. 1999; 67: 3437-43. [ Links ]
17. Passwell JR, Harlev E, Ashkenazi S, Chu C, Miron D, Ramón R, et al. Safety and immunogenicity of improved Shigella O-specific polysaccharide-protein conjugate vaccines in adults in Israel. Infect Immun. 2001; 69: 1351-7. [ Links ]
18. Fries LF, Montemarano AD, Mallet CP, Taylor DN, Hale TL, Lowell GH. Safety and immunogenicity of a proteosome Shigella flexneri 2a lipopolysaccharide vaccine administered intranasally to healthy adults. Infect Immun. 2001; 69: 4545-53. [ Links ]
19. Salinas, B., González, G., González, R., Escalona, M., Materán, M, Pérez-Shael, I. Epidemiological and clinical characteristics of rotavirus diseases during five years of surveillance in Venezuela. Pediatr Infect Dis. 2004; S161-7. [ Links ]
20. Méndez-Castellano H, De Méndez MC. Estratificación social y biología humana: método Graffar modificado. Arch Venez Puerc Pediatr. 1986; 49:93-104. [ Links ]
21. World Health Organization (WHO). A Manual for the treatment of diarrhea: for use by physicians and other senior health workers. Geneva: World Health Organization; 1990. [ Links ]
22. Nataro JP, Bopp CA, Fields PI, Kaper JB, Strockbine NA, Escherichia, Shigella and Salmonella. In Murray PR, Baron EJ, Jorgensen JH, Landry ML, Pfaller MA, editors. Manual of Clinical Microbiology. 9th ed. Washington, DC: American Society for Microbiology; 2007: 670-87. [ Links ]
23. Clinical and Laboratory Standards Institute/NCCLS. Performance standards for antimicrobial susceptibility testing. Sixteenth Informational Supplement. Clinical and Laboratory January Standards Institute,Wayne, Pa. 2006. [ Links ]
24. Opitan J.A, Newman M.J. Distribution of serogroups and serotypes of multiple drug resistant Shigella isolates. Ghana Med J. 2007; 41: 4-8. [ Links ]
25. Lagrand D, Pierce A, Elass E, Carpentier M, Mariller C, Mazurier J. Lactoferrin structure and functions. Adv Exp Biol. 2008; 606: 163-94. [ Links ]
26. World Health Organization. Generic protocol to estimate of Shigella diarrhea and dysenteric mortality. WHO/V and B. 1999; 99:26. [ Links ]
27. Mota M, Varela G, Gadea M, Caffer M, Sirok A, Schelotto F. Serotipos, perfil plasmídico y antibiotipos de cepas de Shigella flexneri aisladas de niños menores de 5 años con diarrea sanguinolenta usuarios de los servicios de Salud Pública. Rev Med Uruguay. 2005; 21: 30-6. [ Links ]
28. Pérez Schael I, Dehollain P, Pérez M, Daoud N, Soto I, González M, Cunto W, Flores J. Impacto de las enfermedades diarreicas en el estado nutricional del niño. An Ven Nutr. 1988; 1:119-28. [ Links ]
29. Fasano A, Noriega FR, Liao FM, Wang W, Levine MM. Effect of Shigella enterotoxin 1 (SHET1) on rabbit intestine in vitro and in vivo. GUT. 1997; 40: 505-11. [ Links ]
30. Fasano A, Noriega FR, Maneval DR, Chanasongcram S, Russell R, Guandalini S, et al. Shigella enterotoxin 1: an enterotoxin of Shigella flexneri 2a active in rabbit small intestine in vivo and vitro. J Clin Invest. 1995; 95:2853-61. [ Links ]
31. Roy S, Thanasekaran K, Dutta AR, Sehgal SC. Distribución of Shigella genes and secreted autotransporter toxin gene among diverse species and serotypes of Shigella isolates from Andaman Islands, India. Trop Med Int Health. 2006; 11: 1694-8. [ Links ]
32. Sivapalasingam S, Nelson JM, Joyce K, Hoekstra M, Angulo FJ, Mintz ED. High prevalence of antimicrobial resistance among Shigella isolates in the United States tested by the National Antimicrobial Resistance Monitoring System from 1999 to 2002. Antimicrobial Agents And Chemotherapy. 2006; 50:49-54. [ Links ]
33. Olukoya DK, Oni O. Plasmid profile analysis and antimicrobial susceptibility patterns of Shigella isolates from Nigeria. Epidemiol Infect. 1990; 105:59-64. [ Links ]
34. Niyogi SK, Mitra U, Dutta P. Changing Patterns of serotypes and antimicrobial susceptibilities of Shigella species isolated from children in Calcutta, India. J Infect Dic. 2001; 54:121-2. [ Links ]
35. Toro CS, Farfán M, Contreras I, Flores O, Navarro N, Mora GC, et al. Genetic analysis of antibiotic-resistance determinants in multidrug-resistant Shigella strains isolated from Chile children. Epidemiol Infect. 2005; 133: 81-6. [ Links ]
36. Merino LA, Hreñuk GE, Ronconi MC, Alonso JM. Resistencia a antibióticos y epidemiología molecular de Shigella spp. en el nordeste argentino. Rev Panam Salud Pública. 2004; 15(4): 219-24. [ Links ]












 uBio
uBio