Revista de la Sociedad Venezolana de Microbiología
versão impressa ISSN 1315-2556
Rev. Soc. Ven. Microbiol. v.28 n.2 Caracas dez. 2008
Genotipificación del virus de papiloma humano en pacientes con condilomas acuminados
Maira Ávilaa,*, María Eugenia Cavazzab, William Vásquezb, Javier Ortegab, Yisis Lópezc, María Correntia
aInstituto de Oncología y Hematología- MPPS
bInstituto de Biomedicina- MPPS- UCV
cHospital Vargas. Alcaldía Metropolitana- Caracas.
* Correspondencia: E-mail: avilamaira@hotmail.com
Resumen: El condiloma acuminado es una de las enfermedades más comunes de transmisión sexual alrededor del mundo. Estas lesiones están asociadas con la infección por los tipos de Virus de Papiloma Humano (VPH) 6 y 11 de bajo riesgo oncogénico. En nuestro país, la prevalencia de la infección por estos virus es alta (65 %), razón por la cual, el objetivo del presente trabajo fue la detección y tipificación del VPH mediante la reacción en cadena de la polimerasa en un grupo de pacientes que presentaban condilomas acuminados en el área genital. De las 90 biopsias evaluadas, de pacientes con infección sugestiva por el VPH, 72 (80 %) correspondieron a condilomas acuminados según el diagnóstico histopatológico, y el 20% presentaron otras patologías. La infección por el VPH se detectó en los 72 condilomas acuminados, observándose con mayor frecuencia el tipo 6 (54,2 %), seguido del tipo 11 (36,1 %); tres casos (4,2 %) presentaron coinfección con los tipos 6 y 11 y en cuatro casos (5,6 %) no se logró tipificar. Los resultados muestran una clara vinculación entre los tipos de VPH 6 y 11 de bajo riesgo oncogénico y el desarrollo de las verrugas genitales, a diferencia de las neoplasias intraepiteliales.
Palabras claves: Virus de Papiloma Humano, condilomas acuminados, reacción en cadena de la polimerasa
Genotyping of human papillomavirus in patients with condylomata acuminata
Abstract: The condylomata acuminata is one of the common sexually transmitted disease around the world. These lesions are associated with the Human Papillomavirus (HPV) types 6 and 11 of oncogenic low-risk. In our country, the prevalence for this virus infection is high (65 %). The aim of this study was the detection and typing of HPV by polimerase chain reaction (PCR) in a group of patients that presented warts in the genital area. Ninety biopsies were evaluated coming from patients with suggestive infection for the HPV: 72 (80 %) were histological confirmed as condylomata acuminata and 20% have other pathologies. The HPV was detected in all specimens of condylomata acuminate. HPV type 6 was observed with more frequency (54.17 %), followed by type 11 (36.11 %); three cases (4.17%) showed co-infection with types 6 and 11 and four cases (5.56 %) were non tipificable. These results show a clear association of low oncogenic risk HPV types 6 and 11 and the development of the genital warts unlike to the cervical intraepithelial neoplasia where exists a great HPV genotypes spectrum.
Keywords: Human Papillomavirus, condylomata acuminata, polymerase chain reaction
Recibido 25 de febrero de 2008; aceptado 29 de octubre de 2008
Introducción
La infección por el virus de papiloma humano (VPH), es una de las más comunes transmitidas sexualmente, tanto en hombres como en mujeres, en todo el mundo. Su prevalencia ha ido aumentando, y se estima que el 1% de la población sexualmente activa está infectada [1].
Estos virus de ADN tienen un genoma de aproximadamente 8000 pares de bases [2]. Son miembros de la familia Papovaviridae y altamente específicos de especies y tejidos, mostrando un tropismo exclusivo por las células epiteliales de las mucosas y de la piel. Hasta el momento, se han identificado, en base a las secuencias de nucleótidos del genoma, más de 100 tipos virales o genotipos, de los cuales, aproximadamente 40 han sido aislados del tracto anogenital [3-5].
Basados en su asociación con el cáncer cervical y las lesiones precursoras, los VPH pueden agruparse en tipos de alto y bajo riesgo oncogénico. Los tipos 6, 11, 42, 43 y 44, están comúnmente asociados con el condiloma acuminado y las displasias leves, razón por la cual se les ha denominado de ¨bajo riesgo oncogénico¨, mientras que los tipos 16, 18, 31, 33, 34, 35, 39, 45, 51, 52, 56, 58, 59, 66, 68 y 70 están relacionados con la neoplasia intraepitelial cervical (NIC), carcinoma in situ y el carcinoma invasor y son considerados de ¨alto riesgo oncogénico¨ [4, 6]. Recientemente, estos virus se han clasificado como carcinógenos clase I [7]. Incluidos en el grupo de alto riesgo, están algunos tipos de VPH que se encuentran con menos frecuencia en las patologías oncológicas, sin embargo, se pueden hallar en lesiones intraepiteliales escamosas (LIE). Los subtipos de bajo riesgo ocasionalmente se encuentran en los carcinomas cervicales [4,7].
Muchas de las infecciones causadas por el VPH se resuelven espontáneamente, sin embargo, estos virus están asociados con una variedad de condiciones clínicas y manifestaciones que van desde infecciones asintomáticas, latentes y lesiones benignas como los condilomas acuminados, hasta las displasias y el carcinoma invasivo del cérvix [3,8].
En el caso de las verrugas anogenitales o condilomas acuminados, que aparecen sobre o alrededor de los genitales y el ano tanto en los hombres como en las mujeres, se encuentran generalmente asociados los tipos de VPH 6 y 11, que son considerados de importancia clínica y principales agentes etiológicos de estas lesiones; sin embargo no están asociados con el desarrollo del cáncer cervical [7,9].
El desarrollo de condilomas acuminados, es el signo más fácilmente reconocido de la infección genital causada por los VPH. Las verrugas genitales son blandas, húmedas, de color carne y aparecen en el área genital semanas o meses después de la infección. Estas lesiones aparecen agrupadas en protuberancias semejantes a un coliflor, o presentan un aspecto plano, pudiendo ser pequeñas o grandes [10].
En ocasiones, las infecciones causadas por estos virus son asintomáticas y tienden a desaparecer espontáneamente en 3 ó 4 meses. Las opciones de tratamiento incluyen la ablación, escisión, o el uso de agentes tópicos tales como podofilina al 5% o imiquimod al 5,0%. Sin embargo, las verrugas genitales con frecuencia son resistentes al tratamiento y tienden a recurrir. La razón de la alta recurrencia no está clara, pero se piensa que puede ser causada por la reinfección o por la activación del VPH persistente en un reservorio endógeno. Algunos estudios han sugerido que los tipos de VPH 6 y 11 están presentes en los folículos pilosos de los pacientes con verrugas genitales o con antecedentes de verrugas genitales recurrentes [9].
Se ha estimado, que cerca de las dos terceras partes de los individuos que tienen relaciones sexuales con un compañero infectado pueden así mismo estar infectados, sin embargo, la mayoría de las infecciones son subclínicas. En este sentido, diversos estudios epidemiológicos, indican claramente que el riesgo de contraer una infección genital por el VPH y el desarrollo del cáncer cervical está influenciado por algunos factores, tales como: el número de parejas sexuales, la frecuencia de intercambio sexual y la presencia de verrugas genitales en la pareja. Otros estudios indican que la edad puede ser un factor de riesgo, siendo más común la infección en las mujeres jóvenes sexualmente activas entre los 18 y 30 años de edad, al igual que en otras infecciones transmitidas sexualmente y su prevalencia disminuye después de los 30 años [7]. En los hombres, solamente el número de intercambios sexuales ha mostrado estar relacionado con la infección [11,12].
Otro factor de riesgo reportado, es la presencia de otras enfermedades infecciosas de transmisión sexual (ITS), como por ejemplo herpes, Chlamydia trachomatis o antecedentes de alergias [10]. En cuanto al hábito de fumar y el uso de contraceptivos orales, aún existen controversias para considerarlos como factores de riesgo en el desarrollo de las verrugas genitales [13-15]. El virus de inmunodeficiencia humana (VIH) es otro factor determinante para la adquisición de la infección. En mujeres VIH positivas, las verrugas se han descrito como un factor contribuyente al desarrollo de la neoplasia intraepitelial cervical [16,17].
Así mismo, el estado inmunológico del hospedador, también se ha propuesto como un factor importante en el control de las infecciones y en el desarrollo de las lesiones del VPH, en especial de las verrugas genitales. Esto se ha sugerido debido a que algunos pacientes inmunosuprimidos tienen una mayor incidencia de lesiones asociadas a infección por el VPH [18]. Así mismo, se puede determinar el desarrollo de una infección persistente por VPH después de una infección primaria [19]. La activación de las vías específicas de inmunidad humoral y celular es importante para la regresión espontánea de las verrugas genitales en los individuos infectados por el VPH [20].
Considerando, que la calidad de vida de los pacientes con verrugas genitales es potencialmente afectada, dependiendo de la localización de las lesiones, sumado a que en nuestro país la infección por estos virus es alta, el objetivo de este trabajo fue realizar la detección y la tipificación del VPH mediante la técnica de reacción en cadena de la polimerasa (PCR por sus siglas en inglés), en un grupo de pacientes con lesiones sugestivas de infección por el VPH en el área genital, atendidos en la Consulta del Servicio de Dermatología del Instituto de Biomedicina, Caracas.
Materiales y Métodos
A.- Material Biológico
Se analizaron 90 muestras de pacientes (40 hombres y 50 mujeres) con lesiones en el área genital, que acudieron a la Consulta del Servicio de Dermatología del Instituto de Biomedicina, en Caracas, desde el año 2006 al 2007. Todos los pacientes presentaban infección sugestiva por el VPH. A cada uno de ellos se les tomaron dos biopsias, una para realizar el diagnóstico histopatológico y la otra para las pruebas de biología molecular de detección y tipificación del virus. En la consulta clínica estos exámenes se realizan de rutina. El procesamiento de estas muestras forma parte del proyecto FONACIT G- 2005000408, el cual fue evaluado por el Comité de Ética del Instituto de Biomedicina y concedió la carta aval para realizar estos procedimientos durante la investigación.
B.- Extracción de ADN
Las biopsias se resuspendieron en 100 μl de buffer lisis (Tris-HCl 10 mM + sarcosina 0,1 %) + 100 μl de proteinasa K (1 mg/ml) y se incubaron a 55ºC por 2 horas. Se extrajo el ADN, agregando igual volumen de cloroformo: fenol: alcohol isoamílico. Posteriormente, el ADN se precipitó con 1/10 volúmenes de acetato de amonio 3M y el doble de volumen de etanol absoluto durante toda la noche a –20ºC. Luego, el sedimento se lavó con etanol al 75% y se resuspendió en 50 μl de agua destilada libre de nucleasas.
C.- Detección del virus de papiloma humano
La detección del VPH se realizó mediante la técnica de PCR. La reacción se llevó a cabo en un volumen de 50 μl, utilizando los oligonucleótidos cebadores consenso MY09 /MY11 correspondientes a una región altamente conservada del gen L1, que codifica para una proteína de la cápside viral y que permiten amplificar un extenso espectro de tipos de VPH.
Para la reacción, 1 μg de ADN se incubó con 6,25 μl de buffer 10X, 0,4 μl de dNTP´s (100mM), 0,2 μl de cada uno de los iniciadores (MY09 y MY11), 4 μl de MgCl2 (50 mM), 1,2 μl de los iniciadores de β- globina, 0,5 μl de Taq DNA polimerasa (5U/μl) y agua destilada libre de nucleasas hasta completar un volumen de 50 μl. La reacción de amplificación, se llevó a cabo en un termociclador MJ Research PTC- 150 bajo las siguientes condiciones: una etapa de desnaturalización inicial a 94ºC por 4 min, seguido de 40 ciclos de desnaturalización: 94ºC por 15 seg e hibridación a 55ºC por 30 seg, una etapa de extensión a 72ºC por 45 seg. y finalmente una extensión a 72ºC por 7 min.
En todas las reacciones de amplificación, se incluyó como control positivo el ADN purificado de células HeLa, infectadas con VPH tipo 18. El producto amplificado se visualizó en un gel de agarosa al 2 % teñido con bromuro de etidio.
Interpretación de los Resultados
Una muestra se consideró positiva, cuando se observaron en el gel dos bandas, una de 450 pb correspondiente al amplificado del VPH y otra de 268 pb correspondiente a la banda de β- globina (control interno). Una muestra se consideró negativa, cuando se observó en el gel una sola banda de 268 pb correspondiente al gen β- globina.
D.- Tipificación del VPH
Para la tipificación del VPH, se utilizó el Kit Multiplex PCR de Maxim Biotech, Inc., que detecta simultáneamente cinco genotipos: el tipo 6 (263 pb) y el 11 (144 pb) considerados de bajo riesgo oncogénico y los genotipos 16 (601 pb), 18 (360 pb) y 33 (413 pb) de alto riesgo oncogénico. La reacción se llevó a cabo en un volumen de 50 μl con los siguientes reactivos: 25 μl de buffer 2X MPCR, 5 μl de la mezcla de los iniciadores, 0,5 μl de Taq polimerasa (5U/μl), 14,5 μl de agua destilada libre de nucleasas y 5 μl del ADN extraído. La amplificación, se realizó en un termociclador MJ Research PTC- 150 bajo las siguientes condiciones: dos ciclos con una etapa de desnaturalización inicial de 96ºC por 1 min., una etapa de hibridación de 63ºC por 4 min., seguido de 35 ciclos de: desnaturalización: 94ºC por 1 min e hibridación 63ºC por 2 min., y una etapa de extensión final por 10 min. El producto amplificado se visualizó en un gel de agarosa al 2% teñido con bromuro de etidio.
E.- Análisis Estadístico
Para el análisis estadístico de asociación entre las variables de genotipo de VPH y localización de los condilomas en el área genital, se usó la prueba Exacta de Fisher con una p < 0.05. El análisis de los datos se realizó usando el programa SPSS, versión 13.0.
Resultados y Discusión
Aproximadamente una tercera parte de los tipos de VPH conocidos que infectan el tracto genital, pueden causar diferentes manifestaciones clínicas que van desde infecciones asintomáticas, infecciones latentes, condilomas acuminados hasta displasias y carcinoma invasivo del cervix [20,21].
Los condilomas acuminados causan grandes problemas, particularmente en los adultos jóvenes, que se infectan después de comenzar la actividad sexual. En nuestro país, la infección por estos virus es alta y su prevalencia va en aumento al igual que en otros países [1].
En nuestro estudio, se analizaron 90 muestras de lesiones del área genital, de 40 hombres y 50 mujeres, sugestivas de infección por el VPH. El análisis histopatológico de las biopsias mostró, que de los 90 pacientes, 72 (80 %) correspondieron a condilomas acuminados, 29 en hombres y 43 en mujeres. El resto de las muestras analizadas (20%) presentaron otras patologías (Tabla 1).
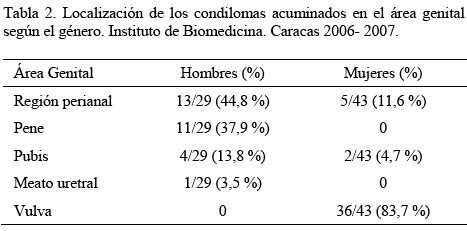
En los hombres, los condilomas acuminados se localizaron con mayor frecuencia en la región perianal (44,8 %), seguido del pene (37,9 %), el pubis (13,8 %), y el meato uretral (3,5 %), mientras que en las mujeres, estas lesiones se localizaron con mayor frecuencia en la vulva (83,7 %), seguida de la región perianal (11,6 %), y el pubis (4,7 %) (Tabla 2), lo que concuerda con un estudio previo donde se evaluaron 74 mujeres que presentaban condilomas acuminados en el área genital, y se encontró que 59 de estas lesiones se localizaban en la vulva (79,7 %), seguidas de 10 en la región perianal (13,5%) [22].
En el presente trabajo, la detección del VPH, se realizó mediante la PCR, que constituye hasta el presente el método de detección más sensible y específico para determinar enfermedad subclínica y la única forma de evidenciar la infección latente, ya que permite detectar entre 10 y 200 copias de genoma viral por muestra [23].
En todos los condilomas acuminados analizados por la PCR, se detectó la presencia del VPH, mientras que en el resto de las muestras analizadas no se observó la presencia del virus: sólo en 1 muestra con diagnóstico histopatológico de papulosis bowenoide se detectó la presencia del virus.
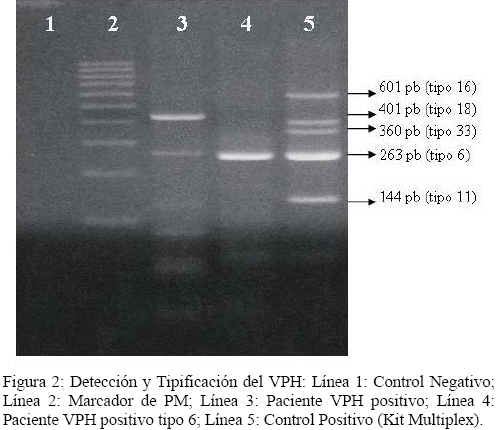
La infección por el VPH se evidenció por la presencia de una banda de 450 pb correspondiente a la amplificación de la región L1 del genoma viral, además de la presencia de una banda de 268 pb correspondiente al control interno de los genes de ß-globina, para corroborar la calidad del ADN y de la reacción de amplificación (Figura 1).
A las muestras que resultaron positivas, posteriormente se les realizó la tipificación utilizando el estuche de Multiplex PCR para VPH, el cual detecta simultáneamente cinco genotipos: el tipo 6 (263 pb) y el 11 (144 pb) considerados de bajo riesgo oncogénico y los genotipos 16 (601 pb), 18 (360 pb) y 33 (413 pb) de alto riesgo oncogénico (Figura 2).
La presencia del virus tipo 6 se observó con mayor frecuencia (54,2 %), lo que concuerda con algunos estudios, que han reportado el VPH tipo 6 como el más frecuente en las lesiones de condilomas acuminados [20,21]. El VPH tipo 11 se detectó en 26 (36,1 %) de los casos, seguido de 3 casos (4,2 %) donde se observó coinfección con los tipos
En general, en nuestra población, al realizar la tipificación del VPH, se observó que el 94,5 % (68/72) de los condilomas acuminados presentaban infección con tipos de bajo riesgo y sólo en el 5,6 % (4/72) de las muestras no se pudo verificar el tipo de virus infectante.
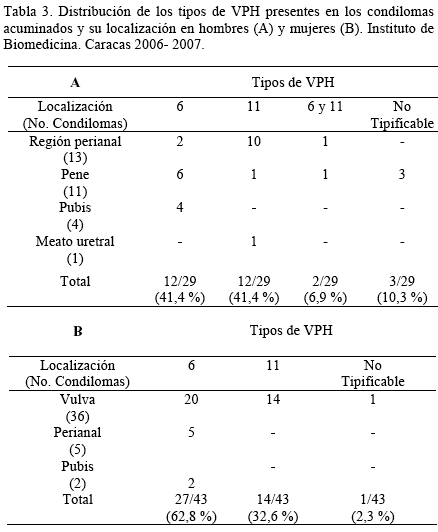
Al estudiar la distribución de los tipos de VPH se observó que en los hombres, los tipos 6 y 11 se encontraron con la misma frecuencia, en 12 casos (41,4 %) respectivamente, mientras que 2 casos (6,9 %) presentaron coinfección con los tipos 6 y 11.
El VPH tipo 11 se presentó preferencialmente en las lesiones de la región perianal (10/13) y el tipo 6 tuvo una distribución más heterogenea, sin embargo se observó con mayor frecuencia ubicado en el pene (Tabla 3A); mientras que en las mujeres, se observó con mayor frecuencia el VPH tipo 6 (62,8 %), seguido del tipo 11 (32,6 %). El VPH tipo 6 se encontró marcadamente asociado a lesiones localizadas en vulva (20/27) y sólo 5 pacientes lo presentaron en la región perianal. En relación al VPH tipo 11, en los 14 casos el virus se detectó únicamente en las lesiones de la región vulvar (Tabla 3B). Se encontró una asociación lineal (p<0,05) al relacionar la localización de la lesión con el genotipo del VPH sólo para los hombres, lo cual puede deberse al tamaño y distribución de la muestra; en los hombres la distribución por localización es más homogénea, mientras que en las mujeres está sesgado a la vulva y la distribución de los tipos es similar (20 casos positivos para tipo 6 y 14 positivos para tipo 11).
Al igual que en estudios previos, nuestros resultados indican que existe un predominio de los tipos de VPH de bajo riesgo 6 y 11 en los condilomas acuminados, estableciendo una clara vinculación entre el desarrollo de estos y la infección con los tipos de bajo riesgo [24,25]. Numerosos estudios, han reportado que los mayores agentes etiológicos de las lesiones de condilomas acuminados son los VPH tipo 6 y 11, debido a que no están asociados con la neoplasia cervical de alto grado [22], sin embargo estos tipos pueden causar neoplasia intraepitelial de menor grado [3,4,7-9,26].
En un estudio, donde se evaluaron 26 mujeres que presentaban condilomas acuminados en el cervix, la vulva y la vagina, la tipificación mostró que el 70% de los casos contenía ADN del VPH tipo 6, mientras que el 30 % contenía ADN del VPH tipo 11 [24]. Estos resultados son similares a los del presente estudio, donde se observó una mayor prevalencia del VPH tipo 6.
A pesar de que la mayoría de los reportes indican que los principales agentes etiológicos en el desarrollo de los condilomas acuminados son los tipos de VPH 6 y 11, otros estudios indican que estas lesiones pueden ser inducidas por otros tipos de VPH, entre ellos los tipos de VPH 40 y 42 [27, 28]. En este sentido, un estudio realizado en pacientes que presentaban condilomas acuminados, se encontró que los tipos más prevalentes, seguidos del tipo 6 y 11 eran los VPH 54 y 58, cada uno representando el 8% [29].
Otro estudio realizado en pacientes inmunocomprometidos, mostró la existencia de otros tipos de bajo riesgo además de los detectados comúnmente. Los tipos de VPH 53 y 54 fueron los más frecuentemente detectados después de los tipos 6 y 11, siendo el VPH tipo 53 especialmente común en las lesiones removidas de los individuos VIH positivos. También, se encontraron los tipos 42, 54 [30]. En otro estudio donde se analizaron muestras de condilomas acuminados por hibridación, se encontró que el 32 % de las muestras contenían más de un tipo de VPH, incluyendo los VPH tipos 6, 11, y los de alto riesgo 16 y 18 [31]. En nuestro estudio, no se observó la presencia de virus de alto riesgo en los condilomas acuminados, en contraste con numerosos estudios que han detectado ocasionalmente tipos adicionales en las verrugas genitales, que incluyen tipos de VPH asociadas con displasia de alto riesgo, tales como el VPH tipo 16 [24,31-34]. En este sentido, en un estudio realizado en 47 lesiones de condilomas acuminados, se encontró que 45 presentaban una infección con los tipos 6 y 11 y solamente 2 casos presentaron co- infección con un tipo de alto riesgo [35].
En el presente trabajo, se identificaron sólo 3 casos de co-infección con los tipos 6 y 11, lo que concuerda con otro estudio donde se reportaron sólo 2 casos de coinfección con estos tipos virales en 180 condilomas acuminados analizados [34]. En contraste, en un estudio donde se analizaron 33 condilomas acuminados, no se encontró la presencia de más de un tipo de VPH en ningún caso [32].
Uno de los resultados más relevantes de este estudio fue la detección de la infección por el VPH tipo 16, considerado de alto riesgo oncogénico, en un paciente con diagnóstico de papulosis bowenoide (Figura 3). La papulosis bowenoide es una forma particular de verrugas anogenitales múltiples que afecta principalmente a adultos jóvenes sexualmente activos y aparece clínicamente como pápulas pigmentadas múltiples coloreadas alrededor del pene o en el labio mayor o menor, sin embargo también pueden aparecer en la región genitoanal [36-38]. Es considerada una enfermedad benigna autolimitada en sujetos inmunocompetentes, mientras que en pacientes inmunodeprimidos estas lesiones deben considerarse premalignas. Las características histológicas son semejantes a las de un carcinoma in situ (enfermedad de Bowen) o neoplasia intraepitelial severa [36,37]. En esta patología, se han identificado diferentes tipos de VPH incluyendo el 34, 35, 39 y 42, sin embargo el más común es el tipo 16 [39].
Conclusiones
En este estudio se pudo observar un predominio de los VPH de bajo riesgo tipo 6 y tipo 11, siendo el tipo 6 el que se encontró con más frecuencia en las diferentes muestras de condiloma acuminado.
En algunos casos se pudo evidenciar coinfección con tipos virales de bajo riesgo. En ningún caso se observó coinfección con tipos virales de alto riesgo.
El empleo de técnicas altamente sensibles como la PCR representan un aporte importante en la prevención y en el control de pacientes, en particular de aquellas lesiones asociadas con VPH de alto riesgo o persistentes que pueden modular la progresión de lesiones benignas a premalignas y a cáncer.
Agradecimientos
Este trabajo ha sido financiado por FONACIT G- 2005000408 y el Ministerio del Poder Popular para la Salud.
Referencias
1. Shin H, Franceschi S, Vaccarella S, Roh J, Ju Y, Oh J et al. Prevalence and determinants of genital infection with papillomavirus, in female and male university students in Busan, South Korea. J Infect Dis. 2004; 190: 468- 76. [ Links ]
2. Scheurer M, Tortolero-Luna G, Adler-Storthz K. Human papillomavirus infection: biology, epidemiology, and prevention. Int J Gynecol Cancer 2005; 15: 727- 46. [ Links ]
3. Munoz N. Human papillomavirus and cancer: the epidemiological evidence. J Clin Virol. 2000; 19: 1- 5. [ Links ]
4. Walboomers J, Jacobs M, Manos M, Bosch F, Kummer J, Shah K et al. Human papillomavirus is a necessary cause of invasive cervical cancer worldwide. J Pathol 1999; 189: 12- 9. [ Links ]
5. de Villiers E, Whitley C, Gunst K. Identification of new papillomavirus types. Methods Mol Med. 2005; 119: 1- 13. [ Links ]
6. Burd, E. Human papillomavirus and cervical cancer. Clin Microbiol Rev. 2003; 16: 1- 17. [ Links ]
7. Cogliano V, Baan R, Starif K, Grosse Y, Scretan B, El GF. Carcinogenicity of human papillomaviruses. Lancet Oncol. 2005; 6: 204. [ Links ]
8. Münger K, Baldwin A, Edwards K, Hayakawa H, Nguyen C, Owens M, et al. Mechanisms of human papillomavirusinduced oncogenesis. J Virol. 2004; 78: 11451- 60. [ Links ]
9. Boxman I, Hogewoning A, Mulder L, Bavinck J, Schegget J. Detection of human papillomavirus types 6 and 11 in pubic and perianal hair from patients with genital warts. J Clin Microbiol. 1999; 37: 2270- 73. [ Links ]
10. Schofield M, Minichiello V, Misrha G, Plummer D, Savage J. Sexually transmitted infections and use of sexual health services among young australias women: women´s health Australia study. Int J STD AIDS. 2000; 11: 313- 23. [ Links ]
11. Hippelainen M, Syrjanen S, Hippelainen M, Koskela H, Pulkkinen J, Saarikoski S et al. Prevalence and risks factors of genital human papillomavirus infections in healthy males: a study on Finnish conscripts. Sex Transm Dis. 1993; 20: 321- 28. [ Links ]
12. Katala V, Syrjanen S, Yikoski M, Hippelinen M, Vayrynen M, Saarikoski S et al. Risk factors associated with cervical human papillomavirus infections: a case control study. Am J Epidemiol. 1993; 138: 735- 45. [ Links ]
13. Habel LA, Van Den Eeden SK, Sherman KJ, McKnights B, Stergachis A, Daling J. Risk factors for incident and recurrent condylomata acuminata among women. A populationbased study. Sex Transm Dis. 1998; 25: 285- 92. [ Links ]
14. Franco E. Epidemiology of anogenital warts and cancer. Obstet Gynecol Clin North Am. 1996; 23: 597- 623. [ Links ]
15. Feldman J, Chirgwin K, Dehovitz J, Minkoff H. The association of smoking and risk of condylomata acuminatum in women. Obstet Gynecol. 1997; 89: 346- 50. [ Links ]
16. Goncalves M, Burattini M, Donadi E, Massad E. Anogenital warts contribuing to the risk of squamous intraepithelial lesions among HIV- positive women of Sao Paulo, Brazil. Int J STD AIDS. 2003; 14: 309- 13. [ Links ]
17. Harris T, Burk R, Palefsky J, Massad L, Bang J, Anastos K et al. Incidence of cervical squamous intraepithelial lesions associated with HIV serostatus, CD4 cell counts, and human papillomavirus test results. JAMA. 2005; 293: 1471- 76. [ Links ]
18. Petry K, Scheffi D, Bode U, Gabrysiak T, Köchel H, Kupsch E et al. Cellular immunodeficiency enhances the progression of human papillomavirus- associated cervical lesions. Int J Cancer. 1994; 57: 836- 40. [ Links ]
19. Smits P. Bakker R, Jong E, Mulder J, Meenhorst P, Kleter B et al. High prevalence of human papillomavirus infections in urine samples from human immunodeficiency virus- infected men. J Clin Microbiol. 2005; 43: 5936- 39. [ Links ]
20. Brown D, Bryan J, Cramer H, Fife K. Analysis of human papillomavirus types in exophitic condylomata acuminata by hybrid capture and Southern blot techniques. J Clin Microbiol. 1993; 31: 2667- 73. [ Links ]
21. Gissman L, Wolnik H, Ikenberg U, koldovsky H, Schnurch H, zur Hausen H. Human papillomavirus types 6 and 11 DNA sequences in genital and laryngeal papillomas and in some cervical cancers. Proc Natl Acad Sci USA. 1983; 80: 560- 63. [ Links ]
22. Sadan O, Bilevsky E, Shejter E, Levy T, Bachar R, Yarden H et al. Occurrence of cervical intraepithelial neoplasia in generally healthy women with exophitic vulvar condyloma acuminate. Infect Dis Obstet Gynecol. 2005; 13(3): 141- 43. [ Links ]
23. Quintero M, Cruz J, Bastidas M, Márquez L, Puig J. Detección y tipificación de virus de papiloma humano (VPH) mediante PCR- RFLP. Rev Obstet Ginecol Venez. 2008; 68(1): 25- 31. [ Links ]
24. Langerberg A, Cone R, Mc Dougall J, Kiviat N, Corey L. Dual infection with human papillomavirus in a population with overt genital condylomas. J Am Acad Dermatol. 1993; 28: 434- 42. [ Links ]
25. Sugase M, Moriyama S, Matsukura T. Human papillomavirus in exophitic condylomatous lesions o different female genital regions. J Med Virol. 1991; 34: 1-6. [ Links ]
26. Koustsky L, Galloway D, Holmes K. Epidemiology of genital human papillomavirus infection. Epidemiol Rev. 1988; 10: 122-63. [ Links ]
27. Bernard H, Chan S, Manos M, Ong C, Villa L, Delius H et al. Identification and assessment of known and novel human papillomavirus by polymerase chain reaction amplification, restriction fragment length polymorphisms, nucelotid sequenc and phylogenetic algorithms. J Infect Dis. 1994; 170: 1077- 85. [ Links ]
28. Van Ranst M, Tachezy R, Burk R. Human papillomavirus nucleotide sequences: What´s in Stock?. Papillomavirus Rev. 1994; 6: 65- 75. [ Links ]
29. Greer C, Wheeler C, Ladner M, Beutner K, Coyne M, Liang H et al. Human papillomavirus (HPV) type distribution and serological response to HPV type 6 virus- like particles in patients with genital warts. J Clin Microbiol. 1995; 33: 2058- 63. [ Links ]
30. Brown D, Schroeder J, Bryan J, Stoler M, Fife K. Detection of multiple human papillomavirus types in condylomta acuminata lesions from otherwise healthy and immunosuppressed patients. J Clin Microbiol. 1999; 37: 3316- 22. [ Links ]
31. Bergeron C, Ferenczy A, Shah K, Naghashfar Z. Multicentric human papillomavirus infections of the femele genital tract- correlation of viral types with abnormal mitotic figures, colposcopic presentation, and location. Obstet Gynecol. 1987; 69: 736- 42. [ Links ]
32. Beckmann A, Sherman K, Myerson D, Daling J, McDougall J, Galloway D. Comparative virologic studies of condylomata acuminata revcal a lack of dual infections with human papillomavirus. J Infect Dis. 1991; 163: 393- 96. [ Links ]
33. Nuovo G, Darfler M, Impraim C, Bromley S. Occurrence of multiple types of human papillomavirus in genital tract lesions. Am J Pathol. 1991; 138: 53- 8. [ Links ]
34. Wilbur D, Reichman R, Stoler M. Detection of infection by human papillomavirus in genital condylomata. A Comparison study using immunocytochemistry and situ nucleic acid hybridization. Am J Clin Pathol. 1988; 89: 505- 10. [ Links ]
35. Hildesheim A, Schiffman M, Gravitt P, Glas A, Greer C, Zhang T et al. Persistence of type- specific human papillomavirus infection among cytologically normal women. J Infect Dis. 1994; 169: 235- 40. [ Links ]
36. Gross G, Hagedorn M, Ikenberg H, Ruflit T, Dahlet C, Grosshans E et al. Bowenoide papulosis- Presence of human papillomavirus (HPV) structural antigens and of HPV 16- related DNA sequences. Arch Dermatol. 1985; 121: 858- 63. [ Links ]
37. Obalek S, Jablonska S, Beaudenon S, Walezak L, Orth G. Bowenoide papulosis of the male and female genitalia: Risk of cervical neoplasia. J Am Acad Dermatol. 1986; 14: 433- 44. [ Links ]
38. Wade T, Kopf A, Ackerman A. Bowenoide papulosis of the genitalia. Arch Dermatol. 1979; 115: 306- 8. [ Links ]
39. Rudlinger R, Grob R, Yu Y, Schnydeb U. Human papillomavirus- 35- positive bowenoid papulosis of the anogenital area and concurrent human papillomavirus 35 positive verruca with bowenoid dysplasia of the periungual area. Arch Dermatol 1989; 125: 655- 9. [ Links ]












 uBio
uBio