Revista de la Sociedad Venezolana de Microbiología
versão impressa ISSN 1315-2556
Rev. Soc. Ven. Microbiol. v.28 n.2 Caracas dez. 2008
Diseminación tisular y efectos histopatológicos producidos por Leishmania mexicana amazonensis en roedores infectados experimentalmente
Elizabeth Bruzuala,*, Lucila Arcayb y María Antonia de la Parte-Péreza
aEscuela de Medicina "JM Vargas", Facultad de Medicina
bInstituto de Zoología Tropical, Facultad de Ciencias. Universidad Central de Venezuela. Caracas – Venezuela.
* Correspondencia: E-mail: ebruzual@cantv.net
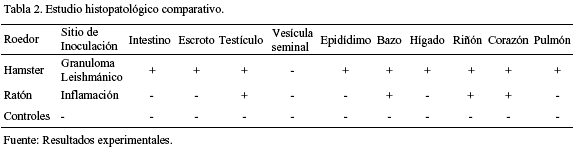
Resumen: Al género Leishmania pertenecen diferentes especies responsables de diversas formas clínicas de leishmaniasis. En este trabajo comparamos los efectos histopatológicos producidos en hamsters (Mesocricetus auratus) y ratones (Mus musculus) infectados experimentalmente por vía subcutánea con 20 x 105 amastigotes de Leishmania mexicana amazonensis. Nuestros resultados mostraron en hamsters daños histopatológicos en intestino, escroto, testículo, epidídimo, bazo, hígado, riñón, corazón y pulmón y en ratones en testículo, bazo, riñón y corazón. Estos resultados evidencian diferencias en la diseminación tisular, metástasis cutáneas, efectos histopatológicos y mortalidad, siendo más amplios, tempranos y graves en hamsters que en ratones.
Palabras clave: Leishmania mexicana amazonensis, diseminación, histopatología, hamsters, ratones
Tissue dissemination and histopathology effects produced by Leishmania mexicana amazonensis in rodents experimentally infected
Abstract: Leishmania comprises different species responsible of a variety of clinical forms of leishmaniasis. In this investigation we compared the histopathological effects produced in hamsters (Mesocricetus auratus) and mice (Mus musculus), inoculated by the subcutaneous route with 20 x 105 amastigotes of Leishmania mexicana amazonensis. Our results in hamsters show tissue damage in gut, scrotum, testicle, epididimus, spleen, liver, kidney, heart and lung and in mice we found histopathological changes in testicle, spleen, kidney and heart. These results show differences on tissue dissemination, cutaneous metastasis, histopathological effects and mortality, being more extensive, early and severe in hamsters then in mice.
Keywords: Leishmania mexicana amazonensis, dissemination, histopathology, rodents
Recibido 13 de abril de 2008; aceptado 17 de diciembre de 2008
Introducción
El género Leishmania incluye diversas especies que causan diferentes formas clínicas de leishmaniasis, enfermedad que afecta a los humanos y gran variedad de animales domésticos y silvestres. Esta enfermedad posee manifestaciones clínicas que dependen del parásito, del vector y muy especialmente de las condiciones inmunológicas del hospedador [1].
La leishmaniasis constituye una enfermedad con variedad de manifestaciones patológicas de diferente gravedad y efectos sobre la salud [2,3], en la cual el hospedador influye en la expresión de la forma clínica y la extensión de la infección causada por las especies de Leishmania que producen lesiones cutáneas. Después del periodo de incubación, las manifestaciones clínicas de la leishmaniasis cutánea (LC) comienzan con una lesión nodular en el sitio de inoculación, con formación de una costra que puede desprenderse, exponiendo una úlcera que se cura gradualmente y deja una cicatriz ligeramente hundida con pigmento alterado. Algunas lesiones pueden perdurar como nódulos o placas [2-6]. Son corrientes los nódulos secundarios en el borde de la lesión [3]. Otros signos o síntomas son: lesiones múltiples primarias o satélites, adenopatías regionales, dolor, prurito e infecciones bacterianas secundarias [2].
La respuesta histológica de la LC es de dos clases: a) respuesta celular inmune, que refleja la inmunidad del hospedador y b) la respuesta hística, que puede mostrar los efectos del antígeno liberado, ya que la lesión tisular parece ser con frecuencia mayor de lo que cabría imputar sólo a los efectos sobre el macrófago hospedador [3].
El estudio de diferentes aspectos relacionados con la LC producida por Leishmania mexicana ha sido abordado por distintos autores en relación a la clínica, diagnóstico y terapéutica [2], así como la influencia genética en la respuesta inmune [7], las características de esta respuesta y los mediadores asociados a la misma [8-12]. Se describe también que la resistencia a la infección por Leishmania está asociada con la activación de los macrófagos mediada por interferón gamma [11]. Igualmente, se ha estudiado cómo el extracto de la glándula salival del vector amplía el espectro clínico de la enfermedad, con la aparición precoz, mayor tamaño de las lesiones y aumento de la carga parasitaria [12]. Otros investigadores estudiaron la infección en hospedadores con algún déficit inmune [13] y también ha sido descrito como el estrés inducido por la inmovilización aguda produce alteraciones clínicas y neuroinmunes que favorecen la invasión del parásito en animales susceptibles [14].
El objetivo principal de nuestro trabajo fue describir y comparar la diseminación tisular y el espectro histopatológico de la LC experimental en hamsters (Mesocricetus auratus) y ratones (Mus musculus) producida por Leishmania mexicana amazonensis.
Materiales y métodos
Parásitos
Usamos una cepa de Leishmania mexicana amazonensis procedente de un caso clínico humano de LC, mantenida en el laboratorio mediante pasajes por vía subcutánea de homogenizados de lesiones cutáneas de hamsters. El inóculo consistió en un homogenizado preparado a partir de lesiones bien desarrolladas en la pata posterior derecha de hamsters infectados, contentivo de 20 x 105 amastigotes de Leishmania mexicana amazonensis en solución salina adicionada con 100 UI/mL de penicilina y 100 mg/mL de estreptomicina.
Animales
Utilizamos hamsters (Mesocricetus auratus) y ratones (Mus musculus) machos jóvenes, identificados con marcas en diferentes áreas corporales, los cuales fueron distribuidos en grupos de siete roedores, cada uno infectado por vía subcutánea y 14 roedores sanos (7 hamsters y 7 ratones); estos últimos constituyeron los grupos control. El mantenimiento y cuidado de los roedores en experimentación se realizó de acuerdo a los lineamientos del Comité de Ética establecidos por la Universidad Libre de Bruselas (Bélgica) para el uso humanitario de animales de laboratorio (condiciones apropiadas de temperatura, agua y alimentación) referido por Aguilar Torrentera F. [1]. Los animales fueron mantenidos en jaulas metálicas de dimensiones y características usuales en los diferentes bioterios de la Universidad Central de Venezuela, los cuales se corresponden con los lineamientos bioéticos de rigor, como son: dimensiones adecuadas para alojar al número de animales de cada grupo, con camas de cáscara de arroz (viruta), temperatura ambiente e iluminación correspondiente a un ciclo día/noche de 12 horas. Fueron alimentados con Ratarina* no esterilizada y agua a demanda, suministrada en bebederos estándar [15]. Al total de los animales infectados se les aplicó un volumen de 0,1 mL de inóculo por vía subcutánea (SC) en la pata posterior derecha. De cada uno de los grupos de animales infectados y sanos fue elegido un ejemplar cada mes y durante cinco meses, post infección, para ser sacrificado mediante inhalaciones de éter en cámara de sacrificio conformada por un recipiente de vidrio transparente con tapa de rosca, donde se colocaba un algodón impregnado con éter (anestesia inhalatoria) y posterior al fallecimiento del animal era autopsiado en una tabla de disección, fijado a la misma en posición ventral mediante agujas de disección, con una aguja para cada pata.
Se tomaron muestras de testículo, epidídimo, vesícula seminal, riñón, hígado, bazo, pulmón y corazón. Todas las muestras se fijaron en formol al 10%, fueron procesadas para hacerles cortes de 4 μm de espesor y posteriormente coloreadas de acuerdo a las técnicas de Hematoxilina y Eosina y Tricrómico de Gomori. El grupo total de animales utilizados en el experimento fue de 28: 14 infectados y 14 controles. Este número de animales se determinó de manera conservadora, considerando la duración del experimento (150 días) y que de los 7 individuos/grupo, podríamos perder alguno por motivos imprevistos durante el desarrollo del experimento.
El control y seguimiento de la lesión en el punto de inoculación en todos los animales infectados, fue realizado macroscópicamente y las lesiones medidas cada quince días, usando un vernier para determinar su extensión. Todas las lesiones desarrolladas tanto en el sitio de inoculación, a distancia (metástasis) y viscerales fueron cuidadosamente observadas durante el tiempo de experimentación y comparadas con los tejidos de los controles sanos.
Resultados
En los hamsters las primeras evidencias de inflamación en el sitio de inoculación se observaron a los 15 días postinfección y en los ratones a los 45 días; los primeros signos de metástasis en los hamsters se presentaron a los 65 días después de iniciado el experimento y en los ratones a los 58 días (Tabla 1). A los 150 días de infección, los animales presentaron una lesión cutánea bien desarrollada en la pata posterior derecha, lesiones a distancia en los pabellones auriculares con aumento de volumen, deformación y múltiples lesiones ulceradas en el hocico, ambas patas anteriores, pata posterior izquierda y en la región escrototesticular.
El estudio histopatológico de la pata posterior derecha (sitio de inoculación), realizado a los 150 días postinfección, mostró un granuloma histiocitario leishmánico nodular, de tamaño variable entre un animal y otro, de color rosado violáceo sin endurecimiento, de borde liso y brillo mediano, con gran invasión de la dermis por macrófagos con citoplasma basófilo y núcleo irregular, llenos de amastigotes localizados dentro de vacuolas, proliferación de zonas de tejido conjuntivo y desarrollo de redes capilares. La epidermis presentó procesos de hiperqueratosis.
En el intestino se observó la membrana mucosa edematizada, con áreas de aspecto hemorrágico sin evidencias de diseminación parasitaria.
En el escroto, se observó aumento de volumen, distensión y engrosamiento de las paredes y el estudio histopatológico de las muestras de los animales infectados mostró un proceso inflamatorio, acompañado de proliferación de fibras colágenas y macrófagos llenos de amastigotes. La epidermis presentó histiocitos que contenían parásitos; la dermis presentó alteración de su estructura normal, invasión de macrófagos llenos de parásitos y focos edematosos ocasionales, mostrando linfocitos y plasmocitos. El tejido celular subcutáneo mostró una mayor proliferación histiocitaria, representada por células llenas de amastigotes (Tabla 2).
Ambos testículos presentaron aumento de volumen con signos de congestión vascular, diseminación del parásito formando nidos de amastigotes en el intersticio testicular y el epitelio seminífero, además de amastigotes dispersos. La albugínea testicular mostró hiperplasia e hipertrofia, además de abundantes macrófagos llenos de amastigotes.
En el epidídimo se observaron signos de congestión vascular y el epitelio de los túbulos presentó sus células vacuolizadas y algunas lisadas, con pérdida de sus membranas intercelulares y cilios, además de diseminación del parásito en el conjuntivo adyacente.
En las vesículas seminales a los 150 días (5 meses) postinfección, no se observó diseminación parasitaria ni lesiones tisulares aparentes (Tabla 2).
En el bazo, el análisis macroscópico mostró adelgazamiento del órgano, color oscuro y consistencia friable. La observación microscópica presentó en el conjuntivo periesplénico abundantes nidos de amastigotes, igualmente adyacentes a la cápsula esplénica y pulpa blanca (Tabla 2).
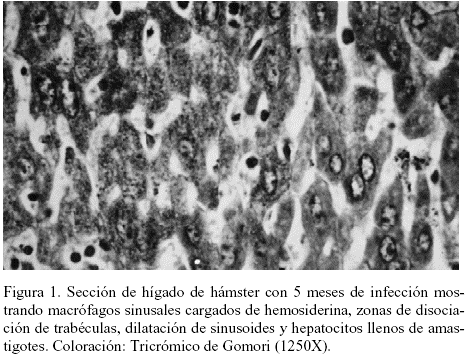
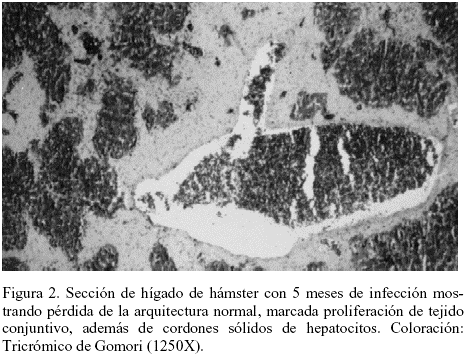
En el hígado, a los 60 días (2 meses) de infección se observó congestión marcada, focos periportales de infiltración linfo-histiocitaria, abundantes macrófagos sinusales cargados de hemosiderina, disociación de trabéculas y sinusoides dilatados. A los 150 días (5 meses) se observó el incremento de la diseminación tisular del parásito, hepatocitos llenos de amastigotes y también pérdida evidente de la arquitectura normal, con proliferación de tejido conjuntivo vascularizado (Figuras 1 y 2).
El riñón mostró a los 60 días (2 meses) diseminación de amastigotes en el conjuntivo perirrenal, congestión y macrófagos cargados de hemosiderina. A los 150 días (5 meses) se observaron modificaciones del epitelio tubular, congestión y glomerulonefrítis proliferativa. La diseminación tisular del parásito se presentó a los 60 días en el conjuntivo perirrenal, además de un infiltrado inflamatorio (Tabla 2).
En el corazón a los 150 días (5 meses) post-infección, los animales presentaron diseminación escasa de parásitos en las fibras cardiacas, las cuales no mostraron lesiones tisulares aparentes.
En el pulmón a los 150 días (5 meses) post-infección, los animales no presentaron diseminación de parásitos, pero si se observó congestión y gránulos de hemosiderina. Los hamsters del grupo control presentaron tejidos normales (Tabla 2).
En los ratones, las primeras señales de inflamación en la zona de inoculación se presentaron a los 45 días (mes y medio) de iniciado el experimento. Las lesiones a distancia comienzan a presentarse en la pata posterior izquierda y base de la cola a los 58 días post-infección.
A los 150 días (5 meses) se realizaron las siguientes observaciones: en los testículos se evidenció diseminación parasitaria, además de engrosamiento de la túnica albugínea con algunas áreas contentivas de nidos de amastigotes; en el epidídimo y vesículas seminales no hubo diseminación parasitaria ni lesiones tisulares aparentes; en el bazo no se observó diseminación de parásitos pero si congestión y presencia de escasos megacariocitos; en el hígado no se presentó diseminación parasitaria ni lesiones tisulares aparentes (Tabla 2).
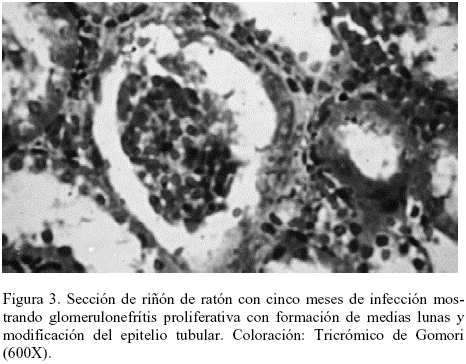
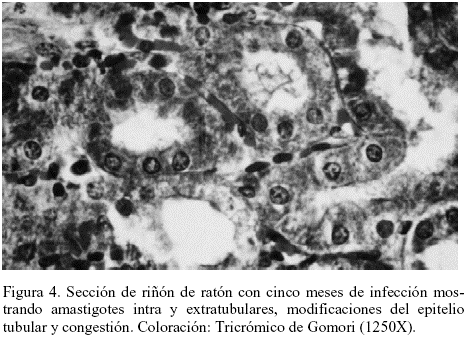
En el riñón se observó congestión, algunas áreas del epitelio tubular lisadas, frecuentes acúmulos linfocitarios cercanos a los vasos sanguíneos y ausencia de parásitos. A los cinco meses post-infección se observaron amastigotes intra y extra tubulares, modificaciones del epitelio tubular y congestión, además de glomerulonefritis proliferativa con formación de medias lunas y modificaciones del epitelio tubular (Tabla 2 y Figuras 3 y 4).
En el corazón, se observó infiltración masiva de amastigotes en las fibras cardiacas y en el tejido conjuntivo, además de degeneración de algunas fibras cardiacas. En el pulmón no se observaron parásitos ni lesiones tisulares. Los ratones del grupo control presentaron tejidos normales (Tabla 2).
Discusión y conclusiones
La leishmaniasis cutánea localizada es conocida en el sureste de México como úlcera de los chicleros y fue descrita por Seidelin en 1912 [16]. Estos autores examinaron la respuesta tisular del hospedador y su correlación con algunas de las características de la presentación clínica, como por ejemplo la relación directa entre el tamaño de la lesión y su tiempo de evolución y la relación inversa entre el tamaño de la lesión y el número de amastigotes presentes en la misma [16].
También se han estudiado los aspectos histopatológicos e inmunes relacionados con la evolución de las lesiones cutáneas experimentalmente producidas por varias especies de Leishmania. Estos aspectos están estrechamente relacionados con el desarrollo de las lesiones y la resolución de las mismas [17]. Por otra parte, la descripción macroscópica de los procesos infecciosos de Sporothrix schenckii y Leishmania mexicana spp. en hamsters inoculados subcutáneamente en el hocico, aportan datos para la diferenciación del comportamiento de estos patógenos en un modelo experimental. La observación secuencial durante 150 días demostró que la infección producida por estos patógenos se presenta inicialmente con edema y eritema local seguido de alopecia, necrosis y ulceración en el sitio de inoculación [18]. En este trabajo describimos los efectos del parásito en los diferentes tejidos examinados y nuestras observaciones concuerdan con los resultados reportados por los autores señalados en la bibliografía consultada.
Leishmania mexicana amazonensis ha sido reconocida como un agente etiológico de la leishmaniasis cutánea en Latinoamérica y es capaz de producir la clínica atípica de leishmaniasis con hepatitis, linfadenopatía y diseminación [19]. Además, también se han estudiado biopsias de piel de lesiones activas y en proceso de cicatrización en animales infectados y sus controles no infectados, para estudio de los diferentes tipos de células inflamatorias mediante inmunohistoquímica [20]. En este estudio se observaron diferentes patrones histopatológicos, los cuales se correspondieron con las observaciones descritas para la LC en humanos.
También ha sido estudiado el curso de la infección, carga parasitaria y la histopatología de las lesiones cutáneas, además de un ganglio linfático tributario abscedado, bazo e hígado en dos cepas de ratones genéticamente diferentes. En ambas apareció la lesión primaria a las 12 semanas posteriores a la inoculación con L. mexicana y luego se observó la diseminación visceral en la cepa genéticamente inmunodeficiente [21]. El estudio de la relación de la respuesta inmune en la morfología del granuloma leishmánico inducido mediante inoculación de L. mexicana en la bolsa del carrillo del hámster, sitio que goza de privilegio inmune, demostró que el desarrollo de esta respuesta inmune no es significativo para el control de la infección [22].
Al inocular hamsters por vía subcutánea con L. mexicana y L. brasiliensis simultáneamente o con un intervalo en la pata anterior derecha y el hocico, el curso de la infección fue independiente para cada uno de los parásitos. En un grupo de animales se comprobó metástasis de la pata al hocico y la transformación parcial del granuloma del tipo tuberculoide al tipo lepromatoso [22]. Zeledón et al, sugieren que la leishmaniasis cutánea diseminada en el Nuevo Mundo solamente es producida por parásitos del complejo mexicana.
Nuestros resultados mostraron una mayor susceptibilidad de los hamsters a la infección por L. mexicana comparada con los ratones, en relación a los siguientes parámetros: a) el tiempo de aparición de las lesiones fue menor en los hamsters que en los ratones; b) el desarrollo de las lesiones fue más grave en los hamsters que en los ratones; c) la mortalidad fue mayor y más temprana en la población de hamsters. Lo anteriormente expuesto nos permite concluir que existe una mayor susceptibilidad del hámster a la infección por Leishmania mexicana amazonensis en relación con el ratón, ya que las lesiones en el sitio de inoculación, la diseminación tisular y daños histopatológicos son de aparición más temprana y graves en los hamsters. Igualmente observamos mortalidad, siendo ésta mayor en hamsters que en ratones. La mayor susceptibilidad de los hamsters con relación a los ratones se evidencia una vez más en este trabajo. La experiencia de nuestro grupo de investigación a través de los años de estudio y comprobaciones experimentales lo corrobora y concuerda con la bibliografía consultada, la cual reporta a lo largo del tiempo la mayor susceptibilidad de los hamsters al parásito.
Referencias
1. Aguilar Torrentera F, Lambot MA, Laman JD, Van Meurs M, Kiss R, Noel JC, Carlier Y. Parasitic load and histopathology of cutaneous lesions, lymph node, spleen, and liver from BALB/c and C57BL/6 mice infected with Leishmania mexicana. Am J Trop Med Hyg 2002; 66(3): 273-9. [ Links ]
2. Berman JD. Human leishmaniasis: clinical, diagnostic, and chemotherapeutic developments in the last 10 years. Clin Infect Dis 1997; 24(4): 684-703. [ Links ]
3. Organización Mundial de la Salud, Serie de Informes Técnicos, Informe de un Comité de Expertos de la OMS. Lucha contra las leishmaniasis. Ginebra 1990. [ Links ]
4. Barral A, Pedral-Sampaio D, Grimaldi Junior G, Momen H, McMahon-Pratt D, et al. Leishmaniasis in Bahia, Brazil: evidence that Leishmania amazonensis produces a wide spectrum of clinical disease. Am J Trop Med Hyg 1991; 44(5): 536-46. [ Links ]
5. Terabe M, Kuramochi T, Hatabu T, Ito M, Uevama Y, Katakura K, Kawazu S, Onodera T, Matsumoto Y. Nonulcerative cutaneous lesion in immunodeficient mice with Leishmania amazonensis infection. Parasitol Int 1999; 48(1): 47-53. [ Links ]
6. Reed SG. Diagnosis of leishmaniasis. Clin Dermatol 1996; 14(5): 471-8. [ Links ]
7. Rosas LE, Keiser T, Barbi J, Satoskar AA, Setter A et al. Genetic background influences immune responses and disease outcome of cutaneous L. mexicana infection in mice. Int Immunol 2005; 17(10):1347-57. [ Links ]
8. Jones DE, Buxbaum LU, Scott P. IL-4-independent inhibition of IL-12 responsiveness during Leishmania amazonensis infection. J Immunol 2000; 165(1): 364-72. [ Links ]
9. Buxbaum LU, Uzonna JE, Goldschmidt MH, Scott P. Control of new world cutaneous leishmaniasis is IL-12 independent but STAT4 dependent. Eur J Immunol 2002; 32(11): 3206-15. [ Links ]
10. Maioli TU, Takane E, Arantes RM, Fietto JL, Afonso LC. Immune response induced by new world Leishmania species in C57BL/6 mice. Parasitol Res 2004; 94(3): 207-12. [ Links ]
11. Guevara-Mendoza O, Une C, Franceschi Carreira P, Orn A. Experimental infection of Balb/c mice with Leishmania panamensis and Leishmania mexicana: induction of early IFN-gamma but not IL-4 is associated with the development of cutaneous lesions. Scand J Immunol 1997; 46(1): 35-40. [ Links ]
12. Norsworthy NB, Sun J, Elnaiem D, Lanzaro G, Soong L. Sand fly saliva enhances Leishmania amazonensis infection by modulating interleukin-10 production. Infect Immun 2004; 72(3): 1240-7. [ Links ]
13. Maldonado J, Marina C, Puig J, Maizo Z, Avilan L. A study of cutaneous lesions caused by Leishmania mexicana in plasmigen deficient mice. Exp Mol Pathol 2006; 80(3): 289- 94. [ Links ]
14. Ruiz MR, Quinones AG, Diaz NL, Tapia FJ. Acute immobilization stress induces clinical and neuroimmunological alterations in experimental murine cutaneous leishmaniasis. Br J Dermatol 2003; 149(4): 731-8. [ Links ]
15. Rojas OC, Medina C, Rumenoff L, Suárez O, Martínez E y cols. Primer reporte de infección natural po Nocardia cyriacigeorgica en ratones BALB/c. Rev Soc Venez Microbiol 2008; 28(1):38-42. [ Links ]
16. Andrade-Narvaez FJ, Medina-Peralta S, Vargas-Gonzalez A, Canto-Lara SB, Estrada-Parra S. The histopathology of cutaneous leishmaniasis due to Leishmania (Leishmania) mexicana in the Yucatan peninsula, Mexico. Rev Inst Med Trop Sao Paulo 2005; 47(4): 191-4. [ Links ]
17. Silveira FT, Moraes MA, Lainson R, Shaw JJ. Experimental cutaneous leishmaniasis. III. Histopathological aspects of the developmental behaviour of the cutaneous lesion induced in Cebus paella (Primates: Cebidae) by Leishmania (Viannia) lainsoni, L. (V) braziliensis and L. (Leishmania) amazonensis. Rev Inst Med Trop Sao Paulo 1990; 32(6): 387-94. [ Links ]
18. Gonzalez de Polania LA, Alzate A, Saravia N. Experimental behaviour of Sporothrix schenckii and Leishmania mexicana in hamsters. Rev Inst Med Trop Sao Paulo 1990; 32(5): 319- 24. [ Links ]
19. Aleixo JA, Nascimento ET, Monteiro GR, Fernandes MZ, Ramos AMO, Wilson ME, Pearson RD, Jeronimo SMB. Atypical american visceral leishmaniasis caused by Leishmania amazonensis infection presenting with hepatitis and adenopathy. Trans Royal Soc Trop Med and Hyg 2006; 100: 79-82. [ Links ]
20. Amaral V, Pirmez C, Goncalves A, Ferreira V, Grimaldi G Jr. Cell populations in lesions of cutaneous leishmaniasis of Leishmania (L.) amazonensis-infected rhesus macaques, Macaca mulatta. Mem Inst Oswaldo Cruz 2000; 95(2): 209- 16. [ Links ]
21. Parreira de Arruda MS, Nogueira ME, Bordon AP. Histological evaluation of the lesion induced by inoculation of Lishmania mexicana in the cheek pouch of the hamster. Rev Soc Bras Med Trop 2002; 35(4): 293-7. [ Links ]
22. Zeledón R, Soto R, González P. Experimental superimposed infection of the hamster with Leishmania mexicana and L. braziliensis. Acta Trop 1982; 39(4): 367-72. [ Links ]












 uBio
uBio