Revista de la Sociedad Venezolana de Microbiología
versão impressa ISSN 1315-2556
Rev. Soc. Ven. Microbiol. v.28 n.2 Caracas dez. 2008
Listeriosis en embarazada: reporte de un caso
Yolanda Garmendiaa, Vivian Vergaraa, María Rosángel Moralesa,*, Edelmira Beníteza, Rayza Lópeza, Yun Rodrígueza, Daniel Gonzálezb,c
aUnidad de Bacteriología-Servicio de Bioanalisis, Maternidad Concepcion Palacios
bUnidad de Terapia Intensiva de Adultos- Maternidad Concepcion Palacios
cUnidad de Terapia Intensiva de Adultos-Hospital Miguel Pérez Carreño. Caracas - Venezuela.
* Correspondencia: E-mail: mariarosangel@yahoo.com
Resumen: Listeria monocytogenes (Lm), es una especie ampliamente distribuida en la naturaleza, ha sido aislada de numerosos animales y es capaz de causar enfermedad en el humano, especialmente cuando hay condiciones predisponentes. Son susceptibles las mujeres embarazadas y sus fetos, ancianos e individuos inmunosuprimidos. La listeriosis durante el embarazo, puede causar infección intrauterina resultando en complicaciones severas como aborto espontáneo, parto pretérmino e infección en neonatos, con alta morbi - mortalidad. Presentamos un caso de una paciente de 39 años de edad con 13 semanas de embarazo, a la cual se le realizó la técnica del cerclaje. Posteriormente, presentó un cuadro de meningitis bacteriana. Se realizaron cultivos de líquido cefalorraquídeo, sangre y orina, entre otros; lográndose el aislamiento de Lm a partir de los hemocultivos. Finalmente fue trasladada a otra institución para drenaje ventrículo peritoneal, donde falleció. Este es el primer caso de diagnóstico de infección severa por Lm en una embarazada en la Maternidad Concepción Palacios (MCP) de la ciudad de Caracas-Venezuela, reportado en la literatura.
Palabras clave: Listeria monocytogenes, listeriosis, embarazo, sepsis
Listeriosis in pregnant woman: case report
Abstract: Listeria monocytogenes (Lm) is a bacterium widely distributed in nature which has been isolated from several animal and is capable of producing disease in human beings, especially when there are predisposing conditions. Pregnant women, their fetuses, aged persons and immunosuppressed individuals are susceptible. Listeriosis during pregnancy can produce intrauterine infection resulting in severe complications such as spontaneous abortion, preterminal deliveries and neonatal infections, resulting in high morbility and mortality. We present the case of a 39 years old patient with a 13-week pregnancy who was submitted to a cerclage technique. She later presented bacterial meningitis. Culture of spinal fluid, blood and urine, among others, were done and Lm was isolated from haemocultures. Finally she was moved to another institution for ventriculo-peritoneal drainage, where she later died. This is the first case of a severe Lm infection in a pregnant woman at the Concepción Palacios Maternity Hospital in Caracas, Venezuela, reported in the literature.
Keywords: Listeria monocytogenes, listeriosis, pregnancy, sepsis
Recibido 22 de febrero de 2008; aceptado 08 de septiembre de 2008
Introducción
El género Listeria está constituido por bacilos grampositivos cortos (0,5 a 0,2 μm por 0,4 a 0,5 μm), no ramificados, no productores de esporas, móviles a 28ºC gracias a flagelos peritricos. Este género incluye las siguientes especies: L. monocytogenes (Lm), L. ivanovvi, L. seeligeri, L. welshimeri, L. innocua, L. grayi, L. denitrificans [1,2]. Sólo Lm tiene importancia clínica y su patogenicidad para el hombre está bien establecida [3]. Se encuentra ampliamente distribuida en la naturaleza, ha sido aislada de suelos, polvo ambiental, agua dulce y salada, alimentos para animales, alimentos crudos de origen animal, incluido aves frescas y congeladas, productos lácteos crudos, etc. [4]. Se considera que su hábitat primario es el suelo y los vegetales en descomposición.
Lm, fue reportada por primera vez por Murray et al [5] en Inglaterra, como responsable de una septicemia epizoótica en conejos y cobayos de laboratorio. Lm origina, bajo ciertas condiciones, la enfermedad denominada listeriosis tanto en el hombre como en una variedad de especies animales [6]. La infección en el humano esta relacionada con una alteración en el sistema inmunológico, siendo las personas más susceptibles los ancianos, mujeres embarazadas y sus fetos y los pacientes en condiciones de inmunosupresión [1,6-10]. Lm es un patógeno intracelular, de allí su predilección por producir enfermedad en las personas con déficit de inmunidad mediada por células. Es agente causal de enfermedad gastrointestinal, sepsis, meningitis, corioamnionitis y feto muerto [3,6].
Puede presentarse en forma epidémica o en casos esporádicos, tanto en el hombre como en animales y se ha descrito un periodo de incubación de 2 a 6 semanas [2,6]. Se ha establecido que la principal vía de transmisión es por alimentos contaminados con materias fecales provenientes de reservorios de animales, humanos o ambientales, así como el suelo[11]. Se ha referido también inoculación directa en caso de veterinarios, cuidadores de animales y agricultores. Por otra parte, se ha descrito infección ascendente, probablemente por listerias procedentes de la vagina, en recién nacidos con enfermedad precoz [6,12]. Además, algunos brotes de infección neonatal de comienzo tardío, indican que Lm también se transmite en forma hospitalaria. Se han descrito brotes de listeriosis nosocomial, asociados a contaminaciones y transmisión en sala de partos [4,9,12].
Los cambios hormonales del embarazo contribuyen a una supresión local de la inmunidad mediada por células en la interfase materno-fetal, este fenómeno es referido como shif Th1-Th2 del embarazo y contribuye con la tolerancia materna al feto, por la supresión de la respuesta inmune anti-fetal mediada por células [13], que en consecuencia incrementa la susceptibilidad de la embarazada a infecciones por microorganismos intracelulares como Lm, causando infecciones severas en el par madre/feto [4,6,14]. Adicionalmente, la localización intracelular de Lm protege a la bacteria de la respuesta inmune humoral [15]. La inmunosupresión local de la interfase materno-fetal de la placenta, facilita la infección intrauterina tras bacteriemia materna asociada, desencadenando septicemia fetal, excreción del agente bacteriano por la orina fetal al líquido amniótico, deglución de este líquido amniótico infectado y compromiso respiratorio y digestivo fetal [6]. Esta enfermedad puede causar lesiones de aspecto granulomatoso llamadas listeriomas, que se observan en todos los parénquimas comprometidos e incluso produce microabscesos placentarios los que al provocar una disminución del flujo uteroplacentario podría ocasionar muerte fetal [6]. La incidencia de listeriosis en mujeres embarazadas es 17 veces mayor que en la población general [16]. Ciertas precauciones durante el embarazo pueden evitar la listeriosis, pero usualmente se omite este tema en el cuidado prenatal y muchas mujeres carecen del conocimiento acerca de esta patología[17].
El diagnóstico definitivo se realiza a través de cultivos seriados de sangre, líquido cefalorraquídeo (LCR) o líquido amniótico [2,6,10]. Esta bacteria posee similitud morfológica con difteroides y estreptococos, precisando de pruebas bioquímicas para su confirmación [6].
En Venezuela se tienen reportes de aislamiento de Lm de origen animal desde el año 1988 [18] y en diversos alimentos desde 2004 [19-21]. Sin embargo, aún no se ha descrito el primer brote por listeriosis y no se encontró reporte de casos de listeriosis en el embarazo, por lo que se planteó describir un caso de listeriosis en una embarazada ocurrido en Caracas, Venezuela.
Caso clínico
Mujer de 39 años de edad en el II trimestre de embarazo que ingresó al Servicio de Obstetricia de la MCP de Caracas para colocación de cerclaje cervical. El diagnóstico de admisión fue: 1) embarazo de 13 semanas por fecha de última regla, 2) pérdida gestacional recurrente, 3) incompetencia cervical. Como antecedentes clínicos relevantes, la paciente tenia IV gestas y III abortos, pruebas para el virus de la hepatitis B y toxoplasma negativas. Ingresó afebril y asintomática. Con leucocitos en 11.3 x103/mm3.
El día 4 de hospitalización con anestesia epidural se realizó cerclaje uterino tipo McDonald, sin complicación.
El día 5 la paciente manifestó cefalea fuerte en región occipital y frontal, que se trató con administración epidural de 15 mL de sangre completa autógena, a nivel de L1-L2. Seguidamente, presentó: cefalea, fotofobia, rigidez de nuca, desviación de la mirada, nauseas, vómitos, sed, hormigueo en miembros inferiores y signos de Kernig y Brudzinski positivos. Los exámenes de laboratorio reportaron: leucocitos 25.4 x103/mm3, con 94.3% de neutrófilos.
Se trasladó el día 7 a la unidad de terapia intensiva de adultos, donde se determinó: sepsis con punto de partida obstétrico, infección del sistema nervioso central: meningitis bacteriana y corioamnionitis por clínica. En vista de la corioamnionitis se procedió a retirar el material de cerclaje. Continuó la sintomatología anteriormente descrita más desorientación y debilidad muscular en miembros inferiores. La tomografía axial computarizada (TAC) evidenció edema cerebral. Se trató con ceftriazone, vancomicina, amikacina y ciprofloxacina. El estudio citoquímico del LCR reveló: cantidad: 0.5mL; aspecto: límpido con sedimento hemático después de centrifugado; color: xantocrómico, después de centrifugado; células: 4.012/mm3; hematíes: 10.750/mm3; diferenciación celular: polimorfonucleares (PMN) 75/mm3, mononucleares (MN) 25/mm3; glucosa: 235mG%; Reacción de Pandy: positivo (2+), no se realizó la determinación de proteínas por ser muestra insuficiente. En la coloración de Gram del LCR se observaron PMN 0-2pC100X y no se observó morfología bacteriana; el cultivo fue negativo. Se tomaron dos muestras de sangre para cultivo bacteriano y cultivo de hongos, todos negativos.
El día 8 fue expulsado el feto a las 14 semanas de gestación. La hematología reflejó: leucocitos: 22.8 x103/mm3, con 93% de neutrófilos. Se realizó cultivo de los hilos del cerclaje, recuperándose: Enterococcus faecalis, Escherichia coli y Klebsiella pneumoniae. Se administra tratamiento con ceftriazone y vancomicina.
El día 9 le indican hemocultivos seriados (2), se realizan cultivos adicionales de secreción endotraqueal y orina. El contaje leucocitario fue de 15.9 x103/mm3.
El día 10 la paciente presentó 17 horas continuas de fiebre; 13.7 x103/mm3 leucocitos con 86% de neutrófilos. Se indicó vancomicina y cefepime.
El día 13 con leucocitos en 18.9 x103/mm3 y neutrófilos en un 84%, se observó edema, hidrocefalia e isquemia por meningitis infecciosa. En el estudio bacteriológico de sangre, se obtienen crecimiento en ambos frascos de bacilos grampositivos cortos. Se envió un reporte presuntivo de Listeria sp por parte del laboratorio luego de realizar pruebas confirmatorias de coloración de Gram, catalasa, movilidad a temperatura ambiente, entre otros. Se efectuaron nuevos cultivos de sangre, los cuales dieron resultados negativos. Adicionalmente, se cultivó secreción endotraqueal y orina, todos negativos. Se trata con vancomicina y meropenem.
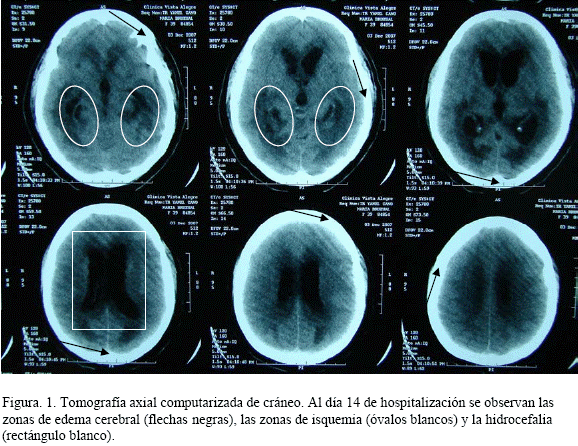
El día 14 la TAC reveló hidrocefalia e isquemia por edema (Figura 1), se continuó tratamiento con vancomicina y meropenem, y se refirió al Servicio de Neurocirugía de otra Institución para drenaje ventricular peritoneal por hidrocefalia secundaria a meningitis infecciosa, donde falleció.
Este es el primer caso de diagnóstico de infección severa por Lm en una embarazada de la MCP reportado en la literatura.
Diagnóstico bacteriológico
Cultivo y aislamiento
Los hemocultivos fueron tomados con las precauciones de asepsia establecidas. Se inocularon frascos para adultos del Sistema Bact-Alert (BioMérieux®), los cuales fueron monitoreados en dicho equipo. El LCR fue sembrado en agar sangre (Blood Agar Base BBL, BD®, USA) y en agar levine (Levine Eosin Methylene Blue Agar BBL, BD®, USA) e incubado en aerobiosis a 37ºC, adicionalmente fue sembrado en medio GC (GC Médium Difco, BD®, USA) que se incubó en microaerofilia a 37ºC por 24-48 horas.
Los dos hemocultivos que resultaron positivos fueron sembrados en agar sangre y agar levine, e incubados en aerobiosis a 37ºC por 24-48 horas.
Identificación
Una vez obtenido el crecimiento del microorganismo en placa se hizo la identificación basada en: a) caracteres del cultivo: en las placas de agar sangre se apreció el crecimiento de colonias pequeñas, de bordes lisos, traslúcidas, grisáceas y beta hemolíticas; b) examen microscópico: se hizo una coloración de Gram en las que se observó bacilos grampositivos cortos aislados y c) caracterización bioquímica: se empleó el Sistema Vitek 32(BioMérieux®), específicamente se inoculó la tarjeta GPI para identificación de grampositivos. Dicha tarjeta contiene 28 pruebas, las cuales incluyen utilización de carbohidratos, esculina, urea, arginina, entre otras. Una vez obtenida la identificación por el Sistema Vitek 32 a las 24 horas, se procedió a confirmar por medio de pruebas convencionales, tales como: catalasa, hidrólisis de la esculina, producción de hidrógeno sulfurado (H2S), reacción de Voges Proskauer, movilidad a temperatura ambiente y a 37ºC, y fermentación de carbohidratos como glucosa, xilosa y manitol.
Los resultados obtenidos mediante características del cultivo, microscópicos y bioquímicos, permitieron el diagnóstico de Lm. La cepa fue enviada a un centro de referencia nacional donde fue confirmada dicha identificación.
Discusión
El número esporádico de casos de listeriosis en países que reportan la enfermedad está en el rango de 0,5 a 0,8 casos/100.000personas [1]. La incidencia anual de listeriosis en Europa ha variado entre 0,1 a 11,3 casos por millón de habitantes [2]. En EEUU, la listeriosis invasiva confirmada por hemocultivo o cultivo de LCR constituyen 7,4 casos por millón de habitantes por año [2,4], con un 27% de infecciones perinatales [22]. Voetsch et al en un estudio más reciente realizado en EEUU, reportó que el 16% de las listeriosis invasiva fueron casos asociados a embarazo [23]. Siegman-Igra et al (2002) reportan una incidencia anual en Israel de 0.6/100.000 personas y un 43% de las listeriosis fueron infecciones perinatales [9]. En Inglaterra se reportó un 34% de infecciones perinatales [24].
La listeriosis asociada a gestación, se manifiesta en cualquier etapa, aunque la mayoría se detecta durante el III trimestre [2,6,8,10], 2/3 de las gestantes con listeriosis perinatal manifiestan un cuadro leve o subclínico pseudogripal, caracterizado por fiebre, cefalea, odinofagia, mialgias, malestares, dorsalgia, náuseas y vómitos [2,6,9]. La bacteriemia sin foco evidente es la presentación clínica más frecuente; sin embargo, Lm exhibe tropismo por la unidad fetoplacental [17] y se ha comprobado que una sola bacteria es suficiente para causar infección en la placenta [25]. Es por esto que durante el embarazo, a través de una propagación transplacentaria Lm causa infección intrauterina, que puede conducir a corioamnionitis, parto prematuro, aborto espontáneo, muerte fetal e infección precoz del neonato [6].
La corioamnionitis es la inflamación de las membranas del feto [26], usualmente es tratada con cefalosporina y clindamicina [7]. Existen casos de listeriosis en los que se ha descrito corioamnionitis con formación de microabscesos [6,7,24,27]. No obstante, los antibióticos señalados anteriormente no son efectivos para tratar listeriosis ya que Lm no es sensible a las cefalosporinas [4,15]. La paciente aquí descrita fue tratada con cefalosporinas al principio de la infección, y es importante destacar que este esquema no cubre infecciones por Lm. Sin embargo, se tienen estudios en los que el procedimiento fue similar, pero al tener el conocimiento del agente causal se cambió por ampicilina o penicilina mas aminoglucósido [6], en este caso se usó meropenen mas vancomicina.
Por otra parte, la transmisión transplacentaria de Lm se traduce en infección intrauterina que -a veces- provoca corioamnionitis, parto prematuro, muerte fetal intrauterina, o enfermedad precoz del recién nacido [4,6], en consecuencia el diagnóstico de coriamnionitis es un indicio de que ocurrió transmisión transplacentaria, además de ser una complicación del cerclaje [29]. Su pronóstico es favorable con antibióticoterapia [6]. De igual forma, se ha descrito que el 5% de las mujeres sanas portan Lm en la vagina [4,8] y se ha encontrado Lm en la secreción vaginal de mujeres con antecedentes de abortos habitual en más de un 70% [6]; por lo que es probable que la paciente aquí descrita, con antecedentes de III abortos, haya sido portadora de Lm en vagina y al ser manipulada en la ejecución del cerclaje, sumado a la susceptibilidad de las embarazadas a infecciones por microorganismos intracelulares como Lm, haya desarrollado la listeriosis fatal. Sin embargo, este hecho no pudo ser corroborado en vista de que la paciente se negó a la revisión ginecológica y en consecuencia no se pudo realizar un cultivo de secreción vaginal o cervical.
Con respecto a los exámenes bacteriológicos; en cuatro cultivos de sangre y uno de LCR que se realizaron al inicio del proceso infeccioso, no se obtuvo aislamiento bacteriano. Este hecho concuerda con lo observado en otros estudios, en los que el crecimiento de Lm en varios tipos de muestras- incluyendo LCR- ha fallado [8,17,18]. Sin embargo, se ha logrado aislar Lm de sangre [8,23], LCR [23], secreción cervical o vaginal [8,23,24], placenta [8,23], líquido amniótico [8,23], líquido pleural [23], líquido ascítico [23], catéter [23] y orina [8,23], entre otros. Igualmente, se ha señalado que la tinción de Gram de LCR no suele aportar ningún dato concluyente [4], lo cual coincide con los datos arrojados en la coloración de Gram realizada al LCR en la que solo se observó de 0-2 PMN pC100X. Por otra parte, se ha determinado que los cultivos de LCR a veces resultan estériles, mientras que los hemocultivos suelen ser diagnósticos [4]; tal y como sucedió en el caso clínico aquí presentado en el que la listeriosis invasiva, fue confirmada por el hallazgo de Lm en hemocultivos, tomados posteriormente (9º día).
Para pacientes con cultivo positivos a Lm el tratamiento de elección es penicilina o ampicilina por tres semanas más gentamicina [15,27]. En pacientes alérgicos a penicilina se puede usar trimetropin-sulfametoxasol, pero no está indicado en mujeres embarazadas [6,7,9]. Las mujeres en gestación con infección por Lm pueden tratarse con eritromicina [4]. No obstante, la paciente recibió al principio de la sintomatología: ceftriazone, vancomicina, amikacina y ciprofloxacina, y luego fue tratada con vancomicina más una cefalosporina. A pesar de que vancomicina es señalado como un tratamiento alternativo en casos de listeriosis [30,31], solo es efectivo en sepsis ya que no atraviesa la barrera hematoencefalica y no puede ser usada en meningitis. Al conocer el diagnóstico de Lm y antes de ser trasladada a otra institución a la paciente se le administró vancomicina más meropenem, este último con actividad antimicrobiana a nivel de las meninges.
El presente trabajo representa un reporte interesante y de importancia en la salud pública, ya que se han descrito como raras las infecciones por Lm en el sistema nervioso central de mujeres embarazadas [28], además de ser un diagnóstico poco frecuente, esta paciente desarrolló la sintomatología típica de listeriosis en embarazada, tal y como lo describe la literatura. Adicionalmente, es importante señalar que la práctica sistemática de hemocultivos en estos casos tiene una alta rentabilidad diagnóstica. Por otra parte hemos encontrado diagnósticos de listeriosis en embarazadas de 27 [32], 20 [33] 17 [8] y 16 [6] semanas de gestación, por lo que podemos decir que probablemente hemos comunicado el caso de diagnóstico más precoz de esta enfermedad en embarazadas.
Agradecimientos
Al Instituto Nacional de Higiene Rafael Rangel, por su colaboración en la confirmación de la identificación bacteriana.
A Anton Kryzanowsky por su amable ayuda en la elaboración del abstract.
A Juan Ernesto Ludert por sus recomendaciones en la elaboración de este artículo.
Referencias
1. Murray PR, Baron EJO, Pfaller MA, Tenover FE, Yolken RH. Manual of Clinical Microbiology. 7th ed. Washington D.C.: ASV; 1999. [ Links ]
2. Koneman EW, Allen SD, Janda WM, Schreckenberger PC, Win WC (h). Diagnóstico Microbiológico. 5ª ed. Buenos Aires: Editorial Panamericana; 1999. [ Links ]
3. Rocourt J, Boerlin P, Grimont F, Jacques C, Piffaretti J. Assigment of Listeria grayi and Listeria murrayi to a single species, Listeria grayi. Int J Sist Bacteriol. 1992;42:171-4. [ Links ]
4. Schuchat A, Broome CV. Infecciones causadas por Listeria monocytogenes. En: Harrison: Principios de Medicina Interna. 15ª Ed.: Ediciones Interamericanas-McGraw Hill; 2002. pp 1083-6. [ Links ]
5. Murray EGD, Webb Ra, Swann MBR. A disease of rabbits characterized by a large mononuclear leucocytosis, caused by a hitherto undescribed bacillus: Bacterium monocytogenes (n.s.p.). J Pathol. 1926;29:407. [ Links ]
6. Cisternas A, Lagos N, Galstuch J, González C, García C, Días J. Infección por Listeria monocytogenes y embarazo con buen resultado perinatal. Rev Chil Obstet Ginecol. 2002;67:237-41. [ Links ]
7. Huang Y, Chen S, Wu M, Chen C, Hsieh W, Tsao B, Horno C, Hsueh P. Molecular evidence for vertical transmission of listeriosis, Taiwan. J Med Microbiol. 2006;55:1601-3. [ Links ]
8. Gupta V, Gautam V, Mehta N, Kumari I, John RM. Listeriosis in second trimester of pregnancy: case report from India. Yon J Infect Dis. 2003;56:60-1. [ Links ]
9. Siegman-Igra Y, Levin R, Weinberger M, Golan Y, Schwartz D, Samra Z, et al. Listeria monocytogenes infection in Israel and review of cases worlwide. Emerg Infect Dis. 2002; 8: 305-10. [ Links ]
10. Abarca K. Infecciones en la mujer embarazada transmisibles al feto. Rev Chil Infect. 2003;20(Supl 1):S41-6. [ Links ]
11. Bell C, Kyariade A. Listeria, una aproximación práctica al microorganismo y su control en los alimentos. 1ª ed. España: Editorial Acribia; 1998. [ Links ]
12. Gellin BG, Broome CV. Listeriosis. JAMA. 1989;261:1313- 20. [ Links ]
13. Jamieson DJ, Theiler RN, Rasmussen SA. Emerging infections and pregnancy. Emerg Infect Dis. 2006;12:1638-43. [ Links ]
14. Smith JL. Food borne infections during pregnancy. J Food Prot. 1999;62:818-29. [ Links ]
15. Yildiz O, Aygen B, Esel D, Kayabas U, Alp E, Sumerjan B, Doganay M. Sepsis and meningitis due to Listeria monocytogenes. Yonsei Med J. 2007;48:433-9. [ Links ]
16. Mylonakis E, Paliou M, Hohmann EL, Calderwood SB, Wing EJ. Listeriosis during pregnancy: a case series and review of 222 cases. Medicine. 2002; 81:260-9. [ Links ]
17. Ogunmodede F, Jones J, Scheftel J, Kirkland E, Schulkin J, Lynfield R. Listeriosis prevention knowledge among pregnant women in the USA. Infec Dis Obst Gynecol. 2005;13:11-5. [ Links ]
18. Gallardo A, Pineda Y, Méndez F. Aislamiento de Listeria monocytogenes en búfalo (Bubalis bubalis). Veterinaria Tropical. 1989;14:29-35. [ Links ]
19. Martínez R, Villalobos L. Aislamiento de Listeria monocytogenes en atún fresco expedido en la ciudad de Cumaná, Venezuela. Rev Cient LUZ. 2004;XIV:354-7. [ Links ]
20. Villalobos L. Identificación por métodos convencionales, PCR y su sceptibilidad a antimicrobianos de Listeria monocytogenes procedentes de quesos frescos comercializados en Cumaná, Venezuela. Trabajo de Ascenso. UDO. 2005. pp115. [ Links ]
21. Villalobos L, Martínez R. Susceptibilidad antimicrobiana de Listeria spp. aisladas de alimentos durante el periodo 2003- 2004. Cumaná, Venezuela. Rev Soc Ven Microbiol 2006;26:31-4. [ Links ]
22. Guellin, BG, Broome CV, Bibb WF, Weaver RE, Gaventa S, Mascola L. The epidemiology of listeriosis in the United States-1986. Listeriosis Study Group. Am J Epidemiol. 1991;133:392-401. [ Links ]
23. Voetsch AC, Angulo FJ, Jones TF, Moore MR, Nadon C, McCarthy, et al. Reduction in the incidente of invasive listeriosis in Foodborne Diseases Active Surveillance Network Sites, 1996-2003. CID. 2007;44:513-20. [ Links ]
24. McLauchin J. Human listeriosis in Britain, 1967-85, a summary of 722 cases. 1. Listeriosis during pregnancy and in the newborn. Epidemiol Infect. 1990;104:181-9. [ Links ]
25. Bakardjiev AI, Theriot JA, Portnoy DA. Listeria monocytogenes traffics from maternal organs to the placenta and back. PLoS Pathog. 2006;2:0623-0631. [ Links ]
26. Dox I, Melloni BJ, Eisner GM. Diccionario Médico Ilustrado de Melloni. 2th ed. Barcelona: Editorial Reverté, S.A.; 1983. [ Links ]
27. Sirry HW, George RH, Wittle MJ. Meningoencephalitis due to Listeria monocytogenes in pregnancy. Br J Obstet Gynaecol. 1996;334:1083-4. [ Links ]
28. Charpentier E, Gerbaut G, Jacquet C, Rocourt J, Courvalin P. Incidence antibiotic resistance in Listeria spp. J Infect Dis. 1995;172:277-81. [ Links ]
29. Rock JA, Thompson JD. Ginecología Quirúrgica. 8va ed. Buenos Aires: Editorial Médica Panamericana; 1998. [ Links ]
30. Charpentier E, Courvalin P. Antibiotic resistente in Listeria spp. Antimic Agents Chem. 1999;43:2103-08. [ Links ]
31. Sepúlveda-Bajo C, Oncala-Sibajas E, Guerrero-Méndez Y, Gálvez-Acebal J. Síndrome de distrés respiratorio agudo asociado a listeriosis del embarazo. Enferm Infecc Microbiol Clin. 2005;23:633-8. [ Links ]
32. Herrera M, Contreras P. Listeriosis y embarazo. Rev Chil Obstet Ginecol. 1994;59:219-23. [ Links ]
33. Fanta E. Modalidad clínica de meningitis bacteriana aguda en recién nacidos. Pediatría al Día. 1995;11:140-43. [ Links ]












 uBio
uBio