Revista de la Sociedad Venezolana de Microbiología
versão impressa ISSN 1315-2556
Rev. Soc. Ven. Microbiol. v.29 n.2 Caracas dez. 2009
Clasificación e identificación de especies de actinomicetos: Un estudio fenotípico comparativo
Mayela Uzcátegui-Negróna,*, José Antonio Serranoa, Patrick Boironb, Verónica Rodríguez-Navab, Andrée Coubleb, Delphine Moniéeb, Karina Sánchez Herrerac, Horacio Sandovalc, Vera Reviakinad, María Mercedes Panizod, Mireya Mendozae
a Universidad de los Andes, Venezuela. * Correspondencia: E-mail: mayela_uzcategui@yahoo.es
b Universidad Claude Bernard Lyon 1, Francia.
c Universidad Autónoma Metropolitana-Xochimilco, México.
d Instituto Nacional de Higiene Rafael Rangel, Venezuela.
e Instituto de Biomedicina, Venezuela.
Resumen:
Las pruebas fisiológicas y bioquímicas constituyen dos de las principales metodologías utilizadas, principalmente en los laboratorios de microbiología, para la identificación y diferenciación de los actinomicetos. La finalidad de este trabajo fue comparar y evaluar los métodos fenotípicos que son utilizados de manera rutinaria en la identificación de estos microorganismos. Se estudiaron setenta y tres cepas de actinomicetos provenientes de tres laboratorios de microbiología de Venezuela. El comportamiento fisiológico y bioquímico de las cepas en estudio fue evaluado mediante pruebas de descomposición de diferentes sustratos. Los resultados obtenidos permitieron observar diferencias en la identificación preliminar de las cepas realizada por estos laboratorios, conduciendo algunas veces a una nueva identificación de las mismas, gracias a la utilización de estos sustratos. Se pudo observar que la metodología empleada permitió la reclasificación taxonómica de casi todas las cepas estudiadas, lo que sugiere que es necesario estandarizar la metodología de identificación para los actinomicetos.
Palabras clave: pruebas fenotípicas, actinomicetos, Nocardia, identificación
Classification and identification of Actinomyces species: A comparative phenotype study
Abstract:
Physiologic and biochemical tests constitute two of the main methodologies, mainly used in microbiology laboratories, for the identification and differentiation of actinomyces. The purpose of this work was to compare and evaluate the phenotypic methods used routinely for the identification of these microorganisms. The study included seventy three actinomyces strains from three microbiology laboratories in Venezuela. The physiologic and biochemical behavior of the strains was evaluated through decomposition tests using different substrates. The results obtained showed differences in the preliminary identification of the strains done in the various laboratories, leading occasionally to a new identification arisen from the use of these substrates. It was seen that with the methods used it was possible to taxonomically reclassify almost all the strains studied, suggesting that it is necessary to standardize the methods for the identification of actinomyces.
Keywords: phenotype tests, actinomyces, Nocardia, identification
Recibido 12 de junio de 2009; aceptado 3 de septiembre de 2009
Introducción
Los actinomicetos son bacterias aeróbicas, grampositivas, filamentosas y parcialmente ácido resistentes, ampliamente distribuidas en el suelo, así como también en otros ambientes naturales del mundo. Inicialmente fueron clasificadas como hongos pero, debido a los estudios de los componentes de su pared celular, se reclasificaron dentro del orden de los Actinomycetales. En este orden se encuentran agrupadas las especies del género Nocardia, quienes se caracterizan por presentar células coco-bacilares a partir de las cuales se desarrollan las formas filamentosas. [1].
Las nocardias son bacterias endémicas en algunos nichos ecológicos que se encuentran en zonas tropicales y subtropicales, mientras que son poco frecuentes en las zonas templadas o frías [2]. Ciertas especies de nocardias tienen gran importancia clínica como agentes patógenos para el hombre y los animales. Las infecciones causadas por estos microorganismos se pueden producir por la inhalación de estas bacterias y/o por inoculación, debida a traumatismos con espinas de plantas (principalmente cactáceas) o astillas de madera contaminadas presentes en el suelo [3]. Cuando se establece la infección por estos microorganismos, la misma puede ser de tipo cutáneo o subcutáneo (actinomicetoma), o de tipo diseminado (nocardiosis). Estas infecciones por lo general afectan a personas inmunodeprimidas, aunque no se descartan otros factores de riesgo adicionales como son la exposición frecuente al contacto con el suelo, principalmente durante la realización de actividades agrícolas sin la adecuada protección de la piel [2,4,5].
En Venezuela se ha observado una frecuencia relativamente elevada de infecciones causadas por nocardias, principalmente actinomicetomas [5]. Estos casos se han reportado sobre todo en las regiones centro-occidental, central y zuliana (97,1 %) y en la región de los Andes (2,9 %) [5]. En la mayoría de los laboratorios de microbiología no especializados, la identificación a nivel de género es posible utilizando las pruebas convencionales de identificación ya establecidas por diferentes autores, basadas en los estudios de morfología y pruebas fisiológicas y bioquímicas [6]. También han sido utilizados los perfiles de sensibilidad a antibióticos (tipos I, II, III, IV, V y VI) para la diferenciación de estas especies [7].
Este género ha sufrido importantes cambios taxonómicos, debido a la realización de estudios moleculares que han demostrado una gran heterogeneidad entre sus especies [8]. La identificación a través de métodos convencionales se dificulta a la hora de separar ciertas especies como Nocardia nova, N. farcinica, N. abscessus (anteriormente llamada N. asteroides tipo I) y N. cyriacigeorgica (anteriormente llamada N. asteroides tipo IV) debido a la similitud que existe entre ellas, por lo que se deben establecer otros criterios adicionales que contribuyan a su separación. Otros parámetros han sido propuestos para la identificación de estas especies, como el crecimiento a 45°C, la actividad de arilsulfatasa y la opacidad de medios, entre otras [7]. El estudio de las características enzimáticas, ofrece una herramienta útil para la identificación, pero estas pruebas a menudo no se encuentran disponibles de manera rutinaria en los laboratorios de microbiología [9]. También se han empleado sistemas comerciales para la identificación de especies de actinomicetos, que se basan en pruebas de asimilación de substratos, pruebas enzimáticas y susceptibilidad a antibióticos, no obstante, estos sistemas no se utilizan como metodología tradicional y su incorporación en los laboratorios para el diagnóstico de estos microorganismos suele ser costosa [10-12].
Las pruebas fenotípicas convencionales que pueden ser utilizadas rutinariamente para identificar las principales especies de microorganismos responsables de la nocardiosis y del actinomicetoma (N. asteroides, N. brasiliensis y N. otitidiscaviarum) se basan en la observación de las características morfológicas macroscópicas de las colonias en los diferentes medios de cultivo, observación de morfología microscópica con las tinciones de Gram y Kinyoun y la descomposición de algunos sustratos específicos, tales como adenina, xantina, caseína, hipoxantina, testosterona, tirosina y urea [13]. Es importante mencionar que el cultivo, y la utilización de las pruebas anteriormente nombradas aun constituyen parámetros útiles y primordiales a nivel bacteriológico para la identificación de las nocardias. Sin embargo, la correcta identificación de estos microorganismos va a depender del establecimiento de una metodología adecuada de diagnóstico, basada en la preparación y utilización de múltiples pruebas de identificación que no se encuentran disponibles a nivel comercial y que generalmente son de difícil interpretación si el personal no está familiarizado y entrenado para esta tarea. Por otra parte, su crecimiento relativamente lento y la gran similitud morfológica y fisiológica que pueden presentar algunas de las especies de este género dificultan aún más la identificación [14,15].
Debido a lo anteriormente expuesto, el objetivo de este estudio fue comparar y evaluar los métodos fenotípicos clásicos utilizados de manera rutinaria en el laboratorio para la identificación de los actinomicetos, particularmente los del género Nocardia.
Materiales y métodos
El presente trabajo se basó en el estudio de 73 cepas de actinomicetos provenientes de las colecciones de cultivos de tres laboratorios de Venezuela: Laboratorio de Ultraestructura de Actinomicetos Patógenos y del Suelo de la Universidad de los Andes (Laboratorio 1), Micoteca del Departamento de Micología del Instituto Nacional de Higiene Rafael Rangel (Laboratorio 2) y Laboratorio de Micología del Instituto de Biomedicina (Laboratorio 3).
Se estudiaron 35 cepas procedentes del laboratorio 1; los criterios fisiológicos utilizados por este laboratorio para la identificación preliminar de las cepas fueron la degradación de caseína, hipoxantina, tirosina y xantina. Del laboratorio 2 se tomaron para este estudio 34 cepas y las pruebas fisiológicas que fueron utilizados para caracterizar estas especies fueron: urea, caseína, tirosina y xantina. Del laboratorio 3 se recibieron para este estudio 4 cepas y no se obtuvo información sobre la metodología de identificación utilizada.
Para realizar la comparación entre las pruebas usadas para la identificación de los actinomicetos, en este trabajo se utilizó el procedimiento elaborado por el laboratorio del Observatorio Francés de Nocardiosis (OFN), ubicado en la Facultad de Farmacia de la Universidad Claude Bernard de Lyon, Francia, utilizando el esquema de identificación descrito en el Manual de Métodos de Laboratorio para el Diagnóstico de la Nocardiosis, el cual emplea criterios fenotípicos y fisiológicos similares a los utilizados en los laboratorios 1 y 2 con algunas modificaciones [15]. Se utilizaron tanto substratos convencionales como especiales, por medio de los cuales se verificó la identificación y/o se realizó la reclasificación de las cepas pertenecientes al género Nocardia.
Todas las cepas fueron subcultivadas en agar Bennett (ácido casamino 2 g/L, extracto de levadura 1 g/L, extracto de carne 1 g/L, glucosa 10 g/L y agar 15 g/L) [14]. El medio de cultivo se incubó hasta lograr abundante crecimiento de los microorganismos. Cada uno de los substratos que se utilizaron fueron elaborados de forma artesanal, empleando como medio de cultivo base el agar Glucose Yeast-Extract (GYEA). Todos fueron esterilizados por el método de tindalización, procedimiento que consistió en tres tratamientos a temperatura de 100 °C por 30 minutos intercalados con intervalos de tiempo a temperatura ambiente.
El comportamiento bioquímico de cada una de las cepas fue estudiado según sus propiedades de descomposición de los siguientes sustratos: caseína al 11%, adenina, ácido úrico y tirosina al 5%, hipoxantina y xantina al 4%, y testosterona al 1%; todos los substratos fueron preparados en concentraciones peso/volumen [15]. Las cepas fueron sembradas en cada substrato y luego se incubaron por dos semanas a 37 °C. Para la lectura e interpretación de los resultados se realizaron observaciones después de 48 horas de incubación, donde la descomposición de cada substrato en particular se observó mediante el aclaramiento del medio alrededor de la colonia, considerándose así la prueba positiva.
Los patrones de descomposición para cada uno de los substratos utilizados por las principales especies de Nocardia se presentan en la tabla 1, la cual fue utilizada como referencia para realizar este estudio de identificación, siguiendo el protocolo propuesto por Boiron et al [14].
Resultados
La distribución general de las cepas utilizadas en este estudio, identificadas por medio de las pruebas de descomposición de substratos particulares, fue la siguiente: complejo N. asteroides: 39 (53,4%); N. brasiliensis: 12 (16,4%); N. otitidiscaviarum: 14 (19,2%) y cepas no identificadas: 8 (11%), para un total de 73 cepas.
El estudio morfológico macroscópico de las colonias en agar Bennett permitió observar las siguientes características relacionadas con el color: predominio de colonias de color beige 12 de 73 (16,4%); colonias color salmón: 14 de 73 (19,2 %) y colonias de color blanco: 39 de 73 (53,4 %). En relación a su aspecto macroscópico se obtuvieron los siguientes resultados: colonias de aspecto céreo y secas: 23 de 73 (31,5%) y de consistencia cartilaginosa, recubierta de hifas aéreas y con aspecto pulverulento tipo tiza: 50 de 73 (68,5%). El crecimiento de la mayoría de las colonias se presentó en la superficie del agar. Todas las cepas fueron grampositivas, observándose formas de cocos y/o bacilos, así como filamentos. Los patrones fisiológicos particulares de las 73 cepas estudiadas se presentan en la tabla 2. Algunas de las cepas enviadas por los laboratorios pertenecían a los géneros Rhodococcus y Actinomadura, sin embargo para este estudio finalmente sólo se consideraron las del género Nocardia.
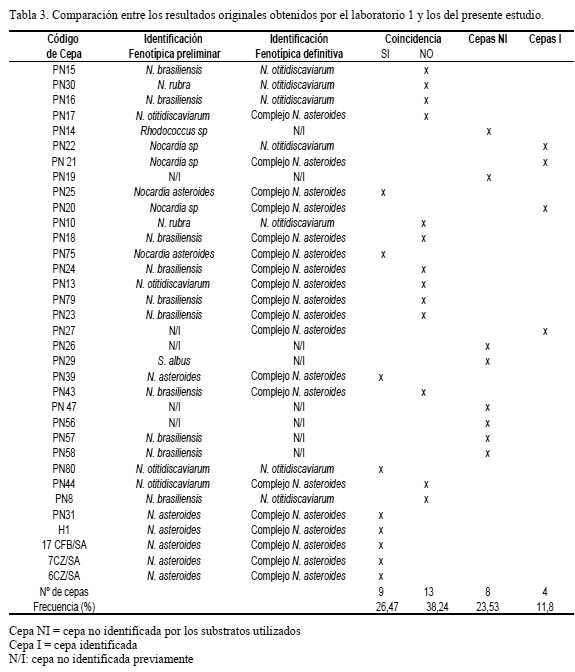
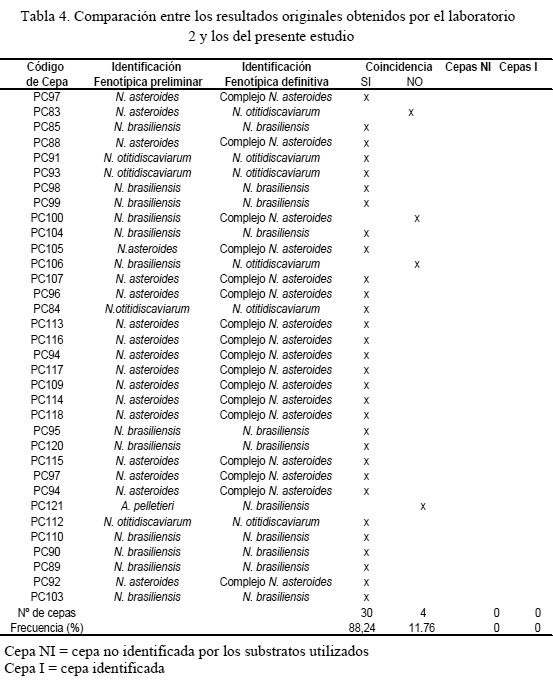
En las tablas 3, 4 y 5 se presentan, de manera individual por cada laboratorio, el grado de concordancia que existió entre la identificación preliminar de las cepas y la identificación posterior realizada en este estudio. En el caso del laboratorio 1 (35 cepas), sólo 9 de las cepas (26,7%) coincidieron con la identificación, 13 cepas (38,2%) no coincidieron y 8 cepas (23,5%) no pudieron ser identificadas, mientras que 4 cepas (11,8%) que no poseían identificación inicial pudieron ser clasificadas por género y especie (Tabla 3). En el caso de las cepas provenientes del laboratorio 2 (34 cepas), al ser nuevamente identificadas aplicando la metodología planteada en este estudio, se observó coincidencia en la mayoría de las identificaciones proporcionadas previamente: 30 cepas (88,2 %) presentaron el mismo patrón de descomposición para los sustratos xantina, caseína y tirosina, 4 cepas (11,8 %) no correspondieron con la identificación original y no se enviaron cepas sin identificación previa (Tabla 4). Todos las cepas que provenían del laboratorio 3 (4 cepas) fueron identificadas como especies distintas, no coincidiendo ninguna con la identificación inicial (Tabla 5), presentando patrones de degradación de sustratos muy diferente al esquema de identificación original. El porcentaje más alto de concordancia lo obtuvo el laboratorio 2 (88,2 %), seguido del laboratorio 1, mientras que el laboratorio 3 no presentó ninguna concordancia. La metodología empleada en este estudio permitió la reclasificación taxonómica de casi todas las cepas estudiadas.
Discusión
Los resultados de este estudio son comparables a los descritos por otros autores, quienes en la evaluación de un gran número de aislados pertenecientes al género Nocardia han subrayado la dificultad que se presenta al momento de identificar las principales especies de este género. En la metodología utilizada para realizar la identificación de estos microorganismos se incluyen la observación macroscópica y microscópica de las colonias, así como la combinación de múltiples pruebas fisiológicas, que pueden ser útiles para la discriminación a nivel de especie. Todas las cepas valoradas en este estudio presentaron características sugestivas del género Nocardia y las diferentes especies obtenidas presentaron un comportamiento fisiológico consistente a lo reportado en otros estudios [11,13,14].
En general, en las cepas enviadas por los tres laboratorios, identificadas posteriormente con la utilización de los sustratos particulares planteados en este estudio, predominaron las especies pertenecientes al complejo N. asteroides (55,8 %). Las pruebas fenotípicas clásicas no permiten diferenciar la mayoría de estas especies de Nocardia, (N. asteroides, N. farcinica y N. nova), sin embargo siguen siendo útiles para establecer una aproximación taxonómica y lograr un diagnóstico presuntivo de las especies de este género [13-15]. Otra especie que se identificó con una frecuencia importante fue N. otitidiscaviarum (20,6 %), mientras que N. brasiliensis no fue identificada en este grupo de cepas; esto llama poderosamente la atención, ya que en Venezuela el actinomicetoma es principalmente causado por N. brasiliensis y menos frecuentemente por N. otitidiscaviarum [2,4,5]. Durante la realización de este trabajo, algunas de las especies que venían clasificadas previamente como N. brasiliensis no correspondieron a esta clasificación, ya que presentaron un patrón de asimilación de substratos específico para N. otitidiscaviarum (caseína negativa y todos los demás substratos probados positivos) al ser identificadas nuevamente mediante las pruebas utilizadas en este estudio. Otra cepa identificada como Actinomadura pelletieri presentó un patrón de descomposición específico de N. brasiliensis. Si bien, Actinomadura se asemeja a Nocardia en muchas de sus características de cultivo, difieren en que forman un micelio aéreo especializado que produce esporas frecuentemente en cadenas, en lugar de un micelio vegetativo que se fragmenta. Al mismo tiempo es importante mencionar que esta especie también se presenta como agente etiológico del actinomicetoma en regiones de Venezuela [2,5].
La concordancia más elevada entre la identificación preliminar y la obtenida posteriormente en este estudio la obtuvo el laboratorio 2 (88,2%), el cual utilizó 3 substratos en la identificación preliminar de las cepas (caseína, tirosina y xantina). El laboratorio 1, utilizando 4 de los substra
tos (caseína, xantina, hipoxantina y tirosina), sólo logró una concordancia de 26,7% (9 cepas). Las diferencias obtenidas en el proceso de identificación pudieron deberse a errores de interpretación al momento de realizar la lectura de las pruebas de descomposición de substratos, ya que son pruebas difíciles de interpretar. Según los resultados de este estudio, las mayores dificultades se presentaron sobre todo en la identificación de N. otitidiscaviarum. No hubo concordancia en la identificación fenotípica de las 4 cepas que provenían del laboratorio 3, y la información sobre las pruebas utilizadas en la identificación preliminar no estuvo disponible.
Es importante señalar que todas las cepas utilizadas en este estudio provienen de colecciones de cultivo; han sido conservadas durante un tiempo prolongado, lo que puede influenciar el resultado de las pruebas de identificación, sumado a que probablemente no se les realizó la actualización taxonómica según las directrices propuestas actualmente. Por otra parte, si estas cepas son manipuladas con frecuencia corren el riesgo de contaminarse, afectando negativamente su identificación posterior. Se recomienda que, una vez que las cepas sean aisladas y purificadas, se conserven según los procedimientos adecuados. Finalmente, la metodología empleada en este estudio permitió la reclasificación taxonómica de casi todas las cepas estudiadas, lo que sugiere que es necesario estandarizar la metodología de identificación para los actinomicetos. Se consideró que el proceso de identificación mejoró muchísimo cuando, además de los estudios morfológicos se realizaron estudios fisiológicos convencionales, utilizando los substratos adenina, hipoxantina, xantina, ácido úrico, testosterona, tirosina y caseína, elaborados bajo las condiciones de preparación y esterilización antes descritas, los cuales mejoraron la calidad de cada substrato, asegurando así su degradación por parte de la bacteria.
Dada la importancia de contar con una adecuada identificación de los miembros del género Nocardia, se recomienda la utilización de las pruebas fenotípicas utilizadas en este estudio para identificar y/o confirmar la taxonomía de los mismos, así como promover la capacitación del personal que se encarga de realizar estas tareas en el laboratorio.
Es necesario establecer un sistema único que describa los procedimientos de aislamiento e identificación de las principales especies de Nocardia, ya que tienen estrecha relación con la calidad de la preparación de los substratos utilizados. Esto evitará problemas de identificación importantes que podrían afectar posteriormente el conocimiento del impacto clínico y microbiológico que tienen estas especies en nuestro país. Lo que se pretende es mejorar la calidad del diagnóstico. Por otra parte, en caso de presentarse dificultades en la identificación, se debe contar con la ayuda de un laboratorio de referencia, el cual contribuya a la mejora continua de la calidad del diagnóstico y aporte respaldo a los resultados obtenidos.
Agradecimientos
A los laboratorios participantes se les agradece su valiosa colaboración al proveer las cepas para la realización de este estudio. Agradecemos al convenio ECOS-Nord Nº V06S01 (Francia-Venezuela, ULA-FONACIT). Un reconocimiento especial para el personal del laboratorio del Observatorio Francés de Nocardiosis de Lyon, Francia, por su gran colaboración en todo momento, desde el inicio de este trabajo.
Referencias
1. McNeil MM, Brown JM. The medically important aerobic actinomycetes: epidemiology and microbiology. Clin Microbiol Rev. 1994; 7: 357-417. [ Links ]
2. Serrano JA, Sandoval AH. El micetoma. Rev Soc Ven Microbiol. 2003; 23: 70-9. [ Links ]
3. Khan ZU, Neil R, Chandy TD, Chung H, Sayer AL, Provost F, Boiron P. Nocardia asteroides in the soil of Kuwait. Mycopathología. 1997; 137: 159-63. [ Links ]
4. Joshi KR, Solanki A, Joshi YR. Mycetoma. India: Agrobios Ed.; 2000. [ Links ]
5. Serrano JA, Sandoval AH, Beaman BL. Actinomicetoma. México: Editorial Plaza y Valdés, S.A.; 2007. [ Links ]
6. Lechevalier MP, Lechevalier H. Chemotaxonomy of aerobic actinomycetes: phospolipid composition. Biochem Syst Ecol. 1997; 5: 249-60. [ Links ]
7. Wallace RJ, Steele L, Sumter G, Smith JM. Antimicrobial susceptibility patterns of Nocardia asteroides. Antimicrob Agents Chemother. 1988; 32: 1776-9. [ Links ]
8. Yassin AF, Rainey FA, Steiner U. Nocardia cyriacigeorgica sp. nov. Int J Syst Evol Microbiol. 2001; 51: 1419-23. [ Links ]
9. Saubolle MA, Sussland D. Nocardiosis: review of clinical and laboratory experience. J Clin Microbiol. 2003; 41: 4497-501. [ Links ]
10. Boiron P, Provost F. Enzymatic characterization of Nocardia spp. and related bacteria by API ZYM profile. Mycopathologia. 1990; 110: 51-6. [ Links ]
11. Muñoz J, Mirelis B, Aragón LM, Gutierrez N, Sánchez F, Español M, Esparcia O, Turquí M Domingo P, Coll P. Clinical and microbiological features of nocardiosis 1997-2003. J Med Microbiol. 2007; 56: 545-50. [ Links ]
12. Kiska DL, Hicks K, Pettit DL. Identification of medically relevant Nocardia species with an abbreviated battery of tests. J Clin Microbiol. 2002; 40: 1346-51. [ Links ]
13. Biehle JR, Cavalieri SJ, Felland T, Zimmer L. Novel method for rapid identification of Nocardia species by detection of preformed enzymes. J Clin Microbiol. 1996; 34: 103-7. [ Links ]
14. Boiron P, Provost F, Dupont B. Methods de Laboratoire pour le diagnostic de la Nocardiose. Technical protocols. Paris: Institut Pasteur; 1993. [ Links ]
15. Wauters G, Avesani V, Charlier J, Janssens M, Vaneechoutte M, Delmée M. Distribution of Nocardia species in clinical samples and their routine rapid identification in the laboratory. J Clin Microbiol. 2005; 43: 2624-8. [ Links ]












 uBio
uBio