Revista de la Sociedad Venezolana de Microbiología
versão impressa ISSN 1315-2556
Rev. Soc. Ven. Microbiol. v.29 n.2 Caracas dez. 2009
Actividad antifúngica de Burkholderia cepacia aislada de maíz amarillo (Zea mays L.) bajo diferentes condiciones de cultivo
Evis Parra González*, Sara Centeno Briceño, Yasmina Araque Calderón
Departamento de Bioanálisis, Escuela de Ciencias. Universidad de Oriente (UDO). Núcleo de Sucre. Cumaná, Venezuela. * Correspondencia: E-mail: eviespin@hotmail.com
Resumen:
Se evaluó la actividad antifúngica in vitro de 4 cepas de Burkholderia cepacia aisladas de rizósfera de maíz amarillo (Zea mays L.) de diferentes plantaciones del municipio Montes, estado Sucre, Venezuela, contra hongos fitopatógenos. Se comparó la actividad antagónica con una cepa control de origen ambiental CVCM 626 (ATCC 25416) y un aislado clínico CVCM 1282, empleando el método directo de enfrentamientos duales y un método indirecto de difusión con discos de agar. Las pruebas se realizaron por triplicado, se midió el diámetro de los halos de inhibición formados y se aplicó un análisis de varianza de una vía, así como la prueba Tukey. Las cuatro cepas aisladas (SR2, ER3, LG12 y N10) mostraron una actividad antifúngica similar sobre Trichoderma viride y ocasionaron una inhibición total o parcial de la esporulación en hongos como Fusarium moniliforme, Fusarium solani, Aspergillus niger y Penicillium expansum. Los mayores halos de inhibición fueron producidos por la cepa control CVCM 626, observándose un promedio de 9,9 mm. No se evidenció ningún nivel de antagonismo utilizando el aislado clínico CVCM 1282. B. cepacia mostró un aumento de la actividad antagónica en presencia de algunas fuentes de carbono como xilosa, maltosa, manosa y fructosa y de aminoácidos como cistina, valina y leucina, en un rango de pH ácido (4 a 5,5), y a una temperatura de 35 ºC.
Palabras clave: actividad antifúngica, Burkholderia cepacia, hongos fitopatógenos
Antifungal activity of Burkholderia cepacia isolated from yellow corn (Zea mays L.) under different culture conditions
Abstract:
The antifungal activity against phytophatogenic fungi of four Burkholderia cepacia strains isolated from yellow corn (Zea mays L.) from different plantations at the Montes Municipality, Sucre State, Venezuela, was evaluated in vitro. The antagonist activity was compared by using a control strain of environmental origin CVCM 626 (ATCC 25416) and one clinical isolate CVM 1282, with the direct dual confrontation method, and an indirect method with agar-diffusion disks. The tests were done in triplicate, measuring the inhibition halos that occurred, and applying a one way variance analysis, as well the Tukey test. The four isolated strains (SR2, ER3, LG12 and N10) showed similar antifungal activity over Trichoderma viride and produced a total or partial inhibition of sporulation of fungi such as Fusarium moniliforme, Fusarium solani, Aspergillus niger and Penicillium expansum. The largest inhibition halos were produced by the control strain CVCM 626, with a 9,9 mm average. There was no evidence of any antagonism level using the clinical isolate CVCM 1282. Burkholderia cepacia showed an increase of antagonist activity in presence of some carbon sources such as xilose, maltose, mannose, and fructose and of amino-acids such as cystine, valine and leucine, in an acid pH range (4 to 5.5), and a 35oC temperature.
Keywords: antifungal activity, Burkholderia cepacia, phytopathogenic fungi
Recibido 31 de marzo de 2009; aceptado 30 de septiembre de 2009
Introducción
El maíz, uno de los cereales más importantes en el mundo después del arroz y el trigo, es atacado por muchos patógenos que reducen la calidad y cantidad en la producción del grano. Las enfermedades causadas por hongos son la principal causa de pérdida de estos cultivos y algunos de ellos producen compuestos que son tóxicos tanto para las plantas como para los consumidores [1-3].
En Venezuela se ha encontrado una alta incidencia de Fusarium moniliforme en granos de híbridos de maíz, constituyendo uno de los problemas fitopatológicos de mayor importancia en la producción de este cereal, debido al daño que ocasionan en la planta y a la producción de metabolitos tóxicos como las fumonisinas, que afectan al grano [4].
Estas enfermedades son usualmente controladas por combinaciones de prácticas culturales, uso de fungicidas y la resistencia natural de la planta. Los fungicidas son la principal solución al control de la enfermedad fúngica, pero su uso es controversial, debido a los efectos ambientales indeseables que ocasionan. En las últimas décadas, muchos científicos han conducido sus investigaciones al desarrollo de nuevas prácticas alternativas que eviten los problemas ocasionados por el uso de pesticidas químicos. En este sentido ha surgido la utilización de microorganismos como posibles reemplazantes de los químicos para el control de un amplio rango de enfermedades en las plantas, ya que ellos pueden producir muchas sustancias químicas de origen lipoprotéico, polipéptidos, bacteriocinas y alcaloides con actividad antifúngica [5-11].
Burkholderia cepacia (anteriormente Pseudomonas cepacia) fue descrita originalmente en 1950 por William Burkholder, como agente causal de la podredumbre de los bulbos de la cebolla [12]. Este microorganismo se caracteriza por su gran versatilidad y capacidad de producir una variedad de interacciones complejas, como la degradación de compuestos aromáticos clorados, la protección y promoción del crecimiento de algunas plantas, y la infección en hombres y animales, sumado a la producción de enfermedades en las plantas [13-15].
En los últimos años, un gran número de especies han sido incluidas en el género Burkholderia [16]. Algunos de estos cambios involucraron a B. cepacia en estudios taxonómicos polifásicos que indicaron que las cepas identificadas fenotípicamente como B. cepacia representan un complejo de nueve especies genéticamente relacionadas, designadas como genomovars, y referidas como el complejo B. cepacia [17-19]. Desde el año 2004, mediante análisis de secuenciación del gen recA y otras técnicas de biología molecular como el análisis de secuencias en múltiples locus (Multilocus Sequence Typing, MLST por sus siglas en inglés), se han descrito siete nuevas especies [20-24] que aún no han sido incluidas formalmente en el complejo B. cepacia.
B. cepacia ha sido reconocida como una bacteria con gran potencial para el control biológico de hongos fitopatógenos [1,5,6]. La actividad inhibitoria de esta bacteria contra una variedad de microorganismos fitopatógenos ha sido atribuida a la producción de metabolitos secundarios como cepacina, pirrolnitrina, altericidina y otros compuestos volátiles y no volátiles aun no identificados [10,25-27]. Jayaswal et al. [28], sugirieron que la actividad antagónica de B. cepacia ante Trichoderma viride podría ser afectada por factores nutricionales debido a las diferencias observadas en el antagonismo al probarse en dos medios distintos: agar papa dextrosa (PDA) y agar harina de maíz (CMA).
En el presente estudio se describen los efectos de la variación de las condiciones nutricionales y ambientales sobre el antagonismo de cuatro cepas de B. cepacia (SB2, ER3, LG12 y N10), aisladas de rizósfera de maíz en diferentes plantaciones del Municipio Montes, estado Sucre, Venezuela, ante hongos como T. viride, Fusarium moniliforme, Fusarium solani y Aspergillus niger, que ocasionan daños a cultivos de maíz y otros cereales económicamente importantes, con el fin de demostrar como las variaciones de temperatura, pH, fuentes de carbono y nitrógeno en el cultivo de B. cepacia afectan la actividad antifúngica in vitro de la bacteria.
Materiales y métodos
Recolección de la muestra y aislamiento de B. cepacia: Las cepas de B. cepacia se aislaron de rizósfera de maíz amarillo (Zea mays L.) de diferentes plantaciones del Municipio Montes, estado Sucre, Venezuela. Los muestreos se realizaron siguiendo la técnica de recolección de muestras vegetales descrita por López R y López M [29]. El aislamiento se realizó siguiendo el método descrito por Di Cello et al. [30]. Se realizaron diluciones seriadas hasta 10-8 de suspensiones de rizósfera en solución salina fisiológica y luego se sembraron por agotamiento en superficie tomando 100 μl de cada dilución en placas de Petri que contenían medio de cultivo agar Luria-Bertani (LB) suplementado con polimixina B (600 U), agar base Burkholderia cepacia (Oxoid, England) suplementado con polimixina B (600 U), gentamicina 10 μg/ml, vancomicina 2,5 μg/ml, y agar MacConkey (Difco, USA); posteriormente se incubaron a 30 ºC durante 24 a 48 horas, verificándose las características morfológicas de las colonias como tamaño, forma, aspecto, color, olor y producción de pigmentos. También se le realizó extendido y coloración de Gram a las colonias aisladas para observar su morfología microscópica. A todos los medios se les adicionó cicloheximida al 1% para evitar el crecimiento de hongos.
Caracterización bioquímica e identificación de B. cepacia: Para la caracterización fenotípica de los aislados bacterianos se utilizaron las siguientes pruebas: oxidasa (tetramethyl p-phenylendiamine dihycloride 1%), utilización de lisina descarboxilasa, resistencia a la polimixina B y oxidación de azúcares (glucosa, sacarosa, lactosa y manitol al 1%) en medio oxidación- fermentación [9]. La caracterización definitiva del microorganismo se llevó a cabo a través del análisis de los resultados de las pruebas convencionales y los resultados obtenidos con las galerías API® 20NE (BioMérieux, Francia). Las cepas se identificaron debidamente de acuerdo a la zona de aislamiento de la manera siguiente: SB2, ER3, LG12, N10.
Cepas control: Se utilizaron una cepa certificada de origen ambiental: CVCM 626 (ATCC 25416) y un aislado de origen clínico: CVCM 1282, provenientes del Centro Venezolano de Colección de Microorganismos, con la finalidad de comparar la acción de estas cepas sobre los hongos. Todas las cepas de B. cepacia fueron mantenidas en caldo tripticasa soya (Difco) con glicerol al 15%.
Especies fúngicas: Las especies utilizadas en el ensayo: T. viride, F. moniliforme, P. expansum, F. solani y A. niger fueron donadas por el Laboratorio de Micología, Departamento de Bioanálisis, Escuela de Ciencias, Universidad de Oriente, y fueron mantenidos en tubos de agar papa dextrosa (PDA).
Preparación de las suspensiones del hongo fitopatógeno y de la bacteria antagonista: Los hongos a ensayar fueron cultivados previamente en agar papa dextrosa (PDA) y se incubaron por una semana a 30 °C. A cada uno de los tubos sembrados con los hongos fitopatógenos se añadieron 10 ml de agua destilada estéril, se agitaron vigorosamente y posteriormente se removieron los conidios. La concentración de conidios se ajustó a 1x106 conidios/ml, utilizando la técnica de recuento directo con hemocitómetro. Se inoculó 0,1 ml de cada una de estas suspensiones sobre placas de Petri, previamente servidas con medio M9 (Na2HPO4 6 g, KH2PO4 3 g, NaCl 0,5 g, NH4Cl 1 g, agar-agar 15 g, H2O destilada 1000 ml suplementado con glucosa 0,4%, MgSO4 1 mM, CaCl2 0,1 mM), y fueron esparcidas con una espátula de Drigalsky.
Se tomaron colonias del cultivo de cada bacteria antagónica con asa bacteriológica y se inocularon en solución salina fisiológica (0,85%) hasta una turbidez igual al patrón 0,5 de la escala de Mc Farland, con una concentración aproximada de 1,5x108 células/ml; posteriormente se sembraron sobre cápsulas de Petri previamente servidas con agar LB y esparcidas con hisopo estéril [31].
Determinación de la actividad antifúngica:
- Método directo: Se colocaron asadas de la suspensión de B. cepacia en el centro de las placas de Petri con agar M9, que fueron inoculadas previamente con la suspensión de conidios de cada uno de los hongos en toda la superficie de la placa. Se incubaron a temperatura ambiente durante 3 a 5 días. Luego se midió la zona de inhibición del crecimiento fúngico [32]. Las pruebas se realizaron por triplicado.
- Método indirecto: Se colocaron dos discos de agar LB de 6 mm de diámetro, con cultivos jóvenes de B. cepacia sobre las placas de agar M9 que contenían los cultivos fúngicos, uno haciendo contacto por la zona del desarrollo microbiano y otro por la zona del medio de cultivo. Las placas se incubaron a 30 ºC durante 3 a 5 días. Luego se midieron los halos inhibitorios producidos con un vernier manual de 0,1 mm de apreciación. Las pruebas se realizaron por triplicado [31]. Adicionalmente, se prepararon controles, colocando discos de agar sin cultivo bacteriano sobre los hongos a estudiar y se incubaron a temperatura ambiente durante 3 a 5 días. En caso de observar formación de halos de inhibición, se procedió a medir los halos de inhibición en las placas de cultivo. La eficiencia de las cepas bacterianas aisladas para inhibir hongos se determinó mediante la comparación de los halos de inhibición, usando análisis de varianza de una vía con un nivel de confianza del 95%, aplicando seguidamente la prueba de Tukey a los resultados que presentaron diferencias significativas [33].
Efecto de las condiciones de cultivo sobre la actividad antifúngica de B. cepacia: Para determinar el efecto de la temperatura y pH se utilizó agar M9 suplementado con glucosa (0,4%), vitamina B1 (1%), triptófano (20 μg/ml) y CaCl2 (0,1 M). Las placas fueron inoculadas con suspensiones de cada una de las cepas bacterianas a estudiar e incubadas a 18, 25, 30, 35 y 40 ºC. El efecto del pH en la producción de actividad antagónica de B. cepacia fue evaluado ajustando el pH del medio M9 suplementado al valor correspondiente entre 3,5 y 8,5, en intervalos de 0,5 unidades, empleando soluciones de ácido clorhídrico o hidróxido de sodio según fuese necesario. Para evaluar los efectos nutricionales se utilizaron los siguientes carbohidratos como única fuente de carbono: xilosa, fructosa, manosa, maltosa, sacarosa, glucosa y lactosa, los cuales fueron adicionados por separado al medio M9, hasta una concentración final de 0,2% p/v, en el cual se cultivaron las cepas de B. cepacia a una temperatura y pH constantes (30 ºC y 6,5 respectivamente). Como única fuente de nitrógeno se utilizaron los aminoácidos cisteína, valina, lisina, alanina, arginina y leucina, adicionados por separado al medio M9, hasta una concentración final de 0,1%, a temperatura y pH constantes (30 ºC y 6,5 respectivamente). Las placas fueron incubadas de 3 a 5 días. Posteriormente fue determinada la actividad antifúngica utilizando el método indirecto
Resultados
Actividad antifúngica de B. cepacia. Método directo: Las propiedades antifúngicas de las cepas de B. cepacia frente a varios hongos fitopatógenos importantes, determinadas por el método directo de enfrentamientos duales se muestran en la tabla 1. Las cuatro cepas de B. cepacia (SB2, ER3, LG12 y N10), aisladas de rizósfera de maíz, mostraron una actividad antifúngica similar, únicamente frente a T. viride, con zonas de inhibición promedio de 8,5; 8,8; 9,9 y 8,0 mm respectivamente, mientras que la mayor actividad se obtuvo con la cepa CVCM 626 (ATCC 25416), con un promedio de inhibición de 13,9 mm (p<0,05). Sin embargo, se observó que las cepas SB2, ER3, LG12 ocasionaron una inhibición parcial de la esporulación de F. solani y F. moniliforme y una inhibición total de la esporulación de A. niger y P. expansum, observándose la formación de micelio aéreo estéril.
Tabla 1. Diámetro promedio (mm) de los halos de inhibición producidos por las cepas de Burkholderia cepacia frente a hongos fitopatógenos mediante enfrentamiento dual (método directo). Período de incubación 72 horas.
|
| Diámetro de Inhibición (mm) | |||||
| SB2 | ER3 | LG12 | N10 | CVCM 626 | CVCM 1282 | |
| Trichoderma viride | 8,5 | 8,8 | 9,9 | 8,0 | 13,9 | 0 |
| Fusarium moniliforme | 0 | 0 | 0 | 0 | 0 | 0 |
| Fusarium solani | 0 | 0 | 0 | 0 | 3.0 | 0 |
| Aspergillus niger | 0 | 0 | 0 | 0 | 0 | 0 |
| Penicillium expansum | 0 | 0 | 0 | 0 | 0 | 0 |
Fusarium solani, no fue inhibido frente a las cepas SB2, ER3, LG12 y N10, pero sí fue inhibido por la cepa CVCM 626, con un halo de inhibición promedio de 3,0 mm. La cepa CVCM 1282, correspondiente a un aislado clínico, no demostró ningún tipo de antagonismo frente a los hongos fitopatógenos estudiados.
Actividad antifúngica de B. cepacia. Método indirecto: La tabla 2 muestra los promedios de los halos de inhibición producidos por las cepas de B. cepacia frente a los diferentes hongos, utilizando la técnica de discos de agar en medio LB con cultivo de B. cepacia de 18 a 24 horas. Se obtuvieron mayores halos de inhibición producidos por las cepas SB2, ER3, LG12, N10 y CVCM 626 frente a T. viride al colocar los discos de agar haciendo contacto con el medio de cultivo (Aa) encontrándose promedios de halos de inhibición de 10 mm; 9,9 mm; 10,3 mm; 8,9 mm y 14,8 mm respectivamente, en comparación con los promedios de halos de inhibición obtenidos a partir de los discos de agar con cepas de B. cepacia haciendo contacto directo con el microorganismo (Bb). En cambio, los halos de inhibición de la cepa CVCM 626 frente a F. solani fueron mayores utilizando discos de agar con cultivos de B. cepacia haciendo contacto directo con el microorganismo (Aa= 3,0 mm; Bb= 4,1 mm). La cepa CVCM 626 demostró una actividad antifúngica significativamente mayor que los aislamientos provenientes de maíz, con promedios de halos de inhibición de: Aa= 14,8 mm y Bb= 10,9 mm (p<0,05). Igualmente, se observó la formación de pequeños halos de inhibición en F. moniliforme por las cepas SB2, ER3, LG12 y N10 (2,0; 2,0; 2,6 y 2,4 mm, respectivamente) que no fueron observados con la cepa control CVCM 626.
Tabla 2. Diámetro promedio (mm) de los halos de inhibición producidos por las cepas de Burkholderia cepacia frente a hongos fitopatógenos mediante la técnica de discos de agar (medio LB). Período de incubación 72 horas (método indirecto).
|
| Diámetro de los halos de inhibición (mm) | |||||||||||
| SB2 | ER3 | LG12 | N10 | CVCM 626 | CVCM 1282 | |||||||
| Aa | Bb | Aa | Bb | Aa | Bb | Aa | Bb | Aa | Bb | Aa | Bb | |
| Trichoderma viride | 10 | 8,0 | 9,9 | 8,7 | 10,3 | 8,0 | 8,9 | 7,9 | 14,8 | 10,9 | 0 | 0 |
| Fusarium moniliforme | 0 | 2,0 | 0 | 2,0 | 0 | 2,6 | 0 | 2,4 | 0 | 0 | 0 | 0 |
| Fusarium solani | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 3,0 | 4,1 | 0 | 0 |
| Aspergillus niger | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 4,5 | 0 | 0 | 0 |
| Penicillium expansum | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
a Haciendo contacto con el medio de cultivo
b Haciendo contacto con el microorganismo
Debido a que el mayor efecto antagónico de las cepas de B. cepacia se demostró sobre T. viride, se utilizó sólo este hongo para los ensayos posteriores.
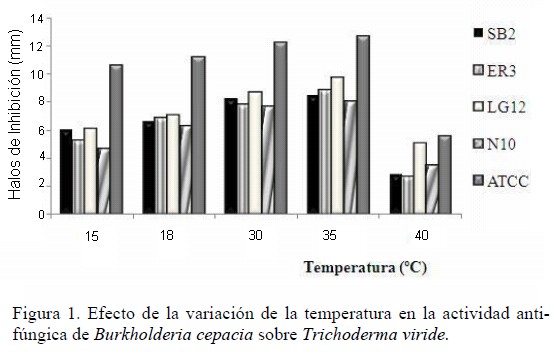
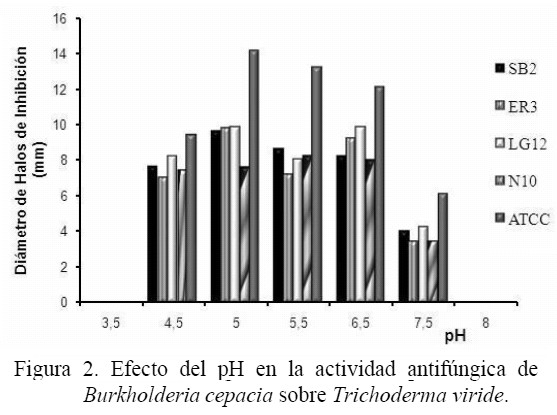
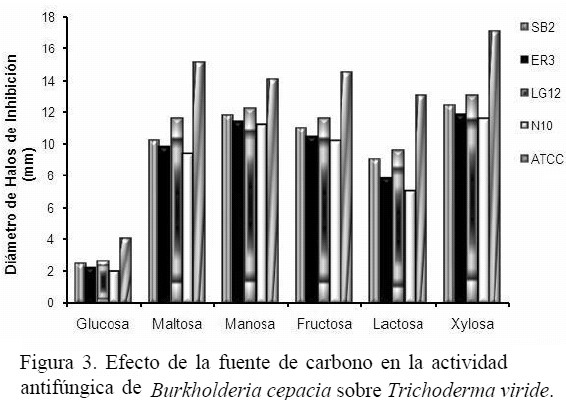
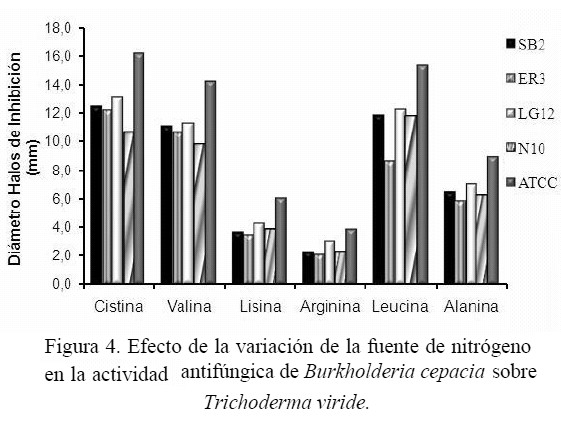
Efecto de las condiciones de cultivo sobre la actividad antifúngica: El efecto de la temperatura sobre la actividad antifúngica de las cepas de B. cepacia frente a T. viride se muestra en la figura 1, demostrándose que la actividad es dependiente de la temperatura de crecimiento de la bacteria. La mayor actividad antifúngica se obtuvo en un rango de temperatura de 18 a 35 ºC, obteniéndose el mayor efecto inhibitorio a 35 ºC en las cepas de B. cepacia CVCM 626, SB2, ER3, LG12 y N10 con 6,9; 7,0; 7,5 y 6,5 mm de inhibición respectivamente, mientras que a temperaturas menores o mayores de 35 ºC los halos de inhibición producidos por las bacterias contra T. viride fueron menores. La actividad antifúngica de B. cepacia también fue afectada por el cambio de pH (figura 2). Se observó actividad antifúngica en todas las cepas de B. cepacia en un rango de pH ácido (4,5 – 6,5). El máximo nivel de antagonismo se observó a pH 5, excepto con la cepa N10 que produjo el mayor antagonismo a pH 5,5. No se produjeron halos de inhibición a pH 8,0 y 8,5, sin embargo, hubo crecimiento de las cepas de B. cepacia y todas produjeron pigmentación, demostrándose que la producción o ausencia del pigmento extracelular por la bacteria no influyó en la actividad antagónica de la misma. No se observó crecimiento de las cepas de B. cepacia a pH 3,5 y 9,0. La figura 3 muestra que el efecto antagónico de las cepas SB2, ER3, LG12, N10 y CVCM 626 contra T. viride fue mayor en presencia de xilosa y maltosa como únicas fuentes de carbono, indicando que estos carbohidratos estimulan la producción de metabolitos antifúngicos de las cepas bacterianas, sin embargo, en presencia de glucosa y lactosa los halos de inhibición producidos por las bacterias contra T. viride fueron menores. La utilización de aminoácidos como única fuente de nitrógeno mostró variación en el nivel del antagonismo de las cepas de B. cepacia (figura 4), obteniéndose un aumento de los halos de inhibición producidos por todas las cepas bacterianas estudiadas en presencia de cisteína, leucina y valina.
Discusión
Investigaciones previas han demostrado la actividad antifúngica de B. cepacia frente a hongos fitopatógenos [10,34-37]. Esta propiedad ha determinado que los investigadores se interesen por esta bacteria como posible agente de control biológico, así como para inhibir el desarrollo de hongos patógenos humanos [37]. En la presente investigación se comprobó la actividad antagónica de B. cepacia contra los hongos fitopatógenos estudiados.
El mecanismo del antagonismo de B. cepacia frente a los hongos ha sido objeto de estudio por varios investigadores, quienes han sugerido hasta ahora tres mecanismos: 1) la producción de sideróforos; 2) la producción de antibióticos y 3) competencia por otros nutrientes [13-16].
Los resultados obtenidos en este estudio evidencian que las cepas pertenecientes al complejo B. cepacia, aisladas de rizósfera de maíz (SB2, ER3, LG12, N10), así como la cepa CVCM 626, inhibieron el crecimiento de hongos fitopatógenos como T. viride por la producción de compuestos antifúngicos difusibles en el medio, observándose una mayor actividad antifúngica cuando se utilizaron discos de agar con cultivo de B. cepacia haciendo contacto con el medio de cultivo. Probablemente la producción de sideróforos no esté implicada en el antagonismo de las cepas bacterianas, ya que no se observó asociación entre la presencia de los halos de inhibición y la pigmentación de las mismas.
Estos resultados son similares a los reportados por Jayaswal et al. [1], quienes aislaron una cepa de B. cepacia (RJ3) productora de una sustancia inhibitoria difusible con actividad antifúngica frente a hongos fitopatógenos, la cual fue purificada por cromatografía de alta eficiencia (HPLC) y caracterizada por resonancia magnética nuclear y espectroscopía infrarroja, de luz ultravioleta y de masa como pirrolnitrina. Quan et al. [27] aislaron y caracterizaron una nueva cepa de B. cepacia (CF-66) con una gran actividad inhibitoria sobre el hongo fitopatógeno Rhizoctonia solani por producción de compuestos antifúngicos. Igualmente, Araque et al. [36] comprobaron la actividad antifúngica de unos aislados nosocomiales de B. cepacia frente a hongos de ambientes hospitalarios atribuida a la producción de sustancias extracelulares por parte de la bacteria.
La producción de compuestos antifúngicos ha sido considerada como uno de los mecanismos involucrados en el antagonismo de B. cepacia [10]. Este microorganismo produce una gran cantidad de antibióticos, los cuales poseen actividad antifúngica, como cepacidina A, cepacidina B, xilocandina y pirrolnitrina [34-37]. Sin embargo, estos compuestos no han sido muy utilizados en la agricultura debido a su limitado espectro antifúngico y estabilidad.
Existen diversos reportes en los que la industria agrícola considera a B. cepacia como un posible agente de control biológico [31,35,38]. B. cepacia puede antagonizar y reprimir muchos patógenos de plantas; se le ha encontrado inhibiendo la germinación de esporas de Alternaria sp., y atacando al hongo Aphanomyces euteiches, el cual causa la podredumbre de raíces de guisantes y alfalfa [39].
Cuando se ensayó la actividad antagónica utilizando cultivo de B. cepacia frente a F. solani, F. moniliforme, A. niger y P. expansum, no se obtuvo inhibición del crecimiento de estos hongos; sólo inhibió el crecimiento de T. viride. Las diferencias observadas entre estos hongos filamentosos frente a la misma cepa bacteriana pueden indicar la utilización de diferentes mecanismos en la elaboración de los compuestos antifúngicos producidos por las bacterias, debido a la existencia de diferencias metabólicas y bioquímicas entre estos hongos. Estos resultados podrían indicar que dichos compuestos actúan sobre sustancias químicas (enzimas) indispensables de T. viride, mientras que para F. solani, F. moniliforme, A. niger y P. expansum se proponen las siguientes alternativas: (i) carecen de estas enzimas, (ii) poseen rutas alternativas que evitan el bloqueo enzimático o bien, (iii) transforman estas sustancias a otras formas que no le sean tóxicas [40,41].
Las variaciones en los factores nutricionales y ambientales de la bacteria a menudo resultan en la alteración de la producción de antibióticos. La alteración involucra cambios tanto en la producción como en la composición del compuesto. Upadhyay et al. [42], Roitman et al. [43] y El-Banna et al. [10] reportaron cambios en la composición y producción de metabolitos secundarios (fenilpirrol) al variar las condiciones de crecimiento de B. cepacia. Los resultados obtenidos en este estudio coinciden con los reportados por estos autores, donde la producción del compuesto antifúngico se vio influenciada por la variación en los factores de crecimiento de las cepas de B. cepacia aisladas de maíz (SB2, ER3, LG12, N10) y la cepa CVCM 626.
La actividad antifúngica máxima se obtuvo a una temperatura de 35 ºC, la cual se encuentra dentro del rango de temperatura óptimo para el crecimiento de B. cepacia [37]. Sin embargo se encontró buena actividad a bajas temperaturas (18 ºC), indicando con esto que existe un amplio rango de temperatura (18-35 ºC) para la producción de actividad antifúngica.
Jayaswal et al. [1] encontraron que las fuentes de nitrógeno inorgánico aumentan la actividad antagónica de B. cepacia. Es posible que la actividad antifúngica de B. cepacia sea afectada por el amonio debido a un cambio de pH en la bacteria. Esto pudiera explicar los resultados obtenidos en este estudio, donde la actividad antifúngica de las cepas fue mayor a pH ácidos que alcalinos. Este resultado es significativo para el uso de B. cepacia como agente de biocontrol, ya que los suelos con pH ácidos probablemente favorecerían la capacidad de B. cepacia de producir actividad antagónica, y los hongos son relativamente capaces de invadir medios ácidos, como es el caso de los hongos fitopatógenos y las levaduras que pueden desarrollarse a un pH de 5,0 a 5,5 [44].
La actividad antifúngica de B. cepacia frente a T. viride fue mayor en presencia de xilosa, maltosa, manosa y fructosa como únicas fuentes de carbono. Igualmente, se observó alteración en la producción de pigmento por parte de la bacteria. Sin embargo, no hubo correlación entre la producción de pigmento y la actividad antagónica. La utilización de cisteína, valina y leucina como única fuente de nitrógeno también favorecieron la actividad antifúngica de las cepas de B. cepacia.
B. cepacia es una bacteria nutricionalmente versátil debido a la capacidad de utilizar un gran número de carbohidratos como fuentes de carbono, así como diversos aminoácidos como fuentes de nitrógeno [37]. Los factores nutricionales tuvieron un gran impacto sobre la actividad antifúngica de B. cepacia, demostrándose, en el presente estudio, la capacidad de la bacteria de inhibir el crecimiento de hongos en presencia de una variedad de fuentes de carbono y nitrógeno, convirtiéndose en una buena perspectiva en el campo de la biotecnología para el control de enfermedades fúngicas en las plantas que tienen una importancia económica considerable.
Conclusiones
Se comprobó la actividad antifúngica in vitro de cepas de B. cepacia aisladas de maíz contra hongos fitopatógenos como T. viride, observándose mayor actividad antagónica cuando la bacteria crece en condiciones de pH ácido (5), a una temperatura de 35 ºC y en presencia de xilosa y cisteína como únicas fuentes de carbono y nitrógeno, respectivamente. Con esto se demostró que la adaptabilidad mostrada por la bacteria, a diferentes condiciones ambientales, podría satisfacer las necesidades para el control de enfermedades fúngicas en la agricultura bajo diferentes condiciones agrícolas.
Referencias
1. Jayaswal R, Fernández M, Sobroeder R. Isolation and characterization of a Pseudomonas strain that restricts growth of various phytopathogenic fungi. Appl Environ Microbiol. 1990; 56: 1053-8. [ Links ]
2. Smith D, White, D. Diseases of corn. Amer Soc Microbiol. 1993; 38: 1-9. [ Links ]
3. Copping L, Menn J. Biopesticides: a review of their action, applications and efficacy. Pest Manag Sci. 2000; 56: 651-767. [ Links ]
4. Mazzani C, Borges O. II Jornadas Científicas del Maíz. Fusarium moniliforme, importante especie de hongo en granos de maíz (Zea mays L.) en Venezuela. 1998. [ Links ]
5. Arima K, Kakinuma A, Tamura G. Surfactin: A crystalline peptide lipid surfactant produced by Bacillus subtilis: isolation, characterization and its inhibition of fibrin clot formation. Biochem Biophys Res Commun. 1968;31: 488-94. [ Links ]
6. Cupples D, Sen J. Isolation and characterization of a bacteriocin produced by Pseudomonas solanacearum. J Gen Microbiol. 1978; 109: 293-303. [ Links ]
7. Wakayama S, Ishikawa F, Eishi K. Mycocerein. A novel antifungal peptide antibiotic produced by Bacillus cereus. Antimicrob Agents Chemother. 1984; 26: 936-40. [ Links ]
8. Cabib E. Differential inhibition of chitin synthetases 1 and 2 from Saccharomyces cerevisae by polyoxin D and nikkomicins. Antimicrob Agents Chemother. 1991; 35:170-3. [ Links ]
9. Jiao Y, Yoshihara T, Ishikuri S, Uchino H, Ichihara A. Structural identification of Cepaciamide A, a novel fungitoxic compound from Pseudomonas cepacia D-202. Tetrahedron Lett. 1996; 37: 1039-40. [ Links ]
10. El-Banna N, Winkelmann G. Pyrrolnitrin from Burkholderia cepacia: antibiotic activity against fungi and novel activities against Streptomycetes. J Appl Microbiol. 1998; 85:69-78. [ Links ]
11. Yu FY, Li ZH, Zeng HC. Profess on the research in antifungal agricultural antibiotics. Chin J Tropical Agric. 2005; 25: 60-5. [ Links ]
12. Burkholder W. Sour skin, a bacterial rot of onion bulbs. Phytopathology. 1950; 64: 468-75. [ Links ]
13. Parke JL, Guirian-Sherman D. Diversity of the Burkholderia cepacia complex and implications for risk assessment of biological control strains. Annu Rev Phytopathol. 2001; 39: 225-58. [ Links ]
14. OSullivan LA, Weightman AJ, Jones TH, Marchbank AM, Tiedje JM, Mahenthiralingam E. Identifying the genetic basis of ecologically and biotechnologically useful functions of the bacterium Burkholderia vietnamiensis. Environ Microbiol. 2007; 9: 1017-34. [ Links ]
15. Mahenthiralingam E, Baldwin A, Dowson CG. Burkholderia cepacia complex bacteria: opportunistic pathogens with important natural biology. J Appl Microbiol. 2008; 104:1539-51. [ Links ]
16. Coenye T, Vandamme P. Diversity and significance of Burkholderia species occupying diverse ecological niches. Environ Microbiol. 2003; 5: 719-29. [ Links ]
17. Coenye T, Mahenthiralingam E, Henry D, Lipuma J, Laevens S, Gillis M, et al. Burkholderia ambifaria sp. nov., a novel member of the Burkholderia cepacia complex including biocontrol and cystic fibrosis-related isolates. Int Syst Evol Microbiol. 2001; 51: 1481-90. [ Links ]
18. Coenye T, Vandamme P, Govan JR, Lipuma JJ. Taxonomy and identification of the Burkholderia cepacia complex. J Clin Microbiol. 2001; 39: 3427-36. [ Links ]
19. Coenye T, Spilker, T, Van Schoor A, Lipuma JJ, Vandamme P. Recovery of Burkholderia cenocepacia strain PHDC from cystic fibrosis patients in Europe. Thorax. 2004; 59: 952-4. [ Links ]
20. Payne GW, Vandamme P, Morgan SH, Lipuma JJ, Coenye T, Weightman AJ, et al. Development of a recA gen-based identification approach for the entire Burkholderia genus. Appl Environ Microbiol. 2005; 71: 3917-27. [ Links ]
21. Balwin A, Mahenthiralingham E, Thickett KM, Honey-Bourne D, Maiden MC, Govan JR, et al. Multilocus sequence typing scheme that provides both species and strain differentiation for the Burkholderia cepacia complex. J Clin Microbiol. 2005; 43: 4665-73. [ Links ]
22. Balwin A, Mahenthiralingham E, Drevinek P, Vandamme P, Govan JR, Waine DJ, et al. Environmental Burkholderia cepacia complex isolates in human infection. Emerg Infect Dis. 2007; 13: 458-61. [ Links ]
23. Mahenthiralingham E, Urban TA, Goldberg JB. The multifarious, multireplicon Burkholderia cepacia complex. Mat Rev Microbiol. 2005; 3: 144-56. [ Links ]
24. Dalmastri C, Baldwin A, Tabacchioni S, Bevivino A, Mahenthiralingam E, Chariani L, et al. Investigating Burkholderia cepacia complex populations recovered from Italian maize rhizosphere by multilocus sequence typing. Environ Microbiol. 2007; 9: 1632-9. [ Links ]
25. Kirinuki T, Iwanuma K, Susuki N, Fukami H, Ueno T. Altericidins, a complex of polipeptide antibiotics produced by Pseudomonas sp. and their effect for the control of black spot of pear caused by Alternaria kikuchiana Tanaka. Sci Rep Fac Agric Kobe Univ. 1977; 12: 223-30. [ Links ]
26. Parker WL, Rathnum ML, Seiner V, Trejo WH, Principe PA, Sykes RB. Cepacin A and Cepacin B, two new antibiotics produced by Pseudomonas cepacia. J Antibiot. 1984; 37: 431-40. [ Links ]
27. Quan CS, Zheng W, Liu Q, Ohta Y, Fan SD. Isolation and characterization of a novel Burkholderia cepacia with strong antifungal activity against Rhizoctonia solani. Appl Microbiol Biotech. 2006; 72: 1276-84. [ Links ]
28. Jayaswal R, Fernández M, Visintin L, Upadhyay R. Transposon Tn259 mutagenesis of Pseudomona cepacia to isolate mutants deficient on antifungal activity. Can J Microbiol. 1993; 38: 309-12. [ Links ]
29. López R, López M. El diagnóstico de suelos y plantas. Métodos de campo y laboratorio, 4ª Ed. Madrid: Editorial Mundi-Prensa; 1990. [ Links ]
30. DiCello F, Bevivino A, Chianni L, Fani R, Paffetti D, Tabacchioni S, et al. Biodiversity of Burkholderia cepacia population isolated from the maize rhizosphere at different plant growth stages. Appl Environ Microbiol. 1997; 63: 4485-93. [ Links ]
31. Parkinson D, Gray T, Williams S. Methods for studying the ecology of soil micro-organisms. IBP Handbook No. 19. Oxford, Inglaterra: Blackwell Ed.; 1971. [ Links ]
32. Mitidieri L. Control biológico de hongos de suelo con Trichoderma. IDIA. 1988; 44:45-9. [ Links ]
33. Sokal R, Rohlf F. Biometría. Principios y métodos estadísticos en la investigación biológica. Madrid; H. Blume Ediciones; 1979. [ Links ]
34. Abe M, Nakazawa T. Characterization of hemolytic and antifungal substance, cepalycin, from Pseudomonas cepacia. Microbiol Inmunol. 1993; 38: 1-9. [ Links ]
35. Kai M, Effmert U, Berg G, Piechulla B. Volatiles of bacterial antagonist inhibit mycelial growth of the plant pathogen Rhizoctonia solani. Appl Environ Microbiol. 2006 ; 55: 1053-7. [ Links ]
36. Araque Y, Alvarado L, Centeno S, Rodríguez V, Vitelli J. Actividad antibiótica y antifúngica de B. cepacia provenientes de ambientes nosocomiales. Servicio Autónomo Hospital Universitario Antonio Patricio Alcalá: Cumaná, Venezuela. Kasmera. 2007; 35: 107-17. [ Links ]
37. Li X, Quan CS, Yu HY, Fan SD. Multiple effects of a novel compound from Burkholderia cepacia against Candida albicans. FEMS Microbiol Lett. 2008; 285: 250-6. [ Links ]
38. Bell D, Wells S, Walksman L. In vitro antagonism of Trichoderma species against six fungal plant pathogens. Phytopathology. 1982; 72: 379-83. [ Links ]
39. Alemán I, Sánchez J, Sealey M, Rojas J, López G. Empleo de una cepa de Burkholderia cepacia en el control de la mancha azul en la madera de pino caribe (Pinus caribaea). Ciencia. 2003; 11: 39-46. [ Links ]
40. Fassouane A, Rachidi M, Rouffaud M, El-Abbouyi A, Nguyen V. In vitro antifungal activity of Bacillus licheniformis FSJ-2 products against dermatophytes. J Mycol Med. 1995; 5: 244-8. [ Links ]
41. Lim D, Hains P, Walsh B, Bergquist P, Nevalainen H. Proteins associated with the cell envelope of Trichoderma reesei: a proteomic approach. Proteomics. 2001; 1: 899-910. [ Links ]
42. Upadhyay R, Visintin L, Jayaswal R. Enviromental factors affecting the antagonism of Pseudomonas cepacia against Trichoderma viride. Can J Microbiol. 1991; 37: 880-4. [ Links ]
43. Roitman J, Mahoney N, Janisiewicz W. Production and composition of phenylpyrrole metabolites produced by Pseudomonas cepacia. Appl Microbiol Biotechnol. 1990; 34: 381-6. [ Links ]
44. Casas RG. Micología General. Caracas: Ediciones de la Biblioteca UCV; 1989. [ Links ]












 uBio
uBio